Bhlhe40基因在调控骨髓间充质干细胞增殖、分化和衰老中的应用
bhlhe40基因在调控骨髓间充质干细胞增殖、分化和衰老中的应用
技术领域
1.本技术涉及基因的功能与应用技术领域,具体而言,涉及螺旋-环-螺旋家族成员e40(basic helix-loop-helix family,member e40,bhlhe40)作为靶基因在调控干细胞增殖、分化和衰老中的应用。
背景技术:
2.骨髓间充质干细胞(bone marrow mesenchymal stem cells,bmscs)因其再生能力强、免疫原性低的特点,使其在组织工程和细胞治疗中具有巨大的应用潜力。目前bmscs在临床应用上的一个瓶颈是体内bmscs数量少,在体内仅占骨髓内单核细胞数量的十万分之一,因此需要先在体外进行培养扩增以获得足够数目的bmscs。bmscs在体外扩增培养的过程中,干细胞的干性会逐渐降低,即干细胞的增殖和多向分化能力逐渐减弱。bmscs干性的降低会影响其在组织工程和细胞治疗过程中的效果,因此在bmscs体外扩增的过程中维持细胞干性对于其临床应用有巨大意义。
3.有研究分别使用未培养的、培养24小时、培养48小时的小鼠bmscs注射到亚致死性照射的小鼠骨髓内,72小时后提取骨髓和脾脏中的基质细胞,发现仅培养24小时就显著降低了骨髓和脾脏中mscs的接种效率,而培养48小时后,在这些器官中未检测到供体来源的bmscs。另有研究表明,使用原代而非培养后的bmscs和造血干细胞在亚致死性照射的小鼠骨髓内共移植可以更好的重建骨髓基质的功能。以上研究表明体内和体外bmscs之间存在较大的生物学特性差异。因此,了解体内、外bmscs的干性差异,有助于在体外扩增培养时维持bmscs的干性。
4.bmscs是具有异质性的细胞群,可能含有不同功能的细胞亚群,因此挑选出最具增殖和分化潜能的bmscs作为种子细胞更有利于体外扩增培养过程。有研究表明,与小鼠体内分离的其他bmscs相比,pαs细胞(小鼠pαs细胞(murine bone marrow-derived pdgfrα+sca-1+cd45-ter119-mesenchymal stromal cells))具有更强的生长潜能和三系分化能力,因此挑选pαs细胞作为种子细胞更有利于体外培养扩增过程。
5.传统的bmscs分离方法主要通过细胞贴壁培养和更换培养基去除不贴壁的细胞,然而这种分离小鼠bmscs的方法存在一些局限性,比如其得到的细胞可能含有其他杂细胞。之前研究报道通过facs(流式细胞荧光分选技术)可以获得更纯的pαs细胞,其分选的marker为cd140a
+
sca-1
+
cd45-ter119-,因此采用这种方式获得fresh pαs细胞。干细胞供体的年龄对干细胞的数目和干性有很大的影响,之前有研究比较4种不同供体年龄的c57小鼠长骨中pαs细胞的比例,研究发现出生后1-3天和胚胎第18.5天的c57小鼠四肢中含有较高比例的pαs细胞。因此综合实验操作的难度、实验花费以及提取细胞数量等因素考虑,选取出生后1-3天的c57乳鼠进行pαs细胞的提取。
6.目前,bhlhe40在肿瘤细胞、免疫细胞中的周期调控、新陈代谢、细胞凋亡、免疫调控等作用被广泛报道,但还未有研究报道bhlhe40在促进pas细胞增殖、调控pαs细胞分化和
延缓pαs细胞衰老中的作用。
技术实现要素:
7.通过比较fresh pαs细胞和p0代pαs细胞的rna-seq数据,发现转录因子bhlhe40在p0代pαs细胞中的表达程度显著低于fresh pαs细胞。此外,通过比较p0代、p1代和p4代pαs细胞的rna-seq数据,同样发现bhlhe40在p4代pαs细胞中的表达水平显著低于p0代和p1代pαs细胞。进一步研究发现,bhlhe40基因具有促进干细胞增殖、调控干细胞分化和延缓干细胞衰老的作用。
8.基于以上研究,本发明提供了一种bhlhe40基因在调控骨髓间充质干细胞增殖、分化或衰老中的应用。
9.进一步的,通过使所述骨髓间充质干细胞中的所述bhlhe40基因过表达来促进所述干细胞增殖、调控干细胞分化或延缓其衰老。
10.所述应用为bhlhe40基因在制备促进干细胞增殖、调控干细胞分化和延缓干细胞衰老的药物中的应用。
11.所述骨髓间充质干细胞为pαs细胞。
12.本发明还提供了一种重组慢病毒,所述重组慢病毒能够过表达bhlhe40基因。
13.进一步的,所述bhlhe40基因的核苷酸序列如seq id no.1所示。
14.本发明提供了一种重组骨髓间充质干细胞,所述重组骨髓间充质干细胞是通过将bhlhe40基因转染到骨髓间充质干细胞中获得,能够过表达所述bhlhe40基因。
15.进一步的,所述骨髓间充质干细胞为pαs细胞。
16.将前述的重组慢病毒感染骨髓间充质干细胞获得所述重组骨髓间充质干细胞。
17.本发明的有益效果包括:本发明发现bhlhe40基因的新功能,即bhlhe40基因具有促进干细胞增殖、调控干细胞分化和延缓干细胞衰老的作用。基于bhlhe40在促进干细胞增殖、调控干细胞分化和延缓干细胞衰老的作用,其可用于制备促进干细胞增殖、调控干细胞分化和延缓干细胞衰老的作用的药物。bhlhe40蛋白本身分子体积小,化学结构简单,因此,药理功能更安全、药效更温和且副作用更少,故bhlhe40在干细胞治疗和组织工程再生中具有广阔的开发应用前景。
附图说明
18.图1是过表达bhlhe40促进体外培养的pαs细胞的增殖能力的结果图;其中,(a)为bhlhe40过表达pαs细胞(bhlhe40)和对照组pαs细胞(vector)的镜下形态;(b)为bhlhe40和vector的cck8检测结果;(c)为bhlhe40和vector的单细胞克隆形成情况;(d)为bhlhe40和vector的多细胞克隆形成情况(*p<0.05,**p<0.01,***p<0.001);
19.图2是过表达bhlhe40促进体外培养的pαs细胞的成骨和成软骨向分化,抑制成脂向分化的染色结果图;其中,(a)为bhlhe40和vector的alp染色和活性定量检测结果;(b)为bhlhe40和vector的ars染色和定量检测结果;(c)为bhlhe40和vector在pm(增殖培养基)条件下油红o染色和定量检测结果;(d)为bhlhe40和vector在am条件下油红o染色和定量检测结果;(e)为bhlhe40和vector孔板阿尔新蓝染色情况;(f)为bhlhe40和vector软骨球切片阿尔新蓝染色情况;(g)为bhlhe40和vector软骨球切片天狼星红染色情况(***p<0.001);
20.图3是过表达bhlhe40促进体外培养的pαs细胞的成骨和成软骨向分化基因,抑制成脂向分化基因的mrna水平表达结果图;其中,(a-b)为bhihe40和vector在om(成骨培养基)条件下培养7天后的alp和runx2 mrna相对表达量;(c-d)为bhlhe40和vector在om条件下培养14天后的runx2和bglap mrna相对表达量;(e-f)为bhlhe40和vector在am条件下培养14天后的ppar和lpl mrna相对表达量;(g-h)为bhlhe40和vector在cm条件下培养21天后的acan和comp mrna相对表达量(与vector组比较,gapdh为内参,***p<0.001);
21.图4是过表达bhlhe40促进体外培养的pαs细胞的成骨和成软骨向分化基因,抑制成脂向分化基因的蛋白水平表达结果图;其中,(a)为bhlhe40和vector的成骨向分化基因bglap的蛋白表达水平;(b)为bhlhe40和vector的成脂向分化基因ppar的蛋白表达水平;(c)为bhlhe40和vector的成软骨向分化基因comp的蛋白表达水平(与vector组比较,***p<0.001);
22.图5是bhlhe40和vector的干性基因的mrna表达水平结果图;其中,(a-c)为干性基因oct4、sox2和nanog mrna相对表达量(与vector组比较,gapdh为内参,**p<0.01,***p<0.001);
23.图6是bhlhe40和vector的干性基因的蛋白表达水平结果图;其中,(a)为干性基因oct4蛋白相对表达量,(b)为干性基因nanog蛋白相对表达量(与vector组比较,***p<0.001);
24.图7是bhlhe40和vector表面marker基因的mrna表达水平结果图;其中,(a-b)为表面markercd140a和sca-1mrna相对表达量(与vector组比较,gapdh为内参,**p<0.01,***p<0.001);
25.图8是bhlhe40和vector表面marker的流式鉴定结果图;其中,(a)为细胞表面marker流式鉴定;(b)为表面marker流式鉴定的定量分析(与vector组比较,***p<0.001);
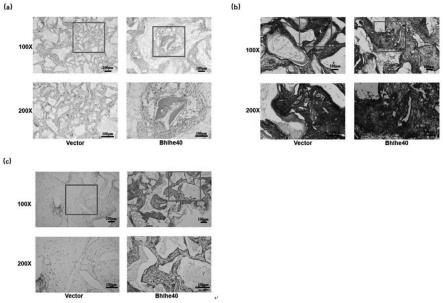
26.图9是bhlhe40和vector的体内异位成骨能力结果图;其中,(a)为h&e染色;(b)为masson染色;(c)为ihc染色;
27.图10是过表达bhlhe40抑制体外培养的pαs细胞的衰老的结果图;其中,(a)为bhlhe40和vector的β-半乳糖苷酶染色情况;(b)为bhlhe40和vector的ros水平变化;(c)为bhlhe40和vector的端粒酶活性和端粒长度检测结果;(d-e)为bhlhe40和vector的p16和p53mrna相对表达量;(f-i)为bhlhe40和vector的il-8、sfrp2、wnt16和gm-csf mrna相对表达量(与vector组比较,gapdh为内参,**p<0.01,***p<0.001);
28.图11是体外培养pαs细胞过表达bhlhe40可能通过促进zbp1的表达调控wnt/β-catenin信号通路维持细胞干性的结果图;其中,(a-c)为bhlhe40和vector的wnt3a、ctnnb1和ccnd1基因的mrna表达水平;(d-h)为bhlhe40和vector分别进行sizbp1和sinc转染后zbp1基因、干性基因、衰老的mrna表达水平;(i-j)为bhlhe40和vector分别进行sizbp1和sinc转染后wnt3a和ccnd1基因的mrna表达水平(gapdh为内参,*p<0.05,**p<0.01,***p<0.001)。
具体实施方式
29.下面结合实施例对本发明进行进一步说明和描述,但所描述的实施例仅仅是本发明的一部分实施例,而不是全部的实施例。基于本发明和实施例中,本领域普通技术人员在
没有做出创造性劳动前提下所获得的所有其他发明和实施例,都属于本发明保护的范围。
30.下述实施例中所使用的实验方法如无特殊说明,均为常规方法。
31.下述实施例中所用的材料、试剂等,如无特殊说明,均可从商业途径得到。实施例1、细胞实验证明过表达bhlhe40促进体外培养的pαs细胞的增殖能力
32.实验过程包括如下几个方面:
33.1.bhlhe40过表达慢病毒感染构建稳定过表达bhlhe40的pαs细胞
34.bhlhe40过表达慢病毒由苏州吉玛公司构建的,克隆载体为lv5,bhlhe40基因的核苷酸序列如seq id no.1所示。
35.atggaa cggatcccca gcgcgcaacc acctcctacc tgcctgccca aagctccagg gctggagcac ggagacctgt cagggatgga ttttgcccac atgtaccaag tgtacaagtc caggcgggga ataaaacgga gcgaagacag caaggaaact tacaaactgc cgcaccggct gattgagaaa aagagacgtg accggattaa cgagtgcatt gcccagctga aggatctcct acccgaacat ctcaaactta ctactttggg tcacttggaa aaagcagtgg ttctggagct tacgttgaag cacgtgaaag cattgacaaa tctaattgat cagcagcagc agaaaatcat tgccctgcag agcggtttac aagctggtga tttgtcggga agaaatctcg aggcagggca agaaatgttc tgctcaggtt tccagacttg tgcccgtgag gtacttcagt acctggcgaa gcatgagaac actcgggacc tgaaatcttc ccagctcgtc actcatctcc atcgtgtggt ctcggagctg ctgcagggtg gtgcttccag gaaaccattg gactcggctc ccaaagccgt ggacttgaaa gagaagccca gcttcctagc caagggatca gaaggccctg ggaaaaactg tgtgccagtc atccagcgga cttttgctcc ctcgggtggg gagcagagcg gcagtgacac ggacacagac agtggctatg gaggtgaatt ggagaagggg gacttgcgca gtgagcagcc gtacttcaaa agcgaccatg gacgcaggtt cgccgtggga gaacgtgtca gcacaattaa gcaagaatcc gaagagcccc ccaccaaaaa gagccgaatg cagctctcag aagaggaagg ccacttcgcg ggcagtgatc tgatgggttc cccatttctt gggccacacc cacatcagcc tcctttttgc cttcccttct atctcatccc accatcggcc actgcctacc tgcctatgct ggagaaatgc tggtacccca cctctgtgcc agtgttatac ccaggcctca acacctcagc tgcagccctc tccagcttca tgaacccaga caagataccg actcccttgc ttctgcccca gagactccct tctcctttgg cacattcgtc cctcgactct tcggccttgc tccaggcttt gaagcagatc cctcctttaa acttagaaac caaagactaa
36.(1)p1或p2代pαs细胞融合至50%~60%时,弃原培养液,用无菌pbs缓冲液轻轻冲洗2~3次,更换新鲜培养基。从-80℃冰箱中取出bhlhe40过表达慢病毒储存液(10cm培养皿需要100μl),冰上融化,小心加入培养基中,同时加10μl聚凝胺(polybrene)。
37.(2)24小时后更换新鲜培养基。转染3~4天后于荧光显微镜下观察荧光强弱,视荧光强度加含有5~10ng/ml的嘌呤霉素进行抗药筛选。以空载体制备的慢病毒感染的pαs细胞作为对照组(vector)。结果如图1中(a)所示。
38.2.cck8细胞增殖实验
39.(1)消化细胞,重悬细胞,进行细胞计数,然后在96孔板中每孔中接种1000个细胞,每孔含200μl培养基。每个时间点3个副孔,检测第0、1、3、5、7和14天的结果,所以每组开始一共接种18个孔。
40.(2)细胞贴壁后,更换新鲜培养基,加入cck8液,然后37℃培养箱孵育1小时,吸取孵育液到新的96孔板中,检测450nm的od值,作为第0天的数值。每2~3天更换培养基,到第1、3、5、7和14天再进行cck8增殖检测,结果如图1中(b)所示。
41.3.单细胞克隆形成实验
42.(1)消化细胞,重悬细胞,然后置于ep管中。通过流式细胞荧光分选仪器,在添加培养基的96孔板中进行单个细胞打板,然后在细胞孵箱中培养。每2~3天更换培养基,到第14天,先在倒置显微镜下观察,标注出孔内有明显细胞克隆的孔。
43.(2)倒掉96孔板中的培养基,对标注的孔进行pbs清洗3遍,然后添加4%的多聚甲醛进行细胞固定30分钟。倒掉多聚甲醛,用pbs清洗3遍,加入1%结晶紫染液进行染色,10分钟后,回收1%结晶紫染液,再用pbs清洗3遍,然后对96孔板进行观察和扫描拍照。结果如图1中(c)所示。
44.4.多细胞克隆形成实验
45.(1)消化细胞,重悬细胞,进行细胞计数,在6孔板中每孔接种500个细胞,每孔含2ml培养基,然后在细胞孵箱中培养。每2~3天更换培养基,到第14天,先在倒置显微镜下观察孔板中多细胞克隆形成情况。
46.(2)倒掉6孔板中的培养基,使用pbs对孔板清洗3遍,然后在孔板中添加4%的多聚甲醛固定细胞30分钟。倒掉多聚甲醛,用pbs清洗3遍,添加l%结晶紫染液,10分钟后,回收1%结晶紫染色,用pbs清洗3遍,然后对6孔板进行观察和扫描拍照。结果如图1中(d)所示。
47.cck8、单细胞和多细胞克隆形成实验结果显示,过表达bhlhe40的pαs细胞的增殖能力强于对照vector组(见图1)。
48.实施例2、细胞和分子生物学实验证明过表达bhlhe40促进体外培养的pαs细胞的成骨和成软骨向分化能力,抑制成脂向分化能力
49.实验过程包括如下几个方面:
50.(一)细胞成骨向分化能力的检测
51.1.alp染色与活性定量检测
52.将bhlhe40过表达pαs细胞(bhlhe40)和对照组pαs细胞(vector)接种于6孔板或者12孔板,待细胞汇合至70%~80%左右时开始进行成骨诱导。成骨诱导后第7天进行alp染色及活性定量实验。
53.(1)alp染色步骤如下:
54.吸尽培养板中接种细胞孔洞里的培养基。使用pbs轻轻冲洗培养板孔洞三次。使用95%冰无水乙醇固定细胞30min。在达到固定时间前,按照碱性磷酸酶显色试剂盒说明书配制好工作液,bcip∶nbt∶缓冲液=1∶1∶38,量以覆盖细胞即可。固定时间到后,倒掉培养板孔洞中的95%乙醇,再用pbs轻轻冲洗三次。加入alp显色工作液,室温避光反应,一般5-15min显色。吸净或倒掉培养板中的工作液,然后用pbs洗1-2次即可终止显色反应,(扫描之前需要把孔洞里的液体吸干净,以免反光,影响扫描结果)进行镜下拍照或大体扫描。显色反应终止后,可以室温晾干保存。
55.(2)alp活性定量实验步骤按照说明书进行。alp染色和活性定量分析结果表明,过表达bhlhe40的pαs细胞的早期成骨向分化能力强于对照vector组(图2中a)。
56.2.茜素红(ars)矿化结节染色及定量检测
57.将bhlhe40过表达pαs细胞(bhlhe40)和对照组pαs细胞(vector)接种于6孔板或者12孔板中,待细胞融合至60%~70%左右时开始进行成骨诱导(om)培养。成骨诱导14天后进行ars染色和定量检测。
58.(1)ars染色步骤如下:
59.吸尽或倒掉孔板中的培养基,pbs洗孔洞三次,小心冲洗,防止细胞剥脱;预冷的95%乙醇固定细胞30min以上;95%冰乙醇固定细胞时配制1%茜素红染液;吸尽或倒掉孔板中95%冰乙醇,用milli q水冲洗三次;孔板内加入茜素红染液至完全覆盖细胞;常温放置,一般染色10-20min。染色结束后回收茜素红染液,milli q水冲洗三次,把非特异性着色冲洗干净。然后进行孔板扫描或镜下拍照.
60.(2)ars定量步骤如下:
61.在ars染色后的孔板内加入等量(大于300μl)的1%十六烷基吡啶溶液,加封口袋置于摇床上室温溶解(溶解时间》1h);待完全溶解后,每孔吸取100μl液体至96孔板,重复三个孔,使用酶标仪在562nm波长下测吸光度值。
62.ars染色和定量分析结果表明,过表达bhlhe40的pαs细胞的晚期成骨向分化能力强于对照vector组(图2中b)。
63.(二)细胞成脂向分化能力的检测
64.1.油红o染色及定量检测
65.将bhlhe40过表达pαs细胞(bhlhe40)和对照组pαs细胞(vector)接种于6孔板或者12孔板中,待细胞融合至100%左右时开始进行成脂诱导(am)培养。成脂诱导14天后进行油红o染色和定量检测。
66.(1)油红o染色步骤如下:
67.吸尽或倒掉孔板内培养基,pbs轻柔冲洗三次。使用10%中性福尔马林溶液固定70min以上,然后倒掉,pbs冲洗三次。加入60%异丙醇没过细胞,润洗3遍左右,每次2-5min。加入油红o工作液以覆盖所有细胞即可,染大概10分钟。镜下观察,染出脂滴即可吸去或倒尽染液,然后在孔板中加入一些pbs,进行镜下拍照。
68.(2)油红o定量检测步骤如下:
69.吸尽或倒掉染色后孔板内pbs,用mili q水清洗3遍,然后在每孔中加入1ml 100%异丙醇,轻摇10min;每个样本取100ul至96孔板中,可有三个复孔,100%异丙醇作为空白对照,在酶标仪500nm处测od值。
70.油红0染色和定量分析结果表明,无论是在pm培养条件下还是am培养条件下,过表达bhlhe40的pαs细胞的成脂向分化能力弱于对照vector组(图2中c-d)。
71.(三)细胞成软骨向分化能力的检测
72.1.细胞孔板阿尔新蓝染色检测
73.将bhlhe40过表达pαs细胞(bhlhe40)和对照组pαs细胞(vector)接种于6孔板或者12孔板,待细胞汇合至50%~60%左右时开始成软骨诱导(cm)。成软骨诱导后第21天进行阿尔新蓝染色检测实验。
74.阿尔新蓝染色步骤如下:
75.(1)弃掉孔板内培养基后用pbs轻轻洗3遍。然后用70%无水乙醇在室温下固定30min。
76.(2)用阿尔新蓝染液染色1-2h。回收阿尔新蓝染液,然后用pbs洗3遍,洗掉未着色染液。先把孔洞里的液体吸干净,然后进行镜下拍照或大体扫描。
77.阿尔新蓝孔板染色结果表明,过表达bhlhe40的pαs细胞的成软骨向分化能力强于
对照vector组(图中2e)。
78.2.细胞软骨球切片阿尔新蓝和天狼星红染色
79.将bhlhe40过表达pαs细胞(bhlhe40)和对照组pαs细胞(vector)消化后计数,以5
×
105个细胞重悬于15ml离心管,1000rmp离心5分钟,使细胞悬液液中的细胞沉淀,然后添加成软骨诱导培养基开始成软骨诱导。成软骨诱导后第21天进行细胞球固定,然后进行阿尔新蓝和天狼星红切片染色。
80.(1)软骨细胞球团经过21天的诱导培养后,用长弯头吸管吸走离心管中的软骨诱导液,用pbs液也可以冲洗细胞球团1-2次,在4%多聚甲醛中过夜固定。
81.(2)软骨球然后经过pbs清洗2-3次,经梯度酒精脱水、石蜡包埋和切片;
82.(3)切片后的石蜡标本提前一天置于烘箱内烤片,然后软骨球石蜡切片分别行阿尔新蓝和天狼星红染色。
83.阿尔新蓝和天狼星红软骨球切片染色结果表明,过表达bhlhe40的pαs细胞的成软骨向分化能力强于对照vector组(图2中f-g)。
84.(四)实时定量pcr
85.1.提取总rna
86.(1)吸尽或倒掉6孔板内的培养基,用pbs轻轻冲洗3次。在通风橱中向6孔板的每个孔洞内加入1ml trizol,室温静置反应5分钟。5min后,用移液枪吹打孔洞内的细胞并转移至相应标记的1.5ml ep管中,可以稍微静置5min左右。
87.(2)向1.5ml ep管中分别加入200μl的三氯甲烷,上下颠倒10-15次,使ep管内液体混匀变为粉红色,呈奶昔状。离心使分层:1.5ml ep管在冰上静置2-3分钟,开始出现分层时,然后在4℃,12000-13000rpm,离心15分钟。
88.(3)小心地从离心机中拿出1.5ml ep管后,避免震动,静置片刻,使管壁上吸附的沉淀慢慢沉下去。小心地提取1.5ml ep管中的上层上清400μl至新的1.5ml ep管中。
89.(4)再在新的1.5ml ep管中分别加入400μl的异丙醇,上下缓慢晃动10次,使之混匀,冰上静置10分钟,然后在4℃,12000rpm,离心10分钟。小心吸去离心后的1.5ml ep管中的上清液,然后分别向每个1.5ml ep管中加入配好的预冷的75%的乙醇各1ml,吹打沉淀,上下颠倒混匀,洗去残留的trizol,然后在4℃,12000rpm,离心5分钟。
90.(5)小心吸去离心后的1.5ml ep管中的上清液,再将配好的预冷的75%的乙醇加入1.5ml ep管中,吹打沉淀,上下颠倒混匀,再次在4℃,12000rpm,离心5分钟。
91.(6)用不同量程的移液枪小心地吸去离心后的1.5ml ep管中的上清液,最后用小枪头尽量吸走底端的液体,再次在4℃,12000rpm,离心3分钟,再次用小枪头尽量吸走剩余液体,1.5ml ep管开口晾干。用预冷的depc水溶解rna沉淀,用枪头小心的吹打,震荡,离心,将1.5ml ep管置于冰盒中,用nanodrop 8000分光光度计测量rna浓度,进行后续的逆转录实验或者-80℃保存。
92.2.逆转录合成cdna
93.(1)在10μl反转录反应体系为例,所需rna体积计算公式如下:
94.所需rna体积(μl)=500(ng)/rna浓度(ng/μl)
95.(2)按照takara试剂盒说明书,配制逆转录反应液。逆转录反应条件如表1所示。
96.表1逆转录反应条件
[0097][0098]
(3)逆转录所得cdna,进行后续的实时定量pcr实验或者-20℃保存。
[0099]
3.实时定量pcr反应
[0100]
(1)配置10μl反应体系,每个样品、每个基因设置三个副孔,具体使用试剂及用量如表2所示。
[0101]
表2反应体系试剂及用量
[0102][0103]
(2)pcr反应条件为:95℃热启动10分钟,95℃变性30秒,60℃退火延伸1分钟,共40个循环。
[0104]
(3)使用δδct法分析数据:以gapdh为内参,目的基因的ct值与内参基因ct值相减,获得δct,然后将实验组δct减去对照组δct得到δδct值,通过公式2-δδct
计算目的基因相对于gapdh/gapdh的表达水平。pcr引物序列如表3所示:
[0105]
表3 pcr引物序列
[0106]
[0107]
[0108][0109]
qrt-pcr结果显示,成骨诱导7天后,过表达bhlhe40的pαs细胞的alp、runx2的mrna表达水平高于对照vector组(图3中a-b);成骨诱导14天后,过表达bhlhe40的pαs细胞的runx2、bglap的mrna表达水平高于对照vector组(图3中c-d);成脂诱导14天后,过表达bhlhe40的pαs细胞的ppar、lpl的mrna表达水平低于对照vector组(图3中e-f);成软骨诱导21天后,过表达bhlhe40的pαs细胞的acan、comp的mrna表达水平高于对照vector组(图3中g-h)。说明过表达bhlhe40能促进pαs细胞的成骨和成软骨向分化。
[0110]
在pm培养条件下,过表达bhlhe40的pαs细胞的oct4、sox2和nanog的mrna表达水平高于对照vector组(图5)。说明过表达bhlhe40能促进pαs细胞干性的表达。
[0111]
在pm培养条件下,过表达bhlhe40的pαs细胞的cd140a、sca-1的mrna表达水平高于
对照vector组(图7)。说明过表达bhlhe40能逆转pαs细胞表面marker的表达。
[0112]
在pm培养条件下,过表达bhlhe40的pαs细胞的p16、p53、il-8、strp2、wnt16、gm-csf的mrna表达水平低于对照vector组(图10中d-i)。说明过表达bhlhe40能逆转pαs细胞的衰老。
[0113]
(五)elisa
[0114]
(1)将bhlhe40过表达pαs细胞(bhlhe40)和对照组pαs细胞(vector)用pbs冲洗2次后,用细胞刮将细胞小心刮下来,将培养液3000转/分,离心10min,弃上清留细胞沉淀。用碳酸盐包被缓冲液将抗体稀释至蛋白质含量为1-10μg/ml。在聚苯乙烯酶标板的每孔加100μl,4℃过夜。次日,弃去孔内溶液,用洗涤缓冲液洗3次,每次3min。
[0115]
(2)每孔加入200μl封闭液,37℃孵育1-2h。小心揭掉封板膜,放入洗板机,洗涤3-5遍。也可以手动洗板:弃去液体,每孔加入300μl洗液,浸泡1-2min,在吸水纸上拍干,重复3-5遍。加适当稀释的待检样品100μl于上述已包被的反应孔中。
[0116]
(3)用封板膜封板后置37℃孵育1-2h。洗涤。于各孔中加稀释好的生物素化抗体工作液100μl。用封板膜封板后置37℃孵育1h。
[0117]
(4)洗涤,于各孔中加稀释好的酶结合物工作液100μl。用封板膜封板后置37℃避光孵育30min,洗涤。于各孔中加入tmb底物溶液100μl,37℃避光反应10~30min,直到倍比稀释的标准品孔出现明显的颜色梯度为止。
[0118]
(5)于各反应孔中加入2m硫酸100μl,颜色由蓝色变为黄色。10min内,在酶标仪上,于450nm处,以空白对照孔调零后测各孔od值。根据标准品的浓度和od值做标准曲线,然后根据标准曲线方程计算出样本浓度。
[0119]
elisa结果显示,成骨诱导14天后,过表达bhlhe40的pαs细胞的bglap的蛋白表达水平高于对照vector组(图4中a);成脂诱导14天后,过表达bhlhe40的pαs细胞的ppar的蛋白表达水平低于对照vector组(图4中b);成软骨诱导21天后,过表达bhlhe40的pαs细胞的comp的蛋白表达水平高于对照vector组(图4中c);在pm条件下培养,过表达bhlhe40的pαs细胞的oct4、nanog的蛋白表达水平高于对照vector组(图6)。说明过表达bhlhe40能促进pαs细胞干性的表达。
[0120]
实施例3细胞和分子生物学实验证明过表达bhlhe40促进体外培养的pαs细胞的表面marker的表达
[0121]
实验过程包括如下几个方面:
[0122]
(1)将pαs细胞消化、离心、重悬。避光操作,将细胞悬液分为6份(空白+单流式抗体*4(每管只加一种流式抗体,流式抗体分别为小鼠cd45、pdgfrα、ter119、sca-1)+实验组):空白组(用1.5ml ep管,不加流式抗体):100μl细胞悬液+500μl pbs/fbs buffer缓冲液。单抗体组(用1.5ml ep管)(4组):每组:100μl细胞悬液+1-2μl对应流式抗体+500μl pbs/fbs buffer缓冲液。实验组(用1.5ml ep管):100μl细胞悬液+依次加1-2μl四种流式抗体+500μl pbs/fbs buffer缓冲液。
[0123]
(2)将空白组、单流式抗体组和实验组,避光放在摇床(4℃,50-60ram)中避光孵育30min。避光孵育完成后,空白组封口后直接放在碎冰上,单流式抗体组和实验组1000rpm离心5min,去上清,加pbs/fbs buffer缓冲液重悬,离心,以上步骤重复3遍。最后实验组、单抗体组加500μl pbs/fbs buffer缓冲液重悬。
[0124]
(3)将样本(1空白对照,4流式单抗体对照,1实验组)至于碎冰上,避光保存,然后进行流式细胞表面marker鉴定。另准备10ml pbs/fbs buffer缓冲液,用于防止细胞过浓堵住流式分选机器,可以稀释一下样本。流式细胞表面鉴定marker:ter119-cd45-sca-1+pdgfrα+,进行流式鉴定。
[0125]
以上实验结果显示,过表达bhlhe40的pαs细胞的pdgfrα和sca-1的蛋白表达水平高于对照vector组(图8)。
[0126]
实施例4动物实验证明过表达bhlhe40促进体外培养的pαs细胞的体内异位成骨能力
[0127]
实验过程包括如下几个方面:
[0128]
(一)动物体内实验
[0129]
所有动物实验手术操作均在spf级动物手术室中进行。
[0130]
裸鼠皮下成骨、成脂和成软骨植入
[0131]
(1)材料准备:无菌纱布、碘伏、75%酒精、1%戊巴比妥钠、1ml注射器、眼科镊、眼科剪、止血钳、挖匙、5-0可吸收缝线、持针器、角针。
[0132]
(2)成骨部分:取fresh或p0-p4代6cm培养iiiipαs细胞或过表达bhlhe40(bhlhe40)和对照组(vector)pαs细胞,pbs洗三遍。成脂部分:取已经成脂诱导7天的p0-p4代6cm培养iiiipαs细胞或过表达bhlhe40(bhlhe40)和对照组(vector)pαs细胞,pbs洗三遍。成软骨部分:取已经成软骨诱导14天的p0-p4代6cm培养iiiipαs细胞或过表达bhlhe40(bhlhe40)和对照组(vector)pαs细胞,pbs洗三遍。
[0133]
(3)加0.5ml胰蛋白酶消化1min,然后加3ml完全培养基终止消化。把细胞从培养皿底吹散下来,然后转移至15ml离心管中,离心,1000转/分钟,5min。离心后吸去15ml离心管中的上清,加1ml培养基至盛有细胞沉淀的离心管,制备细胞悬液,然后在冻存管中与载体混合:成骨部分:与50mgβ-tcp支架材料混合。成脂部分:与适当大小的胶原膜混合。成软骨部分:与适当大小的胶原膜混合
[0134]
(4)将冻存管(不要贴封口膜,但是拧紧)置于15ml离心管中,将装有冻存管的离心管置于37℃,50-100rpm/min摇床孵育1小时。孵育结束后,载体与细胞混合物离心,1000转/分钟,5min。实验动物选择6~8周龄balb/c裸鼠,称重,计算麻药用量(用量ml=体重g/200)。
[0135]
(5)裸鼠腹腔注射麻醉(参考计量1%(质量分数)戊巴比妥麻醉,20g裸鼠约打0.13ml)。裸鼠背部碘伏、酒精消毒,背部正中剪开,钝性分离。用1ml移液枪吸尽细胞冻存管中的液体,用高温灭菌后的勺子收集细胞冻存管内的细胞与载体混合物。
[0136]
(6)用高温灭菌后的勺子,将细胞与载体混合物分别接种在裸鼠背部切口两侧,皮下靠近前肢两侧,使细胞与载体混合物聚集。对位缝合,对皮,酒精再次消毒创口。裸鼠减耳朵做标记,然后置于37℃恒温板保温。裸鼠苏醒后置于笼子内。次日观察裸鼠状态。
[0137]
(二)标本制取及切片染色
[0138]
裸鼠背部皮下成骨植入实验标本制取及切片
[0139]
裸鼠皮下移植8周后取材,移植物被4%多聚甲醛固定24小时,10%edta(ph=7.4)中脱钙2周左右,脱水、透明、浸蜡、石蜡包埋、制成5μm厚的组织学切片,对切片进行苏木精-伊红(h&e)染色、masson三色染色,显微镜下观察切片并进行拍照。
[0140]
he染色结果显示,过表达bhlhe40的pαs细胞形成明显的板层骨,且红染区域高于对照vector组(图9中a);masson染色结果显示,过表达bhlhe40的pαs细胞的胶原纤维蓝染程度和面积高于对照vector组(图9中b);ihc-ocn染色结果显示,过表达bhlhe40的pαs细胞的棕染程度高于对照vector组(图9中c)。上述结果表明过表达bhlhe40能促进pαs细胞成骨向分化。
[0141]
实施例5细胞和分子生物学实验证明过表达bhlhe40抑制体外培养的pαs细胞的衰老
[0142]
实验过程包括如下几个方面:
[0143]
(一)细胞衰老的检测
[0144]
1.β-半乳糖苷酶染色
[0145]
(1)对于6孔板或12孔板中培养的转染空载或过表达bhlhe40质粒的p3或p4代pαs细胞,吸除细胞培养液,用pbs洗涤1次,向孔板中加入1ml β-半乳糖苷酶染色固定液,在室温下固定15分钟。吸除细胞固定液,用pbs洗涤细胞3次,每次3分钟。
[0146]
(2)吸除pbs,每孔加入1ml β-半乳糖苷酶染色工作液。按照说明书进行β-半乳糖苷酶染色工作液的配制。37℃孵育过夜,可以用parafilm或保鲜膜封住6孔板防止蒸发。然后在普通光学显微镜下观察并拍照。
[0147]
β-半乳糖苷酶染色结果表明,过表达bhlhe40的pαs细胞的蓝染程度低于对照vector组(图10中a),说明过表达bhlhe40能逆转pαs细胞的衰老。
[0148]
2.活性氧荧光染色
[0149]
(1)将转染空载或过表达bhlhe40质粒的p3或p4代pαs细胞在孔板内培养至细胞密度达到90%左右,将dcfh-da探针加入无血清培养基中,按照1∶1000用无血清培养液稀释dcfh-da,使终浓度为10μmol/l。去除孔板中细胞培养液,加入适当体积稀释好的dcfh-da。加入的体积以能充分盖住细胞为宜,通常对于6孔板的一个孔加入稀释好的dcfh-da不少于1ml。
[0150]
(2)然后将孔板放在37℃细胞培养箱内孵育20分钟。用无血清细胞培养液洗涤细胞三次,以充分去除未进入细胞内的dcfh-da。将孔板中的细胞置于荧光显微镜下观察与拍照,并记录拍照参数,固定每次的拍照参数以减小批次效应等系统误差。
[0151]
活性氧(ros)荧光染色结果表明,过表达bhlhe40的pαs细胞的绿色荧光程度低于对照vector组(图10中b左图),说明过表达bhlhe40能逆转p αs细胞的衰老。
[0152]
3.活性氧定量检测
[0153]
(1)将转染空载或过表达bhlhe40质粒的p3或p4代pαs细胞在6孔板或6cm培养皿内培养至细胞密度达到90%左右,将dcfh-da探针加入无血清培养基中,按照1:1000用无血清培养液稀释dcfh-da,使终浓度为10μmol/l。去除孔板中细胞培养液,用pbs轻轻洗涤细胞3次。
[0154]
(2)然后用胰蛋白酶消化细胞,pm终止消化,1000rpm,离心5分钟获得细胞沉淀。去除上清,制备细胞悬液,然后进行细胞计数,用稀释好的dcfh-da重悬细胞,使细胞浓度为100万细胞/ml。然后将细胞悬液在37℃细胞培养箱内孵育20分钟,每隔5分钟混匀细胞悬液,目的是使探针和细胞充分接触。
[0155]
(3)用无血清细胞培养液洗涤细胞三次,以充分去除未进入细胞内的dcfh-da。每
个样品设三个副孔,每孔加100μl细胞悬液,然后使用酶标仪测在490nm处的吸光度值并记录。
[0156]
活性氧荧光定量结果表明,过表达bhlhe40的pαs细胞的定量结果低于对照vector组(图10中b右图),说明过表达bhlhe40能逆转pαs细胞的衰老。
[0157]
4.端粒酶活性和端粒长度定量检测
[0158]
收集细胞,按照端粒酶活性试剂盒说明书进行端粒酶活性的检测,依次进行制备待测样品、设孔、加样孵育、洗涤、显色、测定。
[0159]
最后以蛋白检测标准品作为参照,绘制标准曲线,依据标准曲线和样品的od值计算待测样本的蛋白浓度。通过上述检测所得的待测样本的端粒酶活性,除以该样本的蛋白浓度,获得矫正的端粒酶活性(u/gprot)。
[0160]
端粒酶(te)活性检测结果表明,过表达bhlhe40的pαs细胞的端粒酶活性高于对照vector组(图10中c左图),说明过表达bhlhe40能逆转pαs细胞的衰老。
[0161]
(1)按照dna提取试剂盒说明书提取pαs细胞沉淀的dna并测定端粒长度。
[0162]
端粒绝对长度计算:
[0163]
样品dna经nanodrop 8000分光光度计测量dna浓度,按qrt-pcr方案进行检测,所获得的ct与端粒绝对长度/scg标准曲线比对,分别获得各组的atl和scg,通过下式计算获得各组的端粒长度:
[0164]
tl=atl/scg
[0165]
(2)pcr扩增步骤:
[0166]
1)2
×
taq plus master mix(dye plus)解冻完全后,上下颠倒混匀。于冰上按照说明书配制的反应体系。
[0167]
2)推荐pcr反应条件设置如表4所示:
[0168]
表4 pcr反应条件设置
[0169][0170]
③‑④
进行35个循环。
[0171]
(3)端粒长度检测中使用pcr引物序列如表5所示:
[0172]
表5端粒长度检测的pcr引物序列
[0173]
[0174][0175]
端粒酶长度定量检测结果表明,过表达bhlhe40的pαs细胞的端粒酶长度高于对照vector组(图10中c右图),说明过表达bhlhe40能逆转pαs细胞的衰老。
[0176]
实施例6分子生物学实验证明体外培养pαs细胞过表达bhlhe40可能通过促进zbp1的表达调控wnt/b-catenin信号通路促进pαs细胞增殖、调控pαs细胞分化
[0177]
实验过程包括如下几个方面:
[0178]
sirna转染
[0179]
(1)pαs细胞融合至80%~90%时,弃原培养液,用无菌pbs缓冲液冲洗2-3次,更换新鲜培养基。按照说明书,将适量的lipo3000和sirna分别加入两管opti-mem培养基中,混匀后室温静置5分钟。将两管液体混合,室温静置20分钟。
[0180]
(2)将混合物加入到细胞培养基中,48小时后检测sirna的转染效率。在细胞进行成骨、成脂和成软骨诱导培养时,每2~3天更换一次培养基,同时加转sirna一次。
[0181]
rt-pcr等实验步骤与实施例2相同。
[0182]
qrt-pcr结果表明,在pm培养条件下,过表达bhlhe40的pαs细胞(bhlhe40组)的wnt3a、ctnnb1和ccnd1的mrna表达水平高于对照vector组(图11中a-c)。过表达bhlhe40的pαs细胞转染sizbp1(bhlhe40+sizbp1组)的zbp1的mrna表达水平显著低于bhlhe40的pαs细细胞转染空载(bhlhe40+sinc组),表明sirna转染成功(图11中d)。bhlhe40+sizbp1组的oct4、nanog的mrna表达水平显著低于bhlhe40+sinc组(图11中e-f)。bhlhe40+sizbp1组的p16、p53的mrna表达水平显著高于bhlhe40+sinc组(图11中g-h)。bhlhe40+sizbp1组的wnt3a、ccnd1的mrna表达水平显著低于bhlhe40+sinc组(图11中i-j),上述结果说明过表达bhlhe40可能通过促进zbp1的表达调控wnt/β-catenin信号通路调控p控通细胞分化。
[0183]
综上所述,本研究明确了转录因子bhlhe40对原代pαs细胞干性维持的关键调控作用及具体调控机制,因此未来可以以bhlhe40为靶点,探索原代mscs在体外安全有效的扩增技术,为促进以mscs为基础的组织工程或细胞治疗的临床转化奠定坚实基础。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1