一种先导编辑系统及基因编辑方法与流程
本发明属于基因编辑,具体涉及一种先导编辑系统及基因编辑方法。
背景技术:
1、目前,基于crispr-cas系统衍生的一系列基因编辑工具为实现基因组的精准编辑带来巨大的希望。最近出现的先导编辑系统(prime editing,pe)代表了一项非常先进的基因编辑技术的突破,它可以在基因组中引入各种类型的碱基突变以及小片段的插入、删除和替换,同时避免造成dna的双链断裂(double stand break,dsb)。
2、先导编辑系统由一个cas9切口酶与逆转录酶融合表达的pe蛋白和一个具有模版及先导作用的prime editing guide rna(pegrna)组成,其中pegrna由3个部分组成,包括single-guide rna(sgrna)、引物结合位点(prime binding site,pbs)和带有编辑信息的反转录模板(reverse transcription template,rt模板)。最初的第一代pe1和第二代pe2在靶位点的编辑效率有限,最后,研究人员构建了pe3/pe3b,通过共表达靶向互补dna单链并造成切口(nick)的nick-sgrna,利用细胞内源性修复机制提高以逆转录链为模版修复的比例,从而进一步提高了编辑的效率。
3、相比于之前的基因编辑系统,先导编辑功能更强,安全性更高,已被广泛应用于水稻、小麦、斑马鱼和小鼠胚胎等多物种的基因组编辑中。但值得注意的是,先导编辑系统仍然存在的一个重要问题就是编辑效率有限。尤其是对几十bp长度的序列做插入、删除和替换编辑时,编辑效率很低,并且由于常用的pe3系统需要两条grna共同发挥作用才能实现有效的编辑,进一步限制了其应用。
4、最近,一系列针对pe系统优化的工作在一定程度上提高了编辑效率,例如,anzalone等人(programmable deletion,replacement,integration and inversion oflarge dna sequences with twin prime editing nature biotechnology,doi.org/10.1038/s41587-021-01133-w)用双pegrna的策略,提高小片段编辑的效率,但是很大程度上增加了pe系统设计的难度和系统本身的复杂度,增加了其应用的难度。另一项研究报告,adikusuma等人(optimized nickase-and nuclease-based prime editing in human andmouse cells.nucleic acids research,doi.org/10.1093/nar/gkab792)利用核酸酶活性的cas9构建先导编辑系统摆脱了对nick-sgrna的依赖,但造成了大量的非精准编辑,并且精准编辑效率低。
5、尽管如此,对于pe的编辑效率在大多数测试的基因组位点仍然是次优的,小片段的编辑仍是pe编辑的一大难点。另外,pe系统对于两条grna的依赖也没有得到改善。
技术实现思路
1、针对现有技术中存在的上述不足,本发明提供了一种先导编辑系统的开发和应用。
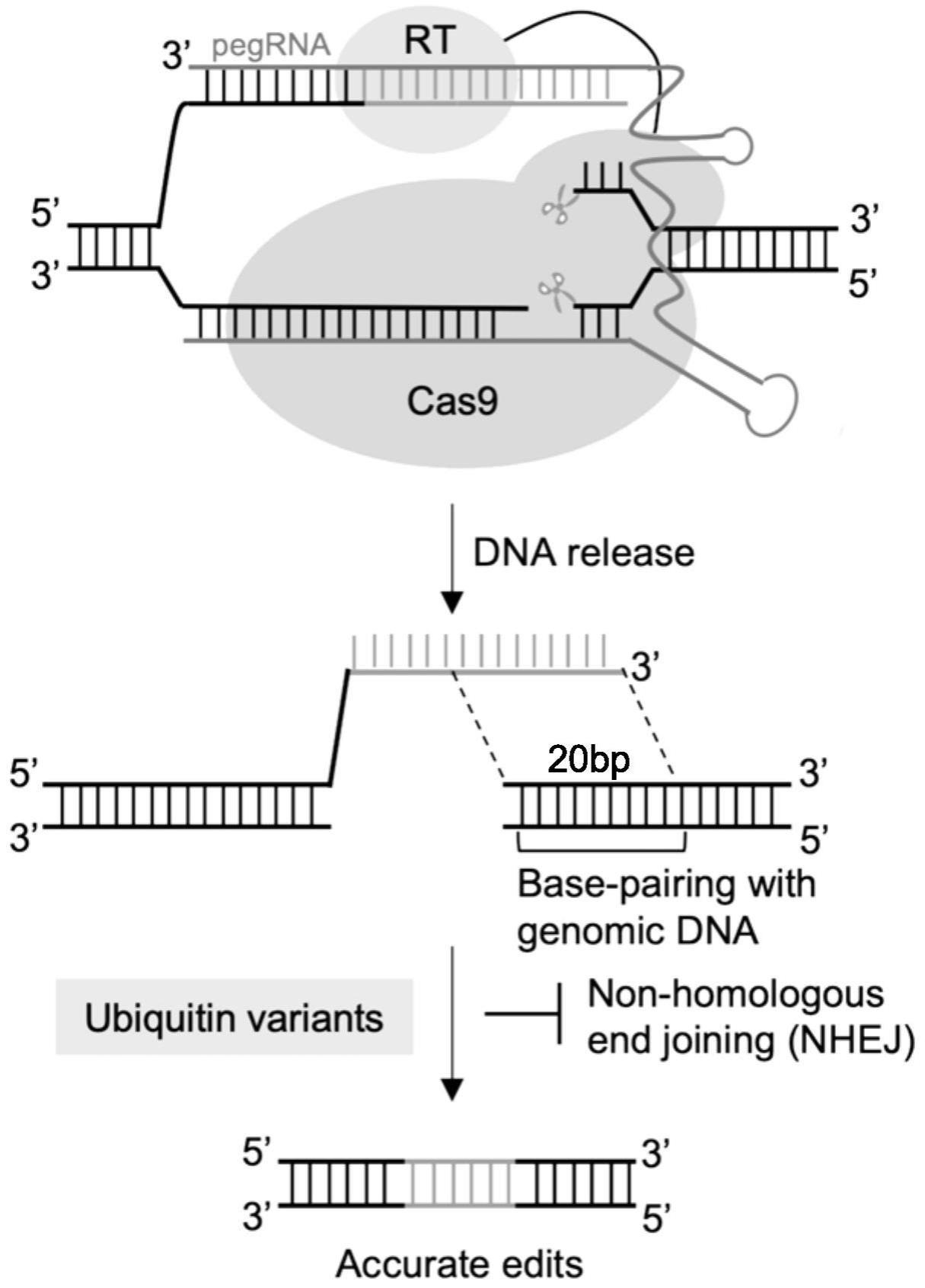
2、一种先导编辑系统,包括具有核酸酶活性的先导编辑器、包含同源序列模板的pegrna,还包括具有非同源末端修复抑制性的蛋白。本发明通过引入具有非同源末端修复抑制性的蛋白,通过抑制非同源末端修复,可以显著降低非精准编辑,提高编辑产物的纯度。
3、优选的,所述非同源末端修复抑制性的蛋白为能够特异性靶向53bp1蛋白并抑制53bp1蛋白活性的蛋白。
4、进一步优选的,所述非同源末端修复抑制性的蛋白为泛素化变体g08或者泛素化变体g08具有i44a突变的突变体,其中泛素化变体g08的氨基酸序列如seq id no:1所示。
5、优选的,所述具有核酸酶活性的先导编辑器包括融合表达的核酸酶活性的cas9蛋白和逆转录酶蛋白。进一步优选的,所述具有核酸酶活性的先导编辑器的氨基酸序列如seqid no:2所示。
6、优选的,包含同源序列模板的pegrna包括带有编辑信息的反转录模板,反转录模板中与基因编辑对象中基因组序列同源的序列长度为15~25bp。最优选为20bp。本发明对修复依赖的同源序列长度进行了优化,通过效率比较发现在15~25bp下效果都较好,并且最佳的长度为20bp。
7、本发明还提供了一种先导编辑用的重组表达序列,用于表达所述先导编辑系统,所述重组表达系统包括:
8、(1)用于表达具有核酸酶活性的先导编辑器的第一基因序列,
9、(2)用于表达具有非同源末端修复抑制性的蛋白的第二基因序列,
10、(3)用于表达包含同源序列模板的pegrna的第三基因序列。
11、优选的,第一基因序列和第二基因序列使用同一表达载体进行表达,并且,第一基因序列和第二基因序列之间通过自切割短肽编码基因序列连接,从而使具有核酸酶活性的先导编辑器与具有非同源末端修复抑制性的蛋白通过自切割短肽进行融合表达。自切割短肽在融合蛋白表达会自动切断,变成两个蛋白。两个蛋白分别去表达,需要增加一个表达载体的转染,结果上看没有差异。好处就是少一个表达载体,更紧凑方便
12、本发明还提供了一种基因编辑方法,使用所述重组表达序列,先根据基因编辑对象中待基因编辑的序列设计pegrna,获得第三基因序列,将第一基因序列、第二基因序列和第三基因序列均导入基因编辑对象中进行基因编辑,获得基因编辑后的产物。
13、本发明基因编辑的类型可以是各种碱基编辑,小片段的插入、删除、替换编辑,组合编辑以及实现条件性或组织特异性编辑。
14、所述基因编辑对象为真核细胞或原核细胞。比如人的细胞或者其他哺乳动物的细胞。优选的,基因编辑对象为人胚胎肾细胞、人宫颈癌细胞或人骨肉瘤细胞,比如,hek293t细胞、hela细胞或u2os细胞。
15、本发明的有益效果是:本发明使用核酸酶先导编辑器结合泛素化变体并通过优化pegrna得到一种效率更高且仅需要一条pegrna的新型先导编辑工具upen。与传统的先导编辑工具相比,其核酸酶活性的先导编辑器不需要额外的nick-sgrna来产生切口提高编辑效率,让pe系统变得更简化,同时双链切割与单链切割激活的修复方式不同,能够摆脱mmr对传统pe的抑制作用,编辑的总体效率增加但编辑的纯度下降。因此,我们在核酸酶先导编辑器的基础上引入一种非同源末端修复抑制性蛋白——泛素化变体,通过抑制非同源末端修复。结果显示,泛素化变体的加入显著降低了非精准编辑提高编辑产物的纯度;同时,我们也对修复依赖的同源序列长度进行优化,通过效率比较找到了最佳的长度,即20bp的同源序列长度;这两种优化方式结合进一步提高了精准编辑效率。基于同源依赖性的修复方式,upen能够实现高效的小片段插入、删除和替换编辑,并且在传统先导编辑器难以编辑的位点也能实现高效编辑,这将有利于进一步扩大先导编辑工具的实用性。
- 还没有人留言评论。精彩留言会获得点赞!