旋毛虫丝氨酸蛋白酶抑制剂在转基因植物生物反应器中的应用
本发明属于蛋白质生物,尤其涉及旋毛虫丝氨酸蛋白酶抑制剂在转基因植物生物反应器中的应用。
背景技术:
1、旋毛虫引起的旋毛虫病是一种重要的人兽共患寄生虫病,其可感染150多种食肉动物和杂食动物,人主要因为生食或半生食含有旋毛虫肌幼虫的肉及肉类产品而感染。旋毛虫病不仅威胁人类公共健康,而且也给动物养殖业和食品安全带来严重的问题。此外,近些年出现了寄生虫对传统的抗蠕虫药的耐药现象,这也迫使尽快研发新的措施来控制这种传染病,开发有效的疫苗是阻止家养动物和人类感染此病的有效措施。
2、转基因植物生物反应器是指通过基因工程技术、利用植物细胞、组织或整株植物来生产疫苗、抗体等医用蛋白及其它生物制剂的生产体系。利用植物作为生物反应器生产医用蛋白产物、诊断试剂或功能食品在生物制药领域中受到广泛的关注,已成为当今医学和生命科学研究领域的热点。转基因植物作为生物反应器生产病原体抗原有许多优点。首先,该系统生产成本低,疫苗生产简单,易于大规模生产,便于冷藏运输。其次,植物表达系统在表达外源蛋白的折叠和组装上跟动物更为相似,从而具有与动物细胞表达产物相似的生物活性和免疫原性。第三这种蛋白加工方式仅仅是利用了土壤、空气和水,可以说是符合绿色、安全环保等特点,在社会节能减排的背景下更加具有优势。第四,植物对胃肠道的酶消化具有抗性,口服给药方法简单。因此转基因植物为开发安全、廉价的动物或人用蛋白提供了一种新的策略具有非常广阔的应用前景和机会。
3、同时,现有技术中针对旋毛虫丝氨酸蛋白酶抑制剂在制备转基因植物生物反应器中的相关研究尚且不足,缺少相关的研究,无法有效的实现相关的应用。
技术实现思路
1、本发明实施例的目的在于提供旋毛虫丝氨酸蛋白酶抑制剂在转基因植物生物反应器中的应用,旨在解决上述背景技术中提出的问题。
2、本发明实施例是这样实现的,旋毛虫丝氨酸蛋白酶抑制剂在转基因植物生物反应器中的应用,所述的转基因植物生物反应器中的应用是通过培育一种表达旋毛虫抗原的大豆植株来实现的。
3、进一步的技术方案,所述的表达旋毛虫抗原的大豆植株的培育方法包括以下步骤:
4、步骤1、目的基因的克隆:
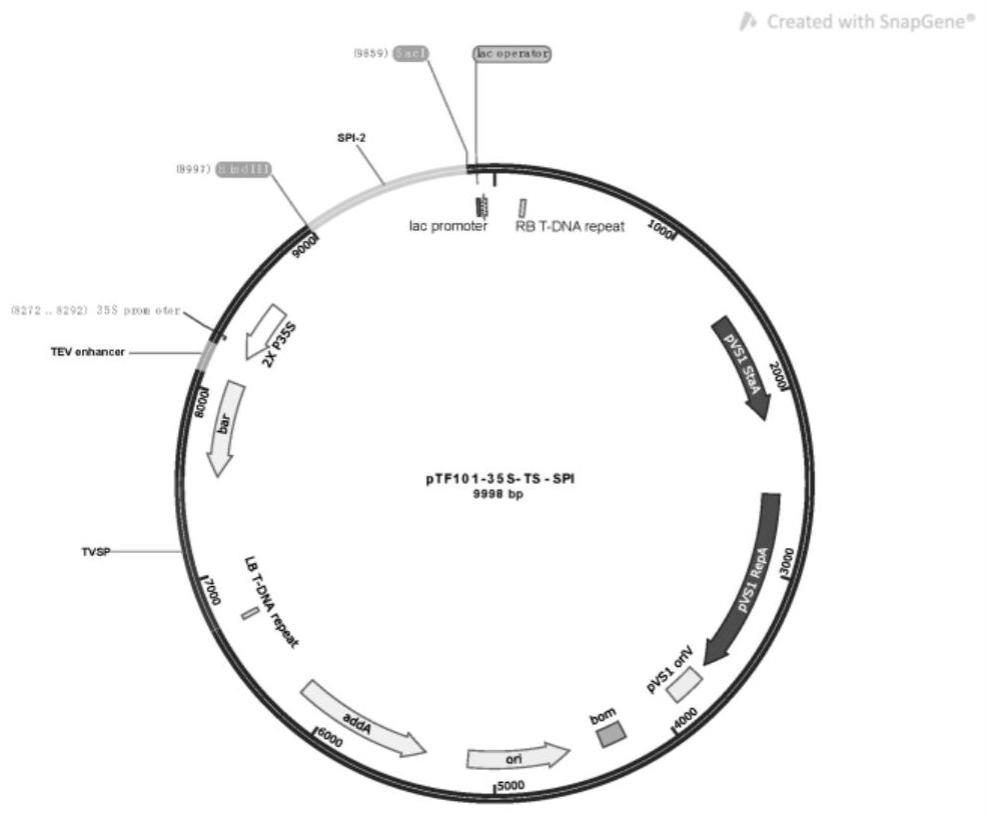
5、根据ncbi上旋毛虫丝氨酸蛋白酶抑制剂(ts-spi)基因序列信息,按照植物密码子偏爱性人工合成基因,同时根据植物双元表达载体多克隆位点分子特征,分别在ts-spi基因上游引入内切酶hidiii酶切位点,下游引入内切酶saci酶切位点。把ts-spi基因片段进行hidiii和saci酶切后连接到ptf101-35s载体上,形成ptf101-35s- ts-spi,具体引物序列如下:
6、ptf101-35s ts-spi f:
7、gcaga acagcaagcttatgttatcggtaatattttctgcag,
8、ptf101-35sts-spi r:
9、gatcggggaaattcgagctcttaccaatacggatacagctgctga,
10、下划线为酶切位点。
11、同时针对ts-spi基因的编码区,设计pcr分子检测扩增特异性引物如下:
12、ts-spi-f:5 '- atgttatcggtaatattttctg -3 ';
13、ts-spi:5 '- ttaccaatacggatacagctgc -3'。
14、以人工合成的ts-spi基因为模板,以ptf101-35s-ts-spi f和r为引物,通过pcr扩增得到含有载体接头序列和ts-spi基因全长pcr片段852bp,然后通过同源重组的方法克隆到ptf101-35s载体中,构建好的质粒经过测序,验证正确的植物表达载体转入农杆菌eha101中,用于下一步大豆遗传转化。
15、步骤2、农杆菌的转化:采用冻融法将质粒ptf101-35s- ts-spi 转化至农杆菌eha101感受态细胞中;
16、步骤3、农杆菌介导的大豆遗传转化:以农杆菌株eha101为工程菌株,将ptf101-35s-ts-spi通过大豆子叶节方法转入受体大豆品种williams82中;
17、步骤4、bar 试纸条检测:
18、取少量嫩绿叶子(约小指甲大小)放入1.5 ml 的离心管中,加入200μl提取缓冲液,用研磨棒捣碎混匀,将试纸条按箭头方向插入混合液中,静止5min后观察结果;若试纸条出现 2 条带表明该植株是 bar阳性植株,若出现 1 条带说明是bar阴性植株,如果没有条带说明操作有误或提取缓冲液不对;
19、步骤5、转基因植株的草丁膦抗性检测:
20、转化载体中以草丁膦作为筛选标记,因此后代采用草丁膦涂抹叶片的方法快速检测转基因苗。具体方法为:用棉签蘸取适量草丁膦( 135 mg·l-1) 溶液, 轻柔擦拭半片叶子,并做好标记,同叶未涂抹的叶子作为对照,在正常光照情况下 3~6d 后观察叶片生长情况。
21、步骤6、转基因植株的pcr检测,利用ts-spi基因引物对t0代转化植株基因组dna进行pcr扩增检测。使用ctab法提取转化植株及对照willimas82的dna,pcr扩增产物通过1%琼脂糖凝胶电泳分离,电泳结果利用凝胶成像系统进行拍照和分析;
22、步骤7、外源目的基因western blot检测:
23、对pcr 检测呈强阳性的转基因植株,利用植物总蛋白提取试剂盒(solarbio,bc3720)提取大豆未成熟种子中的蛋白,将变性后的蛋白样品,采用分离胶为12%、浓缩胶为5%进行sds-page凝胶电泳;电泳结束后,将分离胶按照常规操作进行湿转,将蛋白转印至pvdf膜上,湿转结束后,将pvdf膜置于封闭液(5%脱脂奶粉pbst溶液)中4℃封闭过夜,之后进行一抗孵育,一抗为小鼠抗重组的ts-spi 多抗血清,将该血清使用封闭液体1:200稀释,用稀释后的血清覆盖封闭后的pvdf膜,室温孵育1小时,之后用pbst洗涤pvdf膜3次,5min/次,继续孵育二抗,二抗为经封闭液5000倍稀释的hrp标记的山羊抗小鼠igg的抗体,二抗室温箱孵育1小时,之后经pbst洗涤后,进行ecl化学发光显影,用显影仪器采集图片。
24、进一步的技术方案,所述步骤2的具体操作步骤为:
25、步骤2.1、用冰盒取-80℃冰箱冻存的ptf101-35s感受态细胞,冰浴 10min;
26、步骤2.2、将1µg提取的纯化质粒ptf101-35s- ts-spi 加入 200µl 农杆菌感受细胞中,混匀;
27、步骤2.3、冰浴5-10min,转入液氮冷冻3-5min,迅速置于37℃水浴中热激5min;
28、 步骤2.4、加入500µl 28℃预热的 yep 液体培养基,28℃,200rpm 震荡培养3-4h;
29、步骤2.5、取 200µl 菌液涂布于 yep 固体选择培养基表面(卡那霉素50mg/l+壮观霉素 50mg/l),均匀涂布于整个平板,静止30min,使充分吸收,倒置平板,28℃培养2-3d,观察结果;
30、步骤2.6、待培养基上长出单菌落,挑取单菌落接种于5m l 含有卡那霉素 50mg/l+壮观霉素50mg/l双抗性的yep液体培养中,28℃,160rpm 振荡培养 12~16h。
31、步骤2.7、转化农杆菌 eha101 的 pcr 鉴定:以上述菌液为模板,进行 pcr 鉴定。
32、步骤2.8、保留鉴定结果为阳性的菌液,菌液与甘油按照体积比为 7:3 混合,加入灭菌的2m l 离心管中,-80℃保存,备用。
33、进一步的技术方案,在所述步骤2.7中,pcr 反应采用 20μl 体系,根据ts-spi2基因序列设计引物,
34、上游引物 ts-spi-f: 5’ atgttatcggtaatattttctg -3’;
35、下游引物 ts-spi-r: 5’ ttaccaatacggatacagctgc -3’。
36、菌液 pcr 的组分及用量 :
37、组分 体积
38、2×power taq pcr master mix 10μl
39、ts-spi2-f(10µm) 1μl
40、ts-spi2-r(10µm) 1μl
41、模板 1μl
42、dd h2o 补足至 20μl;
43、反应程序为:94 ℃预变性1 min,95 ℃变性 30 s,57 ℃退火 30 s,72 ℃延伸60s,循环30次,72 ℃后延伸10 min,4 ℃保温,pcr 产物经1%琼脂糖凝胶电泳检测。
44、进一步的技术方案,在所述步骤2中,yep 液体培养基(p h7.0)的制备步骤具体为:用电子天平精确称取胰蛋白胨10g,酵母提取物10g,氯化钠5g,混合置于1l 烧杯中,加入约800m l去离子水,溶解,用1mnaoh调节ph值至7.0,容量瓶中定容至1000m l,高温高压灭菌,4℃保存,备用。
45、进一步的技术方案,在所述步骤2中,yep固体培养基(p h7.0)的制备步骤具体为:用电子天平精确称取胰蛋白胨10g,酵母提取物10g,氯化钠5g,琼脂16g,混合置于1l烧杯中,加入约800m l 去离子水,溶解,用1m naoh调节ph值至7.0,容量瓶中定容至1000m l,高温高压灭菌后,于超净工作台中分装,冷却凝固后,4℃保存,备用。
46、进一步的技术方案,农杆菌介导大豆子叶节转化法包括以下步骤:
47、步骤3.1、农杆菌菌液制备:将含有ptf101-35s-ts-spi质粒的农杆菌28℃培养16h后收集菌体,转入yep液体培养基中(peptone 10g/l,yeast extract10g/l,nacl 5g/l,ph7.0)直至od600值0 .5~0 .7备用;
48、步骤3.2、受体准备:选取大豆受体品种williams82成熟无破损的种子,氯气灭菌16h,灭菌后种子放入gm萌发培养基,培养基配方参照(olhoft et al., 2003,ms+0.8%琼脂+5-10%蔗糖 )弱光萌发16h,获得萌发的大豆种子;
49、步骤3.3、外植体的准备和侵染,采用子叶节法进行农杆菌的侵染转化:切子叶节,从胚轴处将大豆种子一分为二,切时刀尖蘸工程菌液,用手术刀轻刮下胚轴,制造小创口,将切开后的子叶节放入步骤3.1制备好的农杆菌菌液中,轻柔晃动30min,转入共培养基(继代培养基+as(100µmol/l)中,避光培养(23℃,3~5d);
50、步骤3.4、共培养后,将伸长的胚轴切去约3/4,保留约5mm的胚轴,插入加筛选剂的分生培养基(sim)中诱导丛生芽生长,培养条件25℃,光照16h· d-1,光照强度2000lx;
51、步骤3.5、在sim培养基中培养7d后,转入sem筛选培养基中,间隔15d继代1次,筛选3~4轮,得到分生苗;
52、步骤3.6、将已经伸长的分生苗从外置体上切下,转入生根培养基中生根,生根 10d 左右,得到转化苗;
53、步骤3.7、生根健全的转化苗,经炼苗(3~5d)后移入盆中栽培,生根 10 d 左右,温室正常管理。
54、进一步的技术方案,在所述步骤6中,pcr反应体系( 20μl)为:dna模板50 ng,10×buffer 2. 0μl,2. 5 mmol·l-1dntp 1μl,10 μmol·l-1引物各 0. 5 μl,5 u·μl-1taq 酶0. 5μl,加ddh2o补至20 μl;pcr 反应程序: 95℃ ,变性5 min,94℃ ,变性30 s,56℃退火30 s,72 ℃延伸1 min,30个循环,72℃延伸5 min。
55、进一步的技术方案,所述步骤7中的湿转条件为:4℃,70v恒压,2小时。
56、本发明实施例提供的旋毛虫丝氨酸蛋白酶抑制剂在转基因植物生物反应器中的应用,通过提供一种有效表达旋毛虫抗原的大豆植株来实现旋毛虫抗原在转基因植物生物反应器的应用,为开发安全、廉价的动物或人用蛋白提供了一种新的策略具有有非常广阔的应用前景和机会。
- 还没有人留言评论。精彩留言会获得点赞!