一种可视化即时检测微流控芯片及其检测方法
1.本发明属于微流控芯片制造技术和基因诊断领域,具体涉及一种可视化即时检测微流控芯片及其检测方法。
背景技术:
2.水稻是是世界重要的粮食作物,水稻的高产和稳产对于中国乃至全世界的粮食生产安全都有着举足轻重的作用。但是近年来,由于杂交水稻大面积推广和稻田肥水水平提高,稻曲病由历史上的次要病害演变为当前水稻生产上“新三大病害”之一。稻曲病菌可产生子囊孢子、厚垣孢子和薄壁分生孢子。其中,稻曲病孢子以厚垣孢子萌发的分生孢子为主要侵染源,通过气体传播,且传播速度很快。随着
‘
甬优12’为代表的甬优系列籼粳交超级稻的大面积推广和应用,稻曲病发病加重,严重时可造成20%~30%的产量损失。稻曲病不仅严重影响水稻的产量和品质,稻曲病菌产生的毒素ustiloxins,也对人、动物、植物的细胞分裂有强烈的抑制作用,食用后可引起人畜腹泻、早产、甚至流产等中毒现象,甚至死亡,这对稻米的食用安全带来严重的威胁。
3.迄今为止,以气传孢子为媒介的稻曲病检测方法主要有液相色谱法、流式细胞法、形态学显微图像识别法、以及分子生物学法等。前两种方法的准确度较高,但是实验步骤较为复杂。为了能够实现稻曲病的快速检测,国内外展开了广泛研究,其中,显微图像识别法通过对捕捉到的孢子形状及纹理进行特征学习与比对,从而实现快速检测,应用最为广泛。但是空气中的复杂颗粒多,且稻曲病孢子和多数霉菌孢子的尺寸都在3~8微米,形态表征均为圆形,这直接导致常规显微图像法无法有效区分,所以显微图像识别法的准确率较低。以聚合酶链式反应(pcr)为代表的分子生物学方法被广泛应用于稻曲病孢子检测,但是因其需要特定的实验室检测及专业人员操作,且实验流程繁琐,不适合对稻曲病进行即时检测。环介导等温扩增(lamp)不仅具有很高的灵敏度和特异性,而且还可以使用羟基萘酚蓝(hnb)、钙黄绿素和sybr green i等染料进行可视化检测。lamp反应不需要复杂的热循环系统,更适合小型化仪器。但是这种方法预处理样本费时费力,对试剂的需求量较大,且开盖操作会增大假阳性率,难以直接满足即时检测的需要。
4.随着微流控技术的发展,利用微流体动力学技术实现液体中微颗粒的分离、富集理论已日趋成熟。但是,微尺度液流属性与气流有较大不同,气传孢子等微颗粒的分离富集机理尚不清晰。且稻曲病孢子需要通过破壁提取dna,效率低下且限制了即时检测的实际操作。因此,亟需建立一种快速而准确的稻曲病孢子的检测方法。
技术实现要素:
5.针对现有技术中存在的一些不足,本发明提供了一种可视化即时检测微流控芯片及其检测方法;本发明所述可视化即时检测稻曲病菌核酸的微流控芯片集孢子收集、孢子核酸快速释放、扩增及可视化检测等功能为一体;所述微流控芯片结构简单,其检测方法具有快速、无需大型仪器的特点,能够实现对各类真菌孢子尤其是稻曲病孢子的快速检测。
6.本发明是通过以下技术手段实现上述技术目的的。
7.本发明中首先提供了一种可视化即时检测微流控芯片,所述微流控芯片包括上层基片和与上层基片键合的下层底片;
8.所述上层基片中设有孢子纯化区、孢子裂解区、核酸稀释区和可视化检测区;
9.所述孢子纯化区包括样本入口、第一大颗粒分离区、第二大颗粒分离区和收集区;所述样本入口、第一大颗粒分离区、第二大颗粒分离区和收集区之间依次通过第一通道、第二通道和收缩-膨胀通道连通;
10.所述孢子裂解区包括裂解池和设在裂解池上的裂解试剂入口;
11.所述核酸稀释区包括稀释池和设在稀释池上的稀释试剂入口;
12.所述可视化检测区设有阴性对照区和阳性检测区,所述阳性检测区包括第一检测池和设在其上第一反应试剂入口,所述阴性对照区包括第二检测池和设在其上第二反应试剂入口;所述阴性对照区和阳性检测区之间通过微流控通道连通;
13.所述孢子纯化区、孢子裂解区、核酸稀释区和可视化检测区之间依次设有相连接的微流控通道。
14.进一步地,孢子纯化区、孢子裂解区、核酸稀释区、阴性对照区和阳性检测区之间的微流控通道上分别设有控制流体的第一微阀、第二微阀、第三微阀和第四微阀。
15.进一步地,所述第一微阀、第二微阀、第三微阀和第四微阀包括手动微阀,所述手动微阀通过在微流控通道上打孔,孔中塞入软塞得到,所述软塞的材质是硅胶。
16.进一步地,孢子纯化区上还设有与收集区连接的缓冲试剂入口。
17.进一步地,所述可视化检测区中,阴性对照区和阳性检测区对称布置。
18.进一步地,所述样本入口、缓冲试剂入口、裂解试剂入口、稀释试剂入口、第一反应试剂入口和第二反应试剂入口处均设置封堵膜优选地,所述封堵膜为pvdc(聚偏二氯乙烯)膜。
19.进一步地,所述上层基片的材质为pdms(聚二甲基硅氧烷),所述下层底片的材质为玻璃硅片。
20.本发明中还提供了上述可视化即时检测微流控芯片的制备方法,具体包括:
21.(1)使用显影剂显影附有微流控通道图案的感光干膜,得到微流控芯片掩膜;
22.(2)将铸膜溶液浇在步骤(1)制得的微流控芯片掩膜上,并用镂空的pmma(有机玻璃)板固定。
23.(3)将真空泵抽取铸膜溶液中的气泡,并将其放置于干燥箱中静置,得到具有微流控通道结构的上层基片。
24.(4)采用打孔器将区域之间的微通道打孔,以实现流体控制;
25.(5)等离子机键合由步骤(3)获得的上层基片以及键合时用到的下层基片,将上层基片和下层底片放置在加热台上加热,进行进一步键合。
26.进一步地,步骤(3)中,所述真空泵抽取铸膜溶液中的气泡的时间为30min~1h;所述静置时间为3~3.5h。
27.进一步地,步骤(5)中,所述加热的时间为20min-30min。
28.本发明中还提供了上述微流控芯片在真菌孢子可视化检测中的应用,具体的所述真菌孢子包括稻曲病孢子。
29.本发明中还提供了一种微流控芯片可视化检测真菌孢子的方法,所述方法包括如下步骤:
30.(1)孢子收集:
31.将含有真菌孢子的水溶液置于气溶胶发生器中,依次通过真空泵、控制流量的转子流量计与微流控芯片相连接,在微流控芯片的孢子纯化区获得目标孢子;
32.(2)孢子的核酸提取:
33.将缓冲液从微流控芯片的缓冲试剂入口处加入到收集区,并与收集区的孢子混合,然后开启第一微阀,将缓冲液引入孢子裂解区,将裂解液通过裂解试剂入口加入到孢子裂解区,然后关闭第一微阀与第二微阀,将微流控芯片加热处理,加热完成后得到裂解后的粗组织液;
34.接着打开第二微阀,并将所述裂解后的粗组织液引入到核酸稀释区,将去离子水从稀释试剂入口加入到核酸稀释区,并进行加热处理,得到稀释后的粗组织液;
35.(3)孢子的核酸检测:
36.打开第三微阀,将稀释后的粗组织液移到阳性检测区,从第一反应试剂入口加入lamp反应液,然后封堵第一反应试剂入口;从第二反应试剂入口加入lamp反应液到阴性对照区,然后封堵第二反应试剂入口,并将微流控芯片加热,记录检测结果。
37.进一步地,所述lamp反应液包括真菌孢子等温扩增引物、反应缓冲液、甜菜碱、mg
2+
、dntp、sybr green i、bst dna聚合酶以及去离子水。
38.进一步地,当所述真菌孢子为稻曲病孢子时,所述等温扩增引物包括如seq id no:1~seq id no:6所示的核苷酸序列。
39.所述序列具体为:
[0040][0041]
所述lamp反应液包括0.2μl 5μm f3,0.2μl 5μm b3,0.8μl 10μm fip,0.8μl 10μm bip,0.4μl 5μm lf,0.4μl 5μm lb,1μl 10
×
反应缓冲液(无mg2+),1.2μl甜菜碱,0.4μl 100mm mgso4,1.4μl 10mm dntp,1μl sybr green i,0.4μl bst dna聚合酶,0.3μl去离子水。
[0042]
进一步地,步骤(1)中,所述流量为5~19ml/min,更优选为13ml/min。
[0043]
进一步地,步骤(2)中,所述加热反应均为在40~60℃下加热30~50min;优选地所述加热反应均为在60℃下加热50min。
[0044]
所述微流控芯片置于加热板上40~60℃加热30~50min,更优选为60℃加热50min。
[0045]
进一步地,步骤(2)中,所述缓冲液、裂解液、转移的粗组织液和去离子水的用量比为6μl:4μl:0.5μl:9.5μl。
[0046]
进一步地,步骤(3)中,第一反应试剂入口加入的lamp反应液的用量为8.5μl,稀释
后并转移到阳性检测区的粗组织液用量为1.5μl。
[0047]
进一步地,步骤(3)中,所述微流控芯片加热的条件为在60~70℃下加热40~80min,优选地,在65℃下反应60min。
[0048]
进一步地,步骤(3)中,记录检测结果的步骤为:采用蓝光手电筒照射,附加520nm滤光片后的智能手机拍照记录结果。
[0049]
与现有技术相比,本发明的有益效果在于:
[0050]
本发明设计并制作了集孢子收集、核酸释放、等温扩增和可视化检测的pdms微流控芯片,实现了稻曲病孢子样本中的稻曲病菌的快速即时检测。快速收集气传孢子,将裂解液与孢子混合,简化了核酸纯化过程,达到快速释放核酸的目的。
[0051]
本发明中采用气压驱动与软塞控制流体流向,反应液中加入sybr green i作为指示剂,无需任何大型仪器即可在1小时内完成对结果的可视化检测。本发明所述微流控芯片结构简单,其检测方法具有快速、无需大型仪器的特点,能够实现对各类真菌孢子尤其是稻曲病孢子的快速检测。
[0052]
本发明中采用收缩膨胀结构进行孢子的收集,相较于一般的分离结构,如直线、弯曲、螺旋结构,收缩膨胀结构在这些结构优点的基础上,还会产生芯片内壁相互作用力的突然变化,从而提升孢子与其他杂质颗粒的分离程度,进而提高孢子的收集率。
附图说明
[0053]
图1为本发明所述微流控芯片的结构示意图。
[0054]
图2为本发明所述实施例1中检测稻曲病菌的微流控芯片的结构示意图。
[0055]
图3为微流控芯片的检测结果示意图,其中a部分的1-6分别为稻曲病菌、稻瘟病菌、立枯丝核菌、米黄单胞菌、赤霉病菌和镰刀菌的可视化检测结果,ntc为阴性对照组的可视化检测结果,b部分为a部分荧光信号的snr值,c部分为a部分对应的电泳图。
[0056]
图4为微流控芯片用于检测稻曲病的受试者工作特征曲线(roc)。
[0057]
附图标记:
[0058]
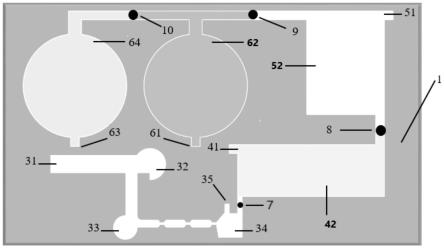
1-上层基片;2-下层底片;3-孢子纯化区;31-样本入口;32-第一大颗粒分离区;33-第二大颗粒分离区;34-收集区;35-缓冲试剂入口;4-孢子裂解区;41-裂解试剂入口;42-裂解池;5-核酸稀释区;51-稀释试剂入口;52-稀释池;6-可视化检测区;61-第一反应试剂入口;62-第一检测池;63-第二反应试剂入口;64-第二检测池;7-第一微阀;8-第二微阀;9-第三微阀;10-第四微阀。
具体实施方式
[0059]
下面结合附图以及具体实施例对本发明作进一步的说明,但本发明的保护范围并不限于此。
[0060]
实施例1:
[0061]
如图1~2所示,本发明所述可视化即时检测的微流控芯片包括pdms材质上层基片1和与上层基片1键合的玻璃硅片材质的下层底片2,所述上层基片1和下层底片2的形状优选为四边形。
[0062]
如图1~2所示,所述上层基片1中设有孢子纯化区3、孢子裂解区4、核酸稀释区5和
可视化检测区6,各分区之间采用微流控通道连接。其中,所述孢子纯化区3包括样本入口31、第一大颗粒分离区32、第二大颗粒分离区33和收集区;所述样本入口31、第一大颗粒分离区32、第二大颗粒分离区33和收集区34之间依次通过第一通道、第二通道和收缩-膨胀通道连通。所述孢子纯化区3还包括与收集区34连接的缓冲试剂入口35,收集区34通过微流控通道与孢子裂解区4上的裂解池42连通,所述裂解池42上还设有裂解试剂入口41。在具体使用过程中,所述缓冲试剂入口35还可以充当小颗粒分离出口,进行小颗粒的分离。
[0063]
如图1~2所示,所述核酸稀释区5包括稀释试剂入口51和稀释池52,所述稀释试剂入口51设置在稀释池52上,所述稀释池52与裂解池42通过微流控通道连通。所述可视化检测区6设有对称分布的阴性对照区和阳性检测区,所述阳性检测区包括第一检测池62和设在其上第一反应试剂入口61,所述阴性对照区包括第二检测池64和设在其上第二反应试剂入口63;所述阴性对照区和阳性检测区之间通过微流控通道连通。
[0064]
如图1~2所示,所述孢子纯化区3、孢子裂解区4、核酸稀释区5、阴性对照区和阳性检测区之间的微流控通道上分别设有控制流体的第一微阀7、第二微阀8、第三微阀9和第四微阀10。在本实施例中,所述第一微阀7、第二微阀8、第三微阀9和第四微阀10均采用手动微阀,所述手动微阀为在芯片成型后将微流控通道打孔,圆孔直径与通道直径一致,圆孔中塞入硅胶材质的软塞得到。所述手动微阀通过软塞插拔实现流体的控制,适合在现场、野外进行实时操作。
[0065]
在实际使用过程中,所述样本入口31、裂解试剂入口41、稀释试剂入口51、第一反应试剂入口61和第二反应试剂入口63处均设置封堵膜,优选地,所述封堵膜为pvdc(聚偏二氯乙烯)膜。
[0066]
实施例2:
[0067]
本实施例为实施例1所述的微流控芯片的制备方法,其包括如下步骤:
[0068]
步骤(1):采用微加工技术制备微流控芯片:将附有微流控通道图案的菲林片与感光干膜贴合,通过曝光机70s的曝光和显影液对感光干膜进行显影,得到微流控芯片掩膜;
[0069]
步骤(2):将铸膜溶液浇在步骤(1)制得的微流控芯片掩膜上,并用镂空的pmma板固定;
[0070]
步骤(3):用真空泵抽取步骤(2)中的铸膜溶液的气泡1小时,并将其放置于干燥箱中静置3小时,以获得具有微流控通道结构的上层基片;
[0071]
步骤(4):采用打孔器将区域之间的微通道打孔,以实现流体控制;
[0072]
步骤(5):等离子机键合由步骤(3)获得的上层基片以及键合时用到的下层底片,将上层基片和下层底片放置在加热台上加热30min,进行进一步键合,制备成可检测稻曲病核酸的微流控芯片。
[0073]
实施例3:
[0074]
本实施例中以稻曲病孢子为例,采用实施例1中所述微流控芯片来进行真菌孢子的检测,但本发明所述微流控芯片的检测范围不仅限于稻曲病孢子,具体检测方法如下所示:
[0075]
1.使用lamp引物设计软件primerexplorer v5,根据稻曲病菌g544(genbank no.ky617817.1)基因设计等温扩增引物;所述引物如下所示:
[0076]
f3:gcaagtctgcatcccaagtc(seq id no:1);
[0077]
b3:cgacggcagcttcatgg(seq id no:2);
[0078]
fip:tgcaaagagactgactggccccttgcgacccgaacccg(seq id no:3);
[0079]
bip:cctccggttccatcccacgagctggaggggagcga(seq id no:4);
[0080]
lf:tgtttcaggaaccttgggtgg(seq id no:5);
[0081]
lb:tcctgctgccttaccgc(seq id no:6)。
[0082]
2.配置lamp反应体系(10μl体系):
[0083]
5μm f3 0.2μl;5μm b3 0.2μl;10μm fip 0.8μl;10μm bip 0.8μl;5μm lf 0.4μl;5μm lb 0.4μl;10
×
反应缓冲液(无mg2+)1μl;甜菜碱1.2μl;100mm mgso
4 0.4μl;10mm dntp 1.4μl;sybr green i 1μl;bst dna聚合酶0.4μl;去离子水0.3μl;dna 1.5μl(来自收集区中的孢子)。
[0084]
3.稻曲病孢子的检测:
[0085]
(1)稻曲病孢子的收集:
[0086]
采集稻曲病厚垣孢子球,轻刮至去离子水中,振荡后获得孢子水溶液;将孢子水溶液置于气溶胶发生器中,通过真空泵的驱动与转子流量计的流量控制,在孢子纯化区3获得稻曲病孢子。(稻曲病厚垣孢子球由中国水稻研究所提供)
[0087]
(2)稻曲病菌的核酸提取:
[0088]
①
将6μl缓冲液从缓冲试剂入口35处加入到微流控芯片的收集区34,与收集区34中的孢子混合,然后将含有孢子的缓冲液引入孢子裂解区4。
[0089]
②
将4μl裂解液从裂解液入口41加入到孢子裂解区4的裂解池42中,关闭第一微阀7和第二微阀8。
[0090]
③
将微流控芯片置于加热台上于60℃下加热50min得到粗组织液,打开第二微阀8。
[0091]
④
将裂解后的粗组织液取0.5μl移至稀释区,并将9.5μl去离子水加入到稀释区,关闭第二微阀8和第三微阀9,短暂加热芯片1分钟。
[0092]
(3)稻曲病菌可视化检测
[0093]
①
打开第三微阀9,将1.5μl稀释后的粗组织液移至可视化检测区。
[0094]
②
从反应试剂入口61加入8.5μl lamp反应液,关闭第三微阀9,封堵反应试剂入口61;从反应试剂入口63加入10μl lamp反应液,关闭第四微阀10,封堵反应试剂入口63。将微流控芯片置于加热台上于65℃加热60min。
[0095]
③
采用蓝光手电筒照射,附加520nm滤光片后的智能手机拍照记录结果。。
[0096]
本实施例中还采用上述方法检测其他五种水稻易感病原体,包括稻瘟病菌、立枯丝核菌、稻黄单胞菌、赤霉病菌和镰刀菌,用于考察所述微流控芯片检测稻曲病菌的特异性。所述检测步骤与稻曲病菌可视化检测相同,记录的结果进行比较。比较步骤为:采用matlab r2016b评估处理后获得的灰度图像的信号强度,将无模板对照(ntc)的均值记录为n(噪声),而将稻曲病菌的稀释dna靶标的均值记录为s(信号)。此外,归一化强度为信噪比(snr),其定义为snr=s/n。
[0097]
上述检测结果如图3所示,其中a部分的1-6分别为稻曲病菌、稻瘟病菌、立枯丝核菌、米黄单胞菌、赤霉病菌和镰刀菌的可视化检测结果,ntc为阴性对照组的可视化检测结果。b部分为a部分荧光信号的snr值,c部分为a部分对应的电泳图。从图中可以看出,a部分
中,1的荧光效果最明显,2-6的荧光很暗;b部分中,1的信噪比最高,为3.8;而2-6的信噪比均低于1.5;c部分仅有1泳道出现扩增条带。这说明所述引物仅对稻曲病菌特异。
[0098]
本实施例中还采用上述方法将微流控芯片测定稻曲病的准确性与rt-pcr试剂盒进行比较,并通过kappa检验(使用spss软件)和接受者操作特征曲线(roc)(使用medcalc软件)进一步评估,检测结果如表1所示:
[0099]
表1.检测结果表
[0100][0101]
从表1中可以看出,微流控芯片检测稻曲病的灵敏度、特异性和准确度分别为94.12%、100%和97.5%。同时,图4的roc表明auc
roc
为0.971,p《0.001,youden指数为0.9412,这同样表明微流控芯片的检测是一种有效的诊断方法。并且,kappa一致性分析证实了两种检测方法之间的高度一致性(0.948为kappa值)。
[0102]
由上述实施例可知,本发明提供了一种集孢子收集、孢子核酸快速释放、扩增及可视化检测于一体的微流控芯片,其可快速、可视化即时检测稻曲病孢子,利用该微流控芯片的检测方法具有快速、简单、无需大型仪器的特点,可应用于各类与稻曲病孢子形态相似的真菌孢子的即时检测。
[0103]
所述实施例为本发明的优选的实施方式,但本发明并不限于上述实施方式,在不背离本发明的实质内容的情况下,本领域技术人员能够做出的任何显而易见的改进、替换或变型均属于本发明的保护范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1