一种增强体外培养二型肺泡上皮细胞扩增能力的方法及其药物组合
1.本发明涉及肺泡上皮细胞培养方法技术领域,具体涉及一种增强体外培养二型肺泡上皮细胞扩增能力的方法及其药物组合。
背景技术:
2.肺泡上皮细胞分离自肺组织,包括一型肺泡上皮细胞(at1)和二型肺泡上皮细胞(at2);一型肺泡上皮细胞,基底部是基底膜,无增殖能力。二型肺泡上皮细胞分泌表面活性物质(二棕榈酰卵磷脂),以降低肺泡表面张力。二型肺泡上皮细胞立方形或圆形,顶端突入肺泡腔,细胞核圆形,胞质着色浅、呈泡沫状。电镜下,细胞游离而有少量微绒毛,胞质内富含线粒体和溶酶体,有较发达的粗面内质网和高尔基复合体。核上方有较多的分泌颗粒,电子密度高、大小不等。二型肺泡上皮细胞有分裂、增殖并分化为一型肺泡上皮细胞的潜能,故具有修复受损伤上皮的作用。二型肺泡上皮细胞作为肺部重要的细胞群,在肺损伤修复,炎症调控,肺顺应性维持等方面具有重要作用。
3.体外分离培养、扩增二型肺泡上皮细胞,在干细胞治疗、细胞自身功能探索方面具有重要的实际作用及研究价值。现有技术中,针对小鼠的二型肺泡上皮细胞分离培养方法主要为:利用免疫黏附法纯化小鼠ⅱ型肺泡上皮细胞,将肺组织细胞悬液接种入小鼠igg包被平皿,收集未黏附的细胞,经离心纯化获得小鼠ⅱ型肺泡上皮细胞;然后,使用dmem/f12完全培养基悬浮纯化的细胞。目前,分离二型肺泡上皮细胞进行体外培养的难点在于:(1)该细胞属于祖细胞,具有分化为一型肺泡上皮细胞的潜能,自然培养条件下,二型肺泡上皮细胞将于分离贴壁48h内发生分化,失去干性及二型肺泡上皮细胞特征;(2)若采取控制培养条件的手段维持at2干性及自身表型,细胞扩增将受到限制。亟需研发一种既能够避免二型肺泡上皮细胞分化,又能够促进二型肺泡上皮细胞扩增的培养方法,以满足科研以及新型干细胞药物开发的需求。
技术实现要素:
4.本发明意在提供一种增强体外培养二型肺泡上皮细胞扩增能力的组合药物,以解决现有技术中的二型肺泡上皮细胞的体外培养和扩增的方法不能同时避免细胞分化和促进细胞扩增的技术问题。
5.为达到上述目的,本发明采用如下技术方案:
6.一种增强体外培养二型肺泡上皮细胞扩增能力的组合药物,其包括阿替美唑和右美托咪定。
7.本方案还提供了一种增强体外培养二型肺泡上皮细胞扩增能力的组合药物在细胞培养中的应用,先使用阿替美唑处理二型肺泡上皮细胞,再使用含有右美托咪定的培养基对二型肺泡上皮细胞进行培养。
8.本方案还提供了一种增强体外培养二型肺泡上皮细胞扩增能力的方法,包括以下
依次进行的步骤:
9.s1:使用阿替美唑处理二型肺泡上皮细胞:
10.s2:使用含有右美托咪定的培养基培养二型肺泡上皮细胞。
11.进一步,阿替美唑和右美托咪定的用量比为1-5:1-5。
12.进一步,阿替美唑和右美托咪定的工作浓度均为1-5μm。
13.进一步,阿替美唑的作用时间为30-45min。
14.进一步,所述组合药物为二型肺泡上皮细胞的增殖促进剂、二型肺泡上皮细胞的干细胞性能的促进剂、以及二型肺泡上皮细胞的表面活性物质分泌性能的促进剂。
15.进一步,在s1中,将二型肺泡上皮细胞接种于空白培养基中,培养48h后在空白培养基中添加终浓度为1-5μm的阿替美唑,再培养30-45min。
16.进一步,在s2中,将添加有阿替美唑的空白培养基更换为含有右美托咪定的培养基,持续对二型肺泡上皮细胞进行培养;右美托咪定的浓度为1-5μm。
17.进一步,在s1和s2中,细胞培养环境均为37℃、5%co2培养箱;空白培养基为含有10%澳洲胎牛血清的dmem/f12培养基。
18.进一步,在s2中,二型肺泡上皮细胞的接种量为5
×
105/ml;在s2中,含有右美托咪定的培养基为添加有右美托咪定的空白培养基。
19.综上所述,本方案的原理及优点是:
20.右美托咪定(dexmedetomidine,dex)为现有技术中的α2-肾上腺素受体激动剂,发明人在探索其促进二型肺泡上皮细胞增殖的机制过程中,发现联合使用α2-肾上腺素受体拮抗剂阿替美唑(atipamezole,atip)后,整体促增殖作用得到增强,且能维持二型肺泡上皮细胞相应蛋白表达特征。上述组合药物用于促进二型肺泡上皮细胞的增殖,并维持二型肺泡上皮细胞的干细胞性能,以及维持二型肺泡上皮细胞的表面活性物质分泌性能。
21.现有技术中普遍认为阿替美唑为α2-肾上腺素受体拮抗剂,右美托咪定为α2-肾上腺素受体激动剂,两者作用机制相反,如果将两者联合使用会出现作用效果相抵消的现象。在针对小鼠干细胞再生的试验中,也出现了联合使用阿替美唑和右美托咪定时不能促进细胞增殖的现象。但是,当发明人将二者联合应用到二型肺泡上皮细胞的体外培养中时,at2细胞的增殖能力、干性和分泌能力得到了非常显著地提升,这是发明人在实验之前所未能预料的。
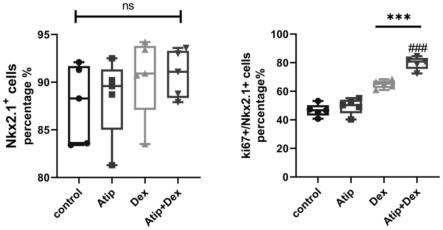
22.本发明所提出的方法,操作简便,费用低廉,效果确切,可以与其他方法联合应用,可在体外维持较长时间at2自身特征的同时促进其自然增殖,具有重要的现实意义和良好的应用前景。
附图说明
23.图1为实施例1的不同浓度dex处理下at2细胞增殖活性统计图(mts法,***表示与control相比,p<0.001)。
24.图2为实施例2的atip和dex联合使用后,at2细胞增殖活性、增殖相关膜配体mrna转录水平和生长因子浓度水平统计图(mean
±
sd,n=6,###表示该组vs.dex组,p<0.001;####表示该组vs.dex组,p<0.0001;***表示与control组比,p<0.001;**表示与control组比,p<0.01)。
25.图3为实施例2的atip和dex联合使用后,at2细胞单克隆细胞集落显微图片。
26.图4为实施例2的不同处理条件下,at2干性相关标记物nkx2.1与细胞增殖标记物ki67共染色的免疫荧光图片(红色荧光ki67,蓝色荧光dapi,绿色荧光nkx2.1)。
27.图5为实施例2的不同处理条件下,at2干性相关标记物nkx2.1与细胞增殖标记物ki67共染色的免疫荧光信号统计图(100
×
随机选取5个视野,以指定染色细胞占总细胞的百分数(%)表示,mean
±
sd,n=5,###表示该组vs.dex组,p<0.001;***表示与control组比,p<0.001;ns表示划定的多组之间不存在显著差异)。
28.图6为实施例2的不同处理条件下,at2特异性分泌的表面活性物质sftpc的wb检测结果图以及相对表达量统计图(相对表达量表示为sftpc条带灰度值/内参gapdh条带灰度值;mean
±
sd,n=3;**表示与其它组相比,p<0.01)。
29.图7为实施例2的不同处理条件下,促增殖相关核转录因子β-catenin的免疫荧光图像(红色荧光β-catenin,蓝色荧光dapi)。
30.图8为实施例2的不同处理条件下,促增殖相关核转录因子taz、at2特异性分泌的表面活性物质sftpc、细胞增殖标记物ki67、at2干性相关标记物nkx2.1的免疫荧光图像(上排:红色荧光ki67,蓝色荧光dapi,绿色荧光sftpc;下排:红色荧光nkx2.1,蓝色荧光dapi,绿色荧光taz)。
31.图9为对比例1的小鼠肝脏/体重比值的统计图。
32.图10为对比例1的不同处理下,细胞增殖标记物ki67阳性细胞的统计图。
具体实施方式
33.下面结合实施例对本发明做进一步详细的说明,但本发明的实施方式不限于此。若未特别指明,下述实施例以及实验例所用的技术手段为本领域技术人员所熟知的常规手段,且所用的材料、试剂等,均可从商业途径得到。
34.实施例1:右美托咪定(dexmedetomidine,dex)对二型肺泡上皮细胞的增殖活性的影响研究
35.二型肺泡上皮细胞(at2)的获取为现有技术,参照文献进行(jansing nl,mcclendon j,kage h,et al.isolation of rat and mouse alveolar type ii epithelial cells.methods mol biol.2018;1809:69-82.doi:10.1007/978-1-4939-8570-8_6),从小鼠肺组织中分离获得at2细胞。获取at2细胞后,进行后续的培养。将at2细胞以5
×
105/ml的接种量接种于含有10%澳洲胎牛血清(gibco公司)的dmem/f12培养基(gibco公司),置37℃、5%co2培养箱内培养,培养48h后给药(不更换培养基),使得培养基中含有不同终浓度的dex(具体浓度梯度值参见图1)。按照上述给药方法初步探索了不同浓度dex对at2的促增殖作用,在dex持续作用24h后(可以一直使用含有右美托咪定的培养基对细胞进行培养以及传代培养,此处取24h的原因是业内使用药物作用后,一个常规的细胞增殖观察时间点),对at2的的增殖活性使用mts法进行检测。实验结果参见图1,由实验结果可知1-5μm浓度的dex具有较强的促增殖活性。
36.实施例2:阿替美唑(atipamezole,atip)和右美托咪定(dexmedetomidine,dex)联合作用效果研究
37.在确认dex的最佳浓度后,发明人接着先使用α2-肾上腺素受体拮抗剂atip进行预
处理,再使用dex处理,以探索dex促增殖效果变化。本方案中,采用的阿替美唑(atipamezole,atip,式ⅰ,cas:104054-27-5;化学式:c
14h16
n2)和右美托咪定盐酸盐(dexmedetomidine hcl,dex,式ⅱ,cas:145108-58-3;化学式:c
13h17
cln2),具体结构式如下:
[0038][0039]
在本实施例中,atip的用量参考药物说明书及领域内常用方案,给药剂量采用dex给药的相同剂量,给药时间采用30-45min。即at2细胞的处理方法为:
[0040]
将at2细胞以5
×
105/ml的接种量接种于含有10%澳洲胎牛血清(gibco公司)的dmem/f12培养基(gibco公司),培养48h后给药atip(不更换培养基),atip的终浓度控制在1-5μm(本实施例具体采用2.5μm),置37℃、5%co2培养箱内培养,细胞孵箱培养30-45min(本实施例具体采用40min);然后将培养基更换为含有dex的培养基,dex的终浓度控制在1-5μm(本实施例具体采用2.5μm),置37℃、5%co2培养箱内培养24h,然后更换为不含药物的培养基进行常规培养(可以一直使用含有右美托咪定的培养基对细胞进行培养以及传代培养,此处取24h的原因是业内使用药物作用后,一个常规的细胞增殖观察时间点)。dex给药后24h分别进行细胞活性检测、增殖相关膜配体delta1、jagged1的mrna转录水平检测,并检测细胞培养基上清液中相关生长因子浓度(tgfβ、wnt5a、pdgf)。实验数据参见图2,control组是在上述的培养过程不使用atip和dex(对应的步骤不添加该药物);atip组是在上述的培养过程只使用2.5μm atip对细胞进行处理(dex在对应的步骤中不添加);dex组是在上述的培养过程只使用2.5μm dex对细胞进行处理(atip在对应的步骤中不添加);atip+dex组即为参照上述方法分步进行atip和dex处理的实验组。由实验数据可知联合给药组合可进一步增强at2增殖活性,同时增加增殖相关膜配体delta1、jagged1的mrna转录水平,提高细胞培养基上清液中相关生长因子浓度(tgfβ、wnt5a、pdgf)。上述实验结果说明了:atip单独使用基本上对at2细胞不具有促进增殖的作用(相对于control),dex单独使用,可以显著提升at2细胞增殖能力(相对于control)。atip和dex的联合使用,可以大大增加at2细胞的增殖活性,atip本身不具备促增殖的效果,但是atip可以增强dex的促细胞增殖效果,这说明atip和dex之间存在协同增效作用,这是发明人在实验之前所未预料到的。
[0041]
dex给药后24h立即使用4%多聚甲醛固定,使用免疫荧光技术评估at2细胞增殖形成细胞集落的情况,可发现使用本培养方法(atip+dex组),at2细胞可有效形成单克隆细胞集落图3。dex给药后24h立即使用4%多聚甲醛固定,进行免疫荧光技术评估at2细胞增殖和干性维持情况,使用at2干性相关标记物nkx2.1与细胞增殖标记物ki67共染色,实验结果参见图4。nkx2.1阳性细胞以及ki67和nkx2.1同时阳性的细胞的百分含量统计结果参见图5。由实验数据可知,联合使用atip和dex不会影响细胞的干性,二型肺泡上皮细胞不会在增殖培养过程中大量分化为一型肺泡上皮细胞。并且,在维持干性的at2细胞中,atip+dex的处理方式可以显著地增加细胞的增殖潜力,其具体的表现为表达增殖标记物ki67的nkx2.1阳性细胞的比例显著高于其他实验组。dex给药后24h立即提取全细胞蛋白,使用westernblot技术评估at2细胞特异性分泌的表面活性物质sftpc表达水平,可以观测到使用本药物组合后的显著增加维持at2特征能力。而单独使用atip或者dex的时候,细胞维持at2特征能力相对对照组没有显著变化。因此,atip+dex的联合处理的方式不但可以促进细胞增殖,还可以促进at2细胞的干性维持以及at2特征能力的维持。
[0042]
dex给药后24h进行免疫荧光技术评估at2细胞的增殖活性激活效果,对促增殖相关核转录因子taz及β-catenin进行了检测,实验结果参见图7和图8,可见使用本药品组合组,上述转录因子发生了显著的核转位,且细胞数量更多,提示增殖活性激活。
[0043]
对比例1
[0044]
中国专利cn113041242a(右美托咪定在促进肝脏再生中的应用)研究了右美托咪定在促进肝脏细胞增殖中的作用。在其实施例中,使用了右美托咪定和阿替美唑联合用于小鼠体内实验方案。内容大致如下:已有文献报道右美托咪定通过与α2-肾上腺素受体结合发挥作用(α2-肾上腺素受体激动剂),在此基础上使用α2-肾上腺素受体抑制剂阿替美唑先进行预处理,进而对右美托咪定的作用效果产生抑制作用。saline组术前30分钟腹腔注射500μl生理盐水,dex组术前30分种按照小鼠体重腹腔注射盐酸右美托咪定25μg/kg,ati组盐酸右美托咪定注射前10分钟按照小鼠体重腹腔注射盐酸阿替美唑250μg/kg。部分实验结果参见图9(节选自cn113041242a的第五幅附图中的a)和图10(节选自cn113041242a的第五幅附图中的c)。上述实验数据说明,在小鼠中,同时使用右美托咪定和阿替美唑,并不会对肝细胞的增殖产生促进作用,使用阿替美唑的目的在于确认右美托咪定在干细胞增殖中的信号通路。该对比例的实验结果可能会对研究人员产生一定的技术偏见,认为右美托咪定和阿替美唑的联合使用,会抵消右美托咪定的促增殖效果。但是,实际上,发明人将右美托咪定和阿替美唑联合使用,用于at2细胞的体外培养时,两者的联合作用可以极大地促进细胞增殖,并同时维持细胞的干性以及at2细胞特征,获得了预料不到的技术效果。
[0045]
以上所述的仅是本发明的实施例,方案中公知的具体技术方案和/或特性等常识在此未作过多描述。应当指出,对于本领域的技术人员来说,在不脱离本发明技术方案的前提下,还可以作出若干变形和改进,这些也应该视为本发明的保护范围,这些都不会影响本发明实施的效果和专利的实用性。本技术要求的保护范围应当以其权利要求的内容为准,说明书中的具体实施方式等记载可以用于解释权利要求的内容。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1