一种NGLY1调控细胞模型的构建方法
本发明涉及基因表达调控,尤其涉及一种ngly1调控细胞模型的构建方法。
背景技术:
1、蛋白翻译后修饰在维持细胞内外环境稳定,细胞的增殖、分化及存活等过程中,起着重要的调节功能。n-糖蛋白去糖基化酶(peptide:n-glycanase,简写为pngase),具有对n-糖蛋白去糖基化的作用,可以水解多肽上天冬酰胺(asn)连接的寡糖,并释放出完整寡糖链。人n-糖蛋白去糖基化酶简称为ngly1(n-glycanase 1),在人体内参与清除细胞内错误折叠的n-糖蛋白,维持机体正常功能。当ngly1缺陷时,会引起罕见的常染色体隐性遗传性疾病,称为ngly1型先天性去糖基化障碍(ngly1-related congenital disorder ofdeglycosylation,简写为ngly1-cddg),患者出现发育迟缓、运动障碍、无泪少汗等症状。但ngly1-cddg的致病机制尚未明确,ngly1在人体内的生物学功能也不清晰。
2、细胞中下调基因表达的方法有基因敲降、基因敲除等,rna干扰是主要的基因敲降方法,处理手段包括shrna慢病毒转染和小片段sirna干扰。其中,小片段sirna干扰是利用sirna干扰片段直接进入细胞质中与rna单链结合,其干扰效果具有瞬时性,不可传递至后代。而shrna慢病毒转染是利用慢病毒将带有目的片段shrna的载体质粒导入细胞中,通过细胞核能够自主进行转录翻译,抑制基因表达,在mrna水平和蛋白水平进行干扰,因此,该方法形成的干扰具有持续性和稳定性,可遗传至后代细胞,构成稳转株。然而,目前尚无能够高效下调ngly1基因表达的shrna慢病毒转染方法。
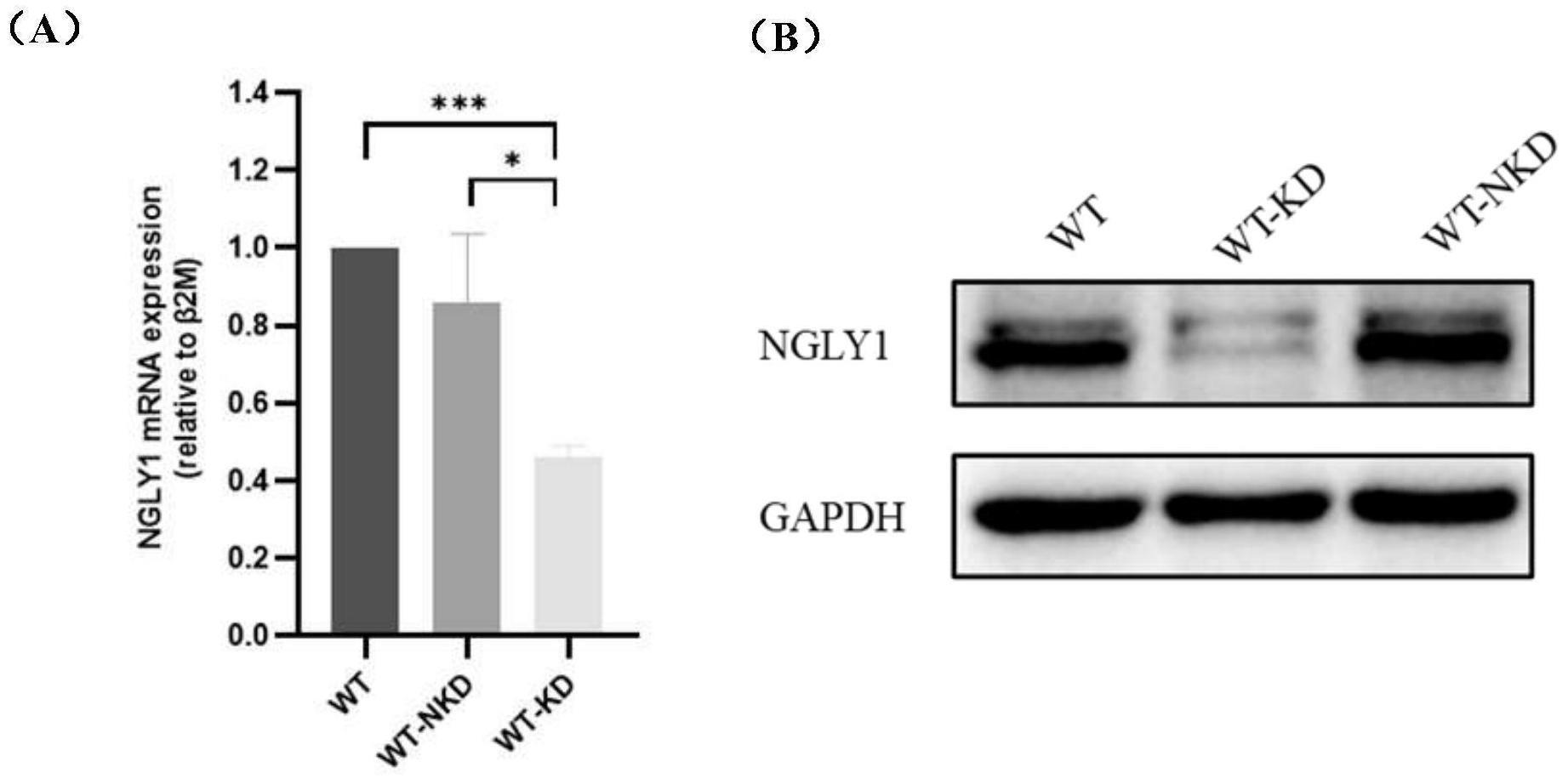
3、因此,提供一种能够高效下调ngly1基因表达的shrna慢病毒转染方法,以及在此基础上,提供一种下调后回补ngly1基因表达的方法,通过下调或回补ngly1基因表达,建立ngly1调控模型,对于ngly1细胞内生理病理研究、ngly1-cddg的致病机制研究,以及ngly1激活剂或抑制剂药物筛选、ngly1-cddg的药物筛选而言具有重要意义。
技术实现思路
1、为了解决现有技术中缺乏高效下调ngly1基因表达的shrna慢病毒转染方法的技术问题,本发明提供了一种ngly1调控细胞模型的构建方法。本发明中提供的shrna、载体质粒和慢病毒能够应用于慢病毒介导的rna干扰技术中,有效下调ngly1基因的表达,构建ngly1下调细胞模型,因而能够为ngly1蛋白的生理病理功能研究提供方法,为ngly1-cddg的致病机制研究奠定基础,并为ngly1激活剂或抑制剂药物筛选、ngly1-cddg的药物筛选提供技术支持。
2、本发明的具体技术方案为:
3、第一方面,本发明提供了一种用于慢病毒介导下调ngly1基因表达的shrna,所述shrna的干扰靶点序列为如seq id no:1所示的核苷酸序列。
4、在慢病毒介导的rna干扰技术中,shrna干扰靶点序列的选取会影响干扰效率,但关于shrna干扰靶点序列的选取对干扰效率的影响,所涉及的因素错综复杂,目前尚未总结出明确的系统性规律表明怎样的干扰靶点序列能够获得较好的干扰效率,其可预测性很差,这为shrna干扰靶点序列的选取带来了极大的技术难度。并且,sirna干扰技术和shrna慢病毒转染干扰技术在干扰过程和机理上存在差异,尚无明确研究显示同一靶点序列在两种rna干扰技术中,干扰效率具有一致性或相关性,事实上,sirna干扰靶点序列与shrna慢病毒转染干扰靶点序列之间并不能通用。
5、本发明团队在结合理论研究和大量试验后,发现将如seq id no:1所示的核苷酸序列作为干扰靶点构建shrna,能够在慢病毒介导的rna干扰技术中,实现较好的干扰效率,有效下调ngly1基因的表达,因而能用于ngly1调控(下调)细胞模型的构建。
6、作为优选,所述shrna的编码序列如seq id no:2所示。
7、第二方面,本发明提供了一种用于慢病毒介导下调ngly1基因表达的载体质粒,所述载体质粒中包含编码所述shrna的核苷酸序列。
8、将编码shrna的核苷酸序列插入载体中,所获得的载体质粒能够用于构建慢病毒,利用这种慢病毒转染靶细胞,能够实现靶细胞中ngly1基因表达的下调。
9、第三方面,本发明提供了所述shrna或者所述载体质粒在慢病毒介导下调ngly1基因表达中的应用。
10、构建ngly1调控(下调)细胞模型,即下调细胞中的ngly1基因表达。
11、第四方面,本发明提供了一种用于下调ngly1基因表达的慢病毒,所述慢病毒中包含编码所述shrna的核苷酸序列,或者包含所述载体质粒。
12、第五方面,本发明提供了所述慢病毒在下调ngly1基因表达中的应用。
13、构建ngly1调控(下调)细胞模型,即下调细胞中的ngly1基因表达。
14、作为优选,所述应用包括以下步骤:采用所述慢病毒,对靶细胞进行转染,使靶细胞内表达所述shrna。
15、进一步地,所述靶细胞为人皮肤成纤维细胞,在转染时,控制病毒感染复数为100~110;或者,所述靶细胞为人肝癌细胞,在转染时,控制病毒感染复数为10~20。
16、上述病毒感染复数即moi,计算方式为:moi=(病毒滴度×病毒体积)/细胞数目。
17、在现有技术中,针对细胞的慢病毒转染moi多为1~20。但本发明团队在实验中发现,在常规的moi下,慢病毒难以有效转染人皮肤成纤维细胞,因而无法抑制人肝癌细胞中ngly1基因的表达,进一步实验发现,当moi提高到100时,能够实现较好的转染。
18、进一步地,所述慢病毒中带有抗生素抗性基因;在转染后,使用1~2μg/ml抗生素溶液对转染后的靶细胞进行初筛,而后使用0.25~0.5μg/ml抗生素溶液维持初筛后靶细胞的ngly1基因表达下调水平。
19、所述抗生素可选嘌呤霉素。
20、第六方面,所述shrna或者所述载体质粒或者所述慢病毒在制备降低人皮肤成纤维细胞内atp含量或提高人肝癌细胞内atp含量的试剂中的应用。
21、本发明首次发现下调ngly1基因表达后,能够降低人皮肤成纤维细胞中的atp含量,以及提高人肝癌细胞中的atp含量。因此,基于慢病毒介导的rna干扰技术下调人肝癌细胞或人皮肤成纤维细胞中的ngly1基因表达,有望为调控细胞产能提供新的手段。
22、第七方面,本发明提供了一种回补ngly1基因表达的细胞模型构建方法,包括以下步骤:将含有目的基因ngly1片段的重组质粒,通过脂质体转导到利用所述shrna或者所述载体质粒或者所述慢病毒下调ngly1基因表达后的靶细胞中。
23、构建ngly1调控(回补)细胞模型,即回补细胞中的ngly1基因表达。在下调ngly1基因表达水平后,采用脂质体介导的重组质粒回补技术,能够实现靶细胞中ngly1基因表达水平的提高,该方法能够用于进一步探究ngly1的生物学功能。
24、作为优选,所述重组质粒中含有抗生素抗性基因;在转导后,使用50~100μg/ml抗生素溶液对转导后的靶细胞进行初筛,而后使用25~50μg/ml抗生素溶液维持初筛后靶细胞的ngly1基因表达回补水平。
25、所述抗生素可选博来霉素。
26、与现有技术相比,本发明具有以下优点:
27、本发明中的shrna、载体质粒和慢病毒能够应用于慢病毒介导的rna干扰技术中,有效下调ngly1基因的表达水平;此外,本发明还提供了一种在下调ngly1基因基因表达后,基于脂质体介导的重组质粒回补技术,回补ngly1基因表达水平的方法。上述下调或回补ngly1基因表达的方法能够实现ngly1调控(下调或回补)细胞模型的构建,为ngly1的生物学功能研究和ngly1-cddg的致病机制研究提供了新的工具,并为ngly1激活剂或抑制剂药物筛选、ngly1-cddg的药物筛选提供了技术支持。
- 还没有人留言评论。精彩留言会获得点赞!