布立西坦中间体的不对称催化氢化合成方法与流程
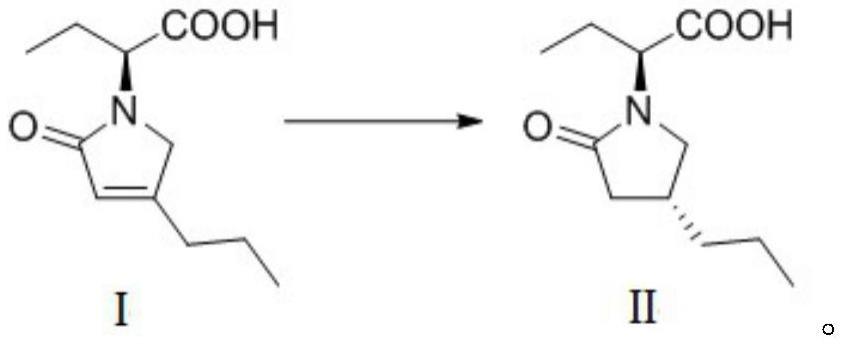
本发明涉及有机化合物合成领域,具体地说,涉及(2s)-2-[(4r)-2-氧代-4-丙基-1-吡咯烷基]丁酸的不对称催化氢化合成方法。
背景技术:
1、布立西坦(brivaracetam),化学名为(2s)-2-[(4r)-2-氧代-4-丙基-1-吡咯烷基]丁酰胺,其结构如下:
2、
3、布立西坦是由比利时ucb公司开发的第三代抗癫痫药物,分别于2016年1月和2月获emea和fda批准上市,用于治疗成人和16岁以上青少年癫痫患者的部分发作,伴有或不伴有继发性全身发作的辅助治疗。
4、原研ucb公司在wo01/62726公开了(2s)-2-[(4r)-2-氧代-4-丙基-1-吡咯烷基]丁酰胺的制备方法,所述方法利用pd/c为催化剂,在nh4cooh存在下,加氢还原化合物374,得到两种对映异构体158和159,两者的比例接近1:1。
5、
6、wo2017/076738a1对wo01/62726记载的方案进行了改进,具体为:将式(iii)所示化合物利用pt/c为催化剂,在甲酸或柠檬酸存在下,催化加氢生成式(ia)和(ib)所示化合物,反应式如下。粗品中目标化合物的手性纯度得到提高,得到的产物的de值约为61%。
7、
8、上述两种方法制备布立西坦的过程中均需要用到色谱柱分离对映异构,难于实现批量生产。广州赛烽医药技术有限公司在cn104892483a中,针对此问题,尝试通过不对称还原制备光学纯度较高的布立西坦,公开了2-氧代-1吡咯烷手性衍生物的制备方法,该方法是以过渡金属为催化剂,在磷配体存在下,以硅氢烷为氢源,低温下,制备得到高光学纯度的布立西坦,但是该方法使用到结构复杂,难于大量获得且价格昂贵的手性配体,严重制约了其工业化应用,此外,手性诱导催化往往对反应条件要求比较苛刻,在生产中往往出现比较严重的放大效应,进一步对其后续应用带来了困难。
9、cn107513031a公开了一种2-氧代-1-吡咯烷手性衍生物的制备方法,该方法涉及利用钯炭、钯氧化铝、钯二氧化硅、钯碳酸钡、钯碳酸钙、氢氧化钯碳、钉碳、雷尼镍、二氧化铂及铑炭等催化剂催化式vi所示化合物生成式i所示化合物(r1为氢或烷基)。该现有技术中,以(2s)-2-(4-丙基-1,5-二氢吡咯-2-酮)丁酸为底物,催化加氢得到(2s)-2-[(4r)-2-氧代-4-丙基-1-吡咯烷基]丁酸,重结晶2次得到的产物的收率为80%,de值为95%,没有公开转化率。wo2019/157856a1公开了一种高手性纯度内酰胺中间体的制备方法,该方法涉及将化合物c在重金属催化剂(钯炭、钯、铂炭、铂、钌炭、铑炭、钯氧化铝、钯二氧化硅、钯碳酸钡、钯碳酸钙、氢氧化钯碳、二氧化钯)以及手性诱导剂(甲酸、柠檬酸、丙二酸、丁二酸、盐酸、氢溴酸等)存在下,加氢还原得到化合物d:
10、经析晶体后的产品收率为77~96%,de值为99.0~99.6%,也没有公开转化率。本技术发明人在实际放大生产中发现虽然利用重金属催化剂(例如,钯炭)催化氢化(2s)-2-(4-丙基-1,5-二氢吡咯-2-酮)丁酸得到的产物的de值较高,但是底物的转化率不够高,目标产品中存在未反应的原料,而且无论是通过重结晶还是通过柱层析都很难将原料从目标产品中除去,导致产品纯化成本高,质量低。
11、综上所述,通过催化氢化得到布立西坦或其中间体的现有方案均不理想。因此,本领域需要一种成本低,操作简单且可得到高手性纯度产品的布立西坦中间体的制备工艺。
技术实现思路
1、针对现有技术中布立西坦及其中间体制备过程中存在的缺陷,本发明一方面提供了一种式ii所示化合物的不对称催化氢化合成方法,所述合成方法包括:在氢气氛围下,在溶剂中,式i所示化合物在面手性二茂金属配体与钌盐反应生成的催化剂以及碱存在下,进行不对称氢化还原,形成式ii所示化合物,反应式如下所示:
2、
3、所述面手性二茂金属配体选自如下式iii~vi所示的化合物:
4、式iii~vi中,r选自h、含1~8个碳的直链或支链烷基、含1~8个碳的环烷基、取代的或未被取代的芳基或苄基,式vi中ar为取代的或未被取代的芳基。
5、所述钌盐选自三(三苯基膦)二氯化钌、二氯(对甲基异丙基苯基)钌(ii)二聚体、苯基氯化钌(ⅱ)二聚体、双(2,2'-联吡啶)二氯化钌、(1,5-环辛二烯)二氯化钌、苯基亚甲基双(三环己基磷)二氯化钌(ii)、对异丙苯基三苯基膦二氯化钌、二(三苯基膦)环戊二烯基氯化钌(ii)、氯(茚基)双(三苯基膦)合钌(ii)、五甲基环戊二烯基双(三苯基膦)氯化钌(ii)、二氯二羰基双(三苯基膦)钌、二氯双[(2-丙基膦)乙基胺]钌(ii)、三(三苯基膦)羰基氢氯化钌(ii),或其组合。
6、在本发明的另一优选例中,上述式iii~vi中,r选自甲基、乙基、异丙基,叔丁基、含6~10个碳的取代的或未被取代的芳基或苄基。在本发明的另一优选例中,上述式iii~vi中,r选自异丙基或叔丁基。在本发明的另一优选例中,ar为苯基。
7、在本发明的另一优选例中,所述面手性茂金属配体选自式iv或vi所示的化合物。在本发明的另一优选例中,所述钌盐选自三(三苯基膦)二氯化钌、二氯(对甲基异丙基苯基)钌(ii)二聚体、苯基氯化钌(ⅱ)二聚体。
8、在本发明的另一优选例中,所述催化剂选自以下结构所示的化合物:
9、
10、
11、在本发明的另一更优选例中,所述催化剂选自以下结构所示的化合物:
12、
13、
14、在本发明的另一更优选例中,所述催化剂选自以下结构所示的化合物:
15、
16、在本发明的另一优选例中,所述溶剂选自甲醇、乙醇、异丙醇、丙醇、丁醇、异丁醇、丙酮、1,4-二氧六环、四氢呋喃、二氯甲烷、乙腈,甲苯、二甲苯、或组合。在本发明的另一更优选例中,所述溶剂选自甲醇、乙醇、异丙醇。
17、在本发明的另一优选例中,所述碱选自lioh、naoh、koh、li2co3、na2co3、k2co3、cs2co3、lihco3、nahco3、khco3、cshco3、na3po4、na2hpo4、nah2po4、三乙胺、吡啶、2,6-甲基吡啶、1,8-二氮杂二环十一碳-7-烯、1,4-二氮杂二环[2.2.2]辛烷,或其组合。在本发明的另一更优选例中,所述碱选自naoh和/或koh。
18、在本发明的另一优选例中,式i所示化合物与所述碱的摩尔为1:0.1~3。在本发明的另一更优选例中,式i所示化合物与所述碱的摩尔为1:0.8~1.5。在本发明的另一更优选例中,式i所示化合物与所述碱的摩尔为1:1。
19、在本发明的另一优选例中,不对称催化氢化合成方法的反应温度为-20~60℃。在本发明的另一更优选例中,不对称催化氢化合成方法的反应温度为15~50℃,例如,25~35℃。
20、在本发明的另一优选例中,不对称催化氢化合成方法的氢气压力为1~80bar,更优选40~60bar,例如,40bar、45bar、50bar、55bar、60bar。
21、在本发明的另一优选例中,不对称催化氢化合成方法中反应底物与催化的摩尔比为10000:1~10:1,更优选,3000:1~100:1。
22、在本发明的另一优选例中,面手性二茂金属配体与钌盐反应生成催化剂的方法包括步骤:将面手性二茂金属配体与钌盐在溶剂中,在60~120℃反应,生成催化剂。在本发明的另一更优选例中,面手性二茂金属配体与钌盐反应生成催化剂的方法中反应温度为70~100℃。
23、在本发明的另一优选例中,面手性二茂金属配体与钌盐反应生成催化剂的方法所用溶剂选自甲醇、乙醇、异丙醇、丙醇、丁醇、异丁醇、丙酮、1,4-二氧六环、四氢呋喃、二氯甲烷、乙腈,甲苯、二甲苯、或组合。
24、在本发明的另一优选例中,上述式ii所示化合物的不对称催化氢化合成方法包括以下步骤:
25、(1)所述面手性二茂钌配体与所述钌盐在溶剂中进行反应,反应完毕,对反应液进行处理分离得到催化剂;
26、(2)将式i所示化合物、步骤(1)得到的催化剂、碱和溶剂加入反应容器中,在氢气氛围下发生不对称氢化还原,形成式ii所示化合物,
27、步骤(1)和(2)所用溶剂可以相同,也可以不同。
28、在本发明的另一优选例中,上述式ii所示化合物的不对称催化氢化合成方法包括以下步骤:
29、(1)所述面手性二茂铁配体与所述钌盐在溶剂中进行反应生成催化剂,得到含催化剂的反应液,
30、(2)向步骤(1)的含催化剂的反应液中加入式i所示化合物、碱和溶剂,在氢气氛围中,式i所示化合物发生不对称氢化还原,形成式ii所示化合物,
31、步骤(1)和(2)所用溶剂优选是相同的。
32、本发明另一方面提供了布立西坦的合成方法,该合成方法包括以下步骤:
33、(1)将上述不对称催化氢化合成方法得到的式ii所示化合物进行酯化反应,得到式ii-1所示化合物,
34、(2)ii-1所示化合物进行氨基化反应得到布立西坦,反应式如下:
35、
36、式ii-1中,r’选自脂肪族或芳香烃基。
37、在另一优选例中,步骤(1)的酯化反应在甲醇或乙醇溶剂中,在氯化亚砜存在下进行。原料用量和反应温度按照此类反应的常规用量和温度,例如,在-10-0℃将氯化亚砜滴加到甲醇中,-15~-5℃搅拌0.5~1.5小时,式ii所示化合物,-15~-5℃搅拌0.5~1.5小时,升温至0~10℃,搅拌1.5~3小时,tlc检测反应至反应完全。
38、在另一优选例中,步骤(2)的氨基化反应在质量浓度为15~28%的氨水和醇的混合溶剂中,-10~5℃通入氨气条件下进行,其中,所述醇为甲醇和/或乙醇。
39、本发明另一方面提供了以下结构所示的化合物在不对称催化氢化1,5-二氢吡咯-2-酮及其衍生物中的用途,其中1,5-二氢吡咯-2-酮及其衍生物加氢还原生成2-吡咯烷酮及其衍生物,
40、
41、
42、本发明的另一方面提供了以下结构所示的化合物在不对称催化氢化1,5-二氢吡咯-2-酮及其衍生物,生成2-吡咯烷酮及其衍生物中的用途,
43、
44、本发明再一方面提供了用于不对称氢化还原的催化剂,其结构如下:
45、
46、
47、应理解,在本发明范围内中,本发明的上述各技术特征和在下文(如实施例)中具体描述的各技术特征之间都可以互相组合,从而构成新的或优选的技术方案。限于篇幅,在此不再一一累述。
- 还没有人留言评论。精彩留言会获得点赞!