一种检验龙胍烯在治疗脉络膜新生血管中作用的实验方法
本发明涉及一种检验龙胍烯在治疗脉络膜新生血管中作用的实验方法,属于眼科治疗。
背景技术:
1、年龄相关性黄斑变性(age-related macular degeneration,amd)是50岁以上人群视网膜的退行性疾病,也是造成发达国家50岁以上人群失明的首要原因1。在世界范围内至2040年,amd患者人数预计将达到2.88亿2。早期和中期amd以玻璃膜疣的形成和色素异常为主要特点,而晚期amd按照病理变化,分为两种类型:湿性amd(wet amd;又名新生血管性amd;neovascular amd;namd)和干性amd(dry amd)。其中namd的特征为络膜新生血管(choroidal neovascularization,cnv),是指来自脉络膜的新血管通过bruch膜的破裂,进入视网膜色素上皮(retinal pigment epithelium,rpe)下或视网膜下间隙的生长3。在cnv病程中,氧化应激、光损伤、炎症等致病因素的不断累积,导致脉络膜血管内皮细胞处于缺氧状态中。虽然namd仅占amd患者的10%,但其引起的失明占amd患者导致失明的90%。目前对于namd而言,最常用的治疗方法是抗血管内皮生长因子(vascular endothelium growthfactor,vegf)药物,例如康柏西普(conbercept,con)和雷珠单抗(ranibizumab,ran),反复玻璃体内注射。尽管抗vegf药物的治疗能够缓解namd的进程,提高namd患者的最佳矫正视力,但在临床应用时一部分namd患者(大约10%)对抗vegf药物治疗无反应,或者治疗一段时间(1-2年)后产生耐药性。并且抗vegf药物的多次反复玻璃体腔内注射,增加了患者的经济负担和复诊困难,并且抗vegf药物能够引起多种眼内副反应,如眼内出血、眼内压增高和眼内炎5。因此寻找namd更佳的治疗策略成为研究者和临床工作者的迫切任务。
2、龙脈烯(longipinene,lon)是金盏花叶(6.5%)、矮地茶、倒扣草、黄芩、没药和苏合香的精油成分,是一种单体药物。研究者采用盘式扩散琼脂法,考察龙脈烯对革兰氏阳性菌(金黄色葡萄球菌atcc 25923和粪肠球菌atcc 29212)以及革兰氏阴性菌(大肠埃希菌atcc25992、肺炎克雷伯菌atcc 23357和铜绿假单胞菌atcc 27853)的抑菌活性。结果表明,其最小抑菌浓度(minimal inhibitory concentration,mic)分别为37、150、150、10和150 μg/ml6。此外,龙脈烯还具有抑制白假丝酵母菌生物膜形成和菌丝生长的功能7。然而龙脈烯对于脉络膜新生血管的作用尚不清楚。故需要通过实验证明其在脉络膜新生血管的作用。
技术实现思路
1、针对上述现有技术存在的问题,本发明提供一种检验龙胍烯在治疗脉络膜新生血管中作用的实验方法,以验证其治疗脉络膜新生血管中的作用,并用以解决现有抗血管内皮生长因子药物治疗技术中反复注射、无应答及眼内副反应的问题。
2、为了实现上述目的,本发明采用的技术方案是:一种检验龙胍烯在治疗脉络膜新生血管中作用的实验方法,包括以下步骤:
3、步骤s1: 小鼠cnv模型的建立,
4、氪激光诱导雄性c57bl/6小鼠(8周大小)cnv模型,用10 mg/kg甲苯噻嗪和80 mg/kg氯胺腹腔注射麻醉,复方托吡卡胺散瞳,手持式灯光照射,保持小鼠体温。将小鼠实验眼固定于裂隙灯前,在1%甲基纤维素的辅助下,将5.4 mm手持式接触镜置于角膜前,用氪离子激光机,激光波长647.1 nm,功率300 mw,光斑直径50 μm,曝光时间0.05秒;围绕视盘并在距视盘2个乳头直径位置等距离光凝,共计4个点,分别位于3、6、9、12点处,以见到有气泡产生提示bruch膜被击破,无玻璃体出血为光凝的成功标准;
5、步骤s2: 小鼠玻璃体腔内注射龙脈烯或者雷珠单抗,
6、激光诱导之后立即取cnv组c57bl/6小鼠称重,麻醉后使用复方托吡卡胺散大两侧瞳孔,生理盐水湿润眼表,左氧氟沙星滴眼,使小鼠侧卧在手术台,在解剖显微镜下拨开眼睑,暴露角巩膜缘,使用10-0针在角巩膜缘后1 mm做切口,33 g注射器刺入玻璃体腔,注射0.5 μl ran(商品名lucentis,novartis pharma ag,switzerland),术后红霉素眼膏涂眼预防感染,c57bl/6小鼠随机分为正常(不做任何处理)、cnv 7 天(不做任何注射)、0.1%二甲亚砜(dimethyl sulfoxide,dmso;0.5 μl)玻璃体内注射、低剂量龙脈烯(l469750,toronto research chemicals,canada;0.5 mg/μl,0.5 μl)玻璃体内注射、中剂量龙脈烯(1 mg/μl,0.5 μl)玻璃体内注射、高剂量龙脈烯(2 mg/μl,0.5 μl)玻璃体内注射和ran玻璃体腔内注射组,龙脈烯溶于0.1% dmso;
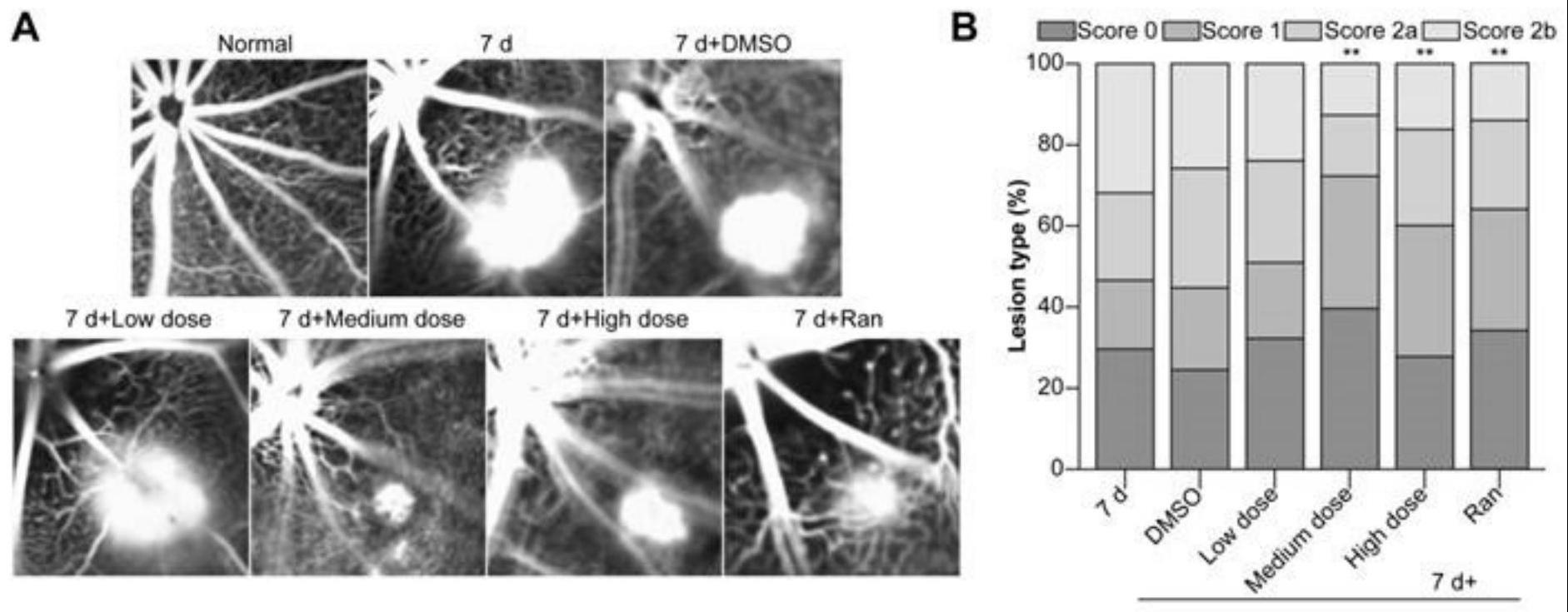
7、步骤s3:小鼠眼底血管造影,
8、小鼠随机分为正常、cnv 7天、cnv 7天 + 0.1% dmso、低剂量龙脈烯玻璃体内注射、中剂量龙脈烯玻璃体内注射、高剂量龙脈烯玻璃体内注射和ran玻璃体内注射组,麻醉处死,复方托吡卡胺散瞳,将10%荧光素钠用注射用水稀释成2%荧光素钠或者吲哚菁绿试剂,经腹腔注射0.3 ml,分别进行眼底荧光造影(fundus fluorescein angiography,ffa)或者吲哚菁绿血管造影(indocyanine green angiography,icga);注射后100-140 s开始用共焦激光视网膜断层扫描仪记录造影过程,记录时间为30 min;cnv分级:0级为无渗出,1级为轻度渗出,2a级为中度渗出,2b级为重度渗出;使用image j软件分析脉络膜渗出面积的改变;研究人员通过徒手绘制工具在icga渗出的区域画出边缘,应用imagej软件的感兴趣区域(region of interest,roi)管理器计算出像素区域;之后根据像素与微米之间的比例(所使用的比例为0.5249)将像素区域转化为微米的平方(microns2,mm2),得到最终的cnv面积;
9、步骤s4:脉络膜铺片及免疫荧光染色,
10、小鼠随机分为cnv 7天、cnv 7天 + 0.1% dmso、低剂量龙脈烯玻璃体内注射、中剂量龙脈烯玻璃体内注射、高剂量龙脈烯玻璃体内注射和ran玻璃体内注射组;将小鼠用20mg/kg甲苯噻嗪和80 mg/kg氯胺酮腹腔注射处死,立即摘出眼球,放入4%多聚甲醛(paraformaldehyde,pfa)中快速固定1 h;在解剖显微镜下,沿赤道部环行剪开巩膜,去除眼前节,小心分离视网膜神经上皮层,获得视网膜-视网膜色素上皮(retinal pigmentepithelium,rpe)-脉络膜复合体眼杯,用冷icc缓冲液反复冲洗眼杯;在暗光下,将1 μg/μlalexa fluor®594 cd31和alexa fluor® 488同工凝集素-b4(isolectin-b4)抗体以1:150的稀释度加入icc缓冲液中;充分混匀后,分别移入装有眼杯的ep管中进行染色,避光置于4oc冰箱过夜;常温下复温2 h,再用icc缓冲液充分冲洗眼杯;将视网膜-rpe-脉络膜复合体平铺于载玻片上,沿视盘方向做4个放射状切口,封片用荧光显微镜观察;cnv的三维图像用zen软件(zeiss,德国)生成,cnv的体积用imaris软件(瑞士)进行测量;
11、步骤s5: 视网膜电图
12、小鼠随机分为cnv 7天、cnv 7天 + 0.1% dmso、低剂量龙脈烯玻璃体内注射、中剂量龙脈烯玻璃体内注射、高剂量龙脈烯玻璃体内注射和ran玻璃体内注射组;激光诱导cnv后7天小鼠进行erg 记录以测量rpe(c波)的电反应;小鼠进行一整晚的黑暗适应,随后1天,小鼠麻醉并扩张瞳孔(2.5%盐酸去氧肾上腺素和1%硫酸阿托品);将角膜环电极施加在小鼠眼上,滴加一滴羟丙甲纤维素滴眼液,以保持角膜和电极之间的电接触;将电极针插入小鼠头皮以提供参考,并插入尾部以提供接地;使用utas e-4000系统(lkc technologies,usa)记录c波的反应,c波从基线到峰值最大值测量,响应速度为100 cd·s·mm闪光值;
13、步骤s6:苏木素伊红(hematoxylin eosin,he)染色
14、小鼠随机分为正常、0.1%dmso、低剂量龙胍烯、中剂量龙胍烯和高剂量龙胍烯组,将小鼠眼球浸入4 %pfa中固定,取视网膜组织进行石蜡包埋,制备厚度约为3 μm的石蜡切片,脱蜡水化后进行he染色,检测小鼠视网膜形态及厚度,视网膜厚度以a(从神经节细胞层到内核层外边缘的距离)到b(从神经节细胞层到外核层外边缘的距离)的比值来表示;
15、步骤s7:脱氧核糖核酸末端转移酶介导的缺口末端标记技术(terminaldeoxynucleotidyl transferase-mediated nick end labeling,tunel)染色
16、1%苯巴比妥钠(3 ml/kg)腹腔注射麻醉小鼠,75%酒精消毒双眼睑周围皮肤,摘除眼球后脱颈处死小鼠;取视网膜,常规石蜡包埋切片,60oc烤片30-60 min,将切片置于二甲苯中10 min,再依次置于100%、95%、85%和75%乙醇中,每次5 min,蒸馏水冲洗,proteinasek孵育30 min,pbs冲洗3 min × 3次,dnaseⅰ孵育15 min,pbs冲洗5 min × 3次,加入适量1 × 平衡缓冲液,使其全部覆盖待检样本区域,37oc孵育30 min,pbs冲洗5 min × 3次,tdt缓冲液37oc孵育60 min,pbs冲洗5 min × 3次,37oc染核10 min,pbs冲洗5 min × 3次,90%甘油封片,荧光显微镜下观察并拍照;
17、步骤s8:酶联免疫吸附试验(enzyme-linked immunosorbent assay,elisa),
18、c57bl/6小鼠随机分为正常、cnv 7天、cnv 7天 + 0.1% dmso、低剂量龙脈烯玻璃体内注射、中剂量龙脈烯玻璃体内注射、高剂量龙脈烯玻璃体内注射和ran玻璃体内注射组;运用elisa检测小鼠视网膜-rpe-脉络膜组织中vegf、pdgf和hb-egf的蛋白水平;将小鼠视网膜-rpe-脉络膜组织进行匀浆,在使用bio-rad方法检测小鼠视网膜-rpe-脉络膜组织蛋白浓度后,将小鼠视网膜-rpe-脉络膜组织置于相应的elisa试剂盒中,根据说明测定vegf、pdgf和hb-egf的蛋白水平;在自动酶标仪上读取450 nm处的吸光度;所有测量均一式三份进行,并根据标准曲线计算组织样品浓度并校正蛋白质浓度;
19、步骤s9:人脉络膜血管内皮细胞培养及分组,
20、人脉络膜血管内皮细胞(human choroidal endothelial cells,hcvecs),生长于含有10%胎牛血清(fetal bovine serum,fbs)的杜尔贝科改良培养基(dulbecco'smodified eagle's medium,dmem);hcvecs分为正常(常氧,95% o2和5% co2培养24 h)、缺氧(1% o2,94% n2和5% co2培养24 h)、缺氧 + 0.1% dmso、缺氧 + 低剂量龙脈烯(1 mg/ml)、缺氧 + 中剂量龙脈烯(2 mg/ml)和缺氧 + 高剂量龙脈烯(4 mg/ml)组;
21、步骤s10:5-乙炔基-2'-脱氧尿苷(5-ethynyl-2´-deoxyuridine,edu)细胞增殖实验,
22、不同组的hcvecs培养24 h后,将小室从37oc二氧化碳培养箱中取出,按照edu试剂盒说明,每孔添加50 μm edu培养基在 37 oc下孵育2 h,弃培养基;pbs清洗细胞3次,每次5min;用4% pfa固定30 min,弃固定液;加入2 mg/ml甘氨酸中和多余的醛基,孵育5 min,弃溶液;pbs洗1次,5 min;pbst洗1次,10 min;pbs洗1次,5 min;加入apollo染液,孵育30min,弃染液;pbst洗3次,每次10 min;加入dapi染液,孵育30 min,弃染液;pbs洗3次,每次10 min;使用抗荧光淬灭封片剂封片,4oc保存;利用荧光显微镜拍摄图像,并分析edu阳性细胞(红色)与dapi阳性细胞(蓝色)的平均比例,作为细胞增殖活性的指标;
23、步骤s11:transwell细胞迁移实验,
24、不同组的hcvecs培养24 h后,用胰酶消化hcvecs制成单细胞悬液,接种于transwell小室上层空间;上室用无血清培养基,下室放置含10% fbs作为趋化力的培养基,37oc培养48 h;取出小室,用4% pfa固定40 min,结晶紫染色30 min;洗涤风干后,随机选取4个视野染色的细胞拍照并在光镜下计数;
25、步骤s12:管腔形成试验,
26、不同组的hcvecs培养24 h后,用胰酶消化hcvecs制成单细胞悬液,24孔板中每孔加200 µl基质胶,置于37oc二氧化碳培养箱中30 min,使其凝固;在基质胶上加入收集的hcvecs悬液,6 h后在相差显微镜下观察细胞是否形成封闭的管腔网络,并测量小管结构的总长度;
27、步骤s13:统计学分析
28、各数据表示为至少三个独立实验的均值±均值的标准误(standard error ofthe mean,sem);两组数据之间的比较运用双侧student-t检验,而多组数据之间的比较用单因素方差分析及bonferroni事后检测,p<0.05为具有统计学差异。
29、本发明的有益效果是:本发明通过实验方法数据的验证,从而能够得出其治疗脉络膜新生血管中的作用,并可以解决现有抗血管内皮生长因子药物治疗技术中反复注射、无应答及眼内副反应的问题。
- 还没有人留言评论。精彩留言会获得点赞!