一种针对口罩中致病性化脓菌的共生增菌培养基的制作方法
本发明涉及一种针对口罩中致病性化脓菌的共生增菌培养基(essp)。
背景技术:
1、口罩(mask)是指佩戴在口鼻部位,能够阻挡空气中的细颗粒物、粉尘、细菌和飞沫等污染物的用具,作为重大突发公共卫生事件中急需的防护类物资,在重大突发的公共卫生安全事件面前其安全性直接关系到一线医务工作者及广大人民群众的生命安危。
2、国内外标准对于口罩的核心微生物指标方面统一关注为:大肠杆菌( escherichia coil)、金黄色葡萄球菌( staphylococcus aureus)、溶血性链球菌( streptococcus hemolytic)、铜绿假单胞菌( pseudomonas aeruginosa)。这四种致病性化脓菌是人类化脓感染中最常见病原菌,可引起伤口化脓、乳腺炎等人和动物的局部化脓性感染,也可引起全身性感染。国内常用于检测非无菌口罩中微生物含量的方法来源于gb15979-2002《一次性使用卫生用品》,检测无菌口罩中的微生物含量的方法来源于gb/t 14233.2-2005《医用输液、输血、注射器具检验方法中的生物学试验方法》。根据相关国家标准,卫生指标中微生物的检测周期一般为5-8天,采用分离培养检测法结果虽准确可靠,但其缺点在于需要根据不同致病菌的生化特性使用对应的培养基在不同的培养条件下进行复壮和前增菌。因此,传统的培养不能满足快速检测的需要。而快速检测的另一个关键前提在于对在同一种培养基质中使用统一条件对多种目标微生物的快速复壮,富集并达到检测限、缩短增菌时间和降低检测背景复杂性的有效手段,更是实现各种检测方法简化的前提。本发明中所公开的essp培养基能突破常规培养的时间和空间局限,可运用于口罩产品中致病性化脓菌的快速前增菌,为防疫物资口罩的质量提供有力保障,并适用于口罩中致病性化脓菌的日常检测。
技术实现思路
1、本发明的目的在于,克服目前常规检测方法中需要根据不同致病菌的生化特性使用对应的培养基在不同的培养条件下进行复壮和前增菌,且培养时间不同的问题。通过使用essp共生增菌培养基,使四种致病性化脓菌在同一培养温度和时间内达到复壮和增菌的目的,在缩短增菌时间和减少人力物力消耗的同时,为建立快速检测方法提供前提,用于弥补和解决目前常规检测方法的不足。
2、为实现上述目的,本发明公开了一种针对口罩中致病性化脓菌的共生增菌培养基(essp),所述培养基由胰蛋白质胨、磷酸氢二钠(12h2o)、葡萄糖、牛心粉、谷氨酰胺、丙酮酸钠、磷酸吡哆醛、维生素b12、氯化钠、氯化锂、亚碲酸钾、去氧胆酸钠、柠檬酸铁铵组成。
3、具体组成如下:胰蛋白质胨5~15 g、磷酸氢二钠(12h2o)1~5g、葡萄糖1~5 g、牛心粉 1~10 g、谷氨酰胺0.1~1.0g、丙酮酸钠2~7g、磷酸吡哆醛 0.5~1.5 mg、维生素b120.5~1.5mg、氯化钠 10~20 g、氯化锂0.1~1.0 g、亚碲酸钾0.1~0.5 mg、去氧胆酸钠0.1~0.5 g、柠檬酸铁铵 0.1~1.0 g、蒸馏水1000ml,ph=7.2±0.2。
4、与现有技术相比,本发明有以下有益效果及突出优点:
5、1、本发明所公开的针对口罩中致病性化脓菌的共生增菌培养基(essp)中,胰蛋白质胨、氯化钠、磷酸氢二钠、葡萄糖、牛心粉及柠檬酸铁铵为细菌提供充足的氮源、碳源及维持多种细菌共生增菌环境下渗透压平衡的电解质;丙酮酸钠、谷氨酰胺、磷酸吡哆醛和维生素b12在一定范围内对目标菌增菌都有促进作用;氯化锂、去氧胆酸钠可抑制革兰氏阳细菌的生长,在一定范围内能抑制非目标菌的生长,同时对金黄色普通球菌及铜绿假单胞菌的适度抑制,能避免其过度生长导致对大肠杆菌和溶血性链球菌的生长抑制,并促进溶血性链球菌的代谢平衡。亚碲酸钾可抑制除凝固酶阳性葡萄球菌外多数非目标菌。
6、2、本发明所公开的针对口罩中致病性化脓菌的共生增菌培养基(essp)能抑制非目标菌的生长,并促进目标菌充分利用营养物质。
7、3、本发明所公开的共生增菌培养基相较于传统微生物学培养方法,就口罩中致病性化脓菌至少四种培养基、三种培养温度、24h±2h的复杂条件进行简化。本发明仅需在统一培养温度36±1℃下,对于一般污染样品8h即可达到常规检测所需的菌悬液浓度;当污染含量较低时,可适当延长培养时间至12±2h 即可达到常规检测所需的菌悬液浓度。填补了口罩中致病性化脓菌共生增菌培养基的技术空白。
8、4、本发明所公开的共生增菌培养基能有效减少了人员、物料的消耗,缩短了检测的周期。能突破常规培养的时间和空间局限,可运用于口罩产品中致病性化脓菌的快速前增菌,为防疫物资口罩的质量提供有力保障,并适用于口罩中致病性化脓菌的日常检测。
9、实施方式
10、以下结合具体实施例对本发明作进一步详细说明。但本发明的保护范围不限于以下的实施例。
11、实施例1:一种针对口罩中致病性化脓菌的共生增菌培养基(essp)目标菌生长效果验证
12、1 试剂和材料
13、1.1供试菌株
14、选取23株实验菌株作为供试菌株。其中大肠杆菌12株,铜绿假单胞菌3株,金黄色葡萄球菌5株, 溶血性链球菌3株,均以-80℃保存于福建省产品质量检验研究院菌种保藏库。具体信息见表1。
15、表1 供试菌株信息
16、 序号 菌种名称 菌种编号 1 大肠埃希氏菌 atcc 25922 2 大肠埃希氏菌 cgmcc 1.03373 3 大肠埃希氏菌 atcc 11229 4 大肠埃希氏菌 cicci 10899 5 大肠埃希氏菌 nctci 10907 6 大肠埃希氏菌 cicc 10907 7 志贺毒性大肠埃希氏菌 cicc 10670 8 产肠毒性大肠埃希氏菌 cicc 10667 9 肠道出血性大肠埃希氏菌 cicc 24187 10 肠道集聚性大肠埃希氏菌 cicc 24186 11 肠道侵袭性大肠埃希氏菌 cicc 10662 12 肠道致病性大肠埃希氏菌 cicc 24189 13 铜绿假单胞菌 cgmcc 1.2464 14 铜绿假单胞菌 atcc27853(fscc232030) 15 铜绿假单胞菌 atcc9027(fscc206001) 16 金黄色葡萄球菌 atcc 25923 17 金黄色葡萄球菌 cgmcc 1.0089 18 金黄色葡萄球菌 atcc 6538 19 金黄色葡萄球菌 y-20-01 20 金黄色葡萄球菌 y-19-01 21 溶血性链球菌 cmcc(b) 32210 22 溶血性链球菌 atcc 21059 23 溶血性链球菌 cmcc(b) 32204
17、1.2主要试剂:
18、乳糖发酵培养基(lfb)、scdlp培养液、脑心浸出液肉汤(bhi)、葡萄糖肉汤(db)、营养琼脂、结晶紫中性红胆盐琼脂、baird parker琼脂培养基、硫代硫酸盐柠檬酸盐胆盐蔗糖琼脂培养基(tcbs):北京陆桥技术股份有限公司; 金黄色葡萄球菌显色琼脂:法国科马嘉公司;胰蛋白质胨、氯化钠、磷酸氢二钠、葡萄糖、牛心粉、柠檬酸铁铵、丙酮酸钠、谷氨酰胺、磷酸吡哆醛和维生素b12、氯化锂、亚碲酸钾、去氧胆酸钠:国药集团化学试剂有限公司。
19、2、实验步骤
20、2.1 essp培养基的配制:
21、称取胰蛋白质胨10.0 g、氯化钠15.0 g、磷酸氢二钠(12h2o)2.5 g、葡萄糖 2.5g、牛心粉5.5g、谷氨酰胺0.5 g、丙酮酸钠4.0g、磷酸吡哆醛1.0 mg、维生素b12 1.0mg、氯化锂0.5 g、亚碲酸钾0.2 mg、去氧胆酸钠0.1 g、柠檬酸铁铵0.5g,加入1000ml蒸馏水,搅拌加热煮沸至完全溶解, 调节ph至7.2±0.2。121 ℃高压灭菌15 min,冷却备用。
22、2.2 验证实验
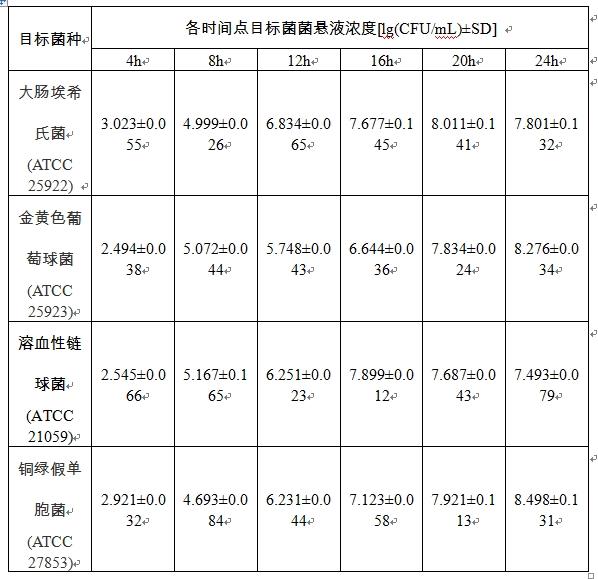
23、生长效果验证实验:按照约1×102cfu/ml为起始量,将4种目标菌属:大肠菌群(表1序号1-12)、铜绿假单胞菌(序号13-15)、金黄色葡萄球菌(序号16-20)、溶血性链球菌(序号21-23),分别接种到90 ml essp培养基及标准对应的增菌培养基中(乳糖发酵培养基、scdlp培养液、bhi培养液、葡萄糖肉汤);同时,在4种目标菌属中挑取4株代表菌株,大肠埃希氏菌(atcc 25922)、铜绿假单胞菌(atcc 27853)、金黄色葡萄球菌(atcc 25923)、溶血性链球菌(atcc 21059)接种到同一essp培养基中。将上述培养物于36±1h℃、200r /min振荡培养 24 h。分别取4、8、12、16、20、24 h 的培养物以选择性平板进行计数,平行试验5次,以标准对应的增菌培养基中为对照组,对不同时间的菌体浓度进行对比验证共生增菌效果。
24、3结果及分析
25、3.1生长效果验证结果
26、在对应的essp培养基中,4种目标菌属:大肠菌群(表1序号1-12)、铜绿假单胞菌(表1序号13-15)、金黄色葡萄球菌(表1序号16-20)、溶血性链球菌(表1序号21-23),按所述条件均能生长。综合来看,大肠菌群和溶血性链球菌在 essp 培养基培养不同时间点的增菌速度均优于对应的lfb和db培养基对照组,增菌效果明显,在培养12±2h及16±2h时达到菌液浓度最高值,提前约8h;溶血性链球菌在培养基培养4 h以后,每4 h增菌速度明显优于对应培养基对照组,于培养16±2h后达到菌液浓度最高值,提前了约6h;金黄色葡萄球菌相比 bhi 培养基对照组在8h前有一定滞后性,但在20±2h时均达到菌液浓度最高值。综上说明,essp培养基对4种目标菌属均有促进生长的正向作用。
27、3.2 共生增菌效果验证结果
28、目标菌在 essp 培养基中共生增菌效果验证结果见表2,由此显示,将4种目标菌属代表菌加入本发明所述的essp培养基进行共生增菌培养,未出现相互抑制,并能在培养8h达到104cfu/ml以上。
29、表2 目标菌增菌在essp培养基中共生增菌效果验证
30、
31、实施例2:人工污染口罩中致病性化脓菌的共生增菌培养基(essp)目标菌生长效果验证
32、1 试剂和材料
33、1.1供试菌株
34、具体信息见表1。
35、1.2主要试剂:
36、乳糖发酵培养基(lfb)、scdlp培养液、脑心浸出液肉汤(bhi)、葡萄糖肉汤(db)、营养琼脂、结晶紫中性红胆盐琼脂、baird parker琼脂培养基、硫代硫酸盐柠檬酸盐胆盐蔗糖琼脂培养基(tcbs):北京陆桥技术股份有限公司; 金黄色葡萄球菌显色琼脂:法国科马嘉公司;胰蛋白质胨、氯化钠、磷酸氢二钠、葡萄糖、牛心粉、柠檬酸铁铵、丙酮酸钠、谷氨酰胺、磷酸吡哆醛和维生素b12、氯化锂、亚碲酸钾、去氧胆酸钠:国药集团化学试剂有限公司。
37、1.3 人工污染样品制备
38、1.3.1 供试样品
39、对随机购买口罩样品的致病性化脓菌进行常规标准检测,挑选10批次合格样品作为供试样品。
40、1.3.2 样品制备
41、将大肠埃希氏菌(atcc25922)、铜绿假单胞菌(atcc27853)金黄色葡萄球菌(atcc25923)和溶血性链球菌(atcc 21059)制备成浓度约1×102cfu/ml菌悬液,各取1ml混合成污染液。在生物安全柜中,从本实施例1.3.1所述样品中,用无菌方法打开用于检测的至少3个包装,从每个包装中准确称取10g±1 g样品,剪碎后取混合污染液4 ml均匀喷洒待用。
42、2、实验步骤
43、2.1 essp培养基的配制:
44、称取胰蛋白质胨10.0 g、氯化钠15.0 g、磷酸氢二钠(12h2o)2.5 g、葡萄糖 2.5g、牛心粉5.5g、谷氨酰胺0.5 g、丙酮酸钠4.0g、磷酸吡哆醛1.0 mg、维生素b121.0mg、氯化锂0.5 g、亚碲酸钾0.2 mg、去氧胆酸钠0.1 g、柠檬酸铁铵0.5g,加入1000ml蒸馏水,搅拌加热煮沸至完全溶解,121℃高压灭菌15min,冷却备用。
45、2.2 验证实验
46、将人工污染样品加入90 ml essp培养基中均质,在对应选择性平板涂布,36±1h℃培养,分别取培养4、8、12、16、20、24 h 的培养物以选择性平板进行计数,平行试验5次。
47、3结果及分析
48、3.1生长效果验证结果
49、人工污染样品中所喷撒接种的目标菌在 essp 培养基中的生长效果验证结果见表3,由此显示,将4种目标菌属代表菌加入本发明所述的essp培养基进行共生增菌培养,未出现相互抑制,并能在培养8h达到104cfu/ml以上。
50、表3 人工污染样品在essp培养基中共生增菌效果验证
51、
52、最后说明的是,以上实施例仅用以说明本发明的技术方案而非限制,尽管参照佳实施例对本发明进行了详细说明,本领域的普通技术人员应当理解,可以对本发明的技术方案进行修改或者等同替换,而不脱离本发明技术方案的宗旨和范围,其均应涵盖在本发明的权利要求范围当中。
- 还没有人留言评论。精彩留言会获得点赞!