因子VIII嵌合蛋白及其用途的制作方法
因子viii嵌合蛋白及其用途
1.本技术是申请日为2015年01月09日、中国申请号为201580009942.9、发明名称为“因子viii嵌合蛋白及其用途”的发明申请的分案申请。
2.对电子提交的序列表的引用
3.以ascii文本文件(名称:2159_441pc02_sequencelisting_st25.txt;大小:823,500字节;以及创建日期:2015年1月9日)形式电子提交的序列表的内容以引用的方式整体并入本文。
4.发明背景
5.甲型血友病(haemophilia a)是一种由编码凝血因子viii(fviii)的基因的缺陷引起的流血病症,并且影响万分之一至万分之二的男性出生者。graw等,nat.rev.genet.6(6):488-501(2005)。受甲型血友病影响的患者可以输注纯化或重组产生的fviii加以治疗。然而,已知所有可商购获得的fviii产品的半衰期都是约8-12小时,从而要求频繁向患者进行静脉内施用。参见weiner m.a.和cairo,m.s.,pediatric hematology secrets,lee,m.t.,12.disorders of coagulation,elsevier health sciences,2001;lillicrap,d.thromb.res.122增刊4:s2-8(2008)。此外,已尝试许多方法来延长fviii半衰期。举例来说,用以延长凝结因子的半衰期的处于开发中的方法包括聚乙二醇化、糖聚乙二醇化和与白蛋白缀合。参见dumont等,blood.119(13):3024-3030(2012年1月13日在线发表)。然而,无论所用蛋白质工程改造如何,当前在开发中的长效fviii产品据报道具有有限半衰期-在临床前动物模型中仅约1.5至2小时。参见同上。已在人中证明一致结果,例如据报道相较于rfviiifc在甲型血友病患者中的半衰期改进多达约1.7倍。参见同上。因此,尽管存在微小改进,但半衰期增加可指示存在其它t1/2限制因素。参见liu,t.等,2007isth会议,摘要#p-m-035;henrik,a.等,2011isth会议,摘要#p=mo-181;liu,t.等,2011isth会议摘要#p-we-131。
6.血浆范威尔邦德因子(von willebrand factor,vwf)的半衰期是约16小时(在13至18小时的范围内)。goudemand j等j thromb haemost2005;3:2219
–
27。vwf半衰期可受以下许多因素影响:糖基化样式、adamts-13(具有血栓反应素(thrombospondin)基序-13的解整合素(disintegrin)和金属蛋白酶)和vwf中的各种突变。
7.在血浆中,95-98%的fviii以与全长vwf的紧密非共价复合物形式循环。这个复合物的形成对于维持体内fviii的适当血浆水平是重要的。lenting等,blood.92(11):3983-96(1998);lenting等,j.thromb.haemost.5(7):1353-60(2007)。全长野生型fviii主要以具有重链(mw 200kd)和轻链(mw 73kd)的异二聚体形式存在。当fviii由于在重链中的位置372和740处以及在轻链中的位置1689处的蛋白水解而活化时,结合于fviii的vwf被从活化fviii移除。活化fviii连同活化因子ix、钙和磷脂一起(“因子x活化酶复合物(tenase complex)”)诱导因子x活化,从而产生大量凝血酶。凝血酶转而接着裂解纤维蛋白原以形成可溶性纤维蛋白单体,所述单体接着自发聚合以形成可溶性纤维蛋白聚合物。凝血酶也活化因子xiii,因子xiii连同钙一起用于交联和稳定化可溶性纤维蛋白聚合物,从而形成交联(不溶性)纤维蛋白。活化fviii通过蛋白水解从循环快速清除。
8.归因于频繁给药和由给药时程引起的不便,所以仍然需要开发要求较小施用频率的fviii产品,即半衰期长于半衰期限制1.5至2倍的fviii产品。
9.发明简述
10.本发明提供一种嵌合蛋白,其包含(i)第一多肽,所述第一多肽包含融合于第一免疫球蛋白(“ig”)恒定区或其一部分的因子viii(“fviii”)蛋白,和(ii)第二多肽,所述第二多肽包含含有vwf的d'结构域和d3结构域的范威尔邦德因子(“vwf”)蛋白,所述vwf蛋白通过在之间的xten序列融合于第二ig恒定区或其一部分,其中所述xten序列含有小于288个氨基酸残基,并且其中所述第一多肽与所述第二多肽连接或缔合。某些实施方案包括如本文所述的嵌合蛋白,其中第二多肽中的xten序列由长度在12个氨基酸与287个氨基酸之间的氨基酸序列组成。
11.也公开如本文所述的嵌合蛋白,其中相较于包含第一多肽和第二多肽的相应融合蛋白,其中所述融合蛋白的第二多肽包含含有至少288个氨基酸的xten序列,所述嵌合蛋白展现较长半衰期。一些实施方案包括含有至少288个氨基酸的xten序列ae288。在一些实施方案中,ae288是seq id no:8。
12.也公开如本文所述的嵌合蛋白,其中第二多肽的xten序列含有约36、约42、约72或约144个氨基酸。在一些实施方案中,第二多肽的xten序列选自ae42、ae72、ae144、ag42、ag72或ag144。
13.一些实施方案包括如本文所述的嵌合蛋白,其中第二多肽的xten序列选自seq id no:9、seq id no:10、seq id no:11、seq id no:55;seq id no:56;seq id no:57;seq id no:58;seq id no:58;seq id no:59;seq id no:14;seq id no:60;seq id no:61;seq id no:62;或seq id no:63。
14.在某些实施方案中,第一多肽进一步包含使fviii蛋白与第一ig恒定区或其一部分连接的第二xten序列。也公开如本文所述的嵌合蛋白,其中第一多肽包含插入在fviii蛋白内一个或多个插入位点处的第三xten序列。在一些实施方案中,第一多肽进一步包含插入在fviii蛋白内一个或多个插入位点处的第二xten序列。在某些实施方案中,第一多肽包含使fviii蛋白与第一ig恒定区或其一部分连接的第三xten序列。
15.也公开如本文所述的嵌合蛋白,其中第二xten序列、第三xten序列、或第二xten序列和第三xten序列各自独立地选自ae42、ae72、ae864、ae576、ae288、ae144、ag864、ag576、ag288和ag144。在一些实施方案中,第二xten序列、第三xten序列、或第二xten序列和第三xten序列各自独立地选自seq id no:8;seq id no:9、seq id no:10、seq id no:11、seq id no:17;seq id no:54;seq id no:19;seq id no:16;seq id no:18;seq id no:15;seq id no:55;seq id no:56;seq id no:57;seq id no:58;seq id no:59;seq id no:14;seq id no:60;seq id no:61;seq id no:62;或seq id no:63。在某些实施方案中,第二xten序列、第三xten序列、或第二xten序列与第三xten序列两者各自独立地是ae288或ag288。在一些实施方案中,通过接头使第二多肽中的xten序列融合于第二ig恒定区或其一部分。在某些实施方案中,接头是可裂解接头。
16.一些实施方案包括如本文所述的嵌合蛋白,其中接头可由选自以下的蛋白酶裂解:因子xia、因子xiia、胰舒血管素(kallikrein)、因子viia、因子ixa、因子xa、因子iia(凝血酶)、弹性蛋白酶-2(elastase-2)、粒酶-b(granzyme-b)、tev、肠激酶(enterokinase)、蛋
白酶3c、分选酶a(sortase a)、mmp-12、mmp-13、mmp-17和mmp-20。在一些实施方案中,接头可由因子iia(凝血酶)裂解。
17.也公开如本文所述的嵌合蛋白,其中接头包含一个或多个包含选自以下的氨基酸序列的裂解位点:rrrr(seq id no:102)、rkr rkr(seq id no:103)、rrrrs(seq id no:104)、tqsfndf tr(seq id no:1)、svsqtskltr(seq id no:3)、dflaegg gvr(seq id no:4)、ttkikpr(seq id no:5)、lvprg(seqid no:6)、alrpr(seq id no:7)、kltraet(seq id no:121)、dftrvvg(seq id no:122)、tmtrivgg(seq id no:123)、spfrstgg(seq id no:124)、lqvrivgg(seq id no:125)、plgrivgg(seq id no:126)、iegrtvgg(seq id no:127)、ltprsllv(seq id no:128)、lgpvsgvp(seq id no:129)、vagdslee(seq id no:130)、gpaglgga(seq id no:131)、gpaglrga(seq id no:132)、aplglrlr(seq id no:133)、palplvaq(seq id no:134)、enlyfqg(seq id no:135)、dddkivgg(seq id no:136)、levlfqgp(seq id no:137)、lpktgses(seq id no:138)、dkntgdyyedsyedisay llsknnaieprsfs(seq id no:88)和ieprsfs(seq id no:194)。在一些实施方案中,接头包含tldprsfllrnpndkyepfwed eek(seq id no:146)。在某些实施方案中,裂解位点包含氨基酸序列lvprg(seq id no:6)。在其它实施方案中,裂解位点包含氨基酸序列ieprsfs(seq id no:194)。在其它实施方案中,裂解位点包含氨基酸序列ieprsfs(seq id no:194),其中所述裂解位点不是fviii的全长a2区。在一些实施方案中,裂解位点包括fviii的a2区的包含至少序列iepr(seq id no:200)的片段。在其它实施方案中,裂解位点包括fviii的a2区的包含至少序列iepr(seq id no:200)的片段,其中所述裂解位点不是全长a2区。在某些实施方案中,在如本文提供或如本领域中已知的凝血酶裂解测定中,裂解位点是可裂解的。
18.一些实施方案包括如本文所述的嵌合蛋白,其中所述第一ig恒定区或其一部分包含第一fc区和/或第二ig恒定区或其一部分包含第二fc区。在一些实施方案中,第一ig恒定区或其一部分和第二ig恒定区或其一部分使嵌合蛋白的半衰期延长。在一些实施方案中,第一多肽和第二多肽通过接头融合。在某些实施方案中,第一多肽和第二多肽通过可加工接头融合。在一些实施方案中,第一ig恒定区或其一部分与第二ig恒定区或其一部分缔合。在某些实施方案中,第一ig恒定区或其一部分通过共价键与第二ig恒定区或其一部分缔合。在一些实施方案中,共价键是二硫键。
19.也公开包含下式(a)-(hh)中的每一个的嵌合蛋白:
20.(a)fviii-f1:f2-l2-x-l1-v;
21.(b)fviii-f1:v-l1-x-l2-f2;
22.(c)f1-fviii:f2-l2-x-l1-v;
23.(d)f1-fviii:v-l1-x-l2-f2;
24.(e)fviii-x2-f1:f2-l2-x1-l1-v;
25.(f)fviii-x2-f1:v-l1-x1-l2-f2;
26.(g)fviii(x2)-f1:f2-l2-x1-l1-v;
27.(h)fviii(x2)-f1:v-l1-x1-l2-f2;
28.(i)f1-x2-f1:f2-l2-x1-l1-v;
29.(j)f1-x2-f1:v-l1-x1-l2-f2;
30.(k)v-l1-x-l2-f2-l3-fviii-l4-f1;
31.(l)v-l1-x-l2-f2-l3-f1-l4-fviii;
32.(m)f1-l4-fviii-l3-f2-l2-x-l1-v;
33.(n)fviii-l4-f1-l3-f2-l2-x-l1-v;
34.(o)fviii-l4-f1-l3-v-l1-x-l2-f2;
35.(p)fviii-l4-f1-l3-f2-l2-x-l1-v;
36.(q)f2-l2-x-l1-v-l3-f1-l4-fviii;
37.(r)f2-l2-x-l1-v-l3-fviii-l4-f1;
38.(s)v-l1-x1-l2-f2-l3-fviii(x2)-l4-f1;
39.(t)v-l1-x1-l2-f2-l3-f1-l4-fviii(x2);
40.(u)f1-l4-fviii(x2)-l3-f2-l2-x1-l1-v;
41.(v)f-l4-fviii(x2)-l3-v-l1-x1-l2-f2;
42.(w)fviii(x2)-l4-f1-l3-v-l1-x1-l2-f2;
43.(x)fviii(x2)-l4-f1-l3-f2-l2-x1-l1-v;
44.(y)f2-l2-x1-l1-v-l3-f1-l4-fviii(x2);
45.(z)f2-l2-x1-l1-v-l3-fviii(x2)-l4-f1;
46.(aa)v-l1-x2-l2-f2-l3-fviii-l4-x2-l5-f1;
47.(bb)v-l1-x2-l2-f2-l3-f1-l5-x2-l4-fviii;
48.(cc)f1-l5-x2-l4-fviii-l3-f2-l2-x2-l1-v;
49.(dd)f1-l5-x2-l4-fviii-l3-v-l1-x2-l2-f2;
50.(ee)fviii-l5-x2-l4-f2-l3-v-l1-x1-l2-f1;
51.(ff)fviii-l5-x2-l4-f2-l3-f1-l2-x1-l1-v;
52.(gg)f1-l2-x1-l1-v-l3-f2-l4-x2-l5-fviii;或
53.(hh)f1-l2-x1-l1-v-l3-fviii-l5-x2-l4-f2;
54.其中v是vwf蛋白,其包含d’结构域和d3结构域,x或x1是含有小于288个氨基酸的第一xten序列,x2是第二xten序列,fviii包括fviii蛋白,fviii(x2)包括具有插入在fviii蛋白内一个或多个插入位点中的第二xten序列的fviii蛋白,f1是第一ig恒定区或其一部分,f2是第二ig恒定区或其一部分,l1、l2、l3、l4或l5是任选接头,(-)是肽键;并且(:)是共价键或非共价键。
55.一些实施方案包括如本文所述的嵌合蛋白,其中x或x1由长度在12个氨基酸与287个氨基酸之间的氨基酸序列组成。
56.在某些实施方案中,相较于包含所述式,例外之处是x或x1是ae288的相应嵌合蛋白,如本文所述的嵌合蛋白展现较长半衰期。在一些实施方案中,ae288是seq id no:8。
57.一些实施方案包括如本文所述的嵌合蛋白,其中式中x或x1含有约36、约42、约72或约144个氨基酸。在某些实施方案中,式中x或x1选自ae42、ae72、ae144、ag42、ag72或ag144。在一些实施方案中,式中x或x1选自seq id no:9、seq id no:10、seq id no:11、seq id no:55;seq id no:56;seq id no:57;seq id no:58;seq id no:59;seq id no:14;seq id no:60;seq id no:61;seq id no:62;或seq id no:63。在某些实施方案中,x2包含长度是至少约36个氨基酸、至少约42个氨基酸、至少约144个氨基酸、至少约288个氨基酸、至少约576个氨基酸、至少约864个氨基酸的氨基酸序列。在某些实施方案中,x2选自ae42、ae72、
ae864、ae576、ae288、ae144、ag864、ag576、ag288和ag144。在一些实施方案中,x2选自seq id no:8;seq id no:9;seq id no:10;seq id no:11;seq id no:17;seq id no:54;seq id no:19;seq id no:16;seq id no:18;seq id no:15;seq id no:55;seq id no:56;seq id no:57;seq id no:58;seq id no:59;seq id no:14;seq id no:60;seq id no:61;seq id no:62;或seq id no:63。在某些实施方案中,x2是ae288或ag288。
58.也公开如本文所述的包含x或x1和/或x2的嵌合蛋白,其相较于不包含x或x1和/或x2的嵌合蛋白展现较长半衰期。在一些实施方案中,l1和/或l2是可裂解接头。在某些实施方案中,l4和/或l5是可裂解接头。在某些实施方案中,接头可由选自以下的蛋白酶裂解:因子xia、因子xiia、胰舒血管素、因子viia、因子ixa、因子xa、因子iia(凝血酶)、弹性蛋白酶-2、粒酶-b、tev、肠激酶、蛋白酶3c、分选酶a、mmp-12、mmp-13、mmp-17和mmp-20。在一些实施方案中,接头可由因子iia(凝血酶)裂解。
59.一些实施方案包括如本文所述的嵌合蛋白,其中接头包含一个或多个包含选自以下的氨基酸序列的裂解位点:rrrr(seq id no:102)、rkrrkr(seq id no:103)、rrrrs(seq id no:104)、tqsfndftr(seq id no:2)、svsqtskltr(seq id no:3)、dflaegggvr(seq id no:4)、ttkikpr(seq id no:5)、lvprg(seq id no:6)、alrpr(seq id no:7)、kltraet(seq id no:121)、dftrvvg(seq id no:122)、tmtrivgg(seq id no:123)、spfrstgg(seq id no:124)、lqvrivgg(seq id no:125)、plgrivgg(seq id no:126)、iegrtvgg(seq id no:127)、ltprsllv(seq id no:128)、lgpvsgvp(seq id no:129)、vagdslee(seq id no:130)、gpaglgga(seq id no:131)、gpaglrga(seq id no:132)、aplglrlr(seq id no:133)、palplvaq(seq id no:134)、enlyfqg(seq id no:135)、dddkivgg(seq id no:136)、levlfqgp(seq id no:137)和lpktgses(seq id no:138)。在一些实施方案中,接头包含tldprsfllrnpndkyepfwedeek(seq id no:146)。在某些实施方案中,接头包含氨基酸序列lvprg(seq id no:6)。在一些实施方案中,接头包括fviii的a1区、fviii的a2区、fviii的a3区或其任何组合。在某些实施方案中,接头包括fvi ii的a2区的片段。在一些情况下,a2区的片段可包含序列dkntgdyyedsyedisayllsknnaieprsfs(seq id no:88)。在其它实施方案中,可使用fviii的a2区的较小片段,包括具有序列ieprsfs(seq id no:194)的片段。在一个特定实施方案中,接头包含氨基酸序列ieprsfs(seq id no:194)。在另一实施方案中,接头包含氨基酸序列ieprsfs(seq id no:194),其中接头不是fviii的全长a2区。
60.也公开如本文所述的嵌合蛋白,其中fviii的a2区包含与isdkntgdyyedsyedisayllsknnaieprsfs(seq id no:106)或dkntgdyyedsyedisayllsknnaieprsfs(seq id no:88)至少约80%、约85%、约90%、约95%或100%同一的氨基酸序列。在一些实施方案中,a1区包含与ismknneeaedydddltdsemdvvrfdddnspsfiqirsv(seq id no:107)至少约80%、约85%、约90%、约95%或100%同一的氨基酸序列。在某些实施方案中,a3区包含与iseitrttlqsdqeeidyddtisvemkkedfdiydedenqsprsfq(seq id no:108)至少约80%、约85%、约90%、约95%或100%同一的氨基酸序列。在一些实施方案中,f1包含第一fc区和/或f2包含第二fc区。
61.一些实施方案包括如本文所述的嵌合蛋白,其中相较于不包含f1和f2的嵌合蛋白,包含f1和f2的嵌合蛋白展现较长半衰期。在某些实施方案中,l3是可加工接头。在一些实施方案中,vwf蛋白通过非共价键与fviii蛋白缔合。在一些实施方案中,相较于无vwf蛋
白和/或xten序列的fviii蛋白或相较于野生型fviii,嵌合蛋白的半衰期被延长。在某些实施方案中,嵌合蛋白的半衰期比无vwf蛋白或xten序列的fviii蛋白或比野生型fviii延长至少约1.5倍、至少约2倍、至少约2.5倍、至少约3倍、至少约4倍、至少约5倍、至少约6倍、至少约7倍、至少约8倍、至少约9倍、至少约10倍、至少约11倍或至少约12倍。
62.也公开如本文所述的嵌合蛋白,其中嵌合蛋白的半衰期是至少约17小时、至少约18小时、至少约19小时、至少约20小时、至少约21小时、至少约22小时、至少约23小时、至少约24小时、至少约25小时、至少约26小时、至少约27小时、至少约28小时、至少约29小时、至少约30小时、至少约31小时、至少约32小时、至少约33小时、至少约34小时、至少约35小时、至少约36小时、至少约48小时、至少约60小时、至少约72小时、至少约84小时、至少约96小时或至少约108小时。在一些实施方案中,嵌合蛋白在hema小鼠中的半衰期是约40小时。在某些实施方案中,vwf蛋白不实质上结合vwf清除受体。在一些实施方案中,vwf蛋白能够保护fviii蛋白免遭一种或多种蛋白酶裂解,保护fviii蛋白免遭活化,使fviii蛋白的重链和/或轻链稳定,或防止fviii蛋白被一种或多种清道夫受体清除。
63.一些实施方案包括如本文所述的嵌合蛋白,其中vwf蛋白通过遮蔽或阻断fviii蛋白上的vwf结合位点来抑制或防止内源性vwf结合fviii蛋白。在某些实施方案中,vwf结合位点位于fviii蛋白的a3结构域或c2结构域、或a3结构域与c2结构域两者中。在一些实施方案中,vwf结合位点包含对应于seq id no:65的氨基酸1669至1689以及2303至2332的氨基酸序列。在一些实施方案中,第一ig恒定区或其一部分和第二ig恒定区或其一部分是相同的或不同的。在某些实施方案中,fviii蛋白连接于和/或插入有至少两个xten序列、至少三个xten序列、至少四个xten序列、至少五个xten序列或至少六个xten序列。
64.也公开如本文所述的嵌合蛋白,其中fviii蛋白包含fviii的一个或多个选自以下的结构域:a1结构域、a1酸性区、a2结构域、a2酸性区、b结构域、a3结构域、a3酸性区、c1结构域、c2结构域、其一个或多个片段及其任何组合。
65.也公开如本文所述的嵌合蛋白,其中fviii蛋白中的一个或多个插入位点位于fviii蛋白的一个或多个选自以下的结构域内:a1结构域、a1酸性区、a2结构域、a2酸性区、a3结构域、b结构域、c1结构域、c2结构域及其任何组合,或位于fviii蛋白的一个或多个选自由以下组成的组的结构域之间:a1结构域和a1酸性区、a1酸性区和a2结构域、a2结构域和a2酸性区、a2酸性区和b结构域、b结构域和a3结构域、a3结构域和c1结构域、c1结构域和c2结构域及其任何组合,或位于fviii蛋白的选自以下的两个结构域之间:a1结构域和a1酸性区、a1酸性区和a2结构域、a2结构域和a2酸性区、a2酸性区和b结构域、b结构域和a3结构域、a3结构域和c1结构域、c1结构域和c2结构域及其任何组合。在一些实施方案中,fviii蛋白中的一个或多个插入位点是一个或多个选自由表7、表8、表9和表10中的氨基酸残基组成的组的氨基酸。在某些实施方案中,fviii蛋白中的插入位点位于紧靠对应于成熟fviii蛋白(seq id no:65)的氨基酸745的下游。在一些实施方案中,fviii蛋白中的插入位点位于紧靠对应于成熟fviii蛋白(seq id no:65)的残基1656和残基1900的下游。在一些实施方案中,fviii蛋白中的插入位点紧靠对应于成熟fviii蛋白(seq id no:65)的残基26、1656和1900的下游。在某些实施方案中,fviii蛋白中的插入位点紧靠对应于成熟fviii蛋白(seq id no:65)的残基403和745的下游。在一些实施方案中,fviii蛋白中的插入位点紧靠对应于成熟fviii蛋白(seq id no:65)的残基745和1900的下游。在某些实施方案中,fviii蛋白
中的插入位点紧靠对应于成熟fviii蛋白(seq id no:65)的残基18和745的下游。在一些实施方案中,fviii蛋白是双链fviii亚型。在一些实施方案中,fviii蛋白是单链fviii亚型。在某些实施方案中,fviii蛋白包含b结构域或其一部分。在一些实施方案中,fviii蛋白是sq b结构域缺失的fviii。
66.一些实施方案包括如本文所述的嵌合蛋白,其中单链fviii亚型在对应于以下的残基处含有至少一个氨基酸取代:对应于全长成熟因子viii多肽(seq id no:65)的残基1648、残基1645或两个残基或sq bdd因子viii(seq id no:67)的残基754、残基751或两个残基。在某些实施方案中,氨基酸取代是除精氨酸以外的氨基酸。在一些实施方案中,双链fviii亚型包含含有fviii的重链的第一链和含有fviii的轻链的第二链,其中所述重链和所述轻链通过金属键彼此缔合。在某些实施方案中,d'结构域包含与seq id no:21的氨基酸764至866至少90%、95%、96%、97%、98%、99%或100%同一的氨基酸序列。在一些实施方案中,d3结构域包含与seq id no:21的氨基酸867至1240至少90%、95%、96%、97%、98%、99%或100%同一的氨基酸序列。在某些实施方案中,vwf蛋白是单体。
67.也公开如本文所述的嵌合蛋白,其包含至少两个vwf蛋白、至少三个vwf蛋白、至少四个vwf蛋白、至少五个vwf蛋白或至少六个vwf蛋白。在某些实施方案中,vwf蛋白包含与seq id no:21的氨基酸764至1240至少90%、95%、96%、97%、98%、99%或100%同一的氨基酸序列。在一些实施方案中,vwf蛋白基本上由以下组成或由以下组成:seq id no:21的氨基酸764至1240。在某些实施方案中,vwf蛋白在对应于seq id no:21的残基1099、残基1142、或残基1099与1142两者的残基处含有至少一个氨基酸取代。在一些实施方案中,vwf蛋白含有取代对应于seq id no:21的残基1099、残基1142、或残基1099与1142两者的残基的除半胱氨酸以外的氨基酸。在某些实施方案中,vwf蛋白进一步包含vwf的d1结构域、d2结构域、或d1和d2结构域。
68.一些实施方案包括如本文所述的嵌合蛋白,其中vwf蛋白进一步包含选自以下的vwf结构域:a1结构域、a2结构域、a3结构域、d4结构域、b1结构域、b2结构域、b3结构域、c1结构域、c2结构域、ck结构域、其一个或多个片段及其任何组合。
69.也公开如本文所述的嵌合蛋白,其中vwf蛋白基本上由以下组成或由以下组成:(1)vwf的d'和d3结构域或其片段;(2)vwf的d1、d'和d3结构域或其片段;(3)vwf的d2、d'和d3结构域或其片段;(4)vwf的d1、d2、d'和d3结构域或其片段;或(5)vwf的d1、d2、d'、d3和a1结构域或其片段。
70.一些实施方案包括如本文所述的嵌合蛋白,其中vwf蛋白进一步包含vwf或fviii的可操作地连接于vwf蛋白的信号肽。
71.也公开如本文所述的嵌合蛋白,其中一个或多个接头的长度是至少约10、20、30、40、50、60、70、80、90、100、110、120、130、140、150、160、170、180、190、200、210、220、230、240、250、300、350、400、450、500、550、600、650、700、750、800、850、900、950、1000、1200、1400、1600、1800或2000个氨基酸残基。在一些实施方案中,一个或多个接头的长度是约1至约2000个氨基酸残基。在某些实施方案中,一个或多个接头包括gly/ser肽。在一些实施方案中,gly/ser肽具有式(gly4ser)n(seq id no:94)或s(gly4ser)n(seq id no:164),其中n是选自由1、2、3、4、5、6、7、8、9和10组成的组的正整数。在某些实施方案中,(gly4ser)n接头是(gly4ser)3(seq id no:100)或(gly4ser)4(seq id no:165)。在一些实施方案中,接头包
含20个氨基酸、35个氨基酸、48个氨基酸、73个氨基酸或95个氨基酸。在某些实施方案中,可裂解接头是sggggsggggsggggsggggsggggslvprgsgg(seq id no:166)。
72.在一些实施方案中,如本文所述的嵌合蛋白是聚唾液酸化、聚乙二醇化或羟乙基淀粉化的。
73.也公开如本文所述的嵌合蛋白,其中第一多肽包括与fviii161(seq id no:69)、fviii169(seq id no:70)、fviii173(seq id no:72)、fviii195(seq id no:73)、fviii196(seq id no:74)、fviii199(seq id no:75)、fviii201(seq id no:76)、fviii203(seq id no:77)、fviii204(seq id no:78)、fviii205(seq id no:79)、fviii266(seq id no:80)、fviii267(seq id no:81)、fviii268(seq id no:82)、fviii269(seq id no:83)、fviii271(seq id no:84)、fviii272(seq id no:85)或fviii282(seq id no:159)至少约80%、90%、95%、99%或100%同一,并且第二多肽包括与vwf057(seq id no:152)或vwf059(seq id no:197)至少约80%、90%、95%、99%或100%同一。在一些实施方案中,第一多肽包含fviii169(seq id no:70),并且第二多肽包含vwf057(seq id no:152)。在其它实施方案中,第一多肽包含fviii169(seq id no:70),并且第二多肽包含vwf059(seq id no:197)。在另一实施方案中,第一多肽包含fviii169(seq id no:70),并且第二多肽包含vwf062(seq id no:199)。在一些实施方案中,嵌合蛋白有效预防和/或阻止从有需要的受试者流血。
74.也公开编码如本文所述的嵌合蛋白的一种多核苷酸或一组多核苷酸。在一些实施方案中,如本文所述的多核苷酸进一步包含编码pc5或pc7的多核苷酸链。
75.一些实施方案包括一种载体,其包含如本文所述的多核苷酸和一种或多种可操作地连接于所述多核苷酸或所述一组多核苷酸的启动子。
76.在一些实施方案中,如本文所述的载体进一步包括包含编码pc5或pc7的多核苷酸链的另外的载体。
77.也公开一种包含如本文所述的多核苷酸或载体的宿主细胞。在一些实施方案中,宿主细胞是哺乳动物细胞。在某些实施方案中,哺乳动物细胞选自hek293细胞、cho细胞和bhk细胞。
78.也公开一种药物组合物,其包含如本文所述的嵌合蛋白、多核苷酸、载体或宿主细胞以及药学上可接受的载体。在一些实施方案中,相较于野生型fviii蛋白,嵌合蛋白具有延长的半衰期。在某些实施方案中,嵌合蛋白的半衰期比野生型fviii延长至少约1.5倍、至少约2倍、至少约2.5倍、至少约3倍、至少约4倍、至少约5倍、至少约6倍、至少约7倍、至少约8倍、至少约9倍、至少约10倍、至少约11倍或至少约12倍。
79.一些实施方案包括如本文所述的组合物,其中嵌合蛋白的半衰期是至少约17小时、至少约18小时、至少约19小时、至少约20小时、至少约21小时、至少约22小时、至少约23小时、至少约24小时、至少约25小时、至少约26小时、至少约27小时、至少约28小时、至少约29小时、至少约30小时、至少约31小时、至少约32小时、至少约33小时、至少约34小时、至少约35小时、至少约36小时、至少约48小时、至少约60小时、至少约72小时、至少约84小时、至少约96小时或至少约108小时。在某些实施方案中,嵌合蛋白在hema小鼠中的半衰期是约40小时。在一些实施方案中,通过选自由以下组成的组的途径施用如本文所述的组合物:局部施用、眼内施用、胃肠外施用、鞘内施用、硬膜下施用和口服施用。在某些实施方案中,胃肠
外施用是静脉内或皮下施用。
80.在一些实施方案中,如本文所述的组合物用于治疗有需要的受试者的流血疾病或病状。在某些实施方案中,流血疾病或病状选自由以下组成的组:流血凝血病症、关节积血、肌肉流血、口腔流血、出血、向肌肉中出血、口腔出血、创伤、头创伤、胃肠流血、颅内出血、腹内出血、胸内出血、骨折、中枢神经系统流血、咽后隙中流血、腹膜后隙中流血、髂腰肌鞘中流血及其任何组合。在一些实施方案中,受试者预定经受手术。在某些实施方案中,治疗是防治性的或按需进行。
81.也公开一种延长或增加嵌合蛋白的半衰期的方法,其中所述方法包括向有需要的受试者添加有效量的如本文所述的嵌合蛋白、多核苷酸、载体、宿主细胞或组合物,其中vwf蛋白、xten序列、第一ig恒定区或其一部分和第二ig恒定区或其一部分使嵌合蛋白的半衰期增加。
82.一些实施方案包括一种治疗有需要的受试者的流血疾病或病症的方法,其包括施用有效量的如本文所述的嵌合蛋白、多核苷酸、载体、宿主细胞或组合物,其中所述流血疾病或病症选自由以下组成的组:流血凝血病症、关节积血、肌肉流血、口腔流血、出血、向肌肉中出血、口腔出血、创伤、头创伤、胃肠流血、颅内出血、腹内出血、胸内出血、骨折、中枢神经系统流血、咽后隙中流血、腹膜后隙中流血和髂腰肌鞘中流血。在一些实施方案中,受试者是动物。在某些实施方案中,动物是人。在一些实施方案中,受试者正罹患甲型血友病。在某些实施方案中,治疗是防治性的或按需进行。在一些实施方案中,有效量是0.1μg/kg至500mg/kg。
83.也公开一种如本文所述的方法,其中通过选自由以下组成的组的途径施用如本文所述的嵌合蛋白、多核苷酸、载体、宿主细胞或组合物:局部施用、眼内施用、胃肠外施用、鞘内施用、硬膜下施用和口服施用。在某些实施方案中,胃肠外施用选自由以下组成的组:静脉内施用、皮下施用、肌肉内施用和皮内施用。
84.一些实施方案包括一种制备嵌合蛋白的方法,其包括用如本文所述的多核苷酸或载体转染一种或多种宿主细胞,以及在宿主细胞中表达所述嵌合蛋白。在一些实施方案中,如本文所述的方法进一步包括分离嵌合蛋白。在某些实施方案中,嵌合蛋白有效阻止和/或预防受试者的流血。
85.附图简述
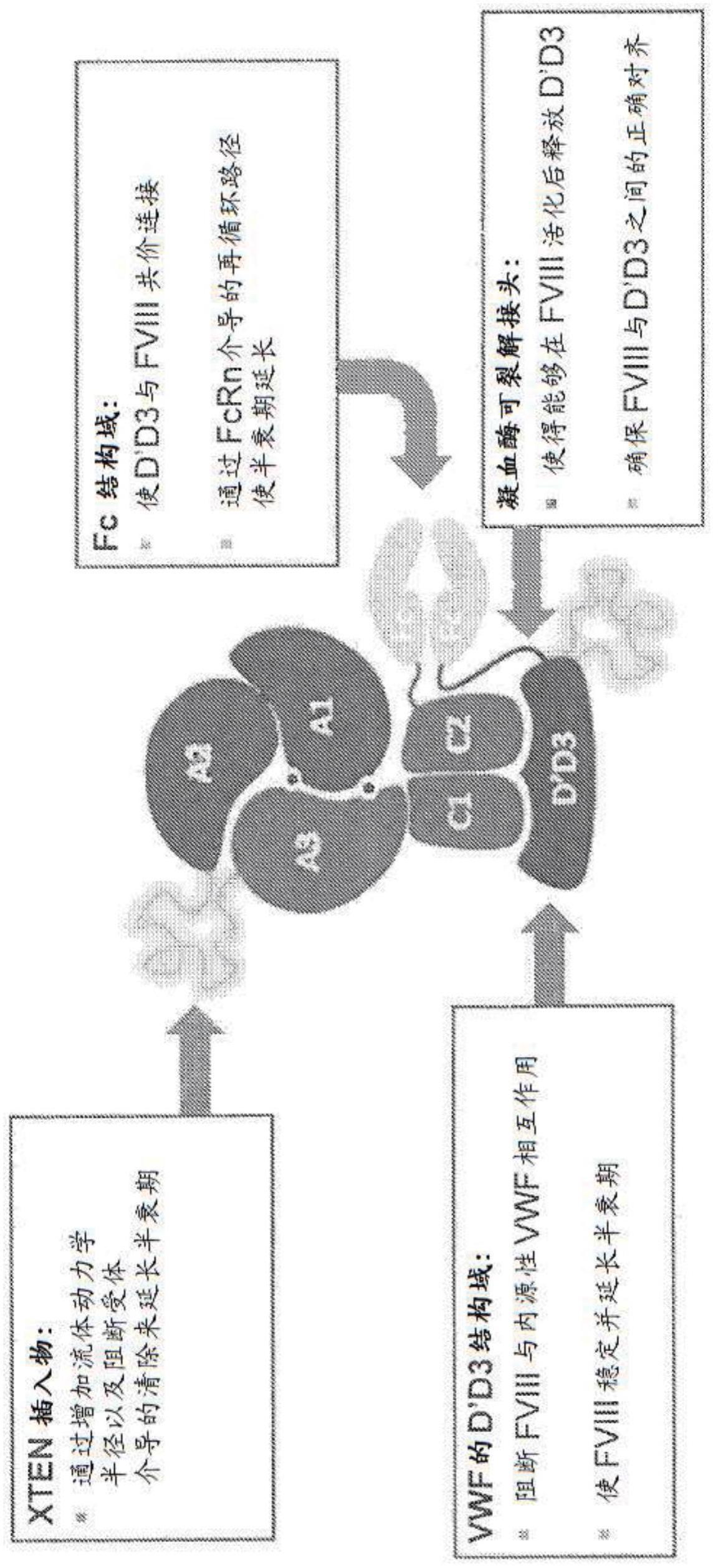
86.图1显示嵌合蛋白的示意图,所述嵌合蛋白包含第一多肽,所述第一多肽包含融合于fc区的fviii蛋白(a1-a2-部分或完全b-a3-c1-c2),其中xten插入在所述fviii蛋白内的插入位点处;和第二多肽,所述第二多肽包含含有d’d3结构域的vwf蛋白、具有小于288个氨基酸的xten、凝血酶可裂解接头和第二fc区。xten插入在fviii蛋白中和/或融合于vwf蛋白通过增加流体动力学半径以及通过阻断受体介导的清除来延长嵌合蛋白的半衰期。vwf的d’d3结构域阻断fviii与内源性vwf相互作用,使fviii蛋白稳定,并且延长嵌合蛋白的半衰期。fc结构域可使d’d3结构域与fviii蛋白共价连接,并且通过fcrn介导的再循环路径来延长嵌合蛋白的半衰期。凝血酶可裂解接头使得能够在fviii活化后释放d’d3结构域,并且确保fviii与vwf的d’d3结构域之间的正确对齐。
87.图2显示fviii-xten-fc:d’d3-xten-fc异二聚体的三质粒表达系统:第一质粒包含编码单链fviii-xten-fc的核苷酸序列,其中xten插入b结构域中;第二质粒包含编码
d1d2d’d3-xten-fc的核苷酸序列,其中xten序列包含小于288个氨基酸;并且第三质粒包含编码pace(一种原肽加工酶)的核苷酸序列。当三种多肽从三种质粒表达时,vwf的d1d2原肽结构域可通过细胞内加工来从d’d3结构域加以加工。所得复合物含有三种产物,第一分子是fviii-xten/d’d3异二聚体,第二分子是副产物,即d’d3-xten-fc的同二聚体,并且第三分子是另一副产物,即fviii(xten)-fc。
88.图3显示xten插入物对异二聚体的半衰期延长的累加作用。fviii169包含融合于fc区的b结构域缺失的fviii蛋白,其中xten序列(例如ae288)插入在对应于成熟全长fviii的氨基酸745处。fviii205包含融合于fc区的b结构域缺失的fviii蛋白,其中xten序列(例如ae144)插入在对应于成熟全长fviii的氨基酸18处,并且另一xten序列(例如ae288)插入在对应于成熟全长fviii的氨基酸745处。vwf031包含通过凝血酶可裂解接头融合于fc区的vwf的d’结构域和d3结构域(无xten)。vwf034包含融合于ae288和fc区的vwf的d’结构域和d3结构域。fviii169/vwf031(倒三角)在hema小鼠中的半衰期是16.7小时;fviii205/vwf031(圆圈)在hema小鼠中的半衰期是29.4小时;并且fviii169/vwf034(方块)在hema小鼠中的半衰期是31.1小时。
89.图4显示当插入在vwf的d’d3结构域与fc结构域之间时,ae144 xten比ae288 xten赋予更佳半衰期延长。举例来说,尽管vwf169/vwf034(方块)在hema小鼠中的半衰期是31.1.小时,但fviii169/vwf057(圆圈)在hema小鼠中的半衰期是42小时。vwf057包含融合于ae144和fc区的vwf的d’d3结构域。
90.图5显示fc结构域为嵌合蛋白异二聚体的半衰期延长所需。当将fviii205/vwf031(圆圈)在hema小鼠中的半衰期与在fcrn结合位点处含有突变(ihh三重突变fc)并且因此不能通过fcrn路径再循环的fviii263/vwf050(方块)的半衰期进行比较时,fviii263/vwf 050的半衰期(23小时)短于vwf205/vwf031的半衰期(29.4小时)。这指示fc区为半衰期延长所必需。
91.图6小图a显示在hema小鼠尾部钳夹模型中,fviii-xten-fc/d’d3-xten-fc异二聚体相较于b结构域缺失的fviii(sq bdd fviii)的类似急性功效。在75iu/kg下对小鼠给药,并且通过aptt测定来测量活性。sq bdd fviii显示为圆圈,而fviii169/vwf034显示为方块,fviii169/vwf057显示为菱形,并且媒介物显示为倒三角。fviii169、vwf034和vwf057的构建体细节显示在本文其它地方。图6小图b显示在37.5iu/kg剂量下,fviii169/vwf034与b结构域缺失的fviii(sq bdd fviii)在hema小鼠中的急性功效的比较,并且通过aptt测定来测量活性。各治疗组中小鼠的中值失血(ul)由水平线指示,c57/bl6小鼠中的失血(ul)显示为中空三角;在37.5iu/kg的rbdd-fviii给药之后的失血(ul)显示为中空圆圈;在37.5iu/kg的fviii169/vwf034给药之后的失血(ul)显示为中空方块,并且在媒介物给药之后的失血(ul)显示为倒三角。
92.图7小图a-b显示rfviii169/vwf057异二聚体在尾部静脉横切流血模型中对hema小鼠提供较长久保护。图7小图a显示在尾部损伤之前72小时接受rfviii169/vwf057(方块)、在尾部损伤之前48小时接受sq bdd-fviii(菱形)、在尾部损伤之前24小时接受sq bdd fviii(倒三角)以及接受媒介物(圆圈)的小鼠中的再流血数据。通过aptt测定来测量活性。x轴显示以小时计的时间,并且y轴显示非流血者的百分比。图7小图b显示图7小图a中所示的四个种类的小鼠中的相应存活数据。相较于在尾部损伤之前24小时接受sq bdd fviii治
疗的小鼠,在尾部损伤之前72小时接受12iu/kg的fviii169/vwf057的小鼠显示关于再流血和存活的类似保护。
93.图8小图a显示在损伤之前96小时接受rfviii-xten-fc/d’d3-xten-fc异二聚体的小鼠中相对于在损伤之前24小时接受rbdd-fviii的小鼠中的类似再流血数据。实心方块显示在损伤之前24小时接受fviii169/vwf034的小鼠中的再流血数据;中空方块显示在损伤之前96小时接受fviii169/vwf034的小鼠中的再流血数据;实心菱形显示在损伤之前24小时接受fviii169/vwf057的小鼠中的再流血数据;中空菱形显示在损伤之前96小时接受fviii169/vwf057的小鼠中的再流血数据;实心圆圈显示在损伤之前24小时接受rbdd-fviii的小鼠中的再流血数据;中空圆圈显示在损伤之前48小时接受rbdd-fviii的小鼠中的再流血数据;并且实心三角显示接受媒介物的小鼠中的再流血数据。x轴显示以小时计的时间,并且y轴显示非流血者的百分比。
94.图8小图b显示在损伤之前96小时接受rfviii-xten-fc/d’d3-xten-fc异二聚体的小鼠中相对于在损伤之前24小时接受rbdd-fviii的小鼠中的存活曲线。x轴显示以小时计的时间,并且y轴显示存活百分比。符号与图8小图a相同。
95.图9显示代表性fviii-vwf异二聚体以及fviii169、fviii286、vwf057、vwf059和vwf062构建体的图解。举例来说,fviii169构建体包含融合于fc区的具有r1648a取代的b结构域缺失的fvii i蛋白,其中xten序列(例如ae288)插入在对应于成熟全长fviii的氨基酸745处(a1-a1-a2-a2-288xten-a3-a3-c1-c2-fc)。fviii286构建体包含融合于fc区的具有r1648取代的b结构域缺失的fviii蛋白,其中xten序列(例如ae288)插入在对应于成熟全长fviii的氨基酸745处,在fviii与fc之间具有另外的a2区(a1-a1-a2-a2-288xten-a3-a3-c1-c2-a2-fc)。vwf057是一种vwf-fc融合构建体,其包含通过包含lvprg凝血酶位点(“lvprg”;seq id no:6)和gs接头(“gs”)的vwf接头连接于fc区的vwf蛋白的d'd3结构域(在d'd3结构域中具有两个氨基酸取代,即c336a和c379a),其中xten序列(即ae144)插入在d'd3结构域与vwf接头之间(d'd3-144xten-gs+lvprg-fc)。vwf059是一种vwf-fc融合构建体,其包含通过fviii的酸性区2(a2)作为vwf接头连接于fc区的vwf蛋白的d'd3结构域(在d'd3结构域中具有两个氨基酸取代,即c336a和c379a),其中xten序列(即ae144)插入在d'd3结构域与vwf接头之间。vwf062是一种vwf-fc融合构建体,其包含连接于fc区的vwf蛋白的d'd3结构域(在d'd3结构域中具有两个氨基酸取代,即c336a和c379a),其中xten序列(即ae144)插入在d'd3结构域与fc区之间(d'd3-144xten-fc)。
96.图10显示表示fviii/vwf异二聚体构建体,例如fviii169/vw f057、fviii169/vwf059、fviii169/vwf059a和fviii169/vwf073的示意图。箭头显示添加任选接头以引入凝血酶裂解位点所处的位点。fviii169/vwf057具有包含lvprg(seq id no:6)的接头。fviii169/vwf059具有包含fviii a2区(即isdkntgdyyedsyedisayllsknnaieprsfsdkth(seq id no:106))的接头。fviii169/vwf059a具有包含截短fviii a2区(即dkntgdyyedsyedisayllsknnaieprsfsdkth(seq id no:88))的接头。fviii169/vwf 073在vwf073构建体(seq id no:175)内具有包含fviii a2区的由ieprsfs(seq id no:194)组成的片段的接头。
97.图11小图a-c显示在凝血酶消化fviii169/vwf057和fviii-fc对照之后的sds-page图像。图11小图a显示用抗d3抗体(ab 96340)对sds-page凝胶的染色。箭头突出“lcfc:
d'd3-xten-fc”,其是未裂解的全长fviii169/vwf057;和“d'd3-144 xten”,其是在由凝血酶裂解之后的所得片段。图11小图b显示用抗hc抗体(gma012)对sds-page凝胶的染色。箭头突出fviii重链(“hc”)和fviii a2结构域。图11小图c显示小图a和b的重叠图。在各图的顶部指示的时间点收集样品。箭头指向相关蛋白质。
98.图12小图a-c显示在凝血酶消化fviii169/vwf059之后的sd s-page图像。图12小图a显示用抗d3抗体(ab 96340)对sds-pa ge凝胶的染色。箭头突出“lcfc:d'd3-xten-fc”,其是未裂解的全长fviii169/vwf059;和“d'd3-144 xten”,其是在由凝血酶裂解之后的所得片段。图12小图b显示用抗hc抗体(gma012)对sds-page凝胶的染色。箭头突出未裂解的全长fviii169/vwf059;d'd3-144xten-a3,其是在由凝血酶裂解之后的所得片段;和“a2”,其是fvii i的a2结构域。图12小图c显示小图a和b的重叠图。在各图的顶部指示的时间点收集样品。
99.图13显示相较于用bdd-fviii对照(方块)治疗的hema小鼠,用fviii169/vwf059(圆圈)治疗的hema小鼠的急性功效数据。在尾部钳夹之后测量失血值。p=0.9883。
100.发明详述
101.本发明涉及一种包含两个多肽的嵌合蛋白,第一多肽包含融合于第一ig恒定区的fviii蛋白,并且第二多肽包含通过xten序列融合于第二ig恒定区或其一部分的vwf蛋白,其中所述xten序列含有小于288个氨基酸。
102.i.定义
103.应注意术语“一”实体是指一个或多个那个实体;例如“一核苷酸序列”应理解为表示一个或多个核苷酸序列。因此,术语“一”、“一个(种)或多个(种)”和“至少一个(种)”在本文中可互换使用。
104.此外,当在本文中使用时,“和/或”应视为特定公开两个指定特征或组分中的每一个,伴有或不伴有另一个。因此,如本文在诸如“a和/或b”的短语中所用的术语“和/或”意图包括“a和b”、“a或b”、“a”(单独)和“b”(单独)。同样,如诸如“a、b和/或c”的短语中所用的术语“和/或”意图涵盖以下方面中的每一个:a、b和c;a、b或c;a或c;a或b;b或c;a和c;a和b;b和c;a(单独);b(单独);和c(单独)。
105.应了解每当在本文中以措辞“包含”描述各个方面的情况下,也提供以“由
…
组成”和/或“基本上由
…
组成”描述的另外类似方面。
106.除非另外定义,否则本文所用的所有技术和科学术语都具有与由本公开所相关领域中的普通技术人员通常理解相同的含义。举例来说,concise dictionary of biomedicine and molecular biology,juo,pei-show,第2版,2002,crc press;the dictionary of cell and molecular biology,第3版,1999,academic press;以及oxford dictionary of biochemistry and molecular biology,修订版,2000,oxford university press提供技术人员以本公开中使用的许多术语的综合词典。
107.单位、前缀和符号以它们的syst
è
me international de unites(si)接受形式表示。数值范围包括界定范围的数值。除非另外指示,否则氨基酸序列以氨基至羧基定向从左至右书写。本文提供的标题并非是对本公开的各个方面的限制,所述各个方面可通过参考说明书整体而得到。因此,通过参考说明书整体,以下紧接着定义的术语被更充分阐释。
108.术语“约”在本文中用于意指近似、大致、大约或在...左右。当术语“约”与数值范
围联合使用时,它通过使边界延伸高于和低于阐述的数值来修饰那个范围。一般来说,术语“约”可通过向上或向下(增高或降低)变化例如10%来修饰数值高于和低于陈述的值。
109.术语“多核苷酸”或“核苷酸”意图涵盖单个核酸以及多个核酸,并且是指分离的核酸分子或构建体,例如信使rna(mrna)或质粒dna(pdna)。在某些实施方案中,多核苷酸包含常规磷酸二酯键或非常规键(例如酰胺键,诸如见于肽核酸(pna)中)。术语“核酸”是指存在于多核苷酸中的任何一个或多个核酸区段,例如dna或rna片段。就“分离的”核酸或多核苷酸来说,其意指已从它的天然环境移除的核酸分子dna或rna。举例来说,出于本发明的目的,载体中含有的编码因子viii多肽的重组多核苷酸被视为是分离的。分离的多核苷酸的其它实例包括维持在异源性宿主细胞中的重组多核苷酸,或呈溶液形式的从其它多核苷酸纯化(部分或实质上纯化)的重组多核苷酸。分离的rna分子包括本发明的多核苷酸的体内或体外rna转录物。本发明的分离的多核苷酸或核酸进一步包括合成产生的所述分子。此外,多核苷酸或核酸可包括调控元件,诸如启动子、增强子、核糖体结合位点或转录终止信号。
110.如本文所用,“编码区”或“编码序列”是多核苷酸的由可翻译成氨基酸的密码子组成的一部分。尽管“终止密码子”(tag、tga或taa)通常不翻译成氨基酸,但它可被视为编码区的一部分,然而任何侧接序列(例如启动子、核糖体结合位点、转录终止子、内含子等)都不是编码区的一部分。编码区的边界通常由在5'末端的起始密码子(编码所得多肽的氨基末端)和在3'末端的翻译终止密码子(编码所得多肽的羧基末端)来确定。本发明的两个或更多个编码区可存在于单一多核苷酸构建体中,例如在单一载体上,或存在于单独多核苷酸构建体中,例如在单独(不同)载体上。那么由此可见单一载体可仅含有单一编码区,或包含两个或更多个编码区,例如单一载体可单独编码如下所述的结合结构域a和结合结构域b。此外,本发明的载体、多核苷酸或核酸可编码融合或未融合于编码本发明的结合结构域的核酸的异源性编码区。异源性编码区包括不限于专门化元件或基序,诸如分泌信号肽或异源性功能性结构域。
111.由哺乳动物细胞分泌的某些蛋白质与分泌信号肽缔合,一旦逐渐增长的蛋白质链跨越粗糙内质网的排出已被引发,所述信号肽即从成熟蛋白质裂解。本领域普通技术人员应了解信号肽通常融合于多肽的n末端,并且从完全或“全长”多肽裂解以产生多肽的分泌或“成熟”形式。在某些实施方案中,使用天然信号肽,或那个序列的保留引导可操作地与它关联的多肽分泌的能力的功能性衍生物。或者,可使用异源性哺乳动物信号肽,例如人组织纤维蛋白溶酶原活化因子(tissue plasminogen activator,tpa)或小鼠β-葡萄糖醛酸酶(β-glucuronidase)信号肽或其功能性衍生物。
112.术语“下游”在涉及核苷酸序列时意指核酸或核苷酸序列位于参照核苷酸序列的3'。在某些实施方案中,下游核苷酸序列涉及在转录起始点之后的序列。举例来说,基因的翻译起始密码子位于转录起始位点的下游。术语“下游”在涉及多肽序列时意指氨基酸或氨基酸插入位点位于参照氨基酸的c末端。举例来说,紧靠对应于成熟野生型fviii蛋白的氨基酸745的下游的插入位点意指插入位点在对应于成熟野生型fviii蛋白的氨基酸745与氨基酸746之间。
113.术语“上游”是指核苷酸序列位于参照核苷酸序列的5'。在某些实施方案中,上游核苷酸序列涉及位于编码区或转录起始点的5'侧的序列。举例来说,大多数启动子位于转
录起始位点的上游。
114.如本文所用,术语“调控区”是指位于编码区的上游(5'非编码序列)、内部或下游(3'非编码序列),并且影响关联的编码区的转录、rna加工、稳定性或翻译的核苷酸序列。调控区可包括启动子、翻译前导序列、内含子、聚腺苷酸化识别序列、rna加工位点、效应物结合位点和茎-环结构。如果编码区意图在真核细胞中表达,那么聚腺苷酸化信号和转录终止序列将通常位于编码序列的3'。
115.编码基因产物(例如多肽)的多核苷酸可包括可操作地与一个或多个编码区关联的启动子和/或其它转录或翻译控制元件。在一可操作关联中,基因产物(例如多肽)的编码区以将所述基因产物的表达置于调控区的影响或控制下的方式与一个或多个调控区关联。举例来说,如果诱导启动子功能导致编码由编码区编码的基因产物的mrna转录,并且如果启动子与编码区之间的连接的性质不干扰启动子引导基因产物表达的能力或不干扰dna模板被转录的能力,那么编码区和启动子被“可操作地关联”。除启动子之外,其它转录控制元件(例如增强子、操纵子、阻遏子和转录终止信号)也可可操作地与编码区关联以引导基因产物表达。
116.多种转录控制区为本领域技术人员所知。这些转录控制区包括不限于在脊椎动物细胞中起作用的转录控制区,诸如但不限于来自巨细胞病毒(立即早期启动子,与内含子-a联合)、猿猴病毒40(早期启动子)和逆转录病毒(诸如劳斯肉瘤病毒(rous sarcoma virus))的启动子和增强子区段。其它转录控制区包括源于脊椎动物基因(诸如肌动蛋白(actin)、热休克蛋白、牛生长激素和兔β-球蛋白)的那些转录控制区,以及能够控制真核细胞中的基因表达的其它序列。另外适合转录控制区包括组织特异性启动子和增强子以及淋巴因子(lymphokine)诱导性启动子(例如可由干扰素或白介素诱导的启动子)。
117.类似地,多种翻译控制元件为本领域普通技术人员所知。这些翻译控制元件包括但不限于核糖体结合位点、翻译起始和终止密码子、以及源于微小rna病毒的元件(特别是内部核糖体进入位点或ires,也被称为cite序列)。
118.如本文所用的术语“表达”是指多核苷酸产生基因产物(例如rna或多肽)所采用的过程。它包括不限于多核苷酸转录成信使rna(mrna)、转移rna(trna)、小发夹rna(shrna)、小干扰rna(sirna)或任何其它rna产物,以及mrna翻译成多肽。表达产生“基因产物”。如本文所用,基因产物可为核酸(例如通过基因转录产生的信使rna)或从转录物翻译的多肽。本文所述的基因产物进一步包括具有转录后修饰(例如聚腺苷酸化或剪接)的核酸、或具有翻译后修饰(例如甲基化、糖基化、添加脂质、与其它蛋白质亚单位缔合、或蛋白水解裂解)的多肽。
[0119]“载体”是指用于将核酸克隆和/或转移至宿主细胞中的任何媒介物。载体可为另一核酸区段可与其连接以便致使所连接区段复制的复制子。“复制子”是指在体内充当自主复制单元,即能够在它自身控制下复制的任何遗传元件(例如质粒、噬菌体、粘粒、染色体、病毒)。术语“载体”包括用于在体外、离体或在体内将核酸引入细胞中的病毒媒介物与非病毒媒介物两者。本领域中已知并使用许多载体,包括例如质粒、修饰的真核病毒或修饰的细菌病毒。将多核苷酸插入适合载体中可通过将适当多核苷酸片段连接至具有互补粘性末端的所选载体中来实现。
[0120]
载体可被工程改造以编码提供对已并有载体的细胞的选择或鉴定的可选择标记
或报道体。可选择标记或报道体的表达允许鉴定和/或选择并有且表达载体上含有的其它编码区的宿主细胞。本领域中已知并使用的可选择标记基因的实例包括:提供对氨苄青霉素(ampicillin)、链霉素(streptomycin)、庆大霉素(gentamycin)、卡那霉素(kanamycin)、潮霉素(hygromycin)、双丙胺膦(bialaphos)除草剂、磺酰胺等的抗性的基因;以及用作表型标记的基因,即花青素(anthocyanin)调控基因、异戊基转移酶基因等。本领域中已知并使用的报道体的实例包括:荧光素酶(luc)、绿色荧光蛋白(gfp)、氯霉素乙酰转移酶(cat)、-半乳糖苷酶(lacz)、-葡萄糖醛酸酶(gus)等。可选择标记也可被视为报道体。
[0121]
术语“质粒”是指染色体外元件,其常携带不是细胞的中心代谢的一部分的基因,并且通常呈环状双链dna分子形式。所述元件可为源于任何来源的具有单链或双链dna或rna的线性、环状或超螺旋自主复制序列、基因组整合序列、噬菌体或核苷酸序列,其中许多核苷酸序列已被接合或重组成能够将启动子片段和所选基因产物的dna序列连同适当3'非翻译序列一起引入细胞中的独特构造。
[0122]
可使用的真核病毒载体包括但不限于腺病毒载体、逆转录病毒载体、腺相关病毒载体和痘病毒(例如痘苗病毒)载体、杆状病毒载体或疱疹病毒载体。非病毒载体包括质粒、脂质体、带电荷脂质(细胞转染剂)、dna-蛋白质复合物和生物聚合物。
[0123]“克隆载体”是指是依序复制的具有一定单元长度的核酸,并且包含复制起点的“复制子”(诸如质粒、噬菌体或粘粒),另一核酸区段可与其连接以便致使所连接区段复制。某些克隆载体能够在一种细胞类型(例如细菌)中复制,并且在另一细胞类型(例如真核细胞)中表达。克隆载体通常包含一种或多种可用于选择包含载体的细胞的序列和/或一个或多个用于插入目标核酸序列的多克隆位点。
[0124]
术语“表达载体”是指被设计以使得能够在插入宿主细胞中之后表达插入的核酸序列的媒介物。插入的核酸序列以与如上所述的调控区可操作关联的方式放置。
[0125]
通过本领域中熟知的方法将载体引入宿主细胞中,所述方法例如转染、电穿孔、显微注射、转导、细胞融合、deae右旋糖苷、磷酸钙沉淀、脂质体转染(溶酶体融合)、使用基因枪、或dna载体转运体。
[0126]
如本文所用的“培养”意指在允许细胞生长或分裂的体外条件下孵育细胞或以存活状态维持细胞。如本文所用的“培养的细胞”意指在体外繁殖的细胞。
[0127]
如本文所用,术语“多肽”意图涵盖单个“多肽”以及多个“多肽”,并且是指由通过酰胺键(也称为肽键)线性连接的单体(氨基酸)组成的分子。术语“多肽”是指具有两个或更多个氨基酸的任何一个或多个链,并且不指特定长度的产物。因此,肽、二肽、三肽、寡肽、“蛋白质”、“氨基酸链”或用于指代具有两个或更多个氨基酸的一个或多个链的任何其它术语包括在“多肽”的定义内,并且术语“多肽”可替代任何这些术语加以使用或可与任何这些术语互换使用。术语“多肽”也意指具有多肽的表达后修饰的产物,所述修饰包括不限于糖基化、乙酰化、磷酸化、酰胺化、由已知保护/封闭基团达成的衍生化、蛋白水解裂解、或由非天然存在的氨基酸达成的修饰。多肽可源于天然生物来源或通过重组技术产生,但未必从指定核酸序列翻译。它可以任何方式,包括通过化学合成产生。
[0128]“分离的”多肽或其片段、变体或衍生物是指不在它的天然环境中的多肽。不要求特定纯化水平。举例来说,分离的多肽可仅从它的天然或自然环境移除。出于本发明的目的,在宿主细胞中表达的重组产生的多肽和蛋白质被视为是分离的,已通过任何适合技术
分离、分级分离、或部分或实质上纯化的天然或重组多肽也被视为是分离的。
[0129]
本发明中也包括多肽的片段或变体及其任何组合。术语“片段”或“变体”在涉及本发明的多肽结合结构域或结合分子时包括保留参照多肽的至少一些性质(例如fcrn结合结构域或fc变体的fcrn结合亲和力、fviii变体的凝血活性或vwf片段的fviii结合活性)的任何多肽。除在本文其它地方讨论的特定抗体片段之外,多肽的片段也包括蛋白水解片段以及缺失片段,但不包括天然存在的全长多肽(或成熟多肽)。本发明的多肽结合结构域或结合分子的变体包括如上所述的片段以及氨基酸序列由于氨基酸取代、缺失或插入而改变的多肽。变体可为天然存在的或非天然存在的。非天然存在的变体可使用本领域已知的诱变技术产生。变异多肽可包含保守性或非保守性氨基酸取代、缺失或添加。
[0130]
本文所用的术语“vwf蛋白”或“vwf蛋白”意指与fviii相互作用,并且保留至少一种或多种通常由全长vwf对fviii提供的性质的任何vwf片段,所述性质例如防止过早活化成fviiia,防止过早蛋白水解,防止与磷脂膜进行可导致过早清除的缔合,防止结合可结合裸露fviii而非vwf结合的fviii的fviii清除受体,和/或使fviii重链和轻链相互作用稳定。
[0131]“保守性氨基酸取代”是其中氨基酸残基被具有类似侧链的氨基酸残基置换的氨基酸取代。具有类似侧链的氨基酸残基的家族已在本领域中加以定义,包括碱性侧链(例如赖氨酸、精氨酸、组氨酸)、酸性侧链(例如天冬氨酸、谷氨酸)、不带电荷极性侧链(例如甘氨酸、天冬酰胺、谷氨酰胺、丝氨酸、苏氨酸、酪氨酸、半胱氨酸)、非极性侧链(例如丙氨酸、缬氨酸、亮氨酸、异亮氨酸、脯氨酸、苯丙氨酸、甲硫氨酸、色氨酸)、β-分支侧链(例如苏氨酸、缬氨酸、异亮氨酸)和芳族侧链(例如酪氨酸、苯丙氨酸、色氨酸、组氨酸)。因此,如果多肽中的氨基酸被来自同一侧链家族的另一氨基酸置换,那么取代被视为是保守性的。在另一实施方案中,一串氨基酸可被在侧链家族成员的顺序和/或组成方面不同的在结构上类似的一串保守置换。
[0132]
如本领域中所知,通过比较一个多肽的氨基酸序列与第二多肽的序列来确定两个多肽之间的“序列同一性”。当在本文中讨论时,任何特定多肽是否与另一多肽至少约50%、60%、70%、75%、80%、85%、90%、95%、99%或100%同一可使用本领域中已知的方法和计算机程序/软体来确定,诸如但不限于bestfit程序(用于unix的wisconsin序列分析包,第8版,genetics computer group,university research park,575science drive,madison,wi 53711)。bestfit使用smith和waterman,advances in applied mathematics 2:482-489(1981)的局部同源性算法以得到两个序列之间具有同源性的最佳区段。当使用bestfit或任何其它序列比对程序来确定特定序列是否与本发明的参照序列例如95%同一时,当然应设置参数以使历经参照多肽序列的全长计算同一性百分比,并且允许同源性空位占参照序列中氨基酸总数的多达5%。
[0133]
如本文所用,通过比对以使第一vwf或fviii序列与第二vwf或fviii序列之间的同一性或类似性最大来鉴定vwf序列或fviii蛋白质序列中“对应于
…
的氨基酸”或“等效氨基酸”。用于鉴定第二vwf或fviii序列中等效氨基酸的编号基于用于鉴定第一vwf或fviii序列中相应氨基酸的编号。
[0134]
如本文所用,术语“插入位点”是指fviii多肽或其片段、变体或衍生物中紧靠可插入异源性部分所处的位置的上游的位置。以某一编号指定“插入位点”,所述编号是成熟天
然fviii(seq id no:65)中由插入位点所对应的氨基酸的编号,所述氨基酸紧靠插入位置的n末端。举例来说,短语“a3在对应于seq id no:65的氨基酸1656的插入位点处包含xten”指示异源性部分位于对应于seq id no:65的氨基酸1656和氨基酸1657的两个氨基酸之间。
[0135]
如本文所用的短语“紧靠氨基酸的下游”是指紧接于所述氨基酸的末端羧基的位置。类似地,短语“紧靠氨基酸的上游”是指紧接于所述氨基酸的末端胺基团的位置。因此,如本文所用的短语“在插入位点的两个氨基酸之间”是指xten或任何其它多肽插入在两个邻近氨基酸之间所处的位置。因此,短语“紧靠氨基酸的下游插入”和“插入在插入位点的两个氨基酸之间”与“在插入位点处插入”同义使用。
[0136]
如本文所用的术语“插入”、“被插入”、“插入
…
中”或语法相关术语是指相对于天然成熟人fviii中的类似位置,xten在嵌合多肽中的位置。如本文所用,所述术语是指重组fviii多肽相对于天然成熟人fviii的特征,并且不指示、暗示或意指制备嵌合多肽所采用的任何方法或过程。举例来说,关于本文提供的嵌合多肽,短语“将xten紧靠fviii多肽的残基745的下游插入”意指所述嵌合多肽在紧靠对应于天然成熟人fviii中的氨基酸745的氨基酸的下游包含xten,其例如由对应于天然成熟人fviii的氨基酸745和746的氨基酸界定。
[0137]“融合”或“嵌合”蛋白包含连接于在自然界中它不天然连接的第二氨基酸序列的第一氨基酸序列。通常存在于单独蛋白质中的氨基酸序列可以融合多肽形式集合在一起,或通常存在于同一蛋白质中的氨基酸序列可以新排列放置在融合多肽中,例如本发明的因子viii结构域与ig fc结构域的融合。例如通过化学合成,或通过产生并翻译其中肽区域以所需关系被编码的多核苷酸来产生融合蛋白。嵌合蛋白可进一步包含通过共价非肽键或非共价键与第一氨基酸序列缔合的第二氨基酸序列。
[0138]
如本文所用,术语“半衰期”是指特定多肽在体内的生物半衰期。半衰期可由向受试者施用的一半数量从动物中的循环和/或其它组织清除所需的时间表示。当构建给定多肽随时间变化的清除曲线时,曲线通常是双相的,即快速α相和较长β相。α相通常表示施用的fc多肽在血管内间隙与血管外间隙之间达到平衡,并且部分地由多肽的大小决定。β相通常表示多肽在血管内间隙中的分解代谢。在一些实施方案中,fviii和包含fviii的嵌合蛋白是单相的,并且因此不具有α相,而仅具有单一β相。因此,在某些实施方案中,如本文所用的术语半衰期是指处于β相的多肽的半衰期。人抗体在人中的典型β相半衰期是21天。
[0139]
如本文所用的术语“连接”是指第一氨基酸序列或核苷酸序列分别共价或非共价接合于第二氨基酸序列或核苷酸序列。第一氨基酸或核苷酸序列可直接接合或毗连于第二氨基酸或核苷酸序列,或者间插序列可使第一序列共价接合于第二序列。术语“连接”不仅意指第一氨基酸序列在c末端或n末端融合于第二氨基酸序列,而且也包括将整个第一氨基酸序列(或第二氨基酸序列)插入第二氨基酸序列(或相应地,第一氨基酸序列)中的任何两个氨基酸中。在一个实施方案中,第一氨基酸序列可通过肽键或接头连接于第二氨基酸序列。第一核苷酸序列可通过磷酸二酯键或接头连接于第二核苷酸序列。接头可为肽或多肽(用于多肽链)或核苷酸或核苷酸链(用于核苷酸链)或任何化学部分(用于多肽链与多核苷酸链两者)。术语“连接”也用连字符(-)指示。
[0140]
如本文所用,术语“与
…
缔合”是指在第一氨基酸链与第二氨基酸链之间形成共价或非共价键。在一个实施方案中,术语“与
…
缔合”意指共价非肽键或非共价键。这个缔合可用冒号,即(:)指示。在另一实施方案中,它意指除肽键之外的共价键。举例来说,氨基酸半
胱氨酸包含可与第二半胱氨酸残基上的硫醇基团形成二硫键或二硫桥的硫醇基团。在大多数天然存在的igg分子中,ch1区和cl区通过二硫键缔合,并且两个重链通过两个二硫键在对应于239和242的位置处缔合,所述位置使用kabat编号系统(位置226或229,eu编号系统)。共价键的实例包括但不限于肽键、金属键、氢键、二硫键、σ键、π键、δ键、糖苷键、抓氢键(agnostic bond)、弯曲键、偶极键、π反向键、双键、三键、四键、五键、六键、共轭、超共轭、芳香性、哈普托数(hapticity)或反键合。非共价键的非限制性实例包括离子键(例如阳离子-π键或盐键)、金属键、氢键(例如二氢键、二氢复合物、低能障氢键或对称氢键)、范德华力(van der walls force)、伦敦分散力(london dispersion force)、机械键、卤素键、亲金性、插入、堆积、熵力或化学极性。
[0141]
本文所用的术语“单体-二聚体杂交物”是指包含通过二硫键彼此缔合的第一多肽链和第二多肽链的嵌合蛋白,其中所述第一链包含凝结因子(例如因子viii)和第一fc区,并且所述第二链包含以下、基本上由以下组成或由以下组成:无凝结因子的第二fc区。因此,单体-二聚体杂交物构建体是一种杂交物,其包含仅具有一个凝结因子的单体方面和具有两个fc区的二聚体方面。
[0142]
如本文所用,术语“裂解位点”或“酶促裂解位点”是指由酶识别的位点。某些酶促裂解位点包括细胞内加工位点。在一个实施方案中,多肽具有由在凝结级联期间活化的酶裂解的酶促裂解位点,以致所述位点的裂解发生在凝块形成的部位处。示例性所述位点包括例如由凝血酶、因子xia或因子xa识别的那些。示例性fxia裂解位点包括例如tqsfndftr(seq id no:1)和svsqtskltr(seq id no:3)。示例性凝血酶裂解位点包括例如dflaegggvr(seq id no:4)、ttkikpr(seq id no:5)、lvprg(seq id no:6)、alrpr(seq id no:7)、isdkntgdyyedsyedisayllsknnaieprsfs(seq id no:106)、dkntgdyyedsyedisayllsknnaieprsfs(seq id no:88)和ieprsfs(seq id no:194)。其它酶促裂解位点在本领域中是已知的,并且描述于本文其它地方。
[0143]
如本文所用,术语“加工位点”或“细胞内加工位点”是指多肽中的一种类型的酶促裂解位点,其是在所述多肽翻译之后起作用的酶的靶标。在一个实施方案中,所述酶在从高尔基体腔(golgi lumen)转运至反面高尔基体(trans-golgi)区室期间起作用。细胞内加工酶在蛋白质从细胞分泌之前裂解多肽。所述加工位点的实例包括例如由内肽酶的pace/弗林蛋白酶(furin)(其中pace是成对碱性氨基酸裂解酶(paired basic amino acid cleaving enzyme)的首字母缩略词)家族靶向的那些。这些酶定位于高尔基体膜,并且在序列基序arg-[任何残基]-(lys或arg)-arg的羧基末端侧上裂解蛋白质。如本文所用,“弗林蛋白酶”家族的酶包括例如pcsk1(也称为pc1/pc3)、pcsk2(也称为pc2)、pcsk3(也称为弗林蛋白酶或pace)、pcsk4(也称为pc4)、pcsk5(也称为pc5或pc6)、pcsk6(也称为pace4)或pcsk7(也称为pc7/lpc、pc8或spc7)。其它加工位点在本领域中是已知的。
[0144]
在包括超过一个加工或裂解位点的构建体中,应了解所述位点可相同或不同。
[0145]
术语“弗林蛋白酶”是指对应于ec编号3.4.21.75的酶。弗林蛋白酶是枯草杆菌蛋白酶样原蛋白转化酶,其也称为pace(成对碱性氨基酸裂解酶)。弗林蛋白酶使非活性前体蛋白质的各段缺失以使它们转化成生物活性蛋白质。在它的细胞内转运期间,vwf的原肽可由弗林蛋白酶从成熟vwf分子裂解。在一些实施方案中,弗林蛋白酶从vwf的d'd3裂解d1d2。在其它实施方案中,编码弗林蛋白酶的核苷酸序列可连同编码vwf片段的核苷酸序列一起
表达以使d1d2结构域可由弗林蛋白酶在细胞内裂解去除。
[0146]
在包括超过一个加工或裂解位点的构建体中,应了解所述位点可相同或不同。
[0147]
如本文所用的“可加工接头”是指包含至少一个在本文其它地方描述的细胞内加工位点的接头。
[0148]
如本文所用的止血病症意指特征在于由于形成纤维蛋白凝块的能力受损或不能形成纤维蛋白凝块而有自发出血或由于创伤而出血的倾向的基因遗传性或获得性病状。所述病症的实例包括血友病。三种主要形式是甲型血友病(因子viii缺乏症)、乙型血友病(因子ix缺乏症或“克雷司马斯病(christmas disease)”)和丙型血友病(因子xi缺乏症,轻微流血倾向)。其它止血病症包括例如范威尔邦德病;因子xi缺乏症(pta缺乏症);因子xii缺乏症;纤维蛋白原、凝血酶原、因子v、因子vii、因子x或因子xiii缺乏症或结构异常;伯纳德-苏里尔综合征(bernard-soulier syndrome),其是一种gpib缺陷症或缺乏症。vwf的受体gpib可为缺陷性的,并且导致缺乏初级凝块形成(初级止血)和流血倾向增加、以及格兰茨曼和内格利血小板无力症(thrombasthenia of glanzman and naegeli)(格兰茨曼血小板无力症)。在肝衰竭(急性和慢性形式)中,由肝产生的凝血因子存在不足;此可增加流血风险。
[0149]
本发明的嵌合分子可防治性加以使用。如本文所用,术语“防治性治疗”是指在流血发作之前施用分子。在一个实施方案中,需要一般性止血剂的受试者正经受或即将经受手术。本发明的嵌合蛋白可在手术之前或之后作为防治剂加以施用。本发明的嵌合蛋白可在手术期间或之后施用以控制急性流血发作。手术可包括但不限于肝移植、肝切除、牙科程序或干细胞移植。
[0150]
本发明的嵌合蛋白也用于按需治疗。术语“按需治疗”是指回应于流血发作的症状或在可能导致流血的活动之前施用嵌合分子。在一个方面,按需治疗可在流血开始时(诸如在损伤之后)或在预期会流血时(诸如在手术之前)给予受试者。在另一方面,按需治疗可在会增加流血风险的活动(诸如接触性运动)之前给予。
[0151]
如本文所用,术语“急性流血”是指无论潜伏原因如何的流血发作。举例来说,受试者可具有创伤、尿毒症、遗传性流血病症(例如因子vii缺乏症)、血小板病症,或由于产生针对凝结因子的抗体而具有抗性。
[0152]
如本文所用的治疗是指例如减轻疾病或病状的严重性;降低疾病病程的持续时间;改善一种或多种与疾病或病状相关的症状;向患有疾病或病状的受试者提供有益作用,而未必治愈所述疾病或病状;或防治一种或多种与疾病或病状相关的症状。在一个实施方案中,术语“治疗”意指通过施用本发明的嵌合蛋白或vwf片段来使受试者中的fviii谷底水平维持在至少约1iu/dl、2iu/dl、3iu/dl、4iu/dl、5iu/dl、6iu/dl、7iu/dl、8iu/dl、9iu/dl、10iu/dl、11iu/dl、12iu/dl、13iu/dl、14iu/dl、15iu/dl、16iu/dl、17iu/dl、18iu/dl、19iu/dl或20iu/dl。在另一实施方案中,治疗意指维持fviii谷底水平在以下之间:约1与约20iu/dl、约2与约20iu/dl、约3与约20iu/dl、约4与约20iu/dl、约5与约20iu/dl、约6与约20iu/dl、约7与约20iu/dl、约8与约20iu/dl、约9与约20iu/dl或约10与约20iu/dl。治疗疾病或病状也可包括维持受试者中的fviii活性在类似于非血友病受试者中的fviii活性的至少约1%、2%、3%、4%、5%、6%、7%、8%、9%、10%、11%、12%、13%、14%、15%、16%、17%、18%、19%或20%的水平下。为治疗所需的最小谷底水平可通过一种或多种已知方法测量,
并且可针对每个人加以调整(增加或减少)。
[0153]
ii.嵌合蛋白
[0154]
本发明涉及使用融合于xten序列的vwf蛋白,通过防止或抑制fviii半衰期限制因素(即内源性vwf)与fviii蛋白缔合来延长嵌合蛋白的半衰期。内源性vwf与约95%至约98%的fviii以非共价复合物形式缔合。尽管内源性vwf是fviii半衰期限制因素,但也已知内源性vwf结合于fviii蛋白质会以各种方式保护fviii。举例来说,全长vwf(呈具有约250kda的多聚体形式)可保护fviii免遭蛋白酶裂解和fviii活化,使fviii重链和/或轻链稳定,并且防止fviii被清道夫受体清除。但同时,内源性vwf通过防止胞饮作用以及通过vwf清除路径从系统清除fviii-vwf复合物而限制fviii半衰期。在不受理论束缚下,据信内源性vwf是阻止融合于半衰期延长物的嵌合蛋白的半衰期比野生型fviii的半衰期长约两倍的半衰期限制因素。因此,本发明涉及使用包含d’结构域和d3结构域的vwf蛋白(例如vwf片段)来防止或抑制内源性vwf与fviii蛋白之间的相互作用,以及同时通过使用xten序列与ig恒定区或其一部分组合来增加所得fviii蛋白的半衰期。特定来说,本发明显示较短xten序列(即在长度方面含有小于288个氨基酸的xten,即短于288个氨基酸的xten)在延长嵌合蛋白的半衰期方面更佳。
[0155]
在一个实施方案中,本发明涉及一种嵌合蛋白,其包含(i)第一多肽,所述第一多肽包含融合于第一ig恒定区或其一部分的fviii蛋白,和(ii)第二多肽,所述第二多肽包含含有vwf的d'结构域和d3结构域的vwf蛋白,所述vwf蛋白通过在之间的xten序列融合于第二ig恒定区或其一部分,其中所述xten序列含有小于288个氨基酸残基,并且其中所述第一多肽与所述第二多肽连接或缔合。在另一实施方案中,第二多肽中的xten序列由长度在12个氨基酸与287个氨基酸之间的氨基酸序列组成。在其它实施方案中,相较于包含第一多肽和第二多肽的相应融合蛋白,其中第二多肽包含含有至少288个氨基酸的xten序列(例如ae288,例如seq id no:8),嵌合蛋白展现较长半衰期。在其它实施方案中,第二多肽中的xten序列含有至少约36、至少约42、至少约72或至少约144个氨基酸,但小于288个氨基酸,例如ae42、ae72、ae144(ae144、ae144_2a、ae144_3b、ae144_4a、ae144_5a、ae144_6b)、ag42、ag72或ag144(ag144、ag144_a、ag144_b、ag144_c、ag144_f),例如seq id no:9、seq id no:10、seq id no:11、seq id no:55;seq id no:56;seq id no:57;seq id no:58;seq id no:59;seq id no:14;seq id no:60;seq id no:61;seq id no:62;或seq id no:63。
[0156]
本发明的嵌合蛋白可进一步包含使fviii蛋白与第一ig恒定区或其一部分连接的第二xten序列。
[0157]
在某些实施方案中,本发明涉及一种嵌合蛋白,其包含(i)第一多肽,所述第一多肽包含融合于第一ig恒定区或其一部分的fviii蛋白,和(ii)第二多肽,所述第二多肽包含含有vwf的d'结构域和d3结构域的vwf蛋白,所述vwf蛋白通过在之间的第一xten序列融合于第二ig恒定区或其一部分,其中所述xten序列含有小于288个氨基酸残基,并且其中所述第一多肽与所述第二多肽连接或缔合,并且其中所述第一多肽进一步包含插入在所述fviii蛋白内一个或多个插入位点处或融合于所述fviii蛋白和/或所述第一ig恒定区或其一部分的第二xten序列。因此,在一个实施方案中,第二xten序列插入在fviii蛋白内一个或多个插入位点处。在另一实施方案中,第二xten序列融合于fviii蛋白和/或第一ig恒定区或其一部分。在其它实施方案中,第二xten序列插入在fviii蛋白内一个或多个插入位点
处,并且第三xten序列融合于fviii蛋白和/或第一ig恒定区或其一部分。
[0158]
第二xten序列和/或第三xten序列可为任何长度的xten氨基酸。举例来说,在本文其它地方公开第二xten序列和/或第三xten序列,例如ae42、ae72、ae864、ae576、ae288、ae144、ag864、ag576、ag288和ag144,例如seq id no:8;seq id no:9、seq id no:10、seq id no:11、seq id no:17;seq id no:54;seq id no:19;seq id no:16;seq id no:18;seq id no:15;seq id no:55;seq id no:56;seq id no:57;seq id no:58;seq id no:59;seq id no:14;seq id no:60;seq id no:61;seq id no:62;或seq id no:63。在特定实施方案中,第二xten序列和/或第三xten序列是ae288或ag288,例如seq id no:8或19。
[0159]
在某些实施方案中,本发明涉及一种嵌合蛋白,其包含(i)第一多肽,所述第一多肽包含通过任选接头融合于第一ig恒定区或其一部分的fviii蛋白,其中任选xten序列(x2)插入在所述fviii蛋白内一个或多个插入位点处或融合于所述fviii蛋白或所述第一ig恒定区或其一部分,和(ii)第二多肽,所述第二多肽包含含有vwf的d'结构域和d3结构域的vwf蛋白,所述vwf蛋白通过在所述vwf蛋白与第二ig恒定区或其一部分之间的xten序列(x1)融合于所述第二ig恒定区或其一部分,其中所述xten序列(x1)含有小于288个氨基酸残基,并且通过接头融合于所述vwf蛋白,并且其中所述第一多肽和所述第二多肽相缔合。在一些实施方案中,本发明涉及一种嵌合蛋白,其包含(i)第一多肽,所述第一多肽包含通过任选接头融合于第一ig恒定区或其一部分的fviii蛋白,其中任选xten序列(x2)插入在所述fviii蛋白内一个或多个插入位点处或融合于所述fviii蛋白或所述第一ig恒定区或其一部分,和(ii)第二多肽,所述第二多肽包含含有vwf的d'结构域和d3结构域的vwf蛋白,所述vwf蛋白通过在所述vwf蛋白与第二ig恒定区或其一部分之间的xten序列(x1)融合于所述第二ig恒定区或其一部分,其中所述xten序列(x1)含有小于288个氨基酸残基,并且通过接头融合于所述第二ig恒定区或其一部分,并且其中所述第一多肽和所述第二多肽相缔合。在其它实施方案中,使xten序列(x1)与vwf蛋白或第二ig恒定区或其一部分融合的接头是可裂解接头。在本文其它地方显示可裂解接头的非限制性实例。在特定实施方案中,接头是凝血酶可裂解接头。
[0160]
在一些实施方案中,嵌合蛋白是两个多肽链,第一链包含上述第一多肽,并且第二链包含上述第二多肽。举例来说,两个多肽链包含(i)第一链,其包含单链fviii蛋白、第一ig恒定区或其一部分以及插入在所述fviii蛋白内一个或多个插入位点处或融合于所述fviii蛋白或所述第一ig恒定区或其一部分的任选xten序列,和(ii)第二链,其包含通过在之间的xten序列(x1)融合于第二ig恒定区或其一部分的vwf蛋白,其中所述xten序列(x1)含有小于288个氨基酸。
[0161]
在某些实施方案中,嵌合蛋白是两个多肽链,第一链包含fviii蛋白的重链,并且第二链从n末端至c末端包含fviii蛋白的轻链、插入在所述fviii蛋白内一个或多个插入位点处或融合于所述fviii蛋白或第一ig恒定区或其一部分的任选xten序列以及第一ig恒定区或其一部分、任选接头(例如可加工接头)、vwf蛋白、xten序列(x1)、第二任选接头(例如可裂解接头)和第二ig恒定区或其一部分。
[0162]
在其它实施方案中,嵌合蛋白是三个多肽链,(i)第一链包含fviii蛋白的重链,(ii)第二链包含fviii蛋白的轻链、第一ig恒定区或其一部分以及插入在所述fviii蛋白的所述重链或所述轻链内一个或多个插入位点处或融合于所述fviii蛋白或所述第一ig恒定
区或其一部分的任选xten序列,以及(iii)第三链包含通过在之间的xten序列(x1)融合于第二ig恒定区或其一部分的vwf蛋白,其中所述第一链和所述第二链通过例如金属键的非共价键缔合,并且所述第二链和所述第三链通过例如二硫键的共价键缔合。
[0163]
在其它实施方案中,嵌合蛋白是单链,其从n末端至c末端包含单链fviii蛋白、插入在所述fviii蛋白内一个或多个插入位点处或融合于所述fviii蛋白或第一ig恒定区或其一部分的任选xten序列以及第一ig恒定区或其一部分、任选接头(例如可加工接头)、vwf蛋白、xten序列(x1)、第二任选接头(例如可裂解接头)和第二ig恒定区或其一部分。
[0164]
在某些实施方案中,嵌合蛋白包含下式(a)-(hh)中的一个:
[0165]
(a)fviii-f1:f2-l2-x-l1-v;
[0166]
(b)fviii-f1:v-l1-x-l2-f2;
[0167]
(c)f1-fviii:f2-l2-x-l1-v;
[0168]
(d)f1-fviii:v-l1-x-l2-f2;
[0169]
(e)fviii-x2-f1:f2-l2-x1-l1-v;
[0170]
(f)fviii-x2-f1:v-l1-x1-l2-f2;
[0171]
(g)fviii(x2)-f1:f2-l2-x1-l1-v;
[0172]
(h)fviii(x2)-f1:v-l1-x1-l2-f2;
[0173]
(i)f1-x2-f1:f2-l2-x1-l1-v;
[0174]
(j)f1-x2-f1:v-l1-x1-l2-f2;
[0175]
(k)v-l1-x-l2-f2-l3-fviii-l4-f1;
[0176]
(l)v-l1-x-l2-f2-l3-f1-l4-fviii;
[0177]
(m)f1-l4-fviii-l3-f2-l2-x-l1-v;
[0178]
(n)fviii-l4-f1-l3-f2-l2-x-l1-v;
[0179]
(o)fviii-l4-f1-l3-v-l1-x-l2-f2;
[0180]
(p)fviii-l4-f1-l3-f2-l2-x-l1-v;
[0181]
(q)f2-l2-x-l1-v-l3-f1-l4-fviii;
[0182]
(r)f2-l2-x-l1-v-l3-fviii-l4-f1;
[0183]
(s)v-l1-x1-l2-f2-l3-fviii(x2)-l4-f1;
[0184]
(t)v-l1-x1-l2-f2-l3-f1-l4-fviii(x2);
[0185]
(u)f1-l4-fviii(x2)-l3-f2-l2-x1-l1-v;
[0186]
(v)f-l4-fviii(x2)-l3-v-l1-x1-l2-f2;
[0187]
(w)fviii(x2)-l4-f1-l3-v-l1-x1-l2-f2;
[0188]
(x)fviii(x2)-l4-f1-l3-f2-l2-x1-l1-v;
[0189]
(y)f2-l2-x1-l1-v-l3-f1-l4-fviii(x2);
[0190]
(z)f2-l2-x1-l1-v-l3-fviii(x2)-l4-f1;
[0191]
(aa)v-l1-x2-l2-f2-l3-fviii-l4-x2-l5-f1;
[0192]
(bb)v-l1-x2-l2-f2-l3-f1-l5-x2-l4-fviii;
[0193]
(cc)f1-l5-x2-l4-fviii-l3-f2-l2-x2-l1-v;
[0194]
(dd)f1-l5-x2-l4-fviii-l3-v-l1-x2-l2-f2;
[0195]
(ee)fviii-l5-x2-l4-f2-l3-v-l1-x1-l2-f1;
[0196]
(ff)fviii-l5-x2-l4-f2-l3-f1-l2-x1-l1-v;
[0197]
(gg)f1-l2-x1-l1-v-l3-f2-l4-x2-l5-fviii;或
[0198]
(hh)f1-l2-x1-l1-v-l3-fviii-l5-x2-l4-f2;
[0199]
其中v是vwf蛋白,其包含d’结构域和d3结构域,
[0200]
x或x1是含有小于288个氨基酸的第一xten序列,
[0201]
x2是第二xten序列,
[0202]
fviii包括fviii蛋白,
[0203]
fviii(x2)包括具有插入在fviii蛋白内一个或多个插入位点中的第二xten序列的fviii蛋白,
[0204]
f1是第一ig恒定区或其一部分,
[0205]
f2是第二ig恒定区或其一部分,
[0206]
l1、l2、l3、l4或l5是任选接头,
[0207]
(-)是肽键;并且
[0208]
(:)是共价键或非共价键。
[0209]
在一个实施方案中,x或x1由长度在12个氨基酸与287个氨基酸之间的氨基酸序列组成。在另一实施方案中,相较于包含其中x或x1是ae288(例如seq id no:8)的式的相应融合蛋白,嵌合蛋白展现较长半衰期。
[0210]
在其它实施方案中,式中x或x1含有至少约36、至少约42、至少约72或至少约144个氨基酸,但小于288个氨基酸,例如ae42、ae72、ae144(ae144、ae144_2a、ae144_3b、ae144_4a、ae144_5a、ae144_6b)、ag42、ag72或ag144(ag144、ag144_a、ag144_b、ag144_c、ag144_f),例如seq id no:9、seq id no:10、seq id no:11、seq id no:55;seq id no:56;seq id no:57;seq id no:58;seq id no:59;seq id no:14;seq id no:60;seq id no:61;seq id no:62;或seq id no:63。
[0211]
在其它实施方案中,x2包含长度是至少约36个氨基酸、至少42个氨基酸、至少144个氨基酸、至少288个氨基酸、至少576个氨基酸或至少864个氨基酸的氨基酸序列,例如ae42、ae72、ae864、ae576、ae288、ae144、ag864、ag576、ag288或ag144,例如seq id no:9;seq id no:10;seq id no:15;seq id no:16;seq id no:8;seq id no:11;seq id no:17;seq id no:18、seq id no:19或seq id no:14。在特定实施方案中,x2是ae288或ag288,例如seq id no:8或19。
[0212]
在某些实施方案中,相较于无x或x1和/或x2的嵌合蛋白,包含x或x1和/或x2的嵌合蛋白具有延长的半衰期。在其它实施方案中,l1和/或l2是可裂解接头。在其它实施方案中,l4和/或l5是可裂解接头。
[0213]
ii.a.范威尔邦德因子(vwf)蛋白
[0214]
vwf(也称为f8vwf)是一种存在于血浆中,并且在内皮(在怀布尔-帕拉德体(weibel-palade body)中)、巨核细胞(血小板的α-颗粒)和内皮下结缔组织中组成性产生的大型多聚糖蛋白。基本vwf单体是具有2813个氨基酸的蛋白质。每个单体都含有许多具有特定功能的特定结构域,即d'/d3结构域(其结合因子viii)、a1结构域(其结合血小板gpib受体、肝素和/或可能胶原蛋白)、a3结构域(其结合胶原蛋白)、c1结构域(其中rgd结构域在这个结构域被活化时结合血小板整合素(integrin)αiibβ3)和在蛋白质的c末端的“半胱氨
酸结(cysteine knot)”结构域(vwf与血小板源性生长因子(pdgf)、转化生长因子-β(tgfβ)和β-人绒毛膜促性腺激素(β-human chorionic gonadotropin,βhcg)共有所述结构域)。
[0215]
在一个实施方案中,vwf蛋白是vwf片段。如本文所用的术语“vwf片段”包括但不限于能够抑制内源性vwf结合fviii的包含d'结构域和d3结构域的功能性vwf片段。在一个实施方案中,vwf片段结合fviii蛋白。在另一实施方案中,vwf片段阻断fviii蛋白上的vwf结合位点,由此抑制fviii蛋白与内源性vwf的相互作用。vwf片段包括保留vwf的这些活性的衍生物、变体、突变体或类似物。
[0216]
人vwf的2813单体氨基酸序列在genbank中以登记号np_000543.2加以报道。编码人vwf的核苷酸序列在genbank中以登记号nm_000552.3加以报道。人vwf的核苷酸序列指定为seq id no:20。seq id no:21是全长vwf的氨基酸序列。vwf的各结构域列于表1中。
[0217]
表1.vwf序列
[0218]
[0219]
[0220]
[0221]
[0222]
[0223]
[0224]
[0225][0226]
如本文所用的vwf蛋白可为包含vwf的d'结构域和d3结构域的vwf片段,其中所述vwf片段结合因子viii(fviii),并且抑制内源性vwf(全长vwf)结合fviii。包含d'结构域和d3结构域的vwf片段可进一步包含选自由以下组成的组的vwf结构域:a1结构域、a2结构域、a3结构域、d1结构域、d2结构域、d4结构域、b1结构域、b2结构域、b3结构域、c1结构域、c2结构域、ck结构域、其一个或多个片段及其任何组合。在一个实施方案中,vwf片段包含以下、基本上由以下组成或由以下组成:(1)vwf的d'和d3结构域或其片段;(2)vwf的d1、d'和d3结构域或其片段;(3)vwf的d2、d'和d3结构域或其片段;(4)vwf的d1、d2、d'和d3结构域或其片段;或(5)vwf的d1、d2、d'、d3和a1结构域或其片段。本文所述的vwf片段不含有结合vwf清除受体的位点。在另一实施方案中,本文所述的vwf片段不是seq id no:21的氨基酸764至1274。本发明的vwf片段可包含连接于或融合于vwf片段的任何其它序列。举例来说,本文所
述的vwf片段可进一步包含信号肽。
[0227]
在一个实施方案中,包含d’结构域和d3结构域的vwf片段与fviii蛋白结合或缔合。通过与fviii蛋白结合或缔合,本发明的vwf片段保护fviii免遭蛋白酶裂解和fviii活化,使fviii的重链和轻链稳定,并且防止fviii被清道夫受体清除。在另一实施方案中,vwf片段与fviii蛋白结合或缔合,并且阻断或防止fviii蛋白结合磷脂和活化的蛋白质c。通过防止或抑制fviii蛋白与内源性全长vwf结合,本发明的vwf片段降低fviii被vwf清除受体清除,并且因此延长嵌合蛋白的半衰期。因此,嵌合蛋白的半衰期延长是由于缺乏vwf清除受体结合位点的vwf片段与fviii蛋白结合或缔合以及由vwf片段遮蔽或保护fviii蛋白免遭含有vwf清除受体结合位点的内源性vwf。结合于vwf片段或由vwf片段保护的fviii蛋白也可允许fviii蛋白再循环。通过消除全长vwf分子中含有的vwf清除路径受体结合位点,本发明的fviii/vwf异二聚体被遮蔽免遭vwf清除路径,从而进一步延长fviii半衰期。
[0228]
在一个实施方案中,适用于本发明的vwf蛋白包含vwf的d'结构域和d3结构域,其中所述d'结构域与seq id no:21的氨基酸764至866至少60%、70%、80%、85%、90%、95%、96%、97%、98%、99%或100%同一,其中所述vwf蛋白防止或抑制内源性vwf结合fviii。在另一实施方案中,vwf蛋白包含vwf的d'结构域和d3结构域,其中所述d3结构域与seq id no:21的氨基酸867至1240至少60%、70%、80%、85%、90%、95%、96%、97%、98%、99%或100%同一,其中所述vwf蛋白防止或抑制内源性vwf结合fviii。在一些实施方案中,本文所述的vwf蛋白包含以下、基本上由以下组成或由以下组成:vwf的d'结构域和d3结构域,所述结构域与seq id no:21的氨基酸764至1240至少60%、70%、80%、85%、90%、95%、96%、97%、98%、99%或100%同一,其中所述vwf蛋白防止或抑制内源性vwf结合fviii。在其它实施方案中,vwf蛋白包含以下、基本上由以下组成或由以下组成:d1、d2、d'和d3结构域,所述结构域与seq id no:21的氨基酸23至1240至少60%、70%、80%、85%、90%、95%、96%、97%、98%、99%或100%同一,其中所述vwf蛋白防止或抑制内源性vwf结合fviii。在其它实施方案中,vwf蛋白进一步包含可操作地与其连接的信号肽。
[0229]
在一些实施方案中,适用于本发明的vwf蛋白基本上由以下组成或由以下组成:(1)d'd3结构域、d1d'd3结构域、d2d'd3结构域或d1d2d'd3结构域和(2)多达约10个氨基酸(例如seq id no:21的氨基酸764至1240至seq id no:21的氨基酸764至1250的任何序列)、多达约15个氨基酸(例如seq id no:21的氨基酸764至1240至seq id no:21的氨基酸764至1255的任何序列)、多达约20个氨基酸(例如seq id no:21的氨基酸764至1240至seq id no:21的氨基酸764至1260的任何序列)、多达约25个氨基酸(例如seq id no:21的氨基酸764至1240至seq id no:21的氨基酸764至1265的任何序列)或多达约30个氨基酸(例如seq id no:21的氨基酸764至1240至seq id no:21的氨基酸764至1260的任何序列)的另外的vwf序列。在特定实施方案中,包含d'结构域和d3结构域或基本上由d'结构域和d3结构域组成的vwf蛋白既不是seq id no:21的氨基酸764至1274也不是全长成熟vwf。在一些实施方案中,d1d2结构域以反式与d'd3结构域一起表达。在一些实施方案中,d1d2结构域以顺式与d'd3结构域一起表达。
[0230]
在其它实施方案中,包含连接于d1d2结构域的d'd3结构域的vwf蛋白进一步包含细胞内裂解位点(例如pace(弗林蛋白酶)或pc5的裂解位点),从而允许在表达后,从d'd3结构域裂解d1d2结构域。细胞内裂解位点的非限制性实例在本文其它地方加以公开。
[0231]
在其它实施方案中,vwf蛋白包含d'结构域和d3结构域,但不包含选自由以下组成的组的氨基酸序列:(1)对应于seq id no:21的氨基酸1241至2813,(2)对应于seq id no:21的氨基酸1270至氨基酸2813,(3)对应于seq id no:21的氨基酸1271至氨基酸2813,(4)对应于seq id no:21的氨基酸1272至氨基酸2813,(5)对应于seq id no:21的氨基酸1273至氨基酸2813,(6)对应于seq id no:21的氨基酸1274至氨基酸2813,及其任何组合。
[0232]
在其它实施方案中,本发明的vwf蛋白包含以下、基本上由以下组成或由以下组成:对应于d'结构域、d3结构域和a1结构域的氨基酸序列,其中所述氨基酸序列与seq id no:21的氨基酸764至1479至少60%、70%、75%、80%、85%、90%、95%、96%、97%、98%、99%或100%同一,其中所述vwf蛋白防止内源性vwf结合fviii。在特定实施方案中,vwf蛋白不是seq id no:21的氨基酸764至1274。
[0233]
在一些实施方案中,本发明的vwf蛋白包含d'结构域和d3结构域,但不包含至少一个选自由以下组成的组的vwf结构域:(1)a1结构域,(2)a2结构域,(3)a3结构域,(4)d4结构域,(5)b1结构域,(6)b2结构域,(7)b3结构域,(8)c1结构域,(9)c2结构域,(10)ck结构域,(11)ck结构域和c2结构域,(12)ck结构域、c2结构域和c1结构域,(13)ck结构域、c2结构域、c1结构域、b3结构域,(14)ck结构域、c2结构域、c1结构域、b3结构域、b2结构域,(15)ck结构域、c2结构域、c1结构域、b3结构域、b2结构域和b1结构域,(16)ck结构域、c2结构域、c1结构域、b3结构域、b2结构域、b1结构域和d4结构域,(17)ck结构域、c2结构域、c1结构域、b3结构域、b2结构域、b1结构域、d4结构域和a3结构域,(18)ck结构域、c2结构域、c1结构域、b3结构域、b2结构域、b1结构域、d4结构域、a3结构域和a2结构域,(19)ck结构域、c2结构域、c1结构域、b3结构域、b2结构域、b1结构域、d4结构域、a3结构域、a2结构域和a1结构域,和(20)其任何组合。
[0234]
在其它实施方案中,vwf蛋白包含d'd3结构域和一个或多个结构域或模块。所述结构域或模块的实例包括但不限于zhour等,blood2012年4月6日在线发表:doi 10.1182/blood-2012-01-405134中公开的结构域和模块,所述文献以引用的方式整体并入本文。举例来说,vwf蛋白可包含d'd3结构域和一个或多个选自由以下组成的组的结构域或模块:a1结构域、a2结构域、a3结构域、d4n模块、vwd4模块、c8-4模块、til-4模块、c1模块、c2模块、c3模块、c4模块、c5模块、c5模块、c6模块及其任何组合。
[0235]
在其它实施方案中,vwf蛋白连接于异源性部分,其中所述异源性部分连接于所述vwf蛋白的n末端或c末端或紧靠所述vwf蛋白中一个或多个氨基酸(例如一个或多个xten插入位点)的下游插入。举例来说,异源性部分在vwf蛋白中的插入位点可在d'结构域、d3结构域或两者中。异源性部分可为半衰期延长物。
[0236]
在某些实施方案中,适用于本发明的vwf蛋白形成多聚体,例如二聚体、三聚体、四聚体、五聚体、六聚体、七聚体或更高级多聚体。在其它实施方案中,vwf蛋白是仅具有一个vwf蛋白的单体。在一些实施方案中,本发明的vwf蛋白可具有一个或多个氨基酸取代、缺失、添加或修饰。在一个实施方案中,vwf蛋白可包括氨基酸取代、缺失、添加或修饰以使vwf蛋白不能形成二硫键或不能形成二聚体或多聚体。在另一实施方案中,氨基酸取代在d'结构域和d3结构域内。在特定实施方案中,适用于本发明的vwf蛋白在对应于以下的残基处含有至少一个氨基酸取代:对应于seq id no:21的残基1099、残基1142、或残基1099与1142两者。至少一个氨基酸取代可为不天然存在于野生型vwf中的任何氨基酸。举例来说,氨基酸
取代可为除半胱氨酸以外的任何氨基酸,例如异亮氨酸、丙氨酸、亮氨酸、天冬酰胺、赖氨酸、天冬氨酸、甲硫氨酸、苯丙氨酸、谷氨酸、苏氨酸、谷氨酰胺、色氨酸、甘氨酸、缬氨酸、脯氨酸、丝氨酸、酪氨酸、精氨酸或组氨酸。在另一实例中,氨基酸取代具有一个或多个防止或抑制vwf蛋白形成多聚体的氨基酸。
[0237]
在某些实施方案中,适用于本文中的vwf蛋白可进一步被修饰以改进它与fviii的相互作用,例如改进对fviii的结合亲和力。作为非限制性实例,vwf蛋白包含在对应于seq id no:21的氨基酸764的残基处的丝氨酸残基和在对应于seq id no:21的氨基酸773的残基处的赖氨酸残基。残基764和/或773可有助于vwf蛋白对fviii的结合亲和力。在其它实施方案中,适用于本发明的vwf蛋白可具有其它修饰,例如蛋白质可被聚乙二醇化、糖基化、羟乙基淀粉化或聚唾液酸化。
[0238]
ii.b.xten序列
[0239]
如本文所用,“xten序列”是指具有主要由小亲水性氨基酸组成的非天然存在的大致上非重复序列的延长长度多肽,其中所述序列在生理条件下具有低度或不具有二级或三级结构。作为嵌合蛋白配偶体,xten可充当载体,从而例如当连接于本发明的vwf蛋白或fviii序列以产生嵌合蛋白时,赋予某些合乎需要的药物动力学、物理化学和药物性质。所述合乎需要的性质包括但不限于药物动力学参数和溶解性特征增强。如本文所用,“xten”明确排除抗体或抗体片段,诸如单链抗体或轻链或重链的fc片段。
[0240]
本发明提供一种较短xten序列,当所述xten序列融合于vwf蛋白和/或第二ig恒定区或其一部分时,相较于较长xten序列,所述较短xten序列提供改进的半衰期延长性质。因此,融合于vwf蛋白和/或第二ig恒定区或其一部分的xten序列在长度方面含有小于288个氨基酸,即短于288个氨基酸。在一个实施方案中,融合于vwf蛋白和/或第二ig恒定区或其一部分的xten序列由长度在12个氨基酸与287个氨基酸之间的氨基酸序列组成。在另一实施方案中,融合于vwf蛋白和/或第二ig恒定区或其一部分的xten序列包含至少约36个氨基酸、至少约42个氨基酸、至少约72个氨基酸或至少约144个氨基酸,但小于288个氨基酸。在其它实施方案中,融合于vwf蛋白和/或第二ig恒定区或其一部分的xten序列选自ae36、ag36、ae42、ag42、ae72、ag72、ae144或ag144。在一个实施方案中,融合于vwf蛋白和/或第二ig恒定区或其一部分的xten序列是与seq id no:9、seq id no:10、seq id no:11或seq id no:14至少80%、85%、90%、95%、96%、97%、98%、99%或100%同一的氨基酸序列,其中相较于无xten序列的嵌合蛋白,嵌合蛋白展现改进的半衰期。
[0241]
本发明的嵌合蛋白可进一步包含另外(第二、第三或更多)的xten序列。另外的xten序列可进一步融合于fviii蛋白或第一ig恒定区或其一部分。另外的xten序列可为任何长度。举例来说,融合于fviii蛋白或第一ig恒定区或其一部分的另外的xten序列是具有大于约20、30、40、50、60、70、80、90、100、150、200、250、300、350、400、450、500、550、600、650、700、750、800、850、900、950、1000、1200、1400、1600、1800或2000个氨基酸残基的肽或多肽。在某些实施方案中,另外的xten序列是具有大于约20至约3000个氨基酸残基、大于约30至约2500个残基、大于约40至约2000个残基、大于约50至约1500个残基、大于约60至约1000个残基、大于约70至约900个残基、大于约80至约800个残基、大于约90至约700个残基、大于约100至约600个残基、大于约110至约500个残基、或大于约120至约400个残基的肽或多肽。
[0242]
xten序列(即融合于vwf蛋白和/或第二ig恒定区或其一部分的xten序列或融合于fviii蛋白和/或第一ig恒定区或其一部分或插入在fviii蛋白内一个或多个插入位点处的xten序列)可包含一个或多个具有9至14个氨基酸残基的序列基序或与所述序列基序至少80%、90%、91%、92%、93%、94%、95%、96%、97%、98%或99%同一的氨基酸序列,其中所述基序包含以下、基本上由以下组成或由以下组成:4至6种类型的选自由以下组成的组的氨基酸:甘氨酸(g)、丙氨酸(a)、丝氨酸(s)、苏氨酸(t)、谷氨酸(e)和脯氨酸(p)。参见us 2010-0239554 a1。
[0243]
在一些实施方案中,xten序列包含非重叠序列基序,其中序列的至少约80%、或至少约85%、或至少约90%、或至少约91%、或至少约92%、或至少约93%、或至少约94%、或至少约95%、或至少约96%、或至少约97%、或至少约98%、或至少约99%或约100%由多个选自从表2a选择的单一基序家族的非重叠序列单元组成,从而产生家族序列。如本文所用,“家族”意指xten具有仅选自来自表2a的单一基序种类的基序;即ad、ae、af、ag、am、aq、bc或bd xten,并且选择xten中不来自家族基序的任何其它氨基酸以实现所需性质,诸如允许通过编码核苷酸并入限制位点,并入裂解序列,或实现与fviii或vwf的更佳连接。在xten家族的一些实施方案中,xten序列包含ad基序家族或ae基序家族或af基序家族或ag基序家族或am基序家族或aq基序家族或bc家族或bd家族的多个非重叠序列基序单元,从而所得xten展现上述同源性范围。在其它实施方案中,xten包含来自表2a的两个或更多个基序家族的多个基序序列单元。可选择这些序列以实现以下更充分描述的由基序的氨基酸组成赋予的所需物理/化学特征,包括诸如净电荷、亲水性、缺乏二级结构或缺乏重复性的性质。在上文于这个段落中所述的实施方案中,可使用本文所述的方法选择并装配并入xten中的基序以实现xten具有约36至约3000个氨基酸残基。
[0244]
表2a.具有12个氨基酸的xten序列基序和基序家族
[0245][0246]
·
表示当以各种排列一起使用时产生“家族序列”的个别基序序列
[0247]
在一些实施方案中,本发明中使用的xten序列与选自由以下组成的组的序列至少60%、70%、80%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%同一:ae42、ag42、ae48、am48、ae72、ag72、ae108、ag108、ae144、af144、ag144、ae180、ag180、ae216、ag216、ae252、ag252、ae288、ag288、ae324、ag324、ae360、ag360、ae396、ag396、ae432、ag432、ae468、ag468、ae504、ag504、af504、ae540、ag540、af540、ad576、ae576、af576、ag576、ae612、ag612、ae624、ae648、ag648、ag684、ae720、ag720、ae756、ag756、ae792、ag792、ae828、ag828、ad836、ae864、af864、ag864、am875、ae912、am923、am1318、
bc864、bd864、ae948、ae1044、ae1140、ae1236、ae1332、ae1428、ae1524、ae1620、ae1716、ae1812、ae1908、ae2004a、ag948、ag1044、ag1140、ag1236、ag1332、ag1428、ag1524、ag1620、ag1716、ag1812、ag1908和ag2004。参见us 2010-0239554 a1。
[0248]
在一个实施方案中,xten序列与选自由以下组成的组的氨基酸序列至少60%、70%、80%、90%、95%、96%、97%、98%、99%或100%同一:ae42(seq id no:9)、ae72(seq id no:10)、ae144_2a(seq id no:55)、ae144_3b(seq id no:56)、ae144_4a(seq id no:57)、ae144_5a(seq id no:58)、ae144_6b(seq id no:59)、ag144_a(seq id no:60)、ag144_b(seq id no:61)、ag144_c(seq id no:62)、ag144_f(seq id no:63)、ae864(seq id no:15)、ae576(seq id no:16)、ae288(seq id no:8)、ae288_2(seq id no:54)、ae144(seq id no:11)、ag864(seq id no:17)、ag576(seq id no:18)、ag288(seq id no:19)、ag144(seq id no:14)及其任何组合。在另一实施方案中,xten序列选自由以下组成的组:ae42(seq id no:9)、ae72(seq id no:10)、ae144_2a(seq idno:55)、ae144_3b(seq id no:56)、ae144_4a(seq id no:57)、ae144_5a(seq id no:58)、ae144_6b(seq id no:59)、ag144_a(seq id no:60)、ag144_b(seq id no:61)、ag144_c(seq id no:62)、ag144_f(seq id no:63)、ae864(seq id no:15)、ae576(seq id no:16)、ae288(seq id no:8)、ae288_2(seq id no:54)、ae144(seq id no:11)、ag864(seq id no:17)、ag576(seq id no:18)、ag288(seq id no:19)、ag144(seq id no:14)及其任何组合。在特定实施方案中,xten序列是ae288。本发明的某些xten序列的氨基酸序列显示于表2b中。
[0249]
表2b.xten序列
[0250]
[0251]
[0252][0253]
在其中xten组分具有小于100%的它的氨基酸由4、5或6种类型的选自甘氨酸(g)、丙氨酸(a)、丝氨酸(s)、苏氨酸(t)、谷氨酸(e)和脯氨酸(p)的氨基酸组成,或小于100%的序列由来自表3的序列基序或表4和13-17的xten序列组成的那些实施方案中,xten的其它氨基酸残基选自其它14种天然l-氨基酸中的任一个,但优先选自亲水性氨基酸,以使xten序列含有至少约90%、91%、92%、93%、94%、95%、96%、97%、98%或至少约99%亲水性氨基酸。不是甘氨酸(g)、丙氨酸(a)、丝氨酸(s)、苏氨酸(t)、谷氨酸(e)和脯氨酸(p)的xten氨基酸分散在整个xten序列中,位于序列基序内部或之间,或集中在xten序列的一个或多个短链段中,例如以在xten组分与fviii或vwf组分之间产生接头。在xten组分包含除甘氨酸(g)、丙氨酸(a)、丝氨酸(s)、苏氨酸(t)、谷氨酸(e)和脯氨酸(p)以外的氨基酸的所述情况下,优选的是小于约2%或小于约1%氨基酸是疏水性残基以使所得序列通常缺乏二级结构,例如不具有超过2%α螺旋或2%β折叠,如通过本文公开的方法所确定。在构建xten时有利性较小的疏水性残基包括色氨酸、苯丙氨酸、酪氨酸、亮氨酸、异亮氨酸、缬氨酸和甲硫氨酸。另外,可设计xten序列以含有小于5%或小于4%或小于3%或小于2%或小于1%或不含有以下氨基酸:半胱氨酸(以避免形成二硫化物和氧化)、甲硫氨酸(以避免氧化)、天冬酰胺和谷氨酰胺(以避免脱酰胺)。因此,在一些实施方案中,除甘氨酸(g)、丙氨酸(a)、丝氨酸(s)、苏氨酸(t)、谷氨酸(e)和脯氨酸(p)之外也包含其它氨基酸的xten组分具有促成α螺旋和β折叠的残基小于5%(如通过chou-fasman算法所测量)的序列,并且具有至少90%或至少约95%或更多无规卷曲形成,如通过gor算法所测量。
[0254]
在其它实施方案中,本发明中使用的xten序列影响本发明的嵌合蛋白的物理或化
学性质,例如药物动力学。本发明中使用的xten序列可展现一种或多种以下有利性质:构象柔性、增强的水溶性、高度蛋白酶抗性、低免疫原性、与哺乳动物受体的低结合性或增加的流体动力学(或斯托克斯(stokes))半径。在特定实施方案中,连接于本发明中的fviii蛋白的xten序列增加药物动力学性质,诸如较长的终末半衰期或增加的曲线下面积(auc),以使本文所述的嵌合蛋白相较于野生型fviii在体内停留时期增加。在其它实施方案中,本发明中使用的xten序列增加药物动力学性质,诸如较长的终末半衰期或增加的曲线下面积(auc),以使fviii蛋白相较于野生型fviii在体内停留时期增加。
[0255]
本发明的一个实施方案是一种fviii/vwf融合蛋白,其包含融合于fc区的fviii部分和融合于fc区的vwf部分,其中xten序列(例如ae288)插入在所述fviii部分内,并且其中具有小于288个氨基酸的xten序列(例如ae144)插入在所述vwf部分与fc部分之间。如实施例中所述,在vwf部分与fc部分之间插入具有小于288个氨基酸的xten对嵌合蛋白的药物动力学的影响大于在vwf部分与fc部分之间插入具有288个氨基酸的xten。举例来说,相较于具有288个氨基酸的xten,在fviii/vwf融合蛋白中的vwf部分与fc部分之间插入具有小于288个氨基酸的xten序列可增加嵌合蛋白的终末半衰期。在一些实施方案中,相对于插入具有288个氨基酸的xten序列,终末半衰期增加至少约5%、至少约10%、至少约15%、至少约20%、至少约25%或至少约30%。在一个特定实施方案中,相对于插入具有288个氨基酸的xten,终末半衰期增加至少约35%。插入具有小于288个氨基酸的xten序列也可增加嵌合蛋白的auc值。在一些实施方案中,相对于插入具有288个氨基酸的xten,auc增加至少约50%、至少约100%或至少约200%。在一个特定实施方案中,auc增加约两倍。插入具有小于288个氨基酸的xten序列也可降低嵌合蛋白的清除率。举例来说,相对于插入具有288个氨基酸的xten序列,清除率可降低至少约5%、至少约10%、至少约15%、至少约20%、至少约25%或至少约30%。相对于插入具有288个氨基酸的xten,插入具有小于288个氨基酸的xten序列可增加平均滞留时间(mrt)和/或降低稳态表观分布体积(vss)。
[0256]
多种方法和测定可用于测定包含xten序列的蛋白质的物理/化学性质。所述方法包括但不限于分析性离心、epr、hplc-离子交换、hplc-尺寸排阻、反相hplc、光散射、毛细管电泳、圆二色性、差示扫描量热法、荧光、hplc-离子交换、hplc-尺寸排阻、ir、nmr、拉曼(raman)光谱法、折射法和uv/可见光谱法。其它方法公开于amau等,prot expr and purif 48,1-13(2006)中。
[0257]
可根据本发明使用的xten序列的其它实例公开于美国专利公布号2010/0239554a1、2010/0323956a1、2011/0046060a1、2011/0046061a1、2011/0077199a1或2011/0172146a1或国际专利公布号wo 2010091122 a1、wo 2010144502 a2、wo 2010144508 a1、wo 2011028228a1、wo 2011028229a1、wo 2011028344a2或wo 20130122617a1中。
[0258]
ii.c.因子viii(fviii)蛋白
[0259]
除非另外规定,否则如本文所用的“fviii蛋白”意指在凝血中发挥它的正常作用的功能性fviii多肽。术语fviii蛋白包括其保留全长野生型因子viii在凝血路径中的功能的功能性片段、变体、类似物或衍生物。“fviii蛋白”可与fviii多肽(或蛋白质)或fviii互换使用。fviii功能的实例包括但不限于能够活化凝血、能够充当因子ix的辅因子、或能够在ca
2+
和磷脂存在下与因子ix形成因子x活化酶复合物,其接着使因子x转化成活化形式xa。fviii蛋白可为人、猪、犬、大鼠或鼠类fviii蛋白。此外,来自人与其它物种的fviii之间的
比较已鉴定可能为功能所需的保守残基(cameron等,thromb.haemost.79:317-22(1998);us 6,251,632)。
[0260]
许多测试可用于评估凝血系统的功能:活化部分凝血激素时间(aptt)测试、显色测定、rotem测定、凝血酶原时间(pt)测试(也用于确定inr)、纤维蛋白原测试(常通过克劳斯(clauss)方法)、血小板计数、血小板功能测试(常通过pfa-100)、tct、流血时间、混合测试(如果患者的血浆与正常血浆混合,那么是否进行异常矫正)、凝血因子测定、抗磷脂抗体、d-二聚体、遗传测试(例如因子v leiden、凝血酶原突变g20210a)、稀释鲁塞尔氏蝰蛇毒液时间(russell's viper venom time,drvvt)、杂项血小板功能测试、凝血弹性描记法(teg或sonoclot)、凝血弹性测量术(例如)或优球蛋白(euglobulin)溶解时间(elt)。
[0261]
aptt测试是衡量“内在”凝血路径(也称为接触活化路径)与共同凝血路径两者的功效的性能指标。这个测试通常用于测量可商购获得的重组凝结因子(例如fviii或fix)的凝结活性。它与衡量外在路径的凝血酶原时间(pt)联合使用。
[0262]
rotem分析提供关于以下完整止血动力学的信息:凝结时间、凝块形成、凝块稳定性和溶解。凝血弹性测量术中的不同参数取决于血浆凝血系统的活性、血小板功能、纤维蛋白溶解或影响这些相互作用的许多因素。这个测定可提供对次级止血的完全综览。
[0263]
已知fviii多肽和多核苷酸序列,也已知许多功能性片段、突变体和修饰形式。以下显示人fviii序列(全长)的实例。
[0264]
表3.全长因子viii的氨基酸序列
[0265]
(全长fviii(fviii信号肽加下划线;fviii重链加双下划线;b结构域用斜体表示;并且fviii轻链呈普通文本形式)
[0266][0267]
表4.编码全长fviii的核苷酸序列(seq id no:66)*
[0268]
[0269]
347(1984);gitschier,j.等,nature 312:326-330(1984);wood,w.i.等,nature 312:330-337(1984);vehar,g.a.等,nature312:337-342(1984);wo 87/04187;wo 88/08035;wo 88/03558;以及美国专利号4,757,006)。从如美国专利号4,965,199中所示的cdna推断fviii氨基酸序列。此外,b结构域部分或完全缺失的fviii显示于美国专利号4,994,371和4,868,112中。在一些实施方案中,人fviii b结构域被如美国专利号5,004,803中所示的人因子v b结构域置换。编码人因子viii的cdna序列和氨基酸序列分别以美国申请公布号2005/0100990的seq id no:1和2显示。
[0275]
猪fviii序列发表在toole,j.j.等,proc.natl.acad.sci.usa 83:5939-5942(1986)中。此外,由从猪脾cdna文库pcr扩增fviii序列获得的完全猪cdna序列已报道于healey,j.f.等,blood88:4209-4214(1996)中。具有所有结构域、所有亚单位和特定氨基酸序列的取代的杂交人/猪fviii公开于lollar和runge的美国专利号5,364,771中和wo 93/20093中。更新近地,猪fviii的a1和a2结构域和用猪a1和/或a2结构域取代相应人结构域的嵌合fviii的核苷酸和相应氨基酸序列报道于wo 94/11503中。lollar,j.s.的美国专利号5,859,204也公开猪cdna和推断的氨基酸序列。美国专利号6,458,563公开一种b结构域缺失的猪fviii。
[0276]
lollar,j.s.的美国专利号5,859,204报道具有降低的抗原性和降低的免疫反应性的fviii功能性突变体。lollar,j.s.的美国专利号6,376,463也报道具有降低的免疫反应性的fviii突变体。saenko等的美国申请公布号2005/0100990报道fviii的a2结构域中的功能性突变。
[0277]
在一个实施方案中,fviii(或嵌合蛋白的fviii部分)可与具有seq id no:67的氨基酸1至1438或seq id no:65的氨基酸1至2332的fviii氨基酸序列(无信号序列)或具有seq id no:64的氨基酸1至19和seq id no:67的氨基酸1至1438或seq id no:64的氨基酸1至19和seq id no:65的氨基酸1至2332的fviii氨基酸序列(具有信号序列)至少50%、60%、70%、80%、90%、95%、96%、97%、98%、99%或100%同一,其中所述fviii具有凝结活性,例如作为辅因子活化因子ix以使因子x转化成活化因子x。fviii(或嵌合蛋白的fviii部分)可与具有seq id no:67的氨基酸1至1438或seq id no:65的氨基酸1至2332的fviii氨基酸序列(无信号序列)同一。fviii可进一步包含信号序列。
[0278]
如本文所用的fviii的“b结构域”与本领域中已知的通过内部氨基酸序列同一性和蛋白水解裂解位点定义的b结构域相同,例如是全长人fviii的残基ser741-arg1648。其它人fviii结构域由以下氨基酸残基界定:a1,残基ala1-arg372;a2,残基ser373-arg740;a3,残基ser1690-asn2019;c1,残基lys2020-asn2172;c2,残基ser2173-tyr2332。a3-c1-c2序列包括残基ser1690-tyr2332。剩余序列残基glu1649-arg1689通常被称为a3酸性区。猪、小鼠和犬fviii的包括b结构域的所有结构域的边界位置在本领域中也是已知的。在一个实施方案中,缺失fviii的b结构域(“b结构域缺失的因子viii”或“bdd fviii”)。bdd fviii的一实例是(重组bdd fviii),其与具有表5中的序列的因子viii部分具有相同序列。(bdd fviii重链加双下划线;b结构域用斜体表示;并且bdd fviii轻链呈普通文本形式)。编码表6的核苷酸序列(seq id no:68)显示于表6中。
[0279]
表5.b结构域缺失的因子viii(bdd fviii)的氨基酸序列
[0280][0281]
表6.编码bdd fviii的核苷酸序列(seq id no:68)*
[0282]
[0283][0284]
*加下划线的核酸编码信号肽。
[0285]“b结构域缺失的fviii”可具有公开于美国专利号6,316,226、6,346,513、7,041,635、5,789,203、6,060,447、5,595,886、6,228,620、5,972,885、6,048,720、5,543,502、5,610,278、5,171,844、5,112,950、4,868,112和6,458,563中的完全或部分缺失。在一些实施方案中,本发明的b结构域缺失的fviii序列包含在美国专利号6,316,226(也在us 6,346,513中)的第4栏第4行至第5栏第28行和实施例1-5处公开的任一缺失。在另一实施方案中,b结构域缺失的因子viii是s743/q1638 b结构域缺失的因子viii(sq bdd fviii)(例如因子viii具有从氨基酸744至氨基酸1637的缺失,例如因子viii具有seq id no:65的氨基酸1-743和氨基酸1638-2332,即seq id no:67)。在一些实施方案中,本发明的b结构域缺失的fviii具有在美国专利号5,789,203(以及us 6,060,447、us 5,595,886和us 6,228,620)的第2栏第26-51行和实施例5-8处公开的缺失。在一些实施方案中,b结构域缺失的因子viii具有以下中描述的缺失:美国专利号5,972,885的第1栏第25行至第2栏第40行;美国专利号6,048,720的第6栏第1-22行和实施例1;美国专利号5,543,502的第2栏第17-46行;美国专利号5,171,844的第4栏第22行至第5栏第36行;美国专利号5,112,950的第2栏第55-68行,图2和实施例1;美国专利号4,868,112的第2栏第2行至第19栏第21行和表2;美国专利号7,041,635的第2栏第1行至第3栏第19行、第3栏第40行至第4栏第67行、第7栏第43行至第8栏第26行、和第11栏第5行至第13栏第39行;或美国专利号6,458,563的第4栏第25-53行。在一些实施方案中,b结构域缺失的fviii缺失大部分b结构域,但仍然含有为在体内将初级翻译产物蛋白水解加工成两个多肽链所必需的b结构域氨基末端序列,如wo 91/09122中所公开。在一些实施方案中,在缺失氨基酸747-1638,即实际上完全缺失b结构域下构建b结构域缺失的fviii。hoeben r.c.等j.biol.chem.265(13):7318-7323(1990)。b结构域缺失的因子viii也可含有fviii的氨基酸771
–
1666或氨基酸868-1562的缺失。meulien p.等protein eng.2(4):301-6(1988)。作为本发明的一部分的另外的b结构域缺失包括以下:缺失氨基酸982至1562或760至1639(toole等,proc.natl.acad.sc i.u.s.a.(1986)83,5939-5942))、
797至1562(eaton等biochemistr y(1986)25:8343-8347))、741至1646(kaufman(pct公布申请号wo 87/04187))、747-1560(sarver等,dna(1987)6:553-564))、741至1648(pasek(pct申请号88/00831))、或816至1598或741至1648(lagner(behring inst.mitt.(1988)第82期:16-25);ep 295597)。在其它实施方案中,bdd fviii包括含有b结构域的保留一个或多个n连接的糖基化位点的片段的fviii多肽,所述位点例如是对应于全长fviii序列的氨基酸序列的残基757、784、828、900、963或任选943。b结构域片段的实例包括如miao,h.z.等,blood 103(a):3412-3419(2004);kasuda,a等,j.thromb.haemost.6:1352-1359(2008);以及pipe,s.w.等,j.thromb.haemost.9:2235-2242(2011)中公开的b结构域的226个氨基酸或163个氨基酸(即保留b结构域的前226个氨基酸或163个氨基酸)。在其它实施方案中,bdd fvi ii进一步包含在残基309处的点突变(从phe成为ser)以改进bdd fviii蛋白的表达。参见miao,h.z.等,blood 103(a):3412-3419(2004)。在其它实施方案中,bdd fviii包括含有b结构域的一部分,但不含有一个或多个弗林蛋白酶裂解位点(例如arg1313和arg1648)的fviii多肽。参见pipe,s.w.等,j.thromb.haemost.9:2235-2242(2011)。可在任何fviii序列中进行各前述缺失。
[0286]
在一些实施方案中,fviii具有部分b结构域。在一些实施方案中,具有部分b结构域的fviii蛋白是fviii198。fviii198是一种含有部分b结构域的单链fviiifc分子-226n6。数字226表示fviii b结构域的n末端226个氨基酸,并且n6表示b结构域中的六个n-糖基化位点。
[0287]
在一个实施方案中,就在氨基酸1648(在全长因子viii或seq id no:65中)、氨基酸754(在s743/q1638 b结构域缺失的因子viii或seq id no:67中)处的精氨酸或相应精氨酸残基(在其它变体中)之后裂解fviii,由此产生重链和轻链。在另一实施方案中,fviii包含通过金属离子介导的非共价键连接或缔合的重链和轻链。
[0288]
在其它实施方案中,fviii是单链fviii,其尚未就在氨基酸1648(在全长fviii或seq id no:65中)、氨基酸754(在s743/q1638 b结构域缺失的fviii或seq id no:67中)处的精氨酸或相应精氨酸残基(在其它变体中)之后被裂解。单链fviii可包含一个或多个氨基酸取代。在一个实施方案中,氨基酸取代在对应于全长成熟因子viii多肽(seq id no:65)的残基1648、残基1645或两者或sq bdd因子viii(seq id no:67)的残基754、残基751或两者的残基处。氨基酸取代可为除精氨酸以外的任何氨基酸,例如异亮氨酸、亮氨酸、赖氨酸、甲硫氨酸、苯丙氨酸、苏氨酸、色氨酸、缬氨酸、丙氨酸、天冬酰胺、天冬氨酸、半胱氨酸、谷氨酸、谷氨酰胺、甘氨酸、脯氨酸、硒代半胱氨酸、丝氨酸、酪氨酸、组氨酸、鸟氨酸、吡咯赖氨酸或牛磺酸。
[0289]
fviii可进一步由凝血酶裂解,接着活化成fviiia,从而充当活化因子ix(fixa)的辅因子。活化fix接着连同活化fviii一起形成x酶复合物,并且使因子x转化成活化因子x(fxa)。对于活化,fviii由凝血酶在于氨基酸372、740和1689(对应于b结构域缺失的fviii序列中的氨基酸372、740和795)处的三个精氨酸残基之后裂解,所述裂解产生具有50kda a1、43kda a2和73kda a3-c1-c2链的fviiia。在一个实施方案中,适用于本发明的fviii蛋白是非活性fviii。在另一实施方案中,fviii蛋白是活化fviii。
[0290]
具有与vwf蛋白连接或缔合的fviii多肽的蛋白质可包含与seq id no:65或67至少50%、60%、70%、80%、90%、95%、96%、97%、98%、99%或100%同一的序列,其中所述
序列具有fviii凝结活性,例如活化因子ix作为辅因子以使因子x转化成活化因子x(fxa)。
[0291]
如本文所用的“杂交”或“嵌合”多肽和蛋白质包括第一多肽链(例如融合于具有小于288个氨基酸的xten序列和第一ig恒定区或其一部分的vwf蛋白)与第二多肽链(例如融合于第二ig恒定区或其一部分的fviii蛋白)的组合,由此形成异二聚体。在一个实施方案中,杂交物中的第一多肽与第二多肽通过蛋白质-蛋白质相互作用(诸如电荷-电荷或疏水性相互作用)彼此缔合。在另一实施方案中,第一多肽包含vwf蛋白-xten-fc融合蛋白,并且第二多肽包含fviii-fc融合蛋白,从而使得杂交物是异二聚体,其中xten含有小于288个氨基酸。在其它实施方案中,第一多肽包含vwf蛋白-xten-fc融合蛋白,并且第二多肽包含fviii(x)-fc融合蛋白,从而使得杂交物是异二聚体,其中xten含有小于288个氨基酸。第一多肽与第二多肽可通过第一fc区与第二fc区之间的共价键(例如二硫键)缔合。第一多肽与第二多肽可进一步通过vwf片段与fviii蛋白之间的结合而彼此缔合。
[0292]
适用于本发明中的fviii蛋白可包括具有一个或多个不影响fviii凝血活性的另外的xten序列的fviii。所述xten序列可融合于fviii蛋白的c末端或n末端或插入在fviii蛋白中一组或多组两个氨基酸残基之间,同时插入不影响fviii凝血活性或fviii功能。在一个实施方案中,插入改进fviii蛋白的药物动力学性质(例如半衰期)。在另一实施方案中,插入可为多个插入,例如大于两个、三个、四个、五个、六个、七个、八个、九个或十个插入。插入位点的实例包括但不限于表7、8、9、10、11、12、13、14、15中所列的位点或其任何组合。
[0293]
连接于一个或多个xten序列的fviii蛋白可表示为fviii(x2)或fviii
(a
→
b)-x-fviii
(c
→
d)
,其中fviii
(a
→
b)
包含以下、基本上由以下组成或由以下组成:fviii蛋白的从氨基酸残基“a”至氨基酸残基“b”的第一部分;x2包含以下、基本上由以下组成或由以下组成:一个或多个xten序列,fviii
(c
→
d)
包含以下、基本上由以下组成或由以下组成:fviii蛋白的从氨基酸残基“c”至氨基酸残基“d”的第二部分;
[0294]
a是fviii蛋白的第一部分的n末端氨基酸残基,
[0295]
b是fviii蛋白的第一部分的c末端氨基酸残基,但也是其中插入xten序列的插入位点的两个氨基酸的n末端氨基酸残基,
[0296]
c是fviii蛋白的第二部分的n末端氨基酸残基,但也是其中插入xten序列的插入位点的两个氨基酸的c末端氨基酸残基,并且
[0297]
d是fviii蛋白的c末端氨基酸残基,并且
[0298]
其中fviii蛋白的第一部分与fviii蛋白的第二部分彼此不相同,并且共同具有足以使fviii蛋白具有fviii凝血活性的长度。
[0299]
在一个实施方案中,fviii蛋白的第一部分和fviii蛋白的第二部分是seq id no:65[全长成熟fviii序列]或seq id no:67[b结构域缺失的fviii]的片段,例如分别是n末端部分和c末端部分。在某些实施方案中,fviii蛋白的第一部分包含fviii蛋白的a1结构域和a2结构域。fviii蛋白的第二部分包含a3结构域、c1结构域和任选c2结构域。在其它实施方案中,fviii蛋白的第一部分包含a1结构域和a2结构域,并且fviii蛋白的第二部分包含b结构域的一部分、a3结构域、c1结构域和任选c2结构域。在其它实施方案中,fviii蛋白的第一部分包含fviii蛋白的a1结构域、a2结构域和b结构域的一部分,并且fviii蛋白的第二部分包含a3结构域、c1结构域和任选c2结构域。在其它实施方案中,fviii蛋白的第一部分包含
fviii蛋白的a1结构域、a2结构域和b结构域的第一部分。fviii蛋白的第二部分包含b结构域的第二部分、a3结构域、c1结构域和任选c2结构域。在一些实施方案中,两个氨基酸(“b”和“c”)可为表7、8、9、10、11、12、13、14和15中所示的氨基酸残基插入位点中的任何一个或多个。举例来说,“b”可为紧靠其中插入或连接一个或多个xten序列的位点的上游的氨基酸残基,并且“c”可为紧靠其中插入或连接一个或多个xten序列的位点的下游的氨基酸残基。在一些实施方案中,“a”是fviii蛋白的首个成熟氨基酸序列,并且“d”是fviii蛋白的末个氨基酸序列。举例来说,fviii
(a
→
b)
可为与seq id no:67[b结构域缺失的fviii氨基酸序列]或seq id no:65[全长fviii]的氨基酸1至745至少70%、80%、90%、95%、96%、97%、98%、99%或100%同一的氨基酸序列,并且fviii
(c
→
d)
可为分别seq id no:67的氨基酸746至1438或seq id no:65的氨基酸1641至2332。
[0300]
在一些方面,fviii蛋白中的插入位点位于fviii蛋白的一个或多个结构域(其是n末端、a1结构域、a2结构域、a3结构域、b结构域、c1结构域、c2结构域、c末端或其两个或更多个组合)中或位于fviii蛋白的两个结构域(其是a1结构域和a1酸性区、以及a1酸性区和a2结构域、a2结构域和a2酸性区、a2酸性区和b结构域、b结构域和a3结构域、以及a3结构域和c1结构域、c1结构域和c2结构域或其任何组合)之间。举例来说,其中可插入xte n序列的插入位点选自由以下组成的组:n末端和a1结构域、n末端和a2结构域、n末端和a3结构域、n末端和b结构域、n末端和c1结构域、n末端和c2结构域、n末端和c末端、a1结构域和a2结构域、a1结构域和a3结构域、a1结构域和b结构域、a1结构域和c1结构域、a1结构域和c2结构域、a1结构域和c末端、a2结构域和a3结构域、a2结构域和b结构域、a2结构域和c1结构域、a2结构域和c2结构域、a2结构域和c末端、a3结构域和b结构域、a3结构域和c1结构域、a3结构域和c2结构域、a3结构域和c末端、b结构域和c1结构域、b结构域和c2结构域、b结构域和c末端、c1结构域和c2结构域、c1结构域和c末端、c2结构域和c末端及其两个或更多个组合。插入位点的非限制性实例列于表7、8、9、10、11、12、13、14和15中。
[0301]
其中紧靠fviii蛋白中的一个或多个氨基酸(例如一个或多个xten插入位点)的下游插入或在c末端或n末端连接xten序列的fviii蛋白在连接于xten序列或由xten序列插入之后保留fviii活性。xten序列可插入fviii蛋白中一次或大于一次、两次、三次、四次、五次或六次以使插入不影响fviii活性(即fviii蛋白仍然保留凝血性质)。
[0302]
适用于本发明中的fviii蛋白可通过任选接头在fviii蛋白的n末端或c末端连接于一个或多个xten多肽或通过一个或多个任选接头紧靠fviii蛋白中的一个或多个氨基酸(例如一个或多个xten插入位点)的下游插入。在一个实施方案中,其中插入xten序列的两个氨基酸残基或xten序列所连接的氨基酸残基对应于seq id no:65[全长成熟fviii]的两个或一个选自由表7、表8、表9和表10中的残基及其任何组合组成的组的氨基酸残基。
[0303]
在其它实施方案中,至少一个xten序列插入本文公开的任何一个或多个xten插入位点或其任何组合中。在一个方面,至少一个xten序列插入表7中公开的一个或多个氨基酸中公开的一个或多个xten插入位点中。
[0304]
表7:示例性xten插入位点
[0305]
[0306]
[0307]
[0308][0309]
*指示xten的基于成熟全长人fviii的氨基酸编号的插入点,其中插入可在指示的氨基酸的n末端侧或c末端侧上。
[0310]
在一些实施方案中,一个或多个xten序列插入在对应于seq id no:65的氨基酸32、220、224、336、339、399、416、603、1656、1711、1725、1905或1910或其任何组合的上游或下游约六个氨基酸内。
[0311]
表8.示例性xten插入范围
[0312][0313]
*离插入残基的距离是指离可进行插入所处的指定插入残基(残基“0”)的n末端(负数)或c末端(正数)的相对氨基酸数目。标号
“‑
x”是指插入位点离指定插入残基的n末端侧x个氨基酸。类似地,标号“+x”是指插入位点离指定插入残基的c末端侧x个氨基酸。
[0314]
举例来说,
“‑
1,+2”指示在表示为-1、0、+1或+2的氨基酸残基的n末端或c末端进行插入。
[0315]
在其它实施方案中,一个或多个xten序列紧靠对应于全长成熟人fviii的一个或多个选自由表9中的一个或多个插入位点组成的组的氨基酸的下游插入。
[0316]
表9.示例性xten插入位点或范围
[0317][0318][0319]
*指示相对于成熟人fviii的氨基酸编号加以编号的插入位点的范围
[0320]
在其它实施方案中,一个或多个xten插入fviii的b结构域中。在一个实例中,xten插入在对应于seq id no:65的氨基酸740与1640之间,其中氨基酸740与1640之间的fviii
序列任选不存在。在另一实例中,xten插入在对应于seq id no:65的氨基酸741与1690之间,其中氨基酸740与1690之间的fviii序列任选不存在。在其它实例中,xten插入在对应于seq id no:65的氨基酸741与1648之间,其中氨基酸741与1648之间的fviii序列任选不存在。在其它实例中,xten插入在对应于seq id no:65的氨基酸743与1638之间,其中氨基酸743与1638之间的fviii序列任选不存在。在其它实例中,xten插入在对应于seq id no:65的氨基酸745与1656之间,其中氨基酸745与1656之间的fviii序列任选不存在。在一些实例中,xten插入在对应于seq id no:65的氨基酸745与1657之间,其中氨基酸745与1657之间的fviii序列任选不存在。在某些实例中,xten插入在对应于seq id no:65的氨基酸745与1667之间,其中氨基酸745与1667之间的fviii序列任选不存在。在其它实例中,xten插入在对应于seq id no:65的氨基酸745与1686之间,其中氨基酸745与1686之间的fviii序列任选不存在。在一些其它实例中,xten插入在对应于seq id no:65的氨基酸747与1642之间,其中氨基酸747与1642之间的fviii序列任选不存在。在其它实例中,xten插入在对应于seq id no:65的氨基酸751与1667之间,其中氨基酸751与1667之间的fviii序列任选不存在。
[0321]
在一些实施方案中,一个或多个xten插入紧靠选自由表10中的氨基酸残基组成的组的插入位点的氨基酸的下游的一个或多个氨基酸中。
[0322]
表10:fviii xten插入位点和构建体标号
[0323]
[0324][0325]
*指示成熟fviii蛋白的氨基酸编号
[0326]
在一个实施方案中,一个或多个xten插入位点位于fviii蛋白的一个或多个表面暴露的柔性环结构(例如容许环)内。举例来说,至少一个xten序列可插入包含其中可插入至少一个xten多肽而不消除重组蛋白的促凝血活性或重组蛋白质在体内表达或在体外于宿主细胞中表达的能力的至少两个“容许环”的各fviii“a”结构域中。容许环是允许插入至
少一个xten序列的除了其它属性之外也具有高表面或溶剂暴露和高构象柔性的区域。a1结构域包含容许环-1(a1-1)区域和容许环-2(a1-2)区域,a2结构域包含容许环-1(a2-1)区域和容许环-2(a2-2)区域,a3结构域包含容许环-1(a3-1)区域和容许环-2(a3-2)区域。
[0327]
在一个方面,fviii a1结构域中的第一容许环(a1-1)位于β链1与β链2之间,并且fviii a2结构域中的第二容许环(a1-2)位于β链11与β链12之间。fviii a2结构域中的第一容许环(a2-1)位于β链22与β链23之间,并且fviii a2结构域中的第二容许环(a2-2)位于β链32与β链33之间。fviii a3结构域中的第一容许环(a3-1)位于β链38与β链39之间,并且fviii a3中的第二容许环(a3-2)位于β链45与β链46之间。在某些方面,包含a1-1的表面暴露的柔性环结构对应于天然成熟人fviii中从seq id no:65的约氨基酸15至约氨基酸45,例如从seq id no:65的约氨基酸18至约氨基酸41的区域。在其它方面,包含a1-2的表面暴露的柔性环结构对应于天然成熟人fviii中从seq id no:65的约氨基酸201至约氨基酸232,例如从seq id no:65的约氨基酸218至约氨基酸229的区域。在其它方面,包含a2-1的表面暴露的柔性环结构对应于天然成熟人fviii中从seq id no:65的约氨基酸395至约氨基酸421,例如从seq id no:65的约氨基酸397至约氨基酸418的区域。在其它实施方案中,包含a2-2的表面暴露的柔性环结构对应于天然成熟人fviii中从seq id no:65的约氨基酸577至约氨基酸635,例如从seq id no:65的约氨基酸595至约氨基酸607的区域。在某些方面,包含a3-1的表面暴露的柔性环结构对应于天然成熟人fviii中从seq id no:65的约氨基酸1705至约氨基酸1732,例如从seq id no:65的约氨基酸1711至约氨基酸1725的区域。在其它方面,包含a3-2的表面暴露的柔性环结构对应于天然成熟人fviii中从seq id no:65的约氨基酸1884至约氨基酸1917,例如从seq id no:65的约氨基酸1899至约氨基酸1911的区域。
[0328]
在另一实施方案中,其中插入至少一个xten序列的一个或多个氨基酸位于a3结构域,例如对应于全长成熟fviii多肽的氨基酸1649至1689内。在特定实施方案中,xten序列插入在seq id no:65(全长成熟fviii)的氨基酸1656与1657之间。在特定实施方案中,包含紧靠对应于seq id no:65的氨基酸1656的下游插入的xten序列的fviii蛋白进一步包含从对应于seq id no:65的氨基酸745至氨基酸1656的缺失。
[0329]
在一些实施方案中,用于一个或多个xten插入的一个或多个插入位点紧靠一个或多个选自由以下组成的组的对应于成熟全长fviii的氨基酸的下游:
[0330]
(1)氨基酸3,(2)氨基酸18,(3)氨基酸22,
[0331]
(4)氨基酸26,(5)氨基酸32,(6)氨基酸40,
[0332]
(7)氨基酸60,(8)氨基酸65,(9)氨基酸81,
[0333]
(10)氨基酸116,(11)氨基酸119,(12)氨基酸130,
[0334]
(13)氨基酸188,(14)氨基酸211,(15)氨基酸216,
[0335]
(16)氨基酸220,(17)氨基酸224,(18)氨基酸230,
[0336]
(19)氨基酸333,(20)氨基酸336,(21)氨基酸339,
[0337]
(22)氨基酸375,(23)氨基酸399,(24)氨基酸403,
[0338]
(25)氨基酸409,(26)氨基酸416,(26)氨基酸442,
[0339]
(28)氨基酸487,(29)氨基酸490,(30)氨基酸494,
[0340]
(31)氨基酸500,(32)氨基酸518,(33)氨基酸599,
[0341]
(34)氨基酸603,(35)氨基酸713,(36)氨基酸745,
[0342]
(37)氨基酸1656,(38)氨基酸1711,(39)氨基酸1720,
[0343]
(40)氨基酸1725,(41)氨基酸1749,(42)氨基酸1796,
[0344]
(43)氨基酸1802,(44)氨基酸1827,(45)氨基酸1861,
[0345]
(46)氨基酸1896,(47)氨基酸1900,(48)氨基酸1904,
[0346]
(49)氨基酸1905,(50)氨基酸1910,(51)氨基酸1937,
[0347]
(52)氨基酸2019,(53)氨基酸2068,(54)氨基酸2111,
[0348]
(55)氨基酸2120,(56)氨基酸2171,(57)氨基酸2188,
[0349]
(58)氨基酸2227,(59)氨基酸2277,和
[0350]
(60)其两个或更多个组合。
[0351]
在一个实施方案中,适用于本发明的fviii蛋白包含两个xten序列,插入第一xten插入位点中的第一xten序列和插入第二xten插入位点中的第二xten。第一xten插入位点和第二xten插入位点的非限制性实例列于表11中。
[0352]
表11.两个xten的示例性插入位点
[0353]
[0354]
[0355][0356]
插入或连接于fviii蛋白的两个xten可相同或不同。在一些实施方案中,适用于本发明的fviii蛋白包含两个插入fviii蛋白中的xten序列,紧靠对应于seq id no:65的氨基酸745的下游插入的第一xten序列,以及紧靠对应于seq id no:65的氨基酸2332(c末端)的下游插入的第二xten序列。在其它实施方案中,第一xten序列紧靠对应于seq id no:65的氨基酸18、26、40、1656或1720的下游插入,并且第二xten序列紧靠对应于seq id no:65的氨基酸403的下游插入。在其它实施方案中,第一xten序列紧靠对应于seq id no:65的氨基酸18、26或40的下游插入,并且第二xten序列紧靠对应于seq id no:65的氨基酸599的下游插入。在其它实施方案中,第一xten序列紧靠对应于seq id no:65的氨基酸1656的下游插入,并且第二xten序列紧靠对应于seq id no:65的氨基酸18、26、40、399、403、1725、1720、1900、1905或2332的下游插入。在某些实施方案中,第一xten序列紧靠对应于seq id no:65的氨基酸1900的下游插入,并且第二xten序列紧靠对应于seq id no:65的氨基酸18、26或40的下游插入。在一些实施方案中,第一xten序列紧靠对应于seq id no:65的氨基酸18、26或40的下游插入,并且第二xten序列紧靠对应于seq id no:65的氨基酸399的下游插入。在其它实施方案中,第一xten序列紧靠对应于seq id no:65的氨基酸1720的下游插入,并且第二xten序列紧靠对应于seq id no:65的氨基酸18、26或40的下游插入。在其它实施方案中,第一xten序列紧靠对应于seq id no:65的氨基酸1720的下游插入,并且第二xten序列紧靠对应于seq id no:65的氨基酸18的下游插入。在特定实施方案中,fviii蛋白包含两个xten序列,紧靠对应于seq id no:65的氨基酸745的下游插入的第一xten序列,以及紧靠对应于seq id no:65的氨基酸2332的下游插入的第二xten序列,其中所述fviii蛋白进一步具有从对应于seq id no:65的氨基酸745至对应于seq id no:65的氨基酸1685的缺失、在对应于seq id no:65的氨基酸1680处的突变或取代(例如y1680f)、在对应于seq id no:65的氨基酸1648处的突变或取代(例如r1648a)、或在对应于seq id no:65的氨基酸1648(例如r1648a)和对应于seq id no:65的氨基酸1680(例如y1680f)处的至少两个突变或取代。在特定实施方案中,fviii蛋白包含两个xten序列,紧靠对应于seq id no:65的氨基酸1656的下游插入的第一xten,以及紧靠seq id no:65的氨基酸2332的下游插入的第二xten序列,其中fviii蛋白进一步具有从对应于seq id no:65的氨基酸745至氨基酸1656的缺失。
[0357]
在某些实施方案中,fviii蛋白包含三个xten序列,插入第一xten插入位点中的第一xten序列、插入第二xten序列中的第二xten序列以及插入第三xten插入位点中的第三xten序列。第一、第二或第三xten序列可相同或不同。第一、第二和第三插入位点可选自本文公开的任一插入位点的组。在一些实施方案中,包含三个xten序列的fviii蛋白可进一步
包含突变或取代,例如对应于seq id no:65的氨基酸1648,例如r1648a。举例来说,第一、第二和第三xten插入位点的非限制性实例列于表12中。
[0358]
表12.三个xten的示例性插入位点
[0359][0360][0361]
在一些实施方案中,fviii蛋白包含三个xten序列,紧靠对应于seq id no:65的氨基酸26的下游插入的第一xten序列,插入在对应于seq id no:65的氨基酸403的下游的第二xten序列,以及插入在对应于seq id no:65的氨基酸1656、1720或1900的下游的第三xten序列。在其它实施方案中,第一xten序列紧靠对应于seq id no:65的氨基酸26的下游插入,第二xten序列插入在对应于seq id no:65的氨基酸1656的下游,并且第三xten序列插入在对应于seq id no:65的氨基酸1720或1900的下游。在其它实施方案中,第一xten序列紧靠对应于seq id no:65的氨基酸26的下游插入,第二xten序列插入在对应于seq id no:65的氨基酸1720的下游,并且第三xten序列插入在对应于seq id no:65的氨基酸1900
的下游。在其它实施方案中,第一xten序列紧靠对应于seq id no:65的氨基酸403的下游插入,第二xten序列插入在对应于seq id no:65的氨基酸1656的下游,并且第三xten序列插入在对应于seq id no:65的氨基酸1720或1900的下游。在其它实施方案中,第一xten序列紧靠对应于seq id no:65的氨基酸403或1656的下游插入,第二xten序列插入在对应于seq id no:65的氨基酸1720的下游,并且第三xten序列插入在对应于seq id no:65的氨基酸1900的下游。在其它实施方案中,第一xten序列紧靠对应于seq id no:65的氨基酸18、26、40、399、403、1711、1720、1725、1900、1905或1910的下游插入,第二xten序列插入在对应于seq id no:65的氨基酸745的下游,并且第三xten序列插入在对应于seq id no:65的氨基酸2332的下游。
[0362]
在其它实施方案中,本发明中的fviii蛋白包含四个xten序列,插入第一插入位点中的第一xten序列、插入第二插入位点中的第二xten序列、插入第三插入位点中的第三xten序列以及插入第四插入位点中的第四xten序列。第一、第二、第三和第四xten序列可相同、不同或呈其组合形式。在一些实施方案中,包含四个xten序列的fviii蛋白可进一步包含突变或取代,例如对应于seq id no:65的氨基酸1648,例如r1648a。第一、第二、第三和第四xten插入位点的非限制性实例列于表13中。
[0363]
表13.四个xten的示例性插入位点
[0364]
[0365]
[0366][0367]
在一些实施方案中,fviii蛋白包含五个xten序列,插入第一插入位点中的第一xten序列、插入第二插入位点中的第二xten序列、插入第三xten插入位点中的第三xten序列、插入第四xten插入位点中的第四xten序列以及插入第五xten插入位点中的第五xten序列。第一、第二、第三、第四或第五xten序列可相同、不同或呈其组合形式。第一、第二、第三、第四和第五插入位点的非限制性实例列于表14中。
[0368]
表14.五个xten的示例性插入位点
[0369][0370]
在某些实施方案中,fviii蛋白包含六个xten序列,插入第一xten插入位点中的第一xten序列、插入第二xten插入位点中的第二xten序列、插入第三xten插入位点中的第三xten序列、插入第四xten插入位点中的第四xten序列、插入第五xten插入位点中的第五xten序列以及插入第六xten插入位点中的第六xten序列。第一、第二、第三、第四、第五或第六xten序列可相同、不同或呈其组合形式。六个xten插入位点的实例包括但不限于表15中所列的插入位点。
[0371]
表15.六个xten的示例性xten插入位点
[0372][0373]
在一特定实例中,第一xten插入在对应于seq id no:65的氨基酸26与27之间,并且第二xten插入在对应于seq id no:65(全长成熟fviii)的氨基酸1720与1721之间。在另一实例中,第一xten插入在对应于seq id no:65的氨基酸403与404之间,并且第二xten插入在对应于seq id no:65的氨基酸1720与1721之间。在一些实例中,第一xten插入在对应于seq id no:65的氨基酸1656与1657之间,并且第二xten插入在对应于seq id no:65的氨基酸1720与1721之间。在其它实例中,第一xten插入在对应于seq id no:65的氨基酸26与27之间,第二xten插入在对应于seq id no:65的氨基酸1656与1657之间,并且第三xten插入在对应于seq id no:65的氨基酸1720与1721之间。在其它实施方案中,第一xten插入在对应于seq id no:65的氨基酸403与404之间,第二xten插入在对应于seq id no:65的氨基酸1656与1657之间,并且第三xten插入在对应于seq id no:65的氨基酸1720与1721之间。在其它实施方案中,第一xten插入在对应于seq id no:65的氨基酸403与404之间,第二xten插入在对应于seq id no:65的氨基酸1656与1657之间,并且第三xten插入在对应于seq id no:65的氨基酸1720与1721之间。在某些实施方案中,第一xten插入在对应于seq id no:65的氨基酸26与27之间,第二xten插入在对应于seq id no:65的氨基酸1720与1721之间,并且第三xten插入在对应于seq id no:65的氨基酸1900与1901之间。在一些实施方
methods and applications"innis等编,academic press,san diego,ca(1990);ho等1989.gene 77:51;horton等1993.methods enzymol.217:270)中。pcr可通过共有恒定区引物或通过基于公开的重链和轻链dna和氨基酸序列的更特异性引物来引发。如上所讨论,pcr也可用于分离编码抗体轻链和重链的dna克隆。在这个情况下,可通过共有引物或较大同源性探针(诸如小鼠恒定区探针)来筛选文库。适于扩增抗体基因的众多引物组在本领域中是已知的(例如基于纯化抗体的n末端序列的5'引物(benhar和pastan.1994.protein engineering 7:1509);cdna末端的快速扩增物(ruberti,f.等1994.j.immunol.methods 173:33);抗体前导序列(larrick等1989biochem.biophys.res.commun.160:1250)。对抗体序列的克隆进一步描述于newman等,1995年1月25日提交的美国专利号5,658,570中,所述专利以引用的方式并入本文。
[0382]
本文所用的ig恒定区可包括所有结构域和铰链区或其部分。在一个实施方案中,ig恒定区或其一部分包含ch2结构域、ch3结构域和铰链区,即fc区或fcrn结合配偶体。
[0383]
如本文所用,术语“fc区”定义为多肽的对应于天然ig的fc区的部分,即如通过它的两个重链的相应fc结构域的二聚缔合所形成。天然fc区与另一fc区形成同二聚体。相反,如本文所用的术语“遗传融合fc区”或“单链fc区”(scfc区)是指合成二聚fc区,其包含在单一多肽链内遗传连接的fc结构域(即在单一连续遗传序列中编码)。
[0384]
在一个实施方案中,“fc区”是指单一ig重链的一部分,其在恰好在木瓜蛋白酶(papain)裂解位点(即igg中的残基216,将重链恒定区的第一残基视为114)上游的铰链区中开始,并且在抗体的c末端结束。因此,完全fc结构域包含至少铰链结构域、ch2结构域和ch3结构域。
[0385]
视ig同种型而定,ig恒定区的fc区可包括ch2、ch3和ch4结构域以及铰链区。包含ig的fc区的嵌合蛋白对嵌合蛋白赋予若干合乎需要的性质,包括稳定性增加、血清半衰期增加(参见capon等,1989,nature 337:525)以及结合fc受体,诸如新生儿fc受体(fcrn)(美国专利号6,086,875、6,485,726、6,030,613;wo 03/077834;us2003-0235536a1),所述文献和专利以引用的方式整体并入本文。
[0386]
ig恒定区或其一部分可为fcrn结合配偶体。fcrn在成人上皮组织中具有活性,并且在肠腔、肺气道、鼻表面、阴道表面、结肠和直肠表面中表达(美国专利号6,485,726)。fcrn结合配偶体是ig的结合fcrn的部分。
[0387]
已从包括人的若干哺乳动物物种分离fcrn受体。已知人fcrn、猴fcrn、大鼠fcrn和小鼠fcrn的序列(story等1994,j.exp.med.180:2377)。fcrn受体在相对较低ph下结合igg(但不结合其它ig类别,诸如iga、igm、igd和ige),以细胞腔至浆膜方向跨细胞主动转运igg,接着在见于间隙液中的相对较高ph下释放igg。它在成人上皮组织(美国专利号6,485,726、6,030,613、6,086,875;;wo 03/077834;us2003-0235536a1),包括肺和肠上皮(israel等1997,immunology 92:69)、肾近端管状上皮(kobayashi等2002,am.j.physiol.renal physiol.282:f358)以及鼻上皮;阴道表面;和胆系表面中表达。
[0388]
适用于本发明中的fcrn结合配偶体涵盖可由fcrn受体特异性结合的分子,包括完整igg、igg的fc片段和包括fcrn受体的完全结合区的其它片段。已基于x射线结晶学描述igg的fc部分的结合fcrn受体的区域(burmeister等1994,nature 372:379)。fc与fcrn的主要接触区域接近ch2结构域与ch3结构域的接合点。fc-fcrn接触都在单一ig重链内。fcrn结
合配偶体包括完整igg、igg的fc片段和igg的包括fcrn的完全结合区域的其它片段。主要接触位点包括ch2结构域的氨基酸残基248、250-257、272、285、288、290-291、308-311和314以及ch3结构域的氨基酸残基385-387、428和433-436。对ig或ig片段的氨基酸编号所作的提及都基于kabat等1991,sequences of proteins of immunological interest,u.s.department of public health,bethesda,md。
[0389]
结合于fcrn的fc区或fcrn结合配偶体可通过fcrn有效地跨越上皮屏障穿梭,由此提供一种全身性施用所需治疗分子的非侵入性手段。另外,包含fc区或fcrn结合配偶体的融合蛋白由表达fcrn的细胞胞饮。但替代被标记以进行降解,这些融合蛋白再次再循环进入循环中,由此增加这些蛋白质的体内半衰期。在某些实施方案中,ig恒定区的部分是fc区或fcrn结合配偶体,其通常通过二硫键和其它非特异性相互作用与另一fc区或另一fcrn结合配偶体缔合以形成二聚体和更高级多聚体。
[0390]
两个fcrn受体可结合单一fc分子。结晶学数据表明各fcrn分子结合fc同二聚体的单一多肽。在一个实施方案中,使fcrn结合配偶体(例如igg的fc片段)连接于生物活性分子会提供一种口服、经颊、舌下、经直肠、经阴道、以经鼻或通过肺途径施用的气雾剂形式、或通过眼途径递送所述生物活性分子的手段。在另一实施方案中,可侵入性施用嵌合蛋白,例如皮下、静脉内。
[0391]
fcrn结合配偶体区域是可由fcrn受体特异性结合,随后由fc区的fcrn受体主动转运的分子或其一部分。特异性结合是指两个分子形成在生理条件下相对稳定的复合物。特异性结合的特征在于亲和力较高而能力较低至中等,如与通常亲和力较低而能力中等至较高的非特异性结合相区分。通常,当亲和常数ka高于106m-1
或高于108m-1
时,结合被视为是特异性的。必要时,可通过改变结合条件来降低非特异性结合而不实质上影响特异性结合。诸如分子浓度、溶液的离子强度、温度、允许结合时间、阻断剂(例如血清白蛋白、乳酪蛋白)浓度等的适当结合条件可由熟练技术人员使用常规技术加以优化。
[0392]
在某些实施方案中,本发明的嵌合蛋白包含一个或多个截短fc区,尽管如此,所述fc区仍然足以对fc区赋予fc受体(fcr)结合性质。举例来说,fc区的结合fcrn的部分(即fcrn结合部分)包含igg1的约氨基酸282-438(eu编号),(其中主要接触位点是ch2结构域的氨基酸248、250-257、272、285、288、290-291、308-311和314以及ch3结构域的氨基酸残基385-387、428和433-436。因此,本发明的fc区可包含fcrn结合部分或由fcrn结合部分组成。fcrn结合部分可源于包括iggl、igg2、igg3和igg4的任何同种型的重链。在一个实施方案中,使用来自具有人同种型igg1的抗体的fcrn结合部分。在另一实施方案中,使用来自具有人同种型igg4的抗体的fcrn结合部分。
[0393]
在另一实施方案中,“fc区”包括fc结构域的氨基酸序列或源于fc结构域的氨基酸序列。在某些实施方案中,fc区包含以下中的至少一个:铰链(例如上、中和/或下铰链区)结构域(抗体fc区的约氨基酸216-230,根据eu编号)、ch2结构域(抗体fc区的约氨基酸231-340,根据eu编号)、ch3结构域(抗体fc区的约氨基酸341-438,根据eu编号)、ch4结构域、或其变体、部分或片段。在其它实施方案中,fc区包含完全fc结构域(即铰链结构域、ch2结构域和ch3结构域)。在一些实施方案中,fc区包含以下、基本上由以下组成或由以下组成:融合于ch3结构域(或其一部分)的铰链结构域(或其一部分)、融合于ch2结构域(或其一部分)的铰链结构域(或其一部分)、融合于ch3结构域(或其一部分)的ch2结构域(或其一部分)、
融合于铰链结构域(或其一部分)与ch3结构域(或其一部分)两者的ch2结构域(或其一部分)。在其它实施方案中,fc区缺乏ch2结构域的至少一部分(例如ch2结构域的全部或一部分)。在特定实施方案中,fc区包含以下或由以下组成:对应于eu编号221至447的氨基酸。
[0394]
在本文中表示为f、f1或f2的fc区可从许多不同来源获得。在一个实施方案中,多肽的fc区源于人ig。然而,应了解fc区可源于另一哺乳动物物种的ig,所述物种包括例如啮齿动物(例如小鼠、大鼠、兔或豚鼠)或非人灵长类动物(例如黑猩猩、猕猴)物种。此外,fc结构域或其部分的多肽可源于任何ig类别(包括igm、igg、igd、iga和ige)和任何ig同种型(包括iggl、igg2、igg3和igg4)。在另一实施方案中,使用人同种型igg1。
[0395]
在某些实施方案中,fc变体赋予由包含所述野生型fc结构域的fc区赋予的至少一种效应物功能的变化(例如fc区结合fc受体(例如fcγri、fcγrii或fcγriii)或补体蛋白(例如c1q)、或触发抗体依赖性细胞毒性(adcc)、吞噬作用或补体依赖性细胞毒性(cdcc)的能力改进或降低)。在其它实施方案中,fc变体提供工程改造的半胱氨酸残基。
[0396]
本发明的fc区可采用本领域认可的已知会赋予效应物功能和/或fcr或fcrn结合变化(例如增强或降低)的fc变体。具体来说,本发明的结合分子可包括例如在以下中公开的一个或多个氨基酸位置处的变化(例如取代):国际pct公布wo88/07089a1、wo96/14339a1、wo98/05787a1、wo98/23289a1、wo99/51642a1、wo99/58572a1、wo00/09560a2、wo00/32767a1、wo00/42072a2、wo02/44215a2、wo02/060919a2、wo03/074569a2、wo04/016750a2、wo04/029207a2、wo04/035752a2、wo04/063351a2、wo04/074455a2、wo04/099249a2、wo05/040217a2、wo04/044859、wo05/070963a1、wo05/077981a2、wo05/092925a2、wo05/123780a2、wo06/019447a1、wo06/047350a2和wo06/085967a2;美国专利公布号us2007/0231329、us2007/0231329、us2007/0237765、us2007/0237766、us2007/0237767、us2007/0243188、us20070248603、us20070286859、us20080057056;或美国专利5,648,260;5,739,277;5,834,250;5,869,046;6,096,871;6,121,022;6,194,551;6,242,195;6,277,375;6,528,624;6,538,124;6,737,056;6,821,505;6,998,253;7,083,784;7,404,956和7,317,091,其各自以引用的方式并入本文。在一个实施方案中,可在一个或多个公开的氨基酸位置处进行特定变化(例如特定取代本领域中公开的一个或多个氨基酸)。在另一实施方案中,可在一个或多个公开的氨基酸位置处进行不同变化(例如对本领域中公开的一个或多个氨基酸位置的不同取代)。
[0397]
igg的fc区或fcrn结合配偶体可根据充分认可的程序(诸如定点诱变等)加以修饰以产生将由fcrn结合的修饰的igg或其fc片段或部分。所述修饰包括保持或甚至增强与fcrn的结合的远离fcrn接触位点的修饰以及在接触位点内的修饰。举例来说,人igg1 fc(fcγ1)中的以下单一氨基酸残基可被取代而不显著损失fc对fcrn的结合亲和力:p238a、s239a、k246a、k248a、d249a、m252a、t256a、e258a、t260a、d265a、s267a、h268a、e269a、d270a、e272a、l274a、n276a、y278a、d280a、v282a、e283a、h285a、n286a、t289a、k290a、r292a、e293a、e294a、q295a、y296f、n297a、s298a、y300f、r301a、v303a、v305a、t307a、l309a、q311a、d312a、n315a、k317a、e318a、k320a、k322a、s324a、k326a、a327q、p329a、a330q、p331a、e333a、k334a、t335a、s337a、k338a、k340a、q342a、r344a、e345a、q347a、r355a、e356a、m358a、t359a、k360a、n361a、q362a、y373a、s375a、d376a、a378q、e380a、e382a、s383a、n384a、q386a、e388a、n389a、n390a、y391f、k392a、l398a、s400a、d401a、
d413a、k414a、r416a、q418a、q419a、n421a、v422a、s424a、e430a、n434a、t437a、q438a、k439a、s440a、s444a和k447a,其中例如p238a表示野生型脯氨酸在位置编号238处被丙氨酸取代。举例来说,一特定实施方案并有n297a突变,从而移除高度保守的n-糖基化位点。除丙氨酸之外,其它氨基酸也可在以上指定的位置处取代野生型氨基酸。突变可单一引入fc中,从而产生超过一百个不同于天然fc的fc区。另外,两个、三个或更多个这些个别突变的组合可一起引入,从而再产生数百个fc区。此外,本发明的构建体的一个fc区可被突变,并且所述构建体的另一fc区完全不突变,或它们两者均可被突变,但突变不同。
[0398]
某些以上突变可对fc区或fcrn结合配偶体赋予新功能性。举例来说,一个实施例并有n297a,从而移除高度保守的n-糖基化位点。这个突变的作用在于降低免疫原性,由此增强fc区的循环半衰期,以及在不损害对fcrn的亲和力下致使fc区不能结合fcγri、fcγriia、fcγriib和fcγriiia(routledge等1995,transplantation60:847;friend等1999,transplantation 68:1632;shields等1995,j.biol.chem.276:6591)。作为由上述突变而产生的新功能性的另一实例,对fcrn的亲和力在一些情况下可增加超过野生型对fcrn的亲和力。这个亲和力增加可反映“缔合”速率增加、“解离”速率降低、或“缔合”速率增加与“解离”速率降低两者。据信会赋予对fcrn的亲和力增加的突变的实例包括但不限于t256a、t307a、e380a和n434a(shields等2001,j.biol.chem.276:6591)。
[0399]
另外,至少三种人fcγ受体似乎识别igg上在下铰链区内的结合位点,通常是氨基酸234-237。因此,新功能性和潜在免疫原性降低的另一实例可由这个区域的突变而产生,如例如通过将人igg1的氨基酸233-236“ellg”置换成来自igg2的相应序列“pva”(有一个氨基酸缺失)。已显示当已引入所述突变时,介导各种效应物功能的fcγri、fcγrii和fcγriii将不结合igg1。ward和ghetie 1995,therapeutic immunology 2:77以及armour等1999,eur.j.immunol.29:2613。
[0400]
在一个实施方案中,ig恒定区或其一部分(例如fc区)是包括序列pknssmisntp(seq id no:89或美国专利号5,739,277的seq id no:3),并且任选进一步包括选自hqslgtq(seq id no:90)、hqnlsdgk(seq id no:91)、hqnisdgk(seq id no:92)或visshlgq(seq id no:93)(或美国专利号5,739,277的分别seq id no:11、1、2和31)的序列的多肽。
[0401]
在另一实施方案中,免疫球蛋白恒定区或其一部分包含在铰链区或其一部分中的与另一免疫球蛋白恒定区或其一部分形成一个或多个二硫键的氨基酸序列。由免疫球蛋白恒定区或其一部分达成的二硫键将包含fviii的第一多肽和包含vwf片段的第二多肽放置在一起以使内源性vwf不置换vwf片段,并且不结合fviii。因此,第一免疫球蛋白恒定区或其一部分与第二免疫球蛋白恒定区或其一部分之间的二硫键会防止内源性vwf与fviii蛋白之间的相互作用。对vwf与fviii蛋白之间的相互作用的这个抑制允许嵌合蛋白的半衰期超过两倍限制。铰链区或其一部分可进一步连接于以下一个或多个结构域:ch1、ch2、ch3、其片段及其任何组合。在特定实施方案中,免疫球蛋白恒定区或其一部分是铰链区和ch2。
[0402]
在某些实施方案中,ig恒定区或其一部分被半糖基化。举例来说,包含两个fc区或fcrn结合配偶体的嵌合蛋白可含有第一糖基化fc区(例如糖基化ch2区)或fcrn结合配偶体和第二无糖基化fc区(例如无糖基化ch2区)或fcrn结合配偶体。在一个实施方案中,接头可插入在糖基化fc区与无糖基化fc区之间。在另一实施方案中,fc区或fcrn结合配偶体被完全糖基化,即所有fc区都被糖基化。在其它实施方案中,fc区可为无糖基化的,即无fc部分
被糖基化。
[0403]
在某些实施方案中,本发明的嵌合蛋白包含对ig恒定区或其一部分的氨基酸取代(例如fc变体),其改变ig恒定区的抗原非依赖性效应物功能,特别是蛋白质的循环半衰期。
[0404]
当相较于缺乏这些取代的蛋白质时,所述蛋白质展现与fcrn的结合增加或降低,并且因此在血清中的半衰期分别增加或降低。预期对fcrn的亲和力改进的fc变体会具有较长血清半衰期,并且所述分子在治疗哺乳动物的方法(其中施用的多肽的长久半衰期例如为治疗慢性疾病或病症所需)中具有适用应用(参见例如美国专利7,348,004、7,404,956和7,862,820)。相反,预期fcrn结合亲和力降低的fc变体会具有较短半衰期,并且所述分子也适用于例如在循环时间缩短可为有利时向哺乳动物施用,例如对于体内诊断成像或在起始多肽在持续延长时期存在于循环中时具有毒性副作用的情况下。fcrn结合亲和力降低的fc变体跨越胎盘的可能性也较小,并且因此也适用于治疗妊娠妇女的疾病或病症。此外,其中可需要fcrn结合亲和力降低的其它应用包括其中需要定位于脑、肾和/或肝的那些应用。在一个示例性实施方案中,本发明的嵌合蛋白展现从血管结构跨越肾小球的上皮的转运降低。在另一实施方案中,本发明的嵌合蛋白展现从脑跨越血脑屏障(bbb)进入血管间隙中的转运降低。在一个实施方案中,fcrn结合改变的蛋白质包含至少一个在ig恒定区的“fcrn结合环”内具有一个或多个氨基酸取代的fc区或fcrn结合配偶体(例如一或两个fc区或fcrn结合配偶体)。fcrn结合环包含野生型全长fc区的氨基酸残基280-299(根据eu编号)。在其它实施方案中,本发明的嵌合蛋白中具有改变的fcrn结合亲和力的ig恒定区或其一部分包括至少一个在fcrn“接触区”内具有一个或多个氨基酸取代的fc区或fcrn结合配偶体。如本文所用,术语fcrn“接触区”包括在野生型全长fc部分的以下位置处的残基:243-261、275-280、282-293、302-319、336-348、367、369、372-389、391、393、408、424、425-440(eu编号)。在其它实施方案中,本发明的具有改变的fcrn结合亲和力的ig恒定区或其一部分包括至少一个在对应于任一以下eu位置的氨基酸位置处具有一个或多个氨基酸取代的fc区或fcrn结合配偶体:256、277-281、283-288、303-309、313、338、342、376、381、384、385、387、434(例如n434a或n434k)和438。改变fcrn结合活性的示例性氨基酸取代公开于国际pct公布号wo05/047327中,所述公布以引用的方式并入本文。
[0405]
本发明中使用的fc区或fcrn结合配偶体也可包含本领域认可的改变嵌合蛋白的糖基化的氨基酸取代。举例来说,嵌合蛋白的连接于vwf片段或fviii蛋白的fc区或fcrn结合配偶体可包括具有导致糖基化(例如n连接或o连接的糖基化)降低的突变的fc区,或可包括糖形式改变(例如低海藻糖(fucose)或无海藻糖聚糖)的野生型fc部分。
[0406]
在一个实施方案中,本发明的未加工嵌合蛋白可包含遗传融合fc区(即scfc区),所述fc区的组成ig恒定区或其一部分中的两个或更多个独立地选自本文所述的ig恒定区或其一部分。在一个实施方案中,二聚fc区的fc区是相同的。在另一实施方案中,至少两个fc区是不同的。举例来说,本发明的蛋白质的fc区或fcrn结合配偶体包含相同数目的氨基酸残基,或它们可在长度方面相差一个或多个氨基酸残基(例如约5个氨基酸残基(例如1、2、3、4或5个氨基酸残基)、约10个残基、约15个残基、约20个残基、约30个残基、约40个残基或约50个残基)。在其它实施方案中,本发明的蛋白质的fc区或fcrn结合配偶体可在序列方面在一个或多个氨基酸位置处不同。举例来说,至少两个fc区或fcrn结合配偶体可在约5个
氨基酸位置(例如1、2、3、4或5个氨基酸位置)、约10个位置、约15个位置、约20个位置、约30个位置、约40个位置、或约50个位置处不同。
[0407]
ii.e.接头
[0408]
本发明的嵌合蛋白进一步包含一个或多个接头。一种接头类型是可裂解接头,其在体内向受试者施用,例如在凝血部位处施用时可由各种蛋白酶裂解。在一个实施方案中,可裂解接头允许在凝血级联部位处从xten序列,由此从嵌合蛋白裂解部分(例如vwf蛋白),由此使活化fviii(fviiia)具有它的fviiia活性。另一接头类型是可加工接头,其含有细胞内裂解位点,并且因此可由宿主细胞中的细胞内加工酶裂解,从而允许适当表达多肽和形成嵌合蛋白。
[0409]
一个或多个接头可存在于嵌合蛋白中的任何两个蛋白质之间。在一个实施方案中,嵌合蛋白包含第一多肽,所述第一多肽包含(i)fviii蛋白和(ii)第一ig恒定区或其一部分;和第二多肽,所述第二多肽包含(iii)vwf蛋白,(iv)接头(例如可裂解接头),(v)xten序列,和(vi)第二ig恒定区或其一部分。在另一实施方案中,嵌合蛋白包含第一多肽,所述第一多肽包含(i)fviii蛋白和(ii)第一ig恒定区或其一部分;和第二多肽,所述第二多肽包含(iii)vwf蛋白,(iv)xten序列,(v)接头(例如可裂解接头),和(vi)第二ig恒定区或其一部分。在其它实施方案中,嵌合蛋白包含第一多肽,所述第一多肽包含(i)fviii蛋白和(ii)第一ig恒定区或其一部分;和第二多肽,所述第二多肽包含(iii)vwf蛋白,(iv)第一接头(例如可裂解接头),(v)xten序列,(vi)第二接头(例如可裂解接头),和(vii)第二ig恒定区或其一部分。在一些实施方案中,第一多肽进一步在fviii蛋白与第一ig恒定区之间包含接头,例如可裂解接头。
[0410]
在某些实施方案中,嵌合蛋白包含单链,其包含(i)fviii蛋白,(ii)第一ig恒定区或其一部分,(iii)接头(例如可加工接头),(iv)vwf蛋白,(v)xten序列,和(vi)第二ig恒定区或其一部分。在其它实施方案中,嵌合蛋白包含单链,其包含(i)fviii蛋白,(ii)第一ig恒定区或其一部分,(iii)第一接头(例如可加工接头),(iv)vwf蛋白,(v)第二接头(例如可裂解接头),(vi)xten序列,和(vii)第二ig恒定区或其一部分。在嵌合蛋白在宿主细胞中表达之后,可加工接头可被加工;因此在宿主细胞中产生的嵌合蛋白可呈包含两个或三个多肽链的最终形式。
[0411]
适用于本发明中的接头可包括任何有机分子。在一个实施方案中,接头包括聚合物,例如聚乙二醇(peg)或羟乙基淀粉(hes)。在另一实施方案中,接头包括氨基酸序列。接头可包含至少约10、20、30、40、50、60、70、80、90、100、150、200、300、400、500、600、700、800、900、1000、1100、1200、1300、1400、1500、1600、1700、1800、1900或2000个氨基酸。接头可包含1-5个氨基酸、1-10个氨基酸、1-20个氨基酸、10-50个氨基酸、50-100个氨基酸、100-200个氨基酸、200-300个氨基酸、300-400个氨基酸、400-500个氨基酸、500-600个氨基酸、600-700个氨基酸、700-800个氨基酸、800-900个氨基酸或900-1000个氨基酸。在一个实施方案中,接头包括xten序列。xten的其它实例可根据本发明加以使用,并且公开于美国专利公布号2010/0239554a1、2010/0323956a1、2011/0046060a1、2011/0046061a1、2011/0077199a1或2011/0172146a1或国际专利公布号wo 2010091122 a1、wo 2010144502 a2、wo 2010144508 a1、wo 2011028228a1、wo 2011028229a1或wo 2011028344a2中。在另一实施方案中,接头是pas序列。
[0412]
在一个实施方案中,接头是聚合物,例如聚乙二醇(peg)或羟乙基淀粉(hes)。在另一实施方案中,接头是氨基酸序列。接头可包含至少约10、20、30、40、50、60、70、80、90、100、150、200、300、400、500、600、700、800、900、1000、1100、1200、1300、1400、1500、1600、1700、1800、1900或2000个氨基酸。接头可包含1-5个氨基酸、1-10个氨基酸、1-20个氨基酸、10-50个氨基酸、50-100个氨基酸、100-200个氨基酸、200-300个氨基酸、300-400个氨基酸、400-500个氨基酸、500-600个氨基酸、600-700个氨基酸、700-800个氨基酸、800-900个氨基酸或900-1000个氨基酸。
[0413]
接头的实例在本领域中是熟知的。在一个实施方案中,接头包含序列gn。接头可包含序列(ga)n。接头可包含序列(ggs)n。在其它实施方案中,接头包含(gggs)n(seq id no:101)。在其它实施方案中,接头包含序列(ggs)n(ggggs)n(seq id no:95)。在这些情况下,n可为整数1-100。在其它情况下,n可为整数1-20,即1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19或20。接头的实例包括但不限于ggg、sggsggs(seq id no:96)、ggs ggsggsggsggg(seq id no:97)、ggsggsggggsggggs(se q id no:98)、ggsggsggsggsggsggs(seq id no:99)或gg ggsggggsggggs(seq id no:100)。接头不消除或减弱vwf蛋白活性或因子viii的凝结活性。任选地,接头增强vwf蛋白活性或因子viii蛋白的凝结活性,例如通过进一步减弱空间位阻效应,以及使vwf蛋白或因子viii部分更易于到达它的靶标结合位点。
[0414]
在一个实施方案中,适用于嵌合蛋白的接头的长度是15-25个氨基酸。在另一实施方案中,适用于嵌合蛋白的接头的长度是15-20个氨基酸。在一些实施方案中,用于嵌合蛋白的接头的长度是10-25个氨基酸。在其它实施方案中,用于嵌合蛋白的接头的长度是15个氨基酸。在其它实施方案中,用于嵌合蛋白的接头是(ggggs)n(seq id no:94),其中g表示甘氨酸,s表示丝氨酸,并且n是整数1-20。
[0415]
ii.f.裂解位点
[0416]
可裂解接头可并有能够以化学方式(例如水解酯键)、以酶促方式(即并有蛋白酶裂解序列)或以光解方式(例如发色团,诸如3-氨基-3-(2-硝基苯基)丙酸(anp))裂解的部分以使一种分子从另一分子释放。
[0417]
在一个实施方案中,可裂解接头在n末端或c末端或两者处包含一个或多个裂解位点。在另一实施方案中,可裂解接头基本上由一个或多个可裂解位点组成或由一个或多个可裂解位点组成。在其它实施方案中,可裂解接头包含本文所述的异源性氨基酸接头序列或聚合物和一个或多个可裂解位点。
[0418]
在某些实施方案中,可裂解接头包含一个或多个可在宿主细胞中裂解的裂解位点(即细胞内加工位点)。裂解位点的非限制性实例包括rrrr(seq id no:102)、rkrrkr(seq id no:103)和rrrrs(seq id no:104)。
[0419]
在一些实施方案中,可裂解接头包括来自fviii的a1区、来自fviii的a2区、来自fviii的a3区、包含x-v-p-r(seq id no:105)和par1外结合位点相互作用基序的凝血酶可裂解位点(其中x是脂族氨基酸)或其任何组合。包括a2区,其包含与对应于全长fviii的glu720至arg740至少约80%、约85%、约90%、约95%或100%同一的氨基酸序列,其中所述a2区能够由凝血酶裂解。在特定实施方案中,适用于本发明的可裂解接头包括a2区,其包含isdkntgdyyedsyedisayllsknnaieprsfs(seq id no:106)。在其它实施方案中,用于本发明
的可裂解接头包括a1区,其包含与对应于全长fviii的met337至arg372至少约80%、约85%、约90%、约95%或100%同一的氨基酸序列,其中所述a1区能够由凝血酶裂解。在特定实施方案中,a1区包含ismknneeaedydddltdsemdvvrfdddnspsfiqirsv(seq id no:107)。在一些实施方案中,本发明的可裂解接头包括a3区,其包含与对应于全长fviii的glu1649至arg1689至少约80%、约85%、约90%、约95%或100%同一的氨基酸序列,其中所述a3区能够由凝血酶裂解。在特定实施方案中,用于本发明的可裂解接头包括a3区,其包含iseitrttlqsdqeeidyddtisvemkkedfdiydedenqsprsfq(seq id no:108)。
[0420]
在其它实施方案中,可裂解接头包括凝血酶裂解位点,其包含x-v-p-r(seq id no:105)和par1外结合位点相互作用基序,并且其中所述par1外结合位点相互作用基序包含s-f-l-l-r-n(seq id no:109)。par1外结合位点相互作用基序可进一步包含选自以下的氨基酸序列:p、p-n、p-n-d、p-n-d-k(seq id no:110)、p-n-d-k-y(seq id no:111)、p-n-d-k-y-e(seq id no:112)、p-n-d-k-y-e-p(seq id no:113)、p-n-d-k-y-e-p-f(seq id no:114)、p-n-d-k-y-e-p-f-w(seq id no:115)、p-n-d-k-y-e-p-f-w-e(seq id no:116)、p-n-d-k-y-e-p-f-w-e-d(seq id no:117)、p-n-d-k-y-e-p-f-w-e-d-e(seq id no:118)、p-n-d-k-y-e-p-f-w-e-d-e-e(seq id no:119)、p-n-d-k-y-e-p-f-w-e-d-e-e-s(seq id no:120)或其任何组合。在一些实施方案中,脂族氨基酸选自甘氨酸、丙氨酸、缬氨酸、亮氨酸或异亮氨酸。
[0421]
在其它实施方案中,可裂解接头包含一个或多个在向受试者施用包含所述可裂解接头的嵌合蛋白之后由蛋白酶裂解的裂解位点。在一个实施方案中,裂解位点由选自由以下组成的组的蛋白酶裂解:因子xia、因子xiia、胰舒血管素、因子viia、因子ixa、因子xa、因子iia(凝血酶)、弹性蛋白酶-2、mmp-12、mmp-13、mmp-17和mmp-20。在另一实施方案中,裂解位点选自由以下组成的组:fxia裂解位点(例如kltr
↓
aet(seq id no:121))、fxia裂解位点(例如df tr
↓
vvg(seq id no:122))、fxiia裂解位点(例如tmtr
↓
ivgg(seq id no:123))、胰舒血管素裂解位点(例如spfr
↓
stgg(seq id no:124))、fviia裂解位点(例如lqvr
↓
ivgg(seq id no:125))、fixa裂解位点(例如plgr
↓
ivgg(seq id no:126))、fxa裂解位点(例如iegr
↓
tvgg(seq id no:127))、fiia(凝血酶)裂解位点(例如ltpr
↓
sllv(seq id no:128))、弹性蛋白酶-2裂解位点(例如lgpv
↓
sgvp(seq id no:129))、粒酶-b裂解(例如vagd
↓
slee(seq id no:130))、mmp-12裂解位点(例如gpag
↓
lgga(seq id no:131))、mmp-13裂解位点(例如gpag
↓
lrga(seq id no:132))、mmp-17裂解位点(例如aplg
↓
lrlr(seq id no:133))、mmp-20裂解位点(例如palp
↓
lvaq(seq id no:134))、te v裂解位点(例如enlyfq
↓
g(seq id no:135))、肠激酶裂解位点(例如dddk
↓
ivgg(seq id no:136))、蛋白酶3c(prescissio n
tm
)裂解位点(例如levlfq
↓
gp(seq id no:137))和分选酶a裂解位点(例如lpkt
↓
gses)(seq id no:138)。在某些实施方案中,fxia裂解位点包括但不限于例如tqsfndftr(seq id no:1)和svsqtskltr(seq id no:3)。非限制性示例性凝血酶裂解位点包括例如dflaegggvr(seq id no:4)、ttkikpr(seq id no:5)、lvprg(seq id no:6)、dkntgdyyedsyedisayllsknnaieprsfs(seq id no:88)或ieprsfs(seq id no:194)以及包含alrpr(seq id no:7)、基本上由alrpr(seq id no:7)组成或由alrpr(seq id no:7)组成的序列(例如alrprvvgga(seq id no:145))。
[0422]
在特定实施方案中,裂解位点是tldprsfllrnpndkyepfwedeek(seq id no:146)。
在另一实施方案中,裂解位点包含dkntgdyyedsyedisayllsknnaieprsfs(seq id no:88)或其片段。在一个特定实施方案中,裂解位点包含ieprsfs(seq id no:194)。在另一实施方案中,裂解位点包含eprsfs(seq id no:195),其中所述裂解位点不是fviii的全长a2区。在另一实施方案中,裂解位点包含iepr(seq id no:200)。在另一实施方案中,裂解位点包含iepr(seq id no:200),其中所述裂解位点不是fviii的全长a2区,或不包含fviii的全长a2区。在其它实施方案中,裂解位点包含dkntgdyyedsyedisayllsknnaieprsfs(seq id no:88)、kntgdyyedsyedisayllsknnaieprsfs(seq id no:139)、ntgdyyedsyedisayllsknnaieprsfs(seq id no:140)、tgdyyedsyedisayllsknnaieprsfs(seq id no:141)、gdyyedsyedisayllsknnaieprsfs(seq id no:142)、dyyedsyedisayllsknnaieprsfs(seq id no:143)、yyedsyedisayllsknnaieprsfs(seq id no:144)、yedsyedisayllsknnaieprsfs(seq id no:176)、edsyedisayllsknnaieprsfs(seq id no:177)、dsyedisayllsknnaieprsfs(seq id no:178)、syedisayllsknnaieprsfs(seq id no:179)、yedisayllsknnaieprsfs(seq id no:180)、edisayllsknnaieprsfs(seq id no:181)、disayllsknnaieprsfs(seq id no:182)、isayllsknnaieprsfs(seq id no:183)、sayllsknnaieprsfs(seq id no:184)、ayllsknnaieprsfs(seq id no:185)、yllsknnaieprsfs(seq id no:186)、llsknnaieprsfs(seq id no:187)、lsknnaieprsfs(seq id no:188)、sknnaieprsfs(seq id no:189)、knnaieprsfs(seq id no:190)、nnaieprsfs(seq id no:191)、naieprsfs(seq id no:192)、aieprsfs(seq id no:193)或ieprsfs(seq id no:194)。在其它实施方案中,裂解位点包含dkntgdyyedsyedisayllsknnaieprsfs(seq id no:88)、kntgdyyedsyedisayllsknnaieprsfs(seq id no:139)、ntgdyyedsyedisayllsknnaieprsfs(seq id no:140)、tgdyyedsyedisayllsknnaieprsfs(seq id no:141)、gdyyedsyedisayllsknnaieprsfs(seq id no:142)、dyyedsyedisayllsknnaieprsfs(seq id no:143)、yyedsyedisayllsknnaieprsfs(seq id no:144)、yedsyedisayllsknnaieprsfs(seq id no:176)、edsyedisayllsknnaieprsfs(seq id no:177)、dsyedisayllsknnaieprsfs(seq id no:178)、syedisayllsknnaieprsfs(seq id no:179)、yedisayllsknnaieprsfs(seq id no:180)、edisayllsknnaieprsfs(seq id no:181)、disayllsknnaieprsfs(seq id no:182)、isayllsknnaieprsfs(seq id no:183)、sayllsknnaieprsfs(seq id no:184)、ayllsknnaieprsfs(seq id no:185)、yllsknnaieprsfs(seq id no:186)、llsknnaieprsfs(seq id no:187)、lsknnaieprsfs(seq id no:188)、sknnaieprsfs(seq id no:189)、knnaieprsfs(seq id no:190)、nnaieprsfs(seq id no:191)、naieprsfs(seq id no:192)、aieprsfs(seq id no:193)或ieprsfs(seq id no:194),其中所述裂解位点不是全长fviii a2区。在某些实施方案中,在如本文提供或如本领域中已知的凝血酶裂解测定中,可裂解接头是可裂解的。
[0423]
iii.多核苷酸、载体和宿主细胞
[0424]
本发明中也提供一种编码本发明的嵌合蛋白的多核苷酸。在一个实施方案中,第一多肽链和第二多肽链可由单一多核苷酸链编码。在另一实施方案中,第一多肽链和第二多肽链由两个不同多核苷酸(即第一核苷酸序列和第二核苷酸序列)编码。在另一实施方案中,第一核苷酸序列和第二核苷酸序列在两个不同多核苷酸(例如不同载体)上。
[0425]
本发明包括一种编码单一多肽链(例如fviii(x2)-f1-l3-f2-l2-x1-l1-v)的多核
苷酸,其中fviii(x2)包括其中在一个或多个插入位点处插入xten序列的fviii蛋白,f1包括第一ig恒定区或其一部分,例如第一fc区,l1包括第一接头,v包括vwf蛋白,x1包括在长度方面具有小于288个氨基酸的xten序列,l2包括第二接头,l3包括第三接头,并且f2包括第二ig恒定区或其一部分,例如第二fc区。本发明也包括两个多核苷酸,第一多核苷酸序列编码包含融合于第一ig恒定区或其一部分的fviii蛋白的第一多肽,并且第二多核苷酸序列编码包含vwf蛋白、在长度方面具有小于288个氨基酸的xten序列以及第二ig恒定区或其一部分的第二多肽。在一些实施方案中,包含两个多肽链或三个多肽链的嵌合蛋白可由单一多核苷酸链编码,接着加工成两个或三个(或更多个)多肽链。在其它实施方案中,包含这些多肽链的嵌合蛋白可由两个或三个多核苷酸链编码。
[0426]
在其它实施方案中,多核苷酸组进一步包含编码蛋白质转化酶的另外的核苷酸链(例如当嵌合多肽由单一多核苷酸链编码时的第二核苷酸链或当嵌合蛋白由两个多核苷酸链编码时的第三核苷酸链)。蛋白质转化酶可选自由以下组成的组:原蛋白转化酶枯草杆菌蛋白酶/kexin 5型(pcsk5或pc5)、原蛋白转化酶枯草杆菌蛋白酶/kexin 7型(pcsk7或pc5)、酵母kex 2、原蛋白转化酶枯草杆菌蛋白酶/kexin 3型(pace或pcsk3)及其两个或更多个组合。在一些实施方案中,蛋白质转化酶是pace、pc5或pc7。在特定实施方案中,蛋白质转化酶是pc5或pc7。参见国际申请号pct/us2011/043568。
[0427]
如本文所用,表达载体是指含有在引入适当宿主细胞中时,为转录和翻译插入编码序列所必需的元件,或在rna病毒载体的情况下,为复制和翻译所必需的元件的任何核酸构建体。表达载体可包括质粒、噬菌粒、病毒及其衍生物。
[0428]
本发明的表达载体将包括编码本文所述的嵌合蛋白的多核苷酸。在一个实施方案中,包含fviii蛋白和第一ig恒定区的第一多肽;包含vwf蛋白、具有小于288个氨基酸的xten序列以及第二ig恒定区或其一部分的第二多肽;或两者的编码序列中的一个或多个被可操作地连接于表达控制序列。如本文所用,当两个核酸序列以允许各组成核酸序列保留它的功能性的方式共价连接时,它们被可操作地连接。当编码序列和基因表达控制序列以将编码序列的表达或转录和/或翻译置于基因表达控制序列的影响或控制下的方式共价连接时,它们被称为被可操作地连接。如果诱导5'基因表达序列中的启动子导致编码序列转录,并且如果两个dna序列之间的键联的性质不(1)导致引入框移突变,(2)干扰启动子区域引导编码序列转录的能力,或(3)干扰相应rna转录物被翻译成蛋白质的能力,那么两个dna序列被称为被可操作地连接。因此,如果基因表达序列能够实现编码核酸序列的转录以使所得转录物翻译成所需蛋白质或多肽,那么所述基因表达序列将被可操作地连接于那个编码核酸序列。
[0429]
如本文所用的基因表达控制序列是有助于它所可操作地连接的编码核酸的高效转录和翻译的任何调控核苷酸序列,诸如启动子序列或启动子-增强子组合。基因表达控制序列可例如是哺乳动物或病毒启动子,诸如组成性或诱导性启动子。组成性哺乳动物启动子包括但不限于以下基因的启动子:次黄嘌呤磷酸核糖基转移酶(hprt)、腺苷脱氨酶、丙酮酸激酶、β-肌动蛋白启动子和其它组成性启动子。在真核细胞中组成性起作用的示例性病毒启动子包括例如来自巨细胞病毒(cmv)、猿猴病毒(例如sv40)、乳头状瘤病毒(papilloma virus)、腺病毒、人免疫缺陷病毒(hiv)、劳斯肉瘤病毒、巨细胞病毒、莫洛尼白血病病毒(moloney leukemia virus)的长末端重复序列(ltr)和其它逆转录病毒的启动子以及单纯
疱疹病毒的胸苷激酶启动子。其它组成性启动子为本领域普通技术人员所知。适用作本发明的基因表达序列的启动子也包括诱导性启动子。诱导性启动子在诱导剂存在下表达。举例来说,诱导金属硫蛋白启动子以促进在某些金属离子存在下的转录和翻译。其它诱导性启动子为本领域普通技术人员所知。
[0430]
一般来说,基因表达控制序列在必要时将包括分别涉及转录和翻译启始的5'非转录和5'非翻译序列,诸如tata盒、加帽序列、caat序列等。尤其地,所述5'非转录序列将包括启动子区域,所述区域包括用于对可操作地接合的编码核酸进行转录控制的启动子序列。基因表达序列任选包括如所需的增强子序列或上游活化子序列。
[0431]
病毒载体包括但不限于来自以下病毒的核酸序列:逆转录病毒,诸如莫洛尼鼠类白血病病毒、哈维(harvey)鼠类肉瘤病毒、鼠类乳腺肿瘤病毒和劳斯肉瘤病毒;腺病毒、腺相关病毒;sv40型病毒;多型瘤病毒;艾伯斯坦-巴尔病毒(epstein-barr virus);乳头状瘤病毒;疱疹病毒;痘苗病毒;脊髓灰质炎病毒;和rna病毒,诸如逆转录病毒。可易于采用本领域中熟知的其它载体。某些病毒载体基于其中非必需基因已被目标基因置换的非细胞病变真核病毒。非细胞病变病毒包括逆转录病毒,其生命周期涉及基因组病毒rna逆转录成dna,随后前病毒整合至宿主细胞dna中。逆转录病毒已被核准用于人基因疗法试验。最适用的是具有复制缺陷性的那些逆转录病毒(即能够引导合成所需蛋白质,但不能制造感染性粒子)。所述遗传改变的逆转录病毒表达载体具有用于在体内高效率转导基因的一般效用。用于产生复制缺陷性逆转录病毒的标准方案(包括以下步骤:将外源性遗传物质并入质粒中,用质粒转染包装细胞系,由所述包装细胞系产生重组逆转录病毒,从组织培养基收集病毒粒子,以及用病毒粒子感染靶标细胞)提供于kriegler,m.,gene transfer and expression,alaboratory manual,w.h.freeman co.,new york(1990)以及murry,e.j.,methods in molecular biology,第7卷,humana press,inc.,cliffton,n.j.(1991)中。
[0432]
在一个实施方案中,病毒是腺相关病毒,其是一种双链dna病毒。腺相关病毒可被工程改造以具有复制缺陷性,并且能够感染广泛范围的细胞类型和物种。它进一步具有诸如以下的优势:热和脂质溶剂稳定性;在不同谱系的细胞(包括造血细胞)中具有高转导频率;以及缺乏重复感染抑制,因此允许进行多级转导。据报道,腺相关病毒可以位点特异性方式整合至人细胞dna中,由此使逆转录病毒感染的插入诱变的可能性和插入基因表达特征的可变性最小。此外,野生型腺相关病毒感染已在不存在选择压力下在组织培养中进行大于100继代,从而暗示腺相关病毒基因组整合是相对稳定事件。腺相关病毒也可以染色体外方式起作用。
[0433]
其它载体包括质粒载体。质粒载体已在本领域中广泛描述,并且为本领域技术人员所熟知。参见例如sambrook等,molecular cloning:a laboratory manual,第2版,cold spring harbor laboratory press,1989。在过去数年中,已发现质粒载体由于不能在宿主基因组内复制以及整合至宿主基因组中而特别有利于在体内将基因递送至细胞中。然而,具有可与宿主细胞相容的启动子的这些质粒可从可操作地编码于质粒内的基因表达肽。一些可从商业供应商获得的通常使用的质粒包括pbr322、puc18、puc19、各种pcdna质粒、prc/cmv、各种pcmv质粒、psv40和pbluescript。特定质粒的其它实例包括pcdna3.1,目录号v79020;pcdna3.1/hygro,目录号v87020;pcdna4/myc-his,目录号v86320;和pbudce4.1,目录号v53220,全部来自invitrogen(carlsbad,ca.)。其它质粒为本领域普通技术人员所熟
知。另外,可使用标准分子生物学技术定制设计质粒以移除和/或添加特定dna片段。
[0434]
在一种可用于产生本发明的蛋白质的昆虫表达系统中,苜蓿银纹夜蛾核多角体病病毒(autographa californica nuclear polyhidrosis virus,acnpv)用作表达外来基因的载体。病毒生长在草地贪夜蛾(spodoptera frugiperda)细胞中。编码序列可被克隆至病毒的非必需区域(例如多角体基因)中,并且置于acnpv启动子(例如多角体启动子)的控制下。成功插入编码序列将导致多角体基因失活,以及产生非封闭重组病毒(即缺乏由多角体基因编码的蛋白质外壳的病毒)。这些重组病毒接着用于感染其中表达插入基因的草地贪夜蛾细胞。(参见例如smith等(1983)j virol 46:584;美国专利号4,215,051)。这个表达系统的其它实例可见于ausubel等编(1989)current protocols in molecular biology,第2卷,greene publish.assoc.&wiley interscience中。
[0435]
可用于表达本发明的蛋白质的另一系统是谷氨酰胺合成酶基因表达系统,也被称为“gs表达系统”(lonza biologics plc,berkshire uk)。这个表达系统详述于美国专利号5,981,216中。
[0436]
在哺乳动物宿主细胞中,可利用许多基于病毒的表达系统。在其中腺病毒用作表达载体的情况下,编码序列可连接于腺病毒转录/翻译控制复合物,例如晚期启动子和三联前导序列。这个嵌合基因可接着通过体外或体内重组插入腺病毒基因组中。插入在病毒基因组的非必需区域(例如区域e1或e3)中将产生在受感染宿主中具有活力,并且能够表达肽的重组病毒。参见例如logan和shenk(1984)proc natl acad sci usa 81:3655)。或者,可使用痘苗7.5k启动子。参见例如mackett等(1982)proc natl acad sci usa 79:7415;mackett等(1984)j virol 49:857;panicali等(1982)proc natl acad sci usa 79:4927。
[0437]
为增加产生效率,多核苷酸可被设计以编码由酶裂解位点分开的本发明的蛋白质的多个单元。所得多肽可被裂解(例如通过用适当酶处理)以回收多肽单元。这可增加由单一启动子驱动的多肽的产量。当用于适当病毒表达系统中时,由mrna编码的各多肽的翻译在转录物内部受引导;例如由内部核糖体进入位点ires引导。因此,多顺反子构建体引导单一大型多顺反子mrna的转录,此转而引导多个个别多肽的翻译。这个方法消除多聚蛋白的产生和酶促加工,并且可显著增加由单一启动子驱动的多肽的产量。
[0438]
转化中使用的载体将通常含有用于鉴定转化体的可选择标记。在细菌系统中,此可包括抗生素抗性基因,诸如氨苄青霉素或卡那霉素。用于培养的哺乳动物细胞中的可选择标记包括赋予对诸如新霉素(neomycin)、潮霉素和甲氨蝶呤(methotrexate)的药物的抗性的基因。可选择标记可为可扩增可选择标记。一种可扩增可选择标记是二氢叶酸还原酶(dihydrofolate reductase,dhfr)基因。simonsen c c等(1983)proc natl acad sci usa 80:2495-9。可选择标记由thilly(1986)mammalian cell technology,butterworth publishers,stoneham,mass.综述,并且对可选择标记的选择完全属于本领域中的普通技能水平。
[0439]
可选择标记可于单独质粒上与目标基因同时引入细胞中,或它们可于同一质粒上引入。如果于同一质粒上,那么可选择标记和目标基因可在不同启动子或相同启动子控制下,后述排列会产生双顺反子信息。这个类型的构建体在本领域中是已知的(例如美国专利号4,713,339)。
[0440]
表达载体可编码允许对重组产生的蛋白质进行简易纯化的标签。实例包括但不限
于载体pur278(ruther等(1983)embo j 2:1791),其中待表达的蛋白质的编码序列可与lac z编码区同框连接至载体中以使标签化融合蛋白得以产生;pgex载体可用于表达具有谷胱甘肽(glutathione)s转移酶(gst)标签的本发明的蛋白质。这些蛋白质通常是可溶性的,并且可易于通过吸附于谷胱甘肽-琼脂糖珠粒,随后在游离谷胱甘肽存在下洗脱来从细胞纯化。载体包括用于在纯化之后简易移除标签的裂解位点(凝血酶或因子xa蛋白酶或prescission protease
tm
(pharmacia,peapack,n.j.))。
[0441]
一种或多种表达载体接着转染或共转染至将表达多肽的适合靶标细胞中。本领域中已知的转染技术包括但不限于磷酸钙沉淀(wigler等(1978)cell 14:725)、电穿孔(neumann等(1982)embo j 1:841)和基于脂质体的试剂。多种宿主表达载体系统可用于表达本文所述的蛋白质,所述系统包括原核细胞与真核细胞两者。这些系统包括但不限于微生物,诸如用含有适当编码序列的重组噬菌体dna或质粒dna表达载体转化的细菌(例如大肠杆菌(e.coli));用含有适当编码序列的重组酵母或真菌表达载体转化的酵母或丝状真菌;用含有适当编码序列的重组病毒表达载体(例如杆状病毒)感染的昆虫细胞系统;用重组病毒表达载体(例如花椰菜花叶病毒(cauliflower mosaic virus)或烟草花叶病毒(tobacco mosaic virus))感染或用含有适当编码序列的重组质粒表达载体(例如ti质粒)转化的植物细胞系统;或动物细胞系统,包括哺乳动物细胞(例如hek 293、cho、cos、hela、hkb11和bhk细胞)。
[0442]
在一个实施方案中,宿主细胞是真核细胞。如本文所用,真核细胞是指具有定形细胞核的任何动物或植物细胞。动物的真核细胞包括脊椎动物(例如哺乳动物)的细胞和无脊椎动物(例如昆虫)的细胞。植物的真核细胞可明确包括不限于酵母细胞。真核细胞不同于例如细菌的原核细胞。
[0443]
在某些实施方案中,真核细胞是哺乳动物细胞。哺乳动物细胞是源于哺乳动物的任何细胞。哺乳动物细胞明确包括但不限于哺乳动物细胞系。在一个实施方案中,哺乳动物细胞是人细胞。在另一实施方案中,哺乳动物细胞是hek 293细胞,其是一种人胚肾细胞系。hek 293细胞可以crl-1533从美国典型培养物保藏中心(american type culture collection,manassas,va)以及以293-h细胞(目录号11631-017)或293-f细胞(目录号11625-019)从invitrogen(carlsbad,calif.)获得。在一些实施方案中,哺乳动物细胞是细胞,其是一种源于视网膜的人细胞系。细胞可从crucell(leiden,the netherlands)获得。在其它实施方案中,哺乳动物细胞是中国仓鼠卵巢(cho)细胞。cho细胞可从美国典型培养物保藏中心(manassas,va.)获得(例如cho-k1;ccl-61)。在其它实施方案中,哺乳动物细胞是幼小仓鼠肾(bhk)细胞。bhk细胞可从美国典型培养物保藏中心(manassas,va.)获得(例如crl-1632)。在一些实施方案中,哺乳动物细胞是hkb11细胞,其是hek293细胞与人b细胞系的杂交细胞系。mei等,mol.biotechnol.34(2):165-78(2006)。
[0444]
在一个实施方案中,将包括fviii(x2)-fc融合物编码序列、vwf蛋白-l1-x1-l2-fc编码序列或两者和可选择标记(例如博莱霉素(zeocin)抗性)的质粒转染至hek 293细胞中以产生嵌合蛋白。
[0445]
在另一实施方案中,将包括fviii-fc融合物编码序列、vwf蛋白-l1-x-l2-fc编码序列或两者和可选择标记(例如博莱霉素(zeocin)抗性)的质粒转染至hek 293细胞中以产生嵌合蛋白。
bioreactor)和其它系统。
[0453]
也选择细胞培养条件以允许vwf片段与fviii蛋白缔合。允许表达vwf片段和/或fviii蛋白的条件可包括存在维生素k来源。举例来说,在一个实施方案中,在补充有4mm谷氨酰胺的cd293培养基(invitrogen,carlsbad,ca)或opticho培养基(invitrogen,carlsbad,ca)中培养稳定转染的hek 293细胞。
[0454]
在一个方面,本发明涉及一种表达、制备或产生本发明的嵌合蛋白的方法,其包括a)转染包含编码所述嵌合蛋白的多核苷酸的宿主细胞以及b)在适于表达所述嵌合蛋白的条件下在培养基中培养所述宿主细胞,其中所述嵌合蛋白得以表达。
[0455]
在其它实施方案中,含有连接于第一ig恒定区或其一部分的fviii蛋白和/或通过xten序列融合于第二ig恒定区或其一部分的vwf蛋白的蛋白质产物被分泌至培养基中。使培养基与细胞分离,浓缩,过滤,接着穿过两个或三个亲和柱,例如蛋白质a柱和一个或两个阴离子交换柱。
[0456]
在某些方面,本发明涉及通过本文所述的方法产生的嵌合蛋白。
[0457]
体外生产允许按比例扩大以产生本发明的大量所需改变多肽。用于在组织培养条件下进行哺乳动物细胞培养的技术在本领域中是已知的,并且包括例如在气升反应器中或在连续搅拌器反应器中进行均质悬浮培养,或例如在中空纤维、微囊中、在琼脂糖微珠粒或陶瓷柱筒上进行固定或包埋细胞培养。必要和/或需要时,多肽的溶液可通过惯用色谱方法纯化,所述方法例如凝胶过滤、离子交换色谱法、疏水性相互作用色谱法(hic、经deae-纤维素的色谱法或亲和色谱法。
[0458]
iv.药物组合物
[0459]
含有本发明的嵌合蛋白的组合物可含有适合药学上可接受的载体。举例来说,它们可含有有助于将活性化合物加工成被设计用于递送至作用部位的制剂的赋形剂和/或助剂。
[0460]
药物组合物可被配制以用于通过快速浓注进行胃肠外施用(即静脉内、皮下或肌肉内)。注射用制剂可以例如于安瓿中或于多剂量容器中的添加有防腐剂的单位剂型提供。组合物可采用诸如于油性或水性媒介物中的混悬液、溶液或乳液的形式,并且可含有配制剂,诸如混悬剂、稳定剂和/或分散剂。或者,活性成分可呈用于用适合媒介物(例如无热原水)复原的粉末形式。
[0461]
适于胃肠外施用的制剂也包括呈水溶性形式(例如水溶性盐)的活性化合物的水溶液。此外,可施用呈适当油性注射混悬液形式的活性化合物混悬液。适合亲脂性溶剂或媒介物包括脂肪油(例如芝麻油)或合成脂肪酸酯(例如油酸乙酯或甘油三酯)。水性注射混悬液可含有增加混悬液的粘度的物质,包括例如羧甲基纤维素钠、山梨糖醇和右旋糖苷。任选地,混悬液也可含有稳定剂。脂质体也可用于囊封本发明的分子以递送至细胞或间质间隙中。示例性药学上可接受的载体是生理可相容溶剂、分散介质、包衣剂、抗细菌剂和抗真菌剂、等张剂和吸收延迟剂、水、盐水、磷酸盐缓冲盐水、右旋糖、甘油、乙醇等。在一些实施方案中,组合物包含等张剂,例如糖、多元醇(诸如甘露糖醇、山梨糖醇)或氯化钠。在其它实施方案中,组合物包含增强活性成分的储存期限或有效性的药学上可接受的物质,诸如湿润剂或少量辅助物质,诸如湿润剂或乳化剂、防腐剂或缓冲剂。
[0462]
本发明的组合物可呈多种形式,包括例如液体(例如可注射和可输注溶液)、分散
液、混悬液、半固体和固体剂型。优选形式取决于施用模式和治疗应用。
[0463]
组合物可被配制成溶液、微乳液、分散液、脂质体或适于高药物浓度的其它有序结构。可通过将活性成分以所需量根据需要与以上列举的一种成分或成分的组合一起并入适当溶剂中,随后进行过滤灭菌来制备无菌可注射溶液。通常,通过将活性成分并入含有基本分散介质和来自以上列举的成分的所需其它成分的无菌媒介物中来制备分散液。在用于制备无菌可注射溶液的无菌粉末的情况下,优选制备方法是真空干燥和冷冻干燥,其产生活性成分外加来自先前无菌过滤溶液的任何另外所需成分的粉末。溶液的适当流动性可例如通过使用包衣剂(诸如卵磷脂(lecithin)),在分散液的情况下通过维持所需粒度以及通过使用表面活性剂加以维持。可注射组合物的延长吸收可通过在组合物中包括延迟吸收的试剂(例如单硬脂酸盐和明胶)来达成。
[0464]
活性成分可与控制释放制剂或装置一起配制。所述制剂和装置的实例包括植入物、经皮贴片和微囊封递送系统。可使用可生物降解的生物相容性聚合物,例如乙烯乙酸乙烯酯、聚酸酐、聚乙醇酸、胶原蛋白、聚原酸酯和聚乳酸。用于制备所述制剂和装置的方法在本领域中是已知的。参见例如sustained and controlled release drug delivery systems,j.r.robinson编,marcel dekker,inc.,new york,1978。
[0465]
可通过形成药物于诸如聚丙交酯-聚乙交酯的可生物降解的聚合物中的微囊封基质来制备可注射储槽制剂。视药物与聚合物的比率和所用聚合物的性质而定,可控制药物释放速率。其它示例性可生物降解的聚合物是聚原酸酯和聚酸酐。储槽可注射制剂也可通过将药物包埋在脂质体或微乳液中来制备。
[0466]
补充性活性化合物可并入组合物中。在一个实施方案中,本发明的嵌合蛋白与另一凝结因子或其变体、片段、类似物或衍生物一起配制。举例来说,凝结因子包括但不限于因子v、因子vii、因子viii、因子ix、因子x、因子xi、因子xii、因子xiii、凝血酶原、纤维蛋白原、范威尔邦德因子或重组可溶性组织因子(rstf)或任何前述各物的活化形式。止血剂的凝结因子也可包括抗纤维蛋白溶解药物,例如ε-氨基-己酸、氨甲环酸。
[0467]
可调整剂量方案以提供最优所需响应。举例来说,可施用单次大丸剂,可随时间施用若干分次剂量,或可如通过治疗情况的紧急性所指示,按比例降低或增加剂量。有利的是以剂量单位形式配制胃肠外组合物以易于施用和达成剂量均一性。参见例如remington'spharmaceutical sciences(mack pub.co.,easton,pa.1980)。
[0468]
除活性化合物之外,液体剂型也可含有惰性成分,诸如水、乙醇、碳酸乙酯、乙酸乙酯、苯甲醇、苯甲酸苄酯、丙二醇、1,3-丁二醇、二甲基甲酰胺、油、甘油、四氢呋喃甲醇、聚乙二醇和脱水山梨醇的脂肪酸酯。
[0469]
适合药物载体的非限制性实例也描述于由e.w.martin所著的remington's pharmaceutical sciences中。赋形剂的一些实例包括淀粉、葡萄糖、乳糖、蔗糖、明胶、麦芽、稻米、面粉、白垩、硅胶、硬脂酸钠、甘油单硬脂酸酯、滑石、氯化钠、脱脂乳粉、甘油、丙二醇、水、乙醇等。组合物也可含有ph缓冲试剂和湿润剂或乳化剂。
[0470]
对于口服施用,药物组合物可采用通过常规手段制备的片剂或胶囊形式。组合物也可制备成液体,例如糖浆或混悬液。液体可包括混悬剂(例如山梨糖醇糖浆、纤维素衍生物或氢化食用脂肪)、乳化剂(卵磷脂或阿拉伯胶(acacia))、非水性媒介物(例如杏仁油、油性酯、乙醇或分馏植物油)和防腐剂(例如对羟基苯甲酸甲酯或对羟基苯甲酸丙酯或山梨
酸)。制剂也可包括调味剂、着色剂和甜味剂。或者,组合物可以用于用水或另一适合媒介物复原的干燥产品形式提供。
[0471]
对于经颊施用,组合物可采用根据常规方案的片剂或糖锭形式。
[0472]
对于通过吸入施用,供根据本发明使用的化合物宜以有或无赋形剂的雾化气雾剂形式或以来自任选具有推进剂的加压包装或雾化器的气雾喷雾剂形式递送,所述推进剂例如是二氯二氟甲烷、三氯氟甲烷、二氯四氟甲烷、二氧化碳或其它适合气体。在加压气雾剂的情况下,剂量单位可通过提供用以递送计量数量的阀来确定。可配制用于吸入器或吹入器中的例如明胶的胶囊和药筒,其含有化合物与诸如乳糖或淀粉的适合粉末基质的粉末混合物。
[0473]
药物组合物也可以例如含有常规栓剂基质(诸如可可脂或其它甘油酯)的栓剂或滞留灌肠剂形式配制用于经直肠施用。
[0474]
在一个实施方案中,药物组合物包含嵌合蛋白、编码所述嵌合蛋白的多核苷酸、包含所述多核苷酸的载体或包含所述载体的宿主细胞以及药学上可接受的载体。相较于野生型fviii蛋白或无vwf片段的相应fviii蛋白,嵌合蛋白中的fviii蛋白具有延长的半衰期。在一个实施方案中,其中嵌合蛋白的半衰期比野生型fviii延长至少约1.5倍、至少约2倍、至少约2.5倍、至少约3倍、至少约4倍、至少约5倍、至少约6倍、至少约7倍、至少约8倍、至少约9倍、至少约10倍、至少约11倍或至少约12倍。在另一实施方案中,因子viii的半衰期是至少约17小时、至少约18小时、至少约19小时、至少约20小时、至少约21小时、至少约22小时、至少约23小时、至少约24小时、至少约25小时、至少约26小时、至少约27小时、至少约28小时、至少约29小时、至少约30小时、至少约31小时、至少约32小时、至少约33小时、至少约34小时、至少约35小时、至少约36小时、至少约48小时、至少约60小时、至少约72小时、至少约84小时、至少约96小时或至少约108小时。
[0475]
在一些实施方案中,通过选自由以下组成的组的途径施用组合物:局部施用、眼内施用、胃肠外施用、鞘内施用、硬膜下施用和口服施用。胃肠外施用可为静脉内或皮下施用。
[0476]
在其它实施方案中,组合物用于治疗有需要的受试者的流血疾病或病状。流血疾病或病状选自由以下组成的组:流血凝血病症、关节积血、肌肉流血、口腔流血、出血、向肌肉中出血、口腔出血、创伤、头创伤、胃肠流血、颅内出血、腹内出血、胸内出血、骨折、中枢神经系统流血、咽后隙中流血、腹膜后隙中流血、髂腰肌鞘中流血及其任何组合。在其它实施方案中,受试者预定经受手术。在其它实施方案中,治疗是防治性的或按需进行。
[0477]
v.基因疗法
[0478]
本发明的其嵌合蛋白可在例如人患者的哺乳动物中体内产生,使用用以治疗选自由以下组成的组的流血疾病或病症的基因疗法方法将是治疗有益的:流血凝血病症、关节积血、肌肉流血、口腔流血、出血、向肌肉中出血、口腔出血、创伤、头创伤、胃肠流血、颅内出血、腹内出血、胸内出血、骨折、中枢神经系统流血、咽后隙中流血、腹膜后隙中流血和髂腰肌鞘中流血。在一个实施方案中,流血疾病或病症是血友病。在另一实施方案中,流血疾病或病症是甲型血友病。这涉及施用可操作地连接于适合表达控制序列的适合嵌合蛋白编码核酸。在某一实施方案中,这些序列并入病毒载体中。适用于所述基因疗法的病毒载体包括腺病毒载体、慢病毒载体、杆状病毒载体、艾伯斯坦巴尔病毒载体、乳多泡病毒载体(papovaviral vector)、痘苗病毒载体、单纯性疱疹病毒载体和腺相关病毒(aav)载体。病
毒载体可为复制缺陷性病毒载体。在其它实施方案中,腺病毒载体在它的e1基因或e3基因中具有缺失。当使用腺病毒载体时,哺乳动物可不暴露于编码可选择标记基因的核酸。在其它实施方案中,将序列并入本领域技术人员已知的非病毒载体中。
[0479]
vi.使用嵌合蛋白的方法
[0480]
本发明涉及一种使用本文所述的嵌合蛋白来防止或抑制内源性vwf结合fviii蛋白的方法。本发明也涉及一种使用具有连接于xten和ig恒定区或其一部分的fviii蛋白的嵌合蛋白的方法。
[0481]
本发明的一个方面涉及通过阻断或遮蔽fviii上的vwf结合位点免遭内源性vwf来防止或抑制fviii与内源性vwf相互作用,以及同时使用与也可为半衰期延长物的ig恒定区或其一部分组合的xten序列来延长嵌合蛋白的半衰期。在一个实施方案中,本发明涉及一种构建半衰期长于野生型fviii的fviii蛋白的方法。适用于方法中的嵌合蛋白包括本文所述的任何一种或多种嵌合蛋白。
[0482]
本发明的另一方面包括一种向有需要的受试者施用包含半衰期长于野生型fviii的fviii蛋白的嵌合蛋白的方法,其中所述方法包括向所述受试者施用本文所述的嵌合蛋白。
[0483]
在一个实施方案中,本发明涉及一种使用xten序列和ig恒定区或其一部分来改进包含fviii蛋白和vwf蛋白的嵌合蛋白的半衰期的方法,其防止或抑制内源性vwf与fviii蛋白相互作用。连接于xten序列(例如fviii(x)),接着与融合于xten和ig恒定区或其一部分的vwf蛋白结合或缔合的fviii蛋白被遮蔽或保护免遭vwf的清除路径,并且因此相较于未结合于vwf蛋白的fviii蛋白,清除率降低。因此,相较于未与xten序列和vwf蛋白结合或缔合的fviii蛋白,遮蔽的fviii蛋白的半衰期得以最大延长。在某些实施方案中,与vwf蛋白缔合或由vwf蛋白保护,并且连接于xten序列的fviii蛋白不由vwf清除受体清除。在其它实施方案中,与vwf蛋白缔合或由vwf蛋白保护,并且连接于xten序列的fviii蛋白从系统被清除慢于未与vwf蛋白缔合或由vwf蛋白保护,并且连接于xten序列的fviii蛋白。
[0484]
在一个方面,包含连接于xten序列的fviii蛋白或与连接于xten的vwf蛋白结合或缔合的fviii蛋白的嵌合蛋白从循环的清除率降低,因为vwf蛋白不含有vwf清除受体结合位点。vwf蛋白防止或抑制与vwf蛋白结合或缔合的fviii通过vwf清除路径从系统清除。适用于本发明的vwf蛋白也可提供至少一种或多种由内源性vwf提供的vwf样fviii保护性质。在某些实施方案中,vwf蛋白或xten序列也可掩蔽一个或多个fviii清除受体结合位点,由此防止fviii通过它自身的清除路径清除。
[0485]
在一些实施方案中,由vwf蛋白或xten序列防止或抑制fviii蛋白结合内源性vwf可发生在体外或体内。
[0486]
也提供一种增加嵌合蛋白的半衰期的方法,其包括向有需要的受试者施用本文所述的嵌合蛋白。与全长vwf结合或缔合的非活化fviii在血浆中的半衰期是约12至14小时。其中在循环中几乎不存在vwf的3型vwd中,fviii的半衰期仅为约六小时,从而由于fviii浓度降低而在所述患者中产生轻度至中度甲型血友病的症状。本发明的与vwf片段或xten序列连接或缔合的嵌合蛋白的半衰期可比与全长vwf结合或缔合的非活化fviii的半衰期增加高至少约1.5倍、1.6倍、1.7倍、1.8倍、1.9倍、2.0倍、2.1倍、2.2倍、2.3倍、2.4倍、2.6倍、2.7.倍、2.8倍、2.9倍、3.0倍、3.1倍、3.2倍、3.3倍、3.4倍、3.5倍、3.6倍、3.7倍、3.8倍、3.9
倍或4.0倍。
[0487]
在一个实施方案中,包含第一多肽(其包含fviii蛋白和第一ig恒定区或其一部分)和第二多肽(其包含vwf蛋白、具有小于288个氨基酸的xten以及ig恒定区或其一部分)的嵌合蛋白展现的半衰期比包含相同第一多肽和无所述xten序列的第二多肽的相应嵌合蛋白或野生型fviii高至少约2倍、2.5倍、3.0倍、3.5倍、4.0倍、4.5倍、5.0倍、5.5倍、6.0倍、7倍、8倍、9倍或10倍。在另一实施方案中,包含第一多肽(其包含fviii蛋白和第一ig恒定区或其一部分)和第二多肽(其包含vwf蛋白、具有小于288个氨基酸的xten以及ig恒定区或其一部分)的嵌合蛋白展现的半衰期比包含相同第一多肽和无所述xten序列的第二多肽的相应嵌合蛋白或野生型fviii高约2至约5倍、约3至约10倍、约5至约15倍、约10至约20倍、约15至约25倍、约20至约30倍、约25至约35倍、约30至约40倍、约35至约45倍。在特定实施方案中,在fviii和vwf双重敲除小鼠中,本发明的嵌合蛋白的半衰期比野生型fviii的半衰期增加高至少约30、31、32、33、34、35、36、37、38、39或40倍。
[0488]
在某些实施方案中,嵌合蛋白在小鼠中展现约40小时的半衰期。
[0489]
在一些实施方案中,嵌合蛋白的半衰期长于与内源性vwf缔合的fviii的半衰期。在其它实施方案中,嵌合蛋白的半衰期是野生型fviii或与内源性vwf缔合的fviii蛋白的半衰期的至少约1.5倍、2倍、2.5倍、3.5倍、3.6倍、3.7倍、3.8倍、3.9倍、4.0倍、4.5倍或5.0倍。
[0490]
在一些实施方案中,作为本发明的结果,相较于无vwf蛋白的fviii蛋白或野生型fviii,嵌合蛋白的半衰期得以延长。本发明的嵌合蛋白的半衰期比无vwf蛋白的嵌合蛋白或野生型fviii的半衰期长至少约1.5倍、至少约2倍、至少约2.5倍、至少约3倍、至少约4倍、至少约5倍、至少约6倍、至少约7倍、至少约8倍、至少约9倍、至少约10倍、至少约11倍或至少约12倍。在一个实施方案中,fviii的半衰期比野生型fviii的半衰期长约1.5倍至约20倍、约1.5倍至约15倍、或约1.5倍至约10倍。在另一实施方案中,相较于野生型fviii或无vwf蛋白的fviii蛋白,fviii的半衰期延长约2倍至约10倍、约2倍至约9倍、约2倍至约8倍、约2倍至约7倍、约2倍至约6倍、约2倍至约5倍、约2倍至约4倍、约2倍至约3倍、约2.5倍至约10倍、约2.5倍至约9倍、约2.5倍至约8倍、约2.5倍至约7倍、约2.5倍至约6倍、约2.5倍至约5倍、约2.5倍至约4倍、约2.5倍至约3倍、约3倍至约10倍、约3倍至约9倍、约3倍至约8倍、约3倍至约7倍、约3倍至约6倍、约3倍至约5倍、约3倍至约4倍、约4倍至约6倍、约5倍至约7倍、或约6倍至约8倍。在其它实施方案中,本发明的嵌合蛋白的半衰期是至少约17小时、至少约18小时、至少约19小时、至少约20小时、至少约21小时、至少约22小时、至少约23小时、至少约24小时、至少约25小时、至少约26小时、至少约27小时、至少约28小时、至少约29小时、至少约30小时、至少约31小时、至少约32小时、至少约33小时、至少约34小时、至少约35小时、至少约36小时、至少约40小时、至少约48小时、至少约60小时、至少约72小时、至少约84小时、至少约96小时或至少约108小时。在其它实施方案中,本发明的嵌合蛋白的半衰期是约15小时至约两周、约16小时至约一周、约17小时至约一周、约18小时至约一周、约19小时至约一周、约20小时至约一周、约21小时至约一周、约22小时至约一周、约23小时至约一周、约24小时至约一周、约36小时至约一周、约48小时至约一周、约60小时至约一周、约24小时至约六天、约24小时至约五天、约24小时至约四天、约24小时至约三天或约24小时至约两天。
[0491]
在一些实施方案中,本发明的嵌合蛋白根据受试者的平均半衰期是约15小时、约
16小时、约17小时、约18小时、约19小时、约20小时、约21小时、约22小时、约23小时、约24小时(1天)、约25小时、约26小时、约27小时、约28小时、约29小时、约30小时、约31小时、约32小时、约33小时、约34小时、约35小时、约36小时、约40小时、约44小时、约48小时(2天)、约54小时、约60小时、约72小时(3天)、约84小时、约96小时(4天)、约108小时、约120小时(5天)、约六天、约七天(一周)、约八天、约九天、约10天、约11天、约12天、约13天或约14天。
[0492]
此外,本发明提供一种治疗或预防流血疾病或病症的方法,其包括施用有效量的嵌合蛋白。在一个实施方案中,流血疾病或病症选自由以下组成的组:流血凝血病症、关节积血、肌肉流血、口腔流血、出血、向肌肉中出血、口腔出血、创伤、头创伤、胃肠流血、颅内出血、腹内出血、胸内出血、骨折、中枢神经系统流血、咽后隙中流血、腹膜后隙中流血和髂腰肌鞘中流血。在特定实施方案中,流血疾病或病症是甲型血友病。
[0493]
通过本发明制备的包含与本文所述的vwf蛋白(其防止或抑制fviii蛋白与内源性vwf相互作用)组合的xten序列和ig恒定区或其一部分的嵌合蛋白具有如将由本领域技术人员认识到的许多用途,包括但不限于治疗患有止血病症的受试者的方法和治疗需要一般性止血剂的受试者的方法。在一个实施方案中,本发明涉及一种治疗患有止血病症的受试者的方法,其包括施用治疗有效量的嵌合蛋白。
[0494]
嵌合蛋白中的fviii蛋白部分通过在带负电荷磷脂表面上充当因子ix的辅因子,由此形成x酶复合物来治疗或预防止血病症。活化凝血因子结合磷脂表面使这个过程定位于血管损害部位。在磷脂表面上,因子viiia使由因子ixa达成的因子x活化的最大速度增加约200,000倍,从而导致凝血酶产生的大规模瞬间爆发。
[0495]
本发明的嵌合蛋白可用于治疗任何止血病症。可通过施用本发明的嵌合蛋白治疗的止血病症包括但不限于甲型血友病以及与因子viii相关的缺乏症或结构异常。在一个实施方案中,止血病症是甲型血友病。
[0496]
本发明的嵌合蛋白可防治性用于治疗患有止血病症的受试者。本发明的嵌合蛋白可用于治疗患有止血病症的受试者的急性流血发作。在另一实施方案中,止血病症可为缺陷性凝结因子,例如范威尔邦德氏因子的结果。在一个实施方案中,止血病症是遗传病症。在另一实施方案中,止血病症是获得性病症。获得性病症可由潜伏继发性疾病或病状所致。无关病状可为例如但不限于癌症、自体免疫疾病或妊娠。获得性病症可由老龄或用以治疗潜伏继发性病症的药物治疗(例如癌症化学疗法)所致。
[0497]
本发明也涉及治疗不患有先天性止血病症,但患有导致获得止血病症(例如由于产生抗fviii抗体或手术)的继发性疾病或病状的受试者的方法。因此,本发明涉及一种治疗需要一般性止血剂的受试者的方法,其包括施用治疗有效量的通过本发明方法制备的嵌合蛋白。
[0498]
本发明也涉及降低fviii的免疫原性或诱导针对fviii的较小免疫原性的方法,其包括施用有效量的本文所述的嵌合蛋白或其编码多核苷酸。
[0499]
在一个实施方案中,需要一般性止血剂的受试者正经受或即将经受手术。本发明的嵌合蛋白可在手术之前、期间或之后作为防治性方案加以施用。本发明的嵌合蛋白可在手术之前、期间或之后施用以控制急性流血发作。
[0500]
本发明的嵌合蛋白可用于治疗具有急性流血发作,未患有止血病症的受试者。急性流血发作可由严重创伤,例如手术、车祸、伤口、枪射击裂伤或导致流血不受控制的任何
其它创伤事件所致。流血发作的非限制性实例包括流血凝血病症、关节积血、肌肉流血、口腔流血、出血、向肌肉中出血、口腔出血、创伤、头创伤、胃肠流血、颅内出血、腹内出血、胸内出血、骨折、中枢神经系统流血、咽后隙中流血、腹膜后隙中流血、髂腰肌鞘中流血及其任何组合。
[0501]
在防治性应用中,向尚未处于疾病状态中的患者施用一种或多种含有本发明的嵌合蛋白或其混合物的组合物以增强所述患者的抗性或减轻与疾病或病症相关的症状。这种量定义为“防治有效剂量”。在治疗性应用中,有时需要在相对较短间隔下的相对较高剂量(例如每剂约1至400mg/kg的多肽,其中5至25mg的剂量更通常用于放射免疫缀合物,并且更高剂量用于细胞毒素药物修饰的多肽)直至疾病进展降低或终止,以及直至患者显示部分或完全疾病症状改善。此后,可向患者施用防治性方案。
[0502]
在一些实施方案中,本发明的嵌合蛋白或组合物用于按需治疗,其包括治疗流血发作、关节积血、肌肉流血、口腔流血、出血、向肌肉中出血、口腔出血、创伤、头创伤(头部创伤)、胃肠流血、颅内出血、腹内出血、胸内出血、骨折、中枢神经系统流血、咽后隙中流血、腹膜后隙中流血或髂腰肌鞘中流血。受试者可需要手术防治、围手术期管理或手术治疗。所述手术包括例如小手术、大手术、拔牙、扁桃体切除术、腹链沟疝切开术、滑膜切除术、全部膝盖置换、开颅术、骨缝合术、创伤手术、颅内手术、腹内手术、胸内手术或关节置换手术。
[0503]
在一个实施方案中,本发明的嵌合蛋白是静脉内、皮下、肌肉内施用或通过任何粘膜表面施用,例如口服、舌下、经颊、经鼻、经直肠、经阴道或通过肺途径施用。本发明的包含vwf片段和fviii蛋白的嵌合蛋白可植入在允许嵌合蛋白缓慢释放至流血部位的生物聚合物固体载体内或连接于所述生物聚合物固体载体,或植入绷带/敷料中。嵌合蛋白的剂量将视受试者和所用特定施用途径而变化。剂量可在0.1至100,000μg/kg体重的范围内。在一个实施方案中,剂量范围是0.1-1,000μg/kg。在另一实施方案中,剂量范围是0.1-500μg/kg。可连续或在特定时间间隔下施用蛋白质。可采用体外测定来确定最优剂量范围和/或施用时程。测量凝结因子活性的体外测定在本领域中是已知的,例如sta-clot viia-rtf凝结测定或rotem凝结测定。另外,可从由动物模型(例如血友病狗)获得的剂量-响应曲线外推有效剂量(mount等2002,blood 99(8):2670)。
[0504]
现已详细描述本发明,通过参照以下实施例将更明确了解本发明,所述实施例仅出于说明目的包括于此,并且不意图限制本发明。本文提及的所有专利、公布和文章都以引用的方式明确和特定并入本文。
实施例
[0505]
除非另外陈述,否则在整篇实施例中,使用以下材料和方法。
[0506]
材料和方法
[0507]
一般来说,除非另外指示,否则本发明的实施采用常规化学技术、生物物理学技术、分子生物学技术、重组dna技术、免疫学技术(尤其例如抗体技术)和标准电泳技术。参见例如sambrook,fritsch和maniatis,molecular cloning:cold spring harbor laboratory press(1989);antibody engineering protocols(methods in molecular biology),510,paul,s.,humana pr(1996);antibody engineering:a practical approach(practical approach series,169),mccafferty编,irl pr(1996);antibodies:
alaboratory manual,harlow等,cs.h.l.press,pub.(1999);以及current protocols in molecular biology,ausubel等编,john wiley&sons(1992)。
[0508]
实施例1:fviii-xten-fc/d’d3-xten-fc异二聚体
[0509]
本发明涉及产生一种通过igg的fc结构域偶联于范威尔邦德因子(vwf)蛋白的d’d3结构域的嵌合fviii分子。连接的d’d3结构域防止fviii与内源性vwf多聚体相互作用。这个分子充当合并其它半衰期延长技术以改进嵌合蛋白的药物动力学的平台。xten序列被并入fviii b结构域中以及d’d3与fc区之间以增加fviii/vwf异二聚体的半衰期。
[0510]
d’d3与fc之间的凝血酶裂解位点允许在由凝血酶活化fviii分子后释放d’d3结构域。
[0511]
实施例2:fviii-xten-fc/d’d3-fc异二聚体的质粒构建
[0512]
克隆vwf050-含ihh三重突变的vwf031
[0513]
fc中的ihh三重突变防止与fcrn相互作用,因此不存在通过fcrn路径使含有fc的分子再循环。fc中的3个突变是i253a、h310a、h435a。
[0514]
通过在rsrii限制位点与not 1限制位点之间用含有ihh三重突变的fc片段交换vwf031质粒的fc区来产生vwf050。
[0515]
克隆vwf057-克隆具有144ae xten+35aa凝血酶可裂解接头的vwf-fc。
[0516]
寡聚物
[0517]
esc 155-针对vwf034中的144ae xten的寡聚物-反向
[0518]
ccccgccaccggatcccccgccaccggatcccccgccaccggatcccccgccaccggaacctccaccgccgctcgaggcaccttcttcagtgctggtgggcgagcccgctggtgacccttcctc
[0519]
esc 156-针对vwf034中的144ae xten-gs接头的寡聚物-反向
[0520]
ggggaagaggaagactgacggtccgcccaggagttctggagctgggcacggtgggcatgtgtgagttttgtcgcctccgctgccccgggggaccagggatcccccgccaccggatcccccgccaccggatcccccgccaccggatcccccgcc
[0521]
esc 157-针对vwf031中的144ae xten的寡聚物-正向
[0522]
gtgaagcctgccaggagccgatatcgggcgcgccaacatcagagagcgccacccctgaaagtggtcccgggagcgagccagc
[0523]
进行两次pcr以获得144ae-xten+具有凝血酶裂解位点的35aa gs接头。
[0524]
使用作为模板的144-ae xten编码dna以及esc 157/esc 155引物对进行第一pcr反应。由这个反应获得的约550bp长的pcr产物用作第二pcr反应的模板,并且使用esc 157/156引物对加以扩增。这个反应产生约700bp长的产物。接着用ecorv-hf和rsrii消化这个700bp pcr产物和vwf034质粒。消化质粒骨架。
[0525]
接着使用vwf034连接700bp pcr产物。
[0526]
克隆vwf058-vwf034中的ihh三重突变
[0527]
fc中的ihh三重突变防止与fcrn相互作用,因此不存在通过fcrn路径使含有fc的分子再循环。fc中的3个突变是i253a、h310a、h435a。
[0528]
通过在rsrii限制位点与not 1限制位点之间用含有ihh三重突变的fc片段交换vwf034质粒的fc区来产生vwf058。
[0529]
克隆fviii-263-具有ihh三重突变的fviii 205
[0530]
fc中的ihh三重突变防止与fcrn相互作用,因此不存在通过fcrn路径使含有fc的分子再循环。fc中的3个突变是i253a、h310a、h435a。
[0531]
通过在rsrii限制位点与not 1限制位点之间用含有ihh三重突变的fc片段交换fviii 205质粒的fc区来产生fviii-263。
[0532]
克隆fviii-282-在b结构域中具有144ae xten的fviii-fc
[0533]
esc 158-针对b结构域中的144ae xten的寡聚物-正向
[0534]
aagaagcttctctcaaaacggcgcgccaacatcagagagcgccacccctgaaagtggtcccgggagcgagccagccacatctgggtcggaaacgccaggc
[0535]
esc 159-针对b结构域中的144ae xten的寡聚物-反向
[0536]
ggtatcatcataatcgatttcctcttgatctgactgaagagtagtacgagttatttcagcttgatggcgtttcaagactggtgggctcgaggcaccttcttcagtgctggtgggcgagcccgctggtgacccttcctcagtggacgtagg
[0537]
使用作为模板的144-ae xten编码dna以及esc 158/esc 159引物对进行第一pcr反应。接着用asci和clal消化由这个反应获得的约550bp长的pcr产物和fviii 169质粒。由消化的fviii 169获得的质粒骨架接着用于连接550bp pcr产物以获得fviii 282。
[0538]
克隆fviii-283-具有ihh三重突变的fviii 169
[0539]
fc中的ihh三重突变防止与fcrn相互作用,因此不存在通过fcrn路径使含有fc的分子再循环。fc中的3个突变是i253a、h310a、h435a。
[0540]
通过在rsrii限制位点与not 1限制位点之间用含有ihh三重突变的fc片段交换fviii 169质粒的fc区来产生fviii-283。
[0541]
实施例3:在hek293细胞中产生fviii-xten-fc/d’d3-xten-fc
[0542]
图2.显示fviii-xten-fc/d’d3-xten-fc构建体的表达的示意图。使用聚乙烯亚胺(pei)在hek293细胞中进行三质粒共转染。第一质粒获得fviii-xten-fc的表达,第二质粒表达d1d2d’d3-xten-fc,并且第三质粒表达pace/弗林蛋白酶,其为从d1d2d’d3-xten-fc酶促移除原肽(即d1d2结构域)所需。这个三质粒表达系统的产物包括fviii-xten-fc/d’d3-xten-fc异二聚体、d’d3-xten-fc同二聚体和微量fviii-xten-fc半合子样貌物质。
[0543]
实施例4:纯化fviii-xten-fc/d’d3-xten-fc异二聚体
[0544]
为纯化fviii-xten-fc/d’d3-xten-fc异二聚体,切向流过滤(tff)步骤用于使条件培养基首先浓缩10倍。接着依次使用亲和色谱法和脱盐柱来进一步纯化滤液中的产物。根据hplc-sec,分子的纯度是可接受的,并且通过蛋白质印迹加以进一步确认。分子的比活性与b结构域缺失的fviii类似,如通过fviii活性测定(实施例5)和od280测量所测量。
[0545]
实施例5:fviii-xten-fc/d'd3-xten-fc异二聚体的比活性
[0546]
通过fviii显色测定和活化部分凝血激素时间(aptt)测定来测量fviii-xten-fc/d’d3-xten-fc异二聚体的活性。sq bdd-fviii、rfviii169/vwf034和rfviii169/vwf057的比显色活性和比aptt活性列于表16中。相较于sq bdd-fviii,对于rfviii169/vwf034和rfviii169/vwf057,我们已观察到类似比显色活性以及比aptt活性降低60%。
[0547]
表16:异二聚体变体的比活性
[0548][0549]
fviii显色测定
[0550]
使用来自diapharma的coatest sp fviii试剂盒(产品号:k824086)测量fviii活性,并且所有孵育都在振荡下在37℃板加热器上进行。
[0551]
凝血因子viii:c的who第8国际标准物(浓缩物,代号07/350)用作测定标准物,所述标准物的范围是100miu/ml至0.78miu/ml。一式两份添加汇合的正常人血浆测定对照和测试样品(用1x coatest缓冲液稀释)至immulon 2hb 96孔板中(25μl/孔)。依序添加新鲜制备的ixa/fx/磷脂混合物(50μl)、25μl 25mm cacl2和50μl fxa底物至各孔中,其中在各次添加之间孵育5分钟。在与底物一起孵育之后,添加25μl 20%乙酸以终止显色反应,并且用spectramax plus(molecular devices)仪器测量od405的吸光度。用softmax pro软件(5.2版)分析数据。最低定量水平(lloq)是7.8miu/ml。
[0552]
fviii aptt测定
[0553]
如下在sysmex ca-1500凝血分析器上进行fviii aptt测定:首先,通过仪器添加50ul含手动稀释的样品、标准物和对照的aptt缓冲液(50mm tris、100mm nacl、1% hsa,ph 7.4)至反应杯中,随后添加50ul缺乏fviii的血浆(george king bio-medical,产品号:0800)。在37℃下孵育1分钟之后,添加50ul aptt试剂(fsl活化脑透明质试剂-dade behring,参考号b4219-2)至反应混合物中,并且在37℃下孵育4分钟。随后,添加50ul 20mm cacl2(dade behring,参考号orfo37),并且将反应杯立刻转移至四个分光光度计通道位置中的一个中以测量混合物中折射光的量,其通过仪器的软件算法被转换成凝结的发生。报道的凝结时间是从添加cacl2开始直至发生凝块形成的时长。通过以100miu/ml至0.78miu/ml的范围将who第8国际fviii标准物稀释于aptt缓冲液中来产生测定标准物。在ms excel中将标准曲线绘制为作为y轴的凝结时间(以秒计)相对于作为x轴的fviii活性对数(以10为底)(miu/ml),并且使用针对这个标准曲线的线性回归线的公式计算个别样品的活性。基于测定性能,量化下限(lloq)是7.8miu/ml。
[0554]
实施例6:xten插入物对异二聚体的半衰期延长的累加作用
[0555]
将xten插入物并入异二聚体中以达成半衰期延长。在fviii b结构域处插入单一288氨基酸(aa)ae-xten导致异二聚体在hema小鼠中的半衰期是16.7小时,如图3中通过rfviii169/vwf031所证明。为进一步改进异二聚体的半衰期,将长度是144aa或288aa的第二xten插入物分别在fviii a1结构域中或紧靠d’d3片段的下游并入fviii169/vwf031中,异二聚体变体被命名为fviii205/vwf031和fviii169/vwf034。
[0556]
通过在200iu/kg剂量下单次静脉内施用测试分子来在缺乏fviii的(hema)小鼠中评估rfviii169/vwf031、rfviii205/vwf031和rfviii169/vwf034的半衰期。在如图3中指示的指定时间点收集血浆样品,通过fviii显色测定来测定样品的fviii活性,使用winnonlin-phoenix程序计算pk参数并列于表17中。
[0557]
如图3和表17中所示,在fviii的a1结构域处或在d’d3的下游添加第二xten插入物分别进一步改进异二聚体的半衰期至29.45或31.10。此外,也由于两种xten插入物而观察到清除率和auc改进大于2倍。
[0558]
表17:异二聚体在hema小鼠中的pk参数
[0559][0560]
实施例7:当插入在d’d3与fc结构域之间时,144aa ae-xten比288aa ae-xten赋予更佳半衰期益处。
[0561]
构建另一异二聚体-fviii169/vwf057以试图鉴定xten插入物在d’d3-xten-fc链内的最优长度,其中使xten插入物的长度从288aa降低至144aa。如图4中所示,相较于rfviii169/vwf034,rfviii169/vwf057的半衰期从31小时增加至42小时。也观察到rfviii169/vwf057的清除率和auc改进,数据列于表18中。因此,当插入在fviii-xten-fc/d’d3-xten-fc异二聚体的d’d3与fc结构域之间时,144aa ae-xten插入物比ae-288aa xten更优。
[0562]
表18:rfviii169/vwf034和rfviii169/vwf057在hema小鼠中的pk参数
[0563][0564][0565]
实施例8:fc结构域延长异二聚体的半衰期
[0566]
fc结构域通过fcrn介导的再循环路径来延长它的融合蛋白的半衰期。为确认fc结构域对异二聚体的半衰期延长的必要性,用三重突变体(i253a/h310a/h435a;ihh)置换rfviii205/vwf031中的野生型fc结构域以形成rfviii263/vwf050,并且通过表面等离子体共振(biacore)测定确认rfviii263/vwf050的fcrn结合被完全消除。相较于rfviii205/vwf031在hema小鼠中评估fviii263/vwf050的半衰期。观察到rfviii263/vwf050的清除率增加以及半衰期和auc降低,如图5和表19中所示。这个结果证明除确保fviii和d’d3共价结合之外,fc结构域也为异二聚体的半衰期改进所必需。
[0567]
表19:rfviii205/vwf031和rfviii263/vwf040在hema小鼠中的pk参数
[0568][0569]
实施例9:fviii-xten-fc/d’d3-xten-fc异二聚体在hema小鼠尾部钳夹流血模型中的急性功效
[0570]
使用hema小鼠尾部钳夹流血模型评估先导异二聚体候选物的急性功效。
[0571]
将8-12周龄雄性hema小鼠随机分入4个治疗组中,并且分别以单次静脉内施用sq bdd-fviii、rfviii169/vwf034、rfviii169/vwf057或媒介物溶液治疗。为模拟fviii的阵发性治疗(以恢复正常fviii血浆水平的50-100%),所选fviii治疗剂量是如通过fviii aptt活性衡量的75iu/kg。在这个剂量水平下,所有测试fviii变体都将在给药后5分钟恢复正常鼠类血浆fviii活性的约70%。
[0572]
将研究中各个别动物的失血体积绘制于图6中。相较于媒介物治疗的动物,观察到所有fviii治疗组的失血体积都显著降低。在三个fviii治疗组内,未发现失血降低有统计显著差异,从而表明异二聚体分子关于按需治疗可潜在地与sq bdd-fviii同样有效。
[0573]
将研究中各个别动物的失血体积绘制于图6中。相较于媒介物治疗的动物,观察到所有fviii治疗组的失血体积都显著降低。在三个fviii治疗组内,未发现失血降低有统计显著差异,从而表明异二聚体分子关于按需治疗可潜在地与sq bdd-fviii同样有效。
[0574]
此外,用较低剂量(37.5iu/kg)的rbdd-fviii或rfviii169/vwf 034治疗hema小鼠,并且结果显示于图6小图b中。与75iu/kg剂量相同,在尾部钳夹损伤后,rfviii169/vwf034对hema小鼠提供与bdd-fviii类似的保护,从而指示所述分子在约35%的正常鼠类循环fviii水平下仍然有效治疗hema小鼠的严重流血发作。
[0575]
如下进行尾部钳夹程序。简要来说,在尾部损伤之前用50mg/kg氯胺酮(ketamine)/0.5mg/kg右旋美托咪啶(dexmedetomidine)混合物使小鼠麻醉,并且放置在37℃加热板上以帮助维持体温。接着使小鼠的尾部在37℃盐水中浸渍10分钟以扩张侧静脉。在静脉扩张之后,通过尾部静脉注射fviii变体或媒介物溶液,并且接着在给药后5分钟使用直边11号解剖刀切断远端5mm尾部。持续30分钟将流出的血液收集至13ml 37℃盐水中,并且通过血液收集管的重量变化来测定失血体积:失血体积=(收集管结束重量-开始重量+0.10)ml。使用t检验(曼惠特尼检验(mann whitney test))和单因素anova(克鲁斯凯-沃利斯检验(kruskal-wallis test),事后检验:邓氏多重比较检验(dunns multiple comparison test))进行统计分析。
[0576]
实施例10:fviii-xten-fc/d’d3-xten-fc异二聚体在hema小鼠尾部静脉横切流血模型中的防治性功效
[0577]
在hema小鼠尾部静脉横切(tvt)模型中测试fviii169/vwf057的防治性功效。tvt模型通过将损伤引入小鼠尾部的侧静脉中来诱发流血,此模拟患有血友病流血病症的患者的自发性流血发作。
[0578]
将8-10周龄雄性hema小鼠随机分入四个治疗组中,并且在尾部静脉损伤之前72小时用fviii169/vwf057治疗,或在损伤之前24小时或48小时用sq bdd-fviii治疗。媒介物治疗的动物用作阴性对照。将损伤后24小时内的再流血或归因于过度失血的安乐死的事件绘制于图7中。
[0579]
如图7中所示,不同于在tvt之前48小时用sq bdd-fviii治疗的小鼠(其中在损伤后观察到仅仅有限保护),相较于在tvt之前24小时接受sq bdd-fviii治疗的小鼠,在尾部损伤之前72小时接受rfviii169/vwf057的小鼠具有关于再流血和存活的类似保护,从而指示在tvt模型中,rfviii169/vwf057可对hema小鼠提供长久至少3倍或更多倍(例如4倍)的保护。因此,rfviii169/vwf057可能显著降低当前fviii防治的治疗频率。
[0580]
类似地,在尾部静脉损伤之前24或96小时用fviii-xten-fc/d’d3-xten-fc异二聚体:rfviii169/vwf034和rfviii169/vwf057治疗hema小鼠。将治疗的再流血和存活数据与通过rbdd-fviii(在损伤之前24或48小时)和媒介物获得的数据进行比较。尽管在尾部静脉损伤之前24小时用rbdd-fviii治疗的小鼠的再流血类似于用媒介物治疗的小鼠,但在损伤之前24小时用异二聚体治疗的小鼠的再流血数据显著好于媒介物治疗组。此外,在损伤之前96小时用异二聚体治疗的小鼠的再流血数据与在损伤之前24小时接受rbdd-fviii的小鼠类似。就tvt损伤后24小时的存活率而言,与用rbdd-fvi ii治疗的小鼠的存活率小于50%相对比,当在损伤之前24小时施用fviii分子时,在fviii-xten-fc/d’d3-xten-fc异二聚体治疗下,大于90%的小鼠存活于tvt损伤。此外,当相较于在损伤之前24小时接受rbdd-fviii治疗的小鼠时,在尾部静脉损伤之前96小时用fviii-xten-fc/d’d3-xten-fc异二聚体治疗的小鼠的存活更佳(在rf viii169/vwf034的情况下)或类似(在rfviii169/vwf057的情况下)。再流血数据与存活数据两者均已指示相对于rbdd-fviii治疗,fvii i-xten-fc/d’d3-xten-fc异二聚体治疗的功效延长4倍。
[0581]
hema小鼠尾部静脉横切模型
[0582]
如下进行尾部静脉横切程序。用含有50mg/kg氯胺酮、0.125mg/kg右旋美托咪啶和0.1mg/kg布诺啡(buprenex)的混合物使小鼠麻醉。在足够麻醉深度处,用直边11号手术刀片在尾部的直径是约2.7mm所处的区域处横切小鼠的侧向尾部静脉。用温热盐水洗去流血以确保清晰观察伤口。接着持续下一24小时将治疗的小鼠单独舍饲在具有白色纸垫料的清洁笼中。每小时观察并记录尾部再流血和小鼠的身体活动直至尾部损伤后12小时。立刻使濒死小鼠安乐死,并且在尾部损伤后24小时进行最终观察。为模拟血友病患者的流血情况以及为确保动物从麻醉完全恢复,给予1mg/kg阿替美唑(atipamezole)溶液以逆转在尾部静脉横切开始时的右旋美托咪啶作用。在12小时观察时期结束时另外施用0.1mg/kg剂量的布诺啡以用于过夜疼痛管理。产生时间相对于再流血以及时间相对于安乐死的存活曲线以进行数据分析,并且对数秩(曼特尔-考克斯(mantel-cox))检验用于统计评估。
[0583]
实施例11:制备fviii169/vwf059和其它构建体
[0584]
psyn fviii 310克隆:
[0585]
以商业手段制备侧接有在n末端的bamh1位点和在c末端的cla 1位点的合成dna片段。这个合成dna用于置换psyn fviii 169构建体(seq id no:155)中的bamh1至cla1区域。合成dna与psyn fviii 169dna两者均用bamh1和cla1双重消化,将消化的合成dna插入消化的psyn fviii 169中以产生psyn fviii 310(seq id no:168;表20)。
[0586]
克隆psyn fviii 312:
[0587]
以商业手段制备侧接有在n末端的bamh1位点和在c末端的afe 1位点的合成dna片段。这个合成dna用于置换psyn fviii 169构建体(seq id no:155)中的bamh1至afe1区域。合成dna与psyn fviii 169dna两者均用bamh1和afe1双重消化,将消化的合成dna插入消化的psyn fviii 169中以产生psyn fviii 312(seq id no:169;表20)。从psyn fviii312产生psyn fviii 312a(seq id no:2;表20)以移除在fviii和xten的接合点处的编码氨基酸残基gap的asci位点。
[0588]
表20:合成fviii构建体。
[0589]
[0590][0591]
克隆psyn vwf059和vwf073:
[0592]
制备编码在d’d3-xten与fc之间的不同接头区域的各种合成dna片段。这些合成dna片段侧接有在n末端的asc1位点和在c末端的not 1位点。这些合成dna用于置换psyn vwf057构建体(seq id no:152)中的asc1至not1区域。psyn vwf059构建体(表21)包含接头区域(seq id no:13),其包括整个fviii酸性区2(a2)。这个位点被报道由凝血酶裂解,并且在fviii活化后,d’d3xten被释放。psyn vwf073构建体(表21)仅含有fviii酸性区2(a2)的凝血酶裂解位点(即ieprsfs)(seq id no:23)。合成dna与psyn vwf057 dna两者均用asc1和not1双重消化。将消化的合成dn a插入消化的psyn vwf057中以产生psyn vwf059和psyn vwf073。通过移除ecorv限制位点来从psyn vwf059产生psyn vwf59a构建体(表21)。通过在hek293细胞中共同表达fviii169和vwf057或vwf059来产生fviii169/vwf057和fviii169/vwf059异二聚体蛋白。
[0593]
表21:合成vwf构建体
–
可裂解接头区域
[0594][0595]
实施例12:凝血酶消化fviii异二聚体以分析d'd3从fc释放
[0596]
在凝血酶消化实验中测试两种fviii异二聚体蛋白,并且考查由凝血酶对它们的裂解速率。这个实验中使用的两种异二聚体构建体是fviii169/vwf057异二聚体和fviii169/vwf059异二聚体,连同fviiifc一起。以上描述fviii169/vwf057和fviii169/vwf059异二聚体。进行三个消化反应:i)fviiifc ii)fviii169/vwf057(图11),和iii)fviii 169/vwf059(图12)。以fviii:凝血酶的摩尔比约22:1,用人α-凝血酶处理测试样品。在37℃水浴中孵育各反应。在各指示的时间点(t=5、15、30、45、60分钟),取出22.5μl样品,用22.5μl非还原性2x sds装载染料终止,并且加热3分钟。接着在sds-page凝胶上操作消化的蛋白质。利用licor系统,使用抗fviii重链(gma012)和抗vwf-d3(ab96340)抗体进行蛋白质印迹。
[0597]
如图11中所示,fviii169/vwf057暴露于凝血酶导致d'd3-xt en-fc的检测水平逐渐降低,同时关联有裂解产物d'd3-144 xten的水平增加。在15分钟之后剩余有未裂解的
fviii169/vwf057。相反,图12显示fviii 169/vwf059由凝血酶更快速裂解,如通过在5分钟之后有少许乃至无可检测的未裂解fviii 169/vwf059所证实。因此,fviii 169/vwf059显示相较于fviii169/vwf057,在凝血酶活化后,d’d3从fc更佳释放。
[0598]
进行平行实验以使用质谱分析(ms)探究凝血酶裂解。根据ms,fviii 169/vwf059再次显示相较于vwf057,d’d3从fc更佳释放。
[0599]
实施例13:fviii169/vwf059在hema小鼠中的体内评估
[0600]
为进一步评估fviii169/vwf059的药物动力学概况和体内效价,通过在150iu/kg剂量下静脉内施用来用fviii169/vwf059治疗hema小鼠。在注射后5分钟、24、48、72、96和120小时通过腔静脉血液收集来收集血浆样品。通过fviii显色测定来测量血浆样品中的fviii活性,并且使用phoenix程序计算pk参数。如表22中所示,相较于fviii169/vwf057,观察到fviii169/vwf059的类似pk概况,从而指示a2凝血酶裂解接头对异二聚体的pk概况不具有负面影响。
[0601]
表22:fviii169/vwf057和fviii169/vwf059在hema小鼠中的pk概况
[0602][0603]
在hema小鼠尾部钳夹模型(描述于实施例9中)中相较于野生型bdd-fviii评估fviii169/vwf059的急性功效。用75iu/kg的fviii169/vwf059或bdd-fviii治疗hema小鼠,并且将各实验小鼠的失血体积绘制于图13中。相较于bdd-fviii,fviii169/vwf059对hema小鼠提供相同保护程度(p=0.9883),从而指示fviii169/vwf059在体内具有完全功能性。
[0604]
fviii-xten-fc/d’d3-fc异二聚体的质粒构建
[0605]
vwf031核苷酸序列(seq id no:147)
[0606]
[0607]
[0608][0609]
vwf031蛋白质序列(seq id no:86)
[0610][0611]
vwf034核苷酸序列(seq id no:148)
[0612]
[0613]
[0614][0615]
vwf034蛋白质序列(seq id no:87)
[0616][0617]
vwf050核苷酸序列(ihh三重突变体)(seq id no:149)
[0618]
[0619][0620]
vwf050蛋白质序列(ihh三重突变体)(seq id no:150)
[0621]
[0622][0623]
vwf057核苷酸序列(seq id no:151)
[0624]
[0625]
[0626][0627]
vwf057蛋白质序列(seq id no:152)
[0628][0629]
vwf058核苷酸序列(具有ihh突变的vwf034)(seq id no:153)
[0630]
[0631][0632]
vwf058蛋白质序列(具有ihh突变的vwf034)(seq id no:154)
[0633][0634]
fviii 169核苷酸序列(seq id no:155)
[0635]
[0636]
[0637][0638]
fviii 169蛋白质序列(seq id no:70)
[0639][0640]
fviii 263核苷酸序列(ihh三重突变体)(seq id no:156)
[0641]
[0642]
[0643][0644]
fviii 263蛋白质序列(ihh三重突变体)(seq id no:157)
[0645][0646]
fviii 282核苷酸序列(seq id no:158)
[0647]
[0648]
[0649][0650]
fviii 282蛋白质序列(seq id no:159)
[0651][0652]
fviii 283核苷酸序列(具有ihh三重突变的fviii 169)(seq id no:160)
[0653]
[0654][0655][0656]
fviii 283蛋白质序列(具有ihh三重突变的fviii 169)(seq id no:161)
[0657][0658]
psynfviii 010核苷酸序列-(双链fviiifc)(seq id no:162)
[0659]
[0660]
[0661][0662]
psynfviii 010蛋白质序列-(双链fviiifc)(seq id no:163)
[0663][0664]
fviii 195蛋白质序列(在氨基酸1656和1900处具有两个144 ae xten的双链fviiifc)(seq id no:73)
[0665][0666]
psyn-fviii-173成熟蛋白质序列(seq id no:72):
[0667][0668]
fviii 196蛋白质序列(在氨基酸26、1656和1900处具有三个144ae xten的双链fviiifc)(seq id no:74)
[0669][0670]
fviii 199蛋白质序列(在氨基酸1656和1900处具有三个144 ae xten的单链fviiifc)(seq id no:75)
[0671][0672]
fviii 201蛋白质序列(在氨基酸26、1656和1900处具有三个144ae xten的单链fviiifc)(seq id no:76)
[0673][0674]
fviii 203蛋白质序列(具有两个ae xten的单链fviiifc;一个288ae xten在b结构域中,并且一个144 ae xten在氨基酸1900处)(seq id no:77)
[0675][0676]
fviii 204蛋白质序列(具有两个ae xten的单链fviiifc;一个288ae xten在b结构域中,并且一个144 ae xten在氨基酸403处)(seq id no:78)
[0677]
[0678][0679]
fviii 205蛋白质序列(具有两个ae xten的单链fviiifc;一个288ae xten在b结构域中,并且一个144 ae xten在氨基酸18处)(seq id no:79)
[0680][0681]
psyn fviii 266蛋白质序列(具有在氨基酸18处的42 ae-xten和在b结构域中的288 ae xten的fviii fc)(seq id no:80)
[0682][0683]
psyn fviii 267蛋白质序列(具有在氨基酸18处的72 ae-xten和在b结构域中的288 ae xten的fviii fc)(seq id no:81)
[0684][0685]
psyn fviii 268蛋白质序列(在氨基酸18处具有144 ae-xten的fviii fc)(seq id no:82)
[0686][0687]
psyn fviii 269蛋白质序列(在氨基酸18处具有72 ae-xten的fviii fc)(seq id no: 83)
[0688]
[0689][0690]
psynfviii 271蛋白质序列(在氨基酸18处具有42 ae-xten的fviii fc)(seq id no:84)
[0691][0692]
psyn fviii蛋白质序列272(具有在氨基酸18处的144 ae xten和在b结构域中的244 ae xten的fviii-无fc)(seq id no:85)
[0693][0694]
psyn-fviii-161蛋白质序列(seq id no:69)(fviii序列氨基酸位置1-1457;加下划线区域表示fc区;弯曲下划线表示在第一fc与vwf片段之间的可裂解接头;加双下划线区域表示vwf片段;粗体区域表示在vwf片段与fc之间的可裂解接头)。
[0695]
[0696][0697]
psyn-fviii-170蛋白质序列(seq id no:71)
[0698][0699]
psyn fviii 310核苷酸序列(编码除2个氨基酸残基之外,b结构域完全缺失,并且在aa 742之后插入288 ae-xten的fviii)(seq id no:170)
[0700]
[0701][0702]
psyn fviii 310蛋白质序列(除2个氨基酸残基之外,b结构域完全缺失,并且在aa 742之后插入288 ae-xten的fviii)(seq id no:171)
[0703][0704]
psyn fviii 312核苷酸序列(编码除5个氨基酸残基之外,b结构域完全缺失,并且在aa 745之后插入288 ae-xten的fviii-b5形式)(seq id no:172)
[0705]
[0706]
[0707][0708]
psyn fviii 312蛋白质序列(除5个氨基酸残基之外,b结构域完全缺失,并且在aa 745之后插入288 ae-xten的fviii-b5形式)(seq id no:173)
[0709][0710]
psyn vwf059核苷酸序列(编码在接头中具有酸性区2(a2)凝血酶位点的vwf d’d3-fc)(seq id no:196)
[0711]
[0712]
[0713][0714]
psyn vwf059蛋白质序列(在接头中具有a2区fviii凝血酶位点的vwf d’d3-fc)-粗体加下划线区域显示a2区(seq id no:197)
[0715][0716]
psyn vwf062核苷酸序列(编码在接头中不具有凝血酶位点的vwf d’d3-fc)(seq id no:198)
[0717]
[0718][0719]
psyn vwf062蛋白质序列(在接头中不具有凝血酶位点的vwf d’d3-fc)(seq id no:199)
[0720][0721]
psyn vwf073核苷酸序列-(编码vwfd1d2d’d3-144 ae xten-fviii截短a2凝血酶位点-fc)(seq id no:174)
[0722]
[0723]
[0724][0725]
psyn vwf073蛋白质序列-(vwfd1d2d’d3-144 ae xten-截短a2凝血酶位点-fc)(seq id no:175)
[0726][0727]
对特定实施方案的上文描述将如此充分揭示本发明的一般性特性以致他人可在不脱离本发明的一般性概念下,在不进行过度实验下,通过应用本领域的技能内的知识而易于针对各种应用来修改和/或改适所述特定实施方案。因此,基于本文呈现的教导和指导,所述改适和修改意图在公开的实施方案的等效物的含义和范围内。应了解本文的措辞
或术语是出于描述而非限制目的,因此本说明书的术语或措辞应由熟练技术人员根据教导和指导加以解释。
[0728]
本发明的其它实施方案将由考虑本文公开的本发明的说明书和实施而为本领域技术人员显而易知。意图说明书和实施例仅被视为具有示例性,其中本发明的真正范围和精神由以下权利要求指示。
[0729]
本文引用的所有专利和出版物都以引用的方式整体并入本文。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1