一种催化活性提高的几丁质脱乙酰酶AsCDA突变体及其应用
本发明属于生物工程,具体公开了细菌acinetobacterschindleri几丁质脱乙酰酶的突变体。
背景技术:
1、壳聚糖是自然界中唯一的阳离子碱性gras(公认安全)级生物资源,有抑菌、抗癌、降低胆固醇和降血压等生物活性,被广泛应用于食品工业、医药、农业和化妆品等领域。因此,导致壳聚糖及其衍生物相关产品的需求量逐年增加,供不应求。中国作为全球最大的壳聚糖生产国和出口国,每年有超过100万吨虾蟹壳来源的几丁质废弃物可用于生产壳聚糖。目前,工业上使用热碱法规模化制备壳聚糖,壳聚糖产品存在质量差、价格低廉的问题,且生产过程中产生大量难以处理的废水给土壤、河流、空气等造成严重污染。在可再生资源高值利用战略目标和传统高污染产业转型升级的大背景下,急需寻求壳聚糖绿色制备的新途径,以促进壳聚糖产业的转型升级和几丁质的高值利用。
2、几丁质脱乙酰酶(cda)可以催化几丁质脱去乙酰基绿色制备壳聚糖,一旦被规模放大可替代工业上现行的热碱法,实现壳聚糖行业的绿色转型升级和几丁质生物资源高值利用,其经济和生态意义重大。1975年首次在mucor rouxii发现cda至今,研究者相继对真菌、细菌和昆虫等来源cdas的克隆表达、酶学性质、结构与功能关系等方面进行了深入研究,结果表明cdas对小分子的几丁寡糖脱乙酰活性高,但其对大分子的晶体几丁质催化效率低,这极大限制了cdas酶工业化应用和壳聚糖产业转型升级。
技术实现思路
1、针对现有技术的不足,本发明基于ascda与几丁寡糖的分子对接和分子动力学模拟的结果,选取位于酶-底口袋的leu69、gly180、arg181和met235四个位点设计半理性设计改造策略,对leu69、gly180、arg181和met235四个位点进行迭代饱和突变,最终获得四突变体m11,其比酶活提高了1.73倍,催化效率也显著提高;并进一步对其催化晶体几丁质制备壳聚糖的酶学特性进行了评估。
2、一种几丁质脱乙酰酶ascda突变体,其氨基酸序列为seq id no.1。
3、本发明提供了所述几丁质脱乙酰酶ascda突变体的筛选方法,包括以下步骤:
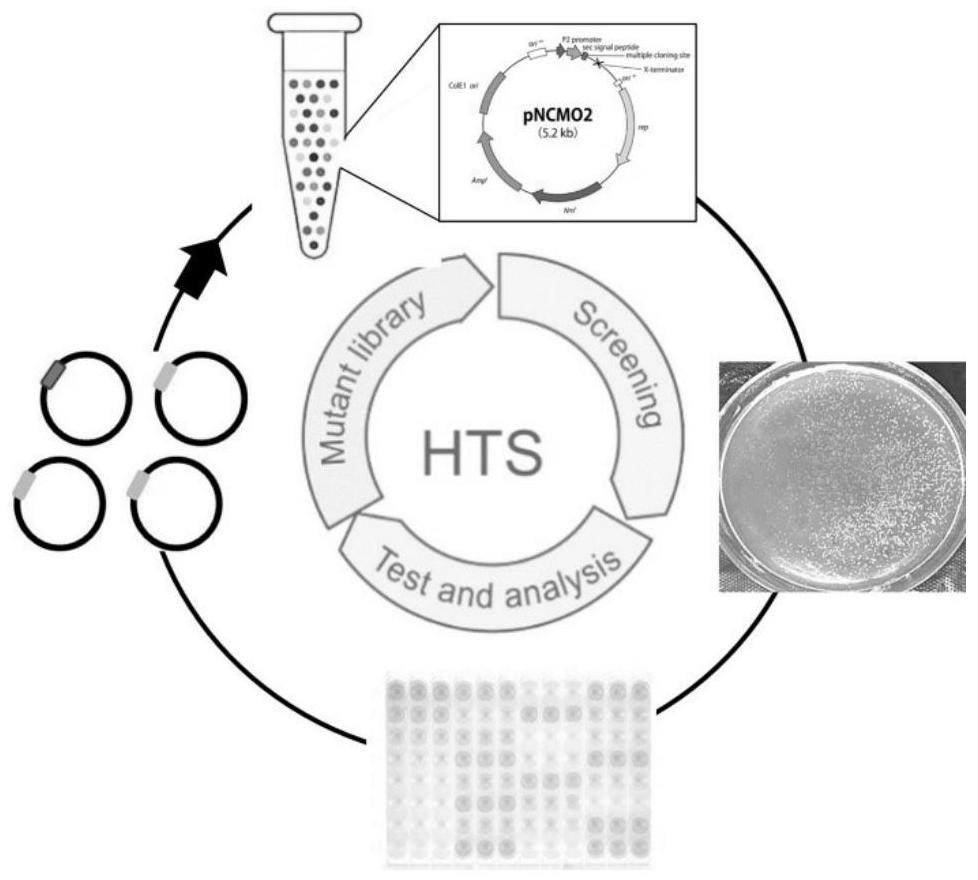
4、1)重组载体pncmo2-his-tag-ascda的构建;
5、以申氏不动杆菌mcda01的基因组(acinetobacter schindleri mcda01,菌株保藏号为cgmcc no.13539)为模板,进行扩增pcr扩增,然后克隆到ascda的完整cds;
6、使用限制性内切酶bamhi和hindiii分别酶切ascda的cds和pncmo2表达载体,然后用dna连接酶将二者连接;
7、进行短小芽孢杆菌b.choshinensis转化,筛选阳性转化子扩增后提取质粒,得到重组载体pncmo2-his-tag-ascda。
8、2)突变文库的构建;
9、以pncmo2-his-tag-ascda为模板,利用定点饱和突变引物对,对ascda酶-底口袋区域的leu69、gly180、arg181和met235四个位点进行迭代饱和突变,利用dpn i酶消化原始模板,得到pncmo2-his-tag-ascdamut,然后将其转入感受态e.coli jm109中,挑取阳性转化子进行测序,从而构建突变菌株文库。
10、3)高通量筛选方法;将测序正确的各重组质粒pncmo2-his-tag-ascdamut分别转到短小芽孢杆菌进行分泌表达,突变体的筛选在96孔深孔板中进行,发酵结束后离心,上清液即为粗酶液,采用对硝基苯胺显色法测定发酵上清液中几丁质脱乙酰酶的酶活力,筛选出活力高的突变体。
11、优选地,所述步骤1)中pcr的扩增反应体系如下:
12、
13、优选的,所述ascda-f序列为seq id no.2,ascda-r序列为seq id no.3。
14、优选地,所述步骤1)中酶切体系如下:
15、
16、37℃条件下bamhⅰ和hindⅲ双酶切2h。
17、优选地,所述步骤1)中连接体系如下:
18、
19、
20、22℃水浴连接4h。
21、优选地,所述步骤1)中短小芽孢杆菌的转化方法为:(1)将10μl待转化的质粒至于4℃条件下保温10min;(2)将混匀的质粒全部加入短小芽孢杆菌感受态细胞中,震荡5s后静置5min;(3)在体系中继续加入150μl 40%peg6000,震荡混匀5-10s;(4)将上述液体与3000rpm、4℃条件下离心5min,去除上清;(5)加入1m l mt培养基后于200rpm、37℃条件下培养2h;(6)3000rpm、4℃条件下离心,收集菌体,将菌体涂布至mt培养基中,过夜培养。mt培养基为在tm培养基的基础上添加4g·l-1的mgcl2。
22、优选地,所述步骤2)中ascda酶-底口袋的leu69位点饱和突变正反向引物对序列分别为seq id no.4和seq id no.5。
23、优选地,所述步骤2)中ascda酶-底口袋的gly180位点饱和突变正反向引物对序列分别为seq id no.6和seq id no.7。
24、优选地,所述步骤2)中ascda酶-底口袋的arg181位点饱和突变正反向引物对序列分别为seq id no.8和seq id no.9。
25、优选地,所述步骤2)中ascda酶-底口袋的met235位点饱和突变正反向引物对序列分别为seq id no.10和seq id no.11。
26、本发明还提供了所述几丁质脱乙酰酶ascda突变体的表达纯化方法,包括以下步骤:
27、s1重组菌株的诱导表达:将筛选出的几丁质脱乙酰酶ascda突变体重组短小芽孢杆菌接种至培养基中,进行培养获得种子液,吸取培养好的种子液,接种至发酵培养基中进行培养以发酵表达重组蛋白;
28、s2几丁质脱乙酰酶ascda突变体的纯化:收集菌体,高压破碎,离心收集上清,亲和层析纯化上清中的目的蛋白质。
29、优选地,所述步骤s1中重组菌株的诱导表达方法为:将重组短小芽孢杆菌从甘油管以2%的接种量接种至含有新霉素抗性的sm培养基中,将接种好的培养基至于200rpm、32℃条件下培养12h做为种子液。吸取培养好的种子液,以5%的接种量接种至含有10μg·ml-1新霉素的tm培养基中,于200rpm、32℃条件下培养82h以发酵表达重组蛋白。
30、优选地,所述步骤s2中的几丁质脱乙酰酶ascda突变酶的纯化方法为:以树脂镍柱,水平放置加入平衡缓冲液洗涤镍柱,将发酵上清液加入镍柱,4℃缓慢颠倒镍柱1小时,使酶和镍柱结合。将柱子垂直放置,使树脂沉淀,打开底部筛子,收集馏分,用平衡缓冲液洗涤镍柱,再加入洗涤缓冲液,收集洗涤流出的液体,加入洗脱缓冲液,收集洗脱液,将洗脱液浓缩即得几丁质脱乙酰酶ascda突变酶。
31、优选地,所述前述的平衡缓冲液为:20mm磷酸盐缓冲液;500mmnacl;20mm咪唑;ph7.4;所述洗涤缓冲液为:20mm磷酸盐缓冲液;500mmnacl;100mm咪唑;ph7.4;所述洗脱缓冲液为:20mm磷酸盐缓冲液;500mmnacl;280mm咪唑;ph7.4。
32、本发明提供了几丁质脱乙酰酶ascda突变体用于催化脱乙酰基的用途
33、本发明提供的几丁质脱乙酰酶ascda突变体用于催化几丁质脱乙酰制备壳聚糖。
34、本发明的有益效果:本发明对leu69、gly180、arg181和met235四个位点进行迭代饱和突变,最终获得四突变体m11,其比酶活提高了1.73倍,催化效率也显著提高,从而有利于降低几丁质脱乙酰酶生物酶法制备壳聚糖的生产成本,促进几丁质脱乙酰酶在壳聚糖产业中的广泛应用。
- 还没有人留言评论。精彩留言会获得点赞!