一种用于模拟DNA链置换的亚微米元DNA系统的制备方法及其应用与流程
本发明属于纳米材料及化学生物学动态组装,更具体地涉及一种用于模拟dna链置换的亚微米元dna系统的制备方法及其应用。
背景技术:
1、dna链置换是由两条部分互补dna链相互杂交成为两条完全互补dna链相互杂交的过程,在该过程中置换出一条或多条预杂交的dna链。其中,dna链置换从互补的单链域(称为脚趾区域)开始,并通过类似于随机行走的分支迁移过程进行置换,其置换过程示意图如图1所示。
2、dna链置换技术在构建动态重构系统方面具有强大的应用前景,如dna回路、类神经元计算、dna纳米机器等。在结构重构层面,大多数已报道的工作是通过操纵用于dna链置换的单链,实现dna纳米结构的重构。如文献报道的通过入侵链和反入侵链实现了dna纳米结构动态组装的自主控制,或者是在纳米尺度上通过添加燃料链执行dna链调控的构象变化,也有文献报道了可以由阳离子浓度或温度等全局参数变构机制精细控制纳米结构的重构。然而这些方法引入了额外的重构因子,限制了系统的自主功能,增加了系统的复杂性。
3、此外,有文献报道了dna瓦片置换策略,该策略能够实现纳米结构自身的自主重新配置和任务执行,该方法依赖于弱相互作用,如碱基堆叠和短的黏性末端(1-2个核苷酸)。而较长的黏性末端(超过5个核苷酸)可以促进构建具有有效识别和重构能力的复杂动态系统,然而在亚微米尺度上利用dna纳米结构中相对稳定的相互作用(如较长的黏性末端)来执行可编程的自主重构,在技术上仍然是一个难题。
技术实现思路
1、本发明的目的在于提供一种用于模拟dna链置换的亚微米元dna系统的制备方法,以及该亚微米元dna系统在亚微米尺度上模拟dna链置换实现自主程序化重构的应用,从而解决采用现有的dna链置换技术构建动态重构系统时需要引入额外的重构因子、限制了系统的自主功能、以及增加了系统的复杂性的问题。
2、为了解决上述问题,本发明采用以下技术方案:
3、根据本发明的第一方面,提供一种用于模拟dna链置换的亚微米元dna系统的制备方法,包括如下步骤:a1:选择一定长度的长链dna作为支架链用于元dna的组装;
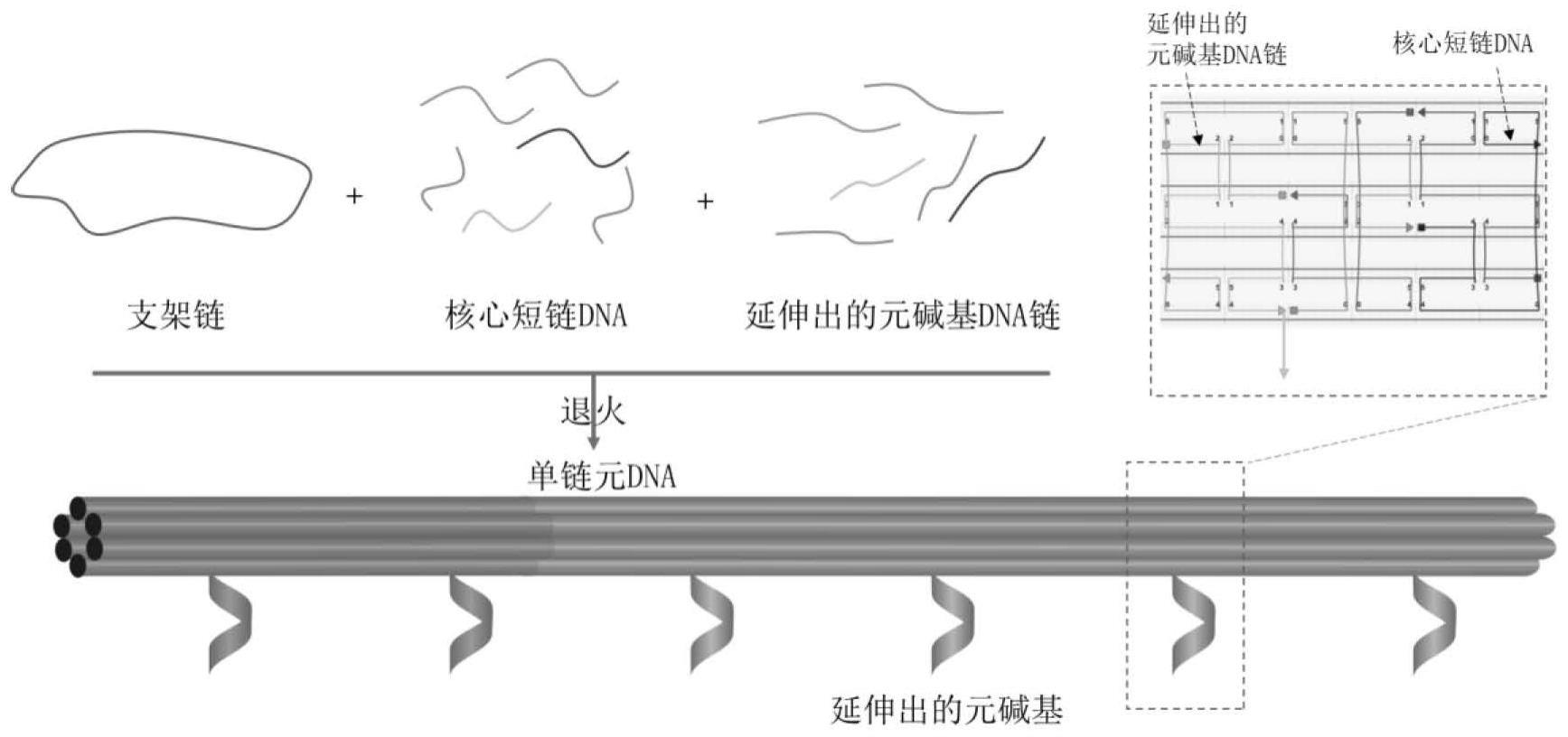
4、a2:分别将一定浓度的支架链、所有不同类型的核心短链dna和延伸出的元碱基dna链混合在含有12.5mm镁离子的1×tae缓冲液中;a3:在pcr仪器中进行pcr退火程序实现不同类型单链元dnas1、s2、s3的组装;a4:通过加入1:1体积的含有peg 8000(15%,w/v)tae缓冲液,mg2+最终浓度为20mm,并离心,去除过量的短链dna,分别获得单链元dnas1、s2和s3;a5:将相同浓度的单链元dnas1和部分互补单链元dnas2以1:1(v:v)的比例混合,然后经过pcr退火程序,获得双链元dna[s1:s2]。
5、根据本发明提供的一种用于模拟dna链置换的亚微米元dna系统的制备方法,通过支架链、核心短链dna和延伸出的元碱基dna链按一定比例混合退火,最终制备得到单链元dna,其制备示意图如图2所示。
6、优选地,步骤a1中采用长度为100~100000个碱基的长链dna作为支架链。
7、更优选地,步骤a1中所述的支架链选取从m13mp18噬菌体中获得的7249个碱基的dna,工作浓度为20nm。应当理解的是,步骤a1中所述的支架链并不仅限于此,还可以是p7308等等。
8、优选地,步骤a2中所采用的支架链的终浓度为0.1-1000nm,核心短链dna的终浓度为0.1-10000nm,延伸出的元碱基dna链的终浓度为0.1-10000nm。
9、根据本发明的一个优选实施例,步骤a2中所述的dna支架链的终浓度为20nm,所有不同类型的核心短链dna终浓度为100nm,延伸出的元碱基dna链终浓度100nm。
10、优选地,步骤a3中所采用的pcr退火程序为:以每循环降1℃的速率将温度从90℃降至85℃,每循环保持1min;接着以每循环降1℃的速率从85℃降至70℃,每循环保持5min;然后以每循环降1℃的速度从70℃降至40℃,最后循环结束时样品的温度保持在4℃。
11、优选地,步骤a4中所述的离心条件为12000rcf,15分钟。
12、优选地,步骤a5中所采用的pcr退火程序为:以每循环降1℃的速率将温度从35℃退火至20℃,每个循环保持10分钟。
13、根据本发明的第二方面,提供了一种亚微米元dna系统在亚微米尺度上模拟dna链置换实现自主程序化重构的应用,包括:使用上述制备方法制备得到的一种用于模拟dna链置换的亚微米元dna系统,在亚微米尺度上实现级联“单输入-单输出”的程序化动态重构,级联“多输入-单输出”的程序化动态重构,以及用于混合逻辑回路的程序化动态重构。
14、根据本发明的一个优选方案,所述应用包括主要步骤如下:b1:将底物双链元dna[s1:s2]和入侵者单链元dna s3加入1×tae/mg2+缓冲液稀释到一定的工作浓度;b2:将一定浓度具有特定荧光分子和淬灭分子修饰的底物双链元dna [s1:s2]与入侵者单链元dnas3以不同的摩尔比混合;b3:采用q-pcr仪(bio-rad cfx opus 96)进行荧光动力学测定,将入侵者单链元dnas3添加到pcr管中并进行反应,在一定温度下,对荧光信号数值进行记录;b4:将最终反应产物进行原子力显微镜的表征。
15、优选地,步骤b1中所述的元dna工作浓度为20-40nm。
16、优选地,步骤b2中所述的双链元dna[s1:s2]浓度为20nm,荧光分子为fam,淬灭分子为bhq1,底物双链元dna与入侵者单链元dna的摩尔比分别为1:1.2、1:1、1:0.8、1:0.6。
17、优选地,步骤b3中所述的荧光动力学测试选择的激发波长为450-490nm,发射波长为510~530nm,温度在25℃,每15分钟记录一次,记录12小时。
18、优选地,步骤b4中所述的原子力显微镜表征方法具体为:将样品分散在1×tae-mg2+缓冲液中,最终浓度为1nm,滴加5μl样品到云母的光滑表面,然后放置5分钟进行吸附,在原子力显微镜上(bruker)选用scanasyst模式,实验使用scanasyst-fluid+探针获取图像。
19、应当知晓的是,关于元dna的dna纳米材料制备与纯化的相关技术可参见我们之前发表的文章(nat.chem.2020,12(11):1067-1075.angew.chem.int.ed.2014,53,12735–12740),然而本发明相对于已经报导的文献利用了更长的原碱基作用力,优化了元dna迁移区的设计,使得元dna取代反应的迁移过程是一个可逆的过程,更适用于复杂的自主重构。
20、与现有技术相比,本发明具有以下显著的优越性:
21、1)本发明基于一种元dna自组装的新型亚微米材料,可用于自主的动态重构,其可以在亚微米尺度或更大尺度上实现类似于纳米尺度dna链置换的功能,其可设计性强,制备简单,特异识别性强。
22、2)本发明的动态重构基于元dna上前端未互补配对dna链杂交驱动的元dna链交换,具有自发性、可程序设计的特点,可适用于更大尺度上的结构动态变化以及逻辑门的执行,相较于普通的动态dna链置换反应,本发明的程序化动态变化长度可以达到0.8微米,实现了动态重构在原子力显微镜下的可视化。
23、3)本发明还具备用量少、操作简便快速等优势。
- 还没有人留言评论。精彩留言会获得点赞!