快速广谱检测支原体的引物探针组合、试剂盒及其应用的制作方法
本发明涉及支原体检测,特别涉及快速广谱检测支原体的引物探针组合、试剂盒及其应用。
背景技术:
1、“支原体”通常被用作柔膜菌纲中所有细菌的惯用名,是一类无细胞壁、形态多样可变,大小介于细菌和病毒之间(直径0.1-0.3μm)的原核微生物。目前已从污水、植物、动物、禽类、昆虫、人、温泉或其他高温环境中发现200多种支原体。支原体的基因组大小为0.58-2.2mbp,碱基gc含量较低(23-40mol%),可自由生活进行二分裂繁殖,也可在细胞膜上共生或细胞内寄生,并具有宿主细胞特异性。支原体感染宿主细胞主要有三个方面的机理:细胞黏附、细胞侵入和细胞融合。细胞受到支原体感染后,可能无明显表型变化,也可能生长速度变慢,产生细胞病变效应,甚至发生染色体畸变和细胞恶化。受支原体污染的生物制品可引起人类多种疾病,威胁人类健康。支原体污染来源广泛,操作人员与污染细胞来源的支原体污染概率最大。据文献报道,连续培养细胞系中支原体的污染率约为15-35%,在生物制药行业中约为0.44-6.70%,95%以上的污染是由以下几种支原体引起:口腔支原体(m.orale)、精氨酸支原体(m.arginini)、猪鼻支原体(m.hyorhinis)、发酵支原体(m.fermentans)、人型支原体(m.hominis)和莱氏无胆甾原体(a.laidlawii)。各国法规和监管部门都明确规定:源于细胞培养的产品都必须确保无支原体污染。
2、常见的支原体检测方法包括培养法、指示细胞法、电镜观察法、免疫检测法、生化测定法、核酸扩增技术(nat)等。目前,各国药典中支原体检测普遍使用的是培养法和指示细胞法。培养法是最经典的支原体分离和检测方法,又称28天培养法,灵敏度可以达到1-10cfu/ml,劣势在于培养时间长,需要使用多种培养基对不同的支原体种类进行检测,并且对于一些难培养的支原体(比如猪鼻支原体)容易出现漏检的现象。指示细胞法在时间上(3-5d)比培养法有一定的优势,但灵敏度不及培养法,且只能检测细胞粘附支原体,对于粘附性较差的口腔支原体和精氨酸支原体,则很容易形成假阴性结果,也不适用于能使指示细胞发生病变的病毒样品。不管是培养法还是指示细胞法,都不适用于对时效性要求较高的嵌合抗原受体t细胞等特殊的细胞治疗类产品的快速放行检测。
3、nat法是基于支原体核酸序列(dna/rna)的扩增,根据原理分为rt-pcr,pcr/nested-pcr/touch down-pcr、qpcr和恒温扩增法。nat法因其便捷快速、灵敏度高、特异性好,已被欧洲药典和日本药典所采用,美国药典中也明确说明可以使用经过验证的nat法或依赖酶活性的方法检测支原体,但要求新方法要与药典方法有可比性。qpcr(荧光定量pcr)主要优势在于可以通过阈值循环数(ct)值准确评估起始模板量,可以实现高通量和同一个反应孔多通道检测,特异性好,灵敏度高,准确性好,检测种类多,被广泛用于国内外生物制品的质控检测。
技术实现思路
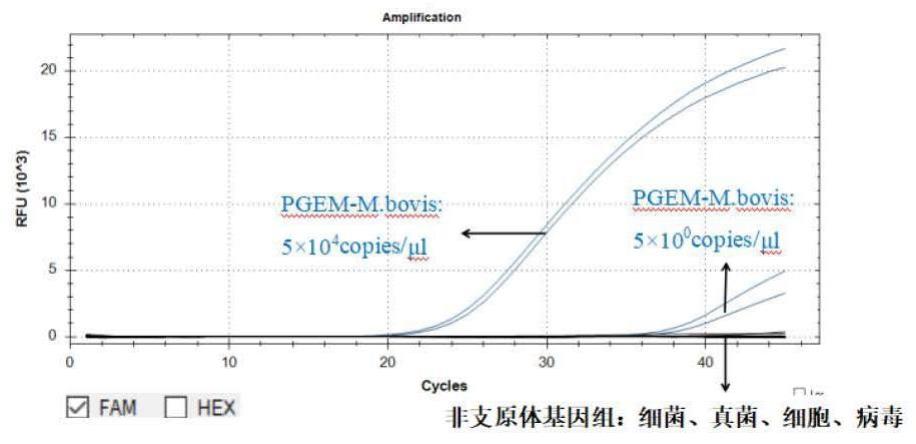
1、针对上述现有的支原体检测传统培养法和指示细胞法在生物制品(特别是对时效性要求较高的细胞治疗产品)快速放行检测方面的不足,本发明提供了快速广谱检测支原体的引物探针组合、试剂盒及其应用,支原体种类繁多,利用较保守序列设计多对引物探针,可实现同一qpcr反应体系中多种支原体的同时快速检测,为生物制品特别是对时效性要求较高的细胞治疗产品的快速检验放行添油助力。本发明提供的引物探针、试剂盒及检测方法,能够在4小时内完成对生物制品中数百种支原体的检测,覆盖度非常广(>132种、>410株支原体),专属性强(不会与细菌、真菌、人类及动物细胞、常见病毒发生交叉反应),灵敏度高(核酸检测限0.1-0.5copies/μl,即1-5copies/reaction,支原体灵敏度达到10cfu/ml以下),耐用性强(抗基质干扰能力强、反复冻融不影响体系稳定性),满足欧洲药典及日本药典支原体nat法验证指南的要求,能够作为支原体检测传统方法的替代或补充方法。本发明具体通过以下技术实现。
2、快速广谱检测支原体的引物探针组合,包括10条正向引物,5条反向引物和4条检测探针;10条所述正向引物的核苷酸序列如seq id no.1-10所示,5条所述反向引物的核苷酸序列如seq id no.11-15所示,4条所述检测探针的核苷酸序列如seq id no.16-19所示;所述检测探针的5’端还偶联有第一荧光标记,3’端还偶联有淬灭基团。
3、上述核苷酸序列中,兼并碱基w代表碱基a、t,兼并碱基y代表碱基c、t,兼并碱基s代表碱基g、c,兼并碱基r代表碱基a、g。
4、优选地,所述第一荧光标记为fam、tet、ned、rox、cy3、cy5、vic、joe或hex荧光标记;所述淬灭基团为mgb、tamra、nfq、eclipse、dabcyl、bhq1或bhq2淬灭基团。
5、更优选地,所述第一荧光标记为fam荧光标记,所述淬灭基团为mgb淬灭基团。
6、本发明还提供了上述引物探针组合在制备用于快速广谱检测支原体的产品中的应用。
7、本发明还提供了一种用于快速广谱检测支原体的试剂盒,包括上述任意一组所述引物探针组合,还包括内控质粒和相应的内控探针,所述内控质粒和内控探针用于监测检测支原体时待测样品中的pcr抑制现象。一般情况下,内控质粒溶于缓冲液中;例如溶解于te buffer,浓度为300copies/μl。
8、优选地,上述试剂盒中,所述内控质粒的目标片段的核苷酸序列如seq id no.20所示,所述内控探针的核苷酸序列如seq id no.21所示;所述内控探针的5’端偶联有与所述第一荧光标记不同的第二荧光标记,3’端偶联有淬灭基团(例如可以选择mgb、tamra、nfq、eclipse、dabcyl、bhq1或bhq2)。
9、更优选地,上述试剂盒中,还包括qpcr反应液、阳性对照和pcr级别水。
10、更优选地,上述试剂盒中,所述qpcr反应液含有pcr缓冲液、dntps、热启动taq聚合酶和mgcl2;所述阳性对照为含有肺炎支原体和口腔支原体的基因组的缓冲液。
11、本发明提供的上述定量试剂,所述阳性对照可以通过将肺炎支原体和口腔支原体的基因组用te buffer配制而成,浓度为100copies/μl。pcr级别水可以选用常规无核酸酶水。本发明提供的上述定量试剂均保存于-20℃,并尽量减少反复冻融。
12、本发明还提供了一种不以疾病诊断和治疗为目的的快速广谱检测支原体的方法,采用上述任意一项所述试剂盒;用于定性检测采样样品、生物制品(包括生物制品的中间产品和终产品)中的支原体污染。生物制品包括细胞库、病毒种子库、基因治疗产品等制品。采样样品包括人体组织、血液样本等各种采样途径获得的样品。
13、本试剂盒能够检测的支原体种类如表1所示,总计能检测>132种、>410株支原体。
14、表1本发明提供的试剂盒能检测的支原体种类
15、 mollicutes(柔膜菌纲) no.of species(物种数) no.of strain(菌株数) mycoplasma sp. 101 328 spiroplasma sp. 14 35 ureaplasma sp. 5 28 entomoplasma sp. 4 5 acholeplasma sp. 8 14 total(总计) 132 410
16、优选地,上述快速广谱检测支原体的方法,包括以下步骤:
17、s1、取待测样品配制成供试品,将所述内控质粒加至供试品或qpcr反应液中;
18、将内控质粒用无菌生理盐水(0.9%的无菌nacl溶液)配制成阴性对照;将阳性对照基因组加入内控质粒和无核酸酶水并稀释配制成阳性对照;将内控质粒用无核酸酶水配制成无模板对照;
19、分别提取所述供试品和阴性对照中的核酸;
20、s2、在荧光定量pcr仪上创建所述第一荧光标记和第二荧光标记双通道,对供试品、阴性对照、阳性对照和无模板对照分别进行qpcr反应,分别读取双通道的ct值;
21、s3、针对ct值进行结果判定;
22、若支原体的第一荧光标记通道的ct值<40且有正常扩增曲线,则判定为支原体阳性;
23、若支原体的第一荧光标记通道和内控的第二荧光标记通道均无ct值,则判定为pcr抑制;
24、若支原体的第一荧光标记通道无ct值,内控的第二荧光标记通道ct值<40且有正常扩增曲线,则判定为支原体阴性;
25、若支原体的第一荧光标记通道ct值≥40且有正常扩增曲线,内控的第二荧光标记通道ct值<40且有正常扩增曲线,则判定检测结果无效;
26、若支原体的第一荧光标记通道ct值≥40且有正常扩增曲线,内控的第二荧光标记通道无ct值,则判定为pcr抑制。
27、需要说明的是,上述快速广谱检测支原体的方法中,内控质粒可以选择直接加在供试品中,即在提取供试品核酸之前就已经加入内控质粒;也可以选择在进行qpcr之前,加在qpcr反应液中,即在提取供试品核酸之后加入内控质粒。这两种内控质粒的加入方法都属于本发明的保护范围。
28、还需要说明的是,当选择内控质粒直接加在供试品中时,先将待测样品离心沉淀细胞,然后采用以下4种中的任意1种方法加入内控质粒:
29、第一种,直接取上清液,加入内控质粒后配制成供试品备用;第二种,取上清液再次离心富集支原体,再次去除上清后重悬支原体,加入内控质粒后配制成供试品;第三种,取上清液重悬(106)细胞沉淀,再加入内控质粒后配制成供试品;第四种,取上清液再次离心富集支原体,再次去除上清后重悬支原体,然后重悬细胞沉淀,再加入内控质粒后配制成供试品。
30、当选择加在qpcr反应液中时,与上述4种方法的区别就在于在配制供试品时不加入任何内控质粒,而是将定量的内控质粒和qpcr反应液混合均匀,直接配置成混合液。在需要qpcr反应前,取定量的混合液和样品模板混合均匀,随后进行qpcr反应;并且做若干个重复。
31、上述内控质粒的具体加入方法同样属于本发明的保护范围。
32、上述检测方法以细胞培养物为例,具体步骤如下:
33、s1、供试品处理(内控质粒在样本提取前加入时):
34、取1ml细胞培养悬液或培养上清于1.5ml ep管中,500g离心5min,沉淀细胞;取200μl上清液于另一1.5ml ep管中,加入5μl内控质粒后配制成供试品备用;
35、或者,取1ml细胞培养悬液或培养上清于1.5ml ep管中,500g离心5min,沉淀细胞;取去除细胞沉淀的上清液1ml于另一1.5ml ep管中,4℃20000g离心10min,富集支原体,小心去除上清,但不要吸走支原体(可留下20-30μl上清),用170μl 0.9%的无菌nacl溶液重悬支原体,加入5μl内控质粒后配制成供试品备用;
36、或者,取1ml细胞培养悬液或培养上清于1.5ml ep管中,500g离心5min,沉淀细胞;取200μl上清液重悬106细胞沉淀,再加入5μl内控质粒后配制成供试品备用;
37、或者,取1ml细胞培养悬液或培养上清于1.5ml ep管中,500g离心5min,沉淀细胞;取去除细胞沉淀的上清液1ml于另一1.5ml ep管中,4℃20000g离心10min,富集支原体,小心去除上清,但不要吸走支原体(可留下20-30μl上清),用170μl 0.9%的无菌nacl溶液重悬支原体;用重悬液重悬106细胞沉淀,再加入5μl内控质粒后配制成供试品备用;
38、阴性对照(nec)处理:取195μl 0.9%的无菌nacl溶液,加入5μl内控质粒,待提取;
39、采用qiaamp minelute virus spin kit(qiagen,57704)对供试品和阴性对照进行核酸提取。用100μl无rna酶水(65℃预热)进行洗脱,并将洗脱液重新加入入离心柱,进行二次洗脱,分别得到样品模板和阴性对照模板;
40、阳性对照(pc)处理:取0.5μl阳性对照基因组、0.5μl内控质粒加入9μl无核酸酶水,进行20倍稀释,配制成阳性对照备用;
41、无模板对照(ntc)处理:取0.5μl内控质粒加入9.5μl无核酸酶水,进行20倍稀释,配制成无模板对照备用;
42、s2、pcr反应管制备:pcr反应管的制备及加样操作应于冰盒上进行;
43、供试品管:依次取qpcr反应液15μl、样品模板10μl,混合均匀,总反应体积25μl,做2个重复孔。
44、阴性对照nec管:依次取qpcr反应液15μl、阴性对照模板10μl,混合均匀,总反应体积25μl,做2个重复孔。
45、阳性对照pc管:取10μl阳性对照、15μl qpcr反应液混合均匀,总反应体积25μl,做2个重复孔。
46、无模板对照ntc管:取10μl无模板对照与15μl qpcr反应液混合均匀,总反应体积25μl,做2个重复孔。
47、在荧光定量pcr仪上创建所述第一荧光标记(例如fam)和第二荧光标记(例如hex)双通道,对供试品、阴性对照、阳性对照和无模板对照分别进行qpcr反应,qpcr反应条件为:①37℃,2min;②95℃,5min;③以95℃,15sec;53℃,25sec;72℃,20sec为一个循环,单次循环后读板,共45个循环;分别读取双通道的ct值;
48、s3、针对ct值进行结果判定。
49、根据特定qpcr仪设备及配套控制软件选择ct值读取模式,以bio-rad cfx96为例,cq determination mode选择regression模式,或者选择single threshold mode,手动拖拽阈值线至阳性对照线性扩增起始位置。读取检测样本、阴性对照nec、阳性对照pc、无模板对照ntc的ct值。nec、pc、ntc的检测结果应为下表2所示。
50、表2质控结果分析
51、支原体样品结果判定遵循下表3的原则。
52、表3支原体样品检测结果判定
53、需要说明的是,上述步骤s2的供试品管的制备操作方法,前提是步骤s1在供试品处理时已经提前将内控质粒加入待测样品中,即内部控制对照在样本提取前加入作为包括提取及pcr整个过程的对照。此时,支原体阴性样本中(fam:无ct读值)内部控制对照(内控hex通道)的ct值与阴性对照nec中ct值间隔应在±3cycles范围之内。
54、若选择内部控制对照加在qpcr反应液中,则上述步骤s2的供试品管的制备操方法可以具体为:先取15μl qpcr反应液与0.5μl内控质粒混合均匀,配置成混合液;然后取所述混合液15μl与样品模板10μl,混合均匀,总反应体积25μl,做2个重复孔。此时,支原体阴性样本中(fam:无ct读值)内部控制对照(内控hex通道)的ct值与阴性对照nec中ct值间隔应在±2cycles范围之内。
55、总而言之,本发明提供的快速广谱检测支原体的方法中,内控质粒的加入方法有多种选择。不论是加至供试品中,还是在qpcr反应前加至qpcr反应液中,内控质粒的加入方法都属于本发明的保护范围。
56、与现有技术相比,本发明的有益之处在于:
57、1、与药典支原体检测传统方法比,本试剂盒及检测方法的一个明显优势即操作简便,时间周期短、所使用的样本量少,可为生物制品特别是细胞治疗产品早期支原体污染监控及产品快速放行提供重要参考;
58、2、与国内市场常用的普通pcr快速支原体检测相比,本试剂盒中的引物探针所检测的支原体种类覆盖度广,可以检测>132种、>410株支原体;专属性强,不会与细菌、真菌、人类及动物细胞、常见病毒发生交叉反应;灵敏度高,核酸检测限在0.1-0.5copies/μl,即1-5copies/reaction,支原体灵敏度可达10cfu/ml以下;耐用性强,满足欧洲药典及日本药典支原体nat法验证指南的要求,本试剂盒及检测方法有望批准作为对时效性要求较高的细胞治疗类等生物制品的快速检验放行的方法,解决国内目前对这类产品的快速放行主要依靠国外进口试剂盒的不足;
59、3、本试剂盒中加入了内部控制系统(内控质粒和内控探针),可监测提取得率以及样品中可能存在的pcr抑制情况,避免假阴性的出现,结果判断更加准确可靠。
- 还没有人留言评论。精彩留言会获得点赞!