诱导间充质干细胞分化为类胰岛细胞团的方法与流程
本发明涉及一种诱导间充质干细胞分化为类胰岛细胞团的方法,属于胚胎发育与组织再生医学。
背景技术:
1、糖尿病是一种全身性代谢疾病,能够引发多器官并发症,包括糖尿病肾病、眼底血管病变、糖尿病足等,是已知并发症最多的疾病,严重影响患者的生活质量。糖尿病患者若血糖控制不佳,可诱发酮症酸中毒和高渗性高血糖血症,威胁患者的生命。其中,ⅰ型糖尿病是由胰岛β细胞功能缺陷导致的胰岛素分泌不足所致,ⅱ型糖尿病则由体内胰岛素抵抗所导致的相对胰岛素不足所致。糖尿病患者的慢病管理过程漫长且繁琐,包括长期的生活干预、血糖检测、口服药物治疗和持续的胰岛素替代治疗,繁杂的治疗过程降低了患者的依从性。因此,近年来有许多研究探索细胞替代治疗的可行性。
2、胰岛直接移植是最早的细胞替代疗法,国外研究者从刚刚脑死亡的患者获取胰腺样本,往主胰管中注入胶原酶进行消化,然后在显微镜下分选胰岛,移植给糖尿病患者。但是,这样的方法有明显的弊端:首先,符合条件的脑死亡捐献者非常稀缺,因此胰岛的来源不足;其次,胶原酶消化胰腺的时间难以把握,并且在显微镜下手工分离胰岛的操作困难,对操作者的操作水平要求较高;再次,捐献者的胰岛在进入糖尿病患者体内后,会受到宿主免疫系统的攻击,因免疫排斥反应而存活率不佳。
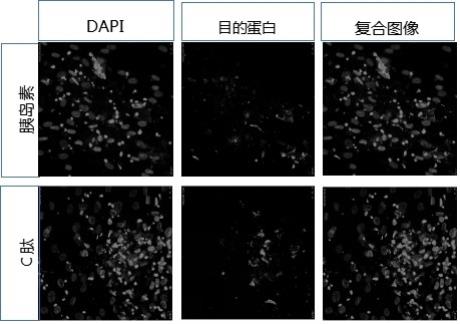
3、干细胞来源充足,为糖尿病的细胞替代疗法开拓了新的思路。目前,世界上有几百项登记注册的干细胞治疗糖尿病临床试验。有些研究者将干细胞直接注射入糖尿病患者的血管或肝脏中,有的研究者则在体外诱导干细胞分化为具有胰岛素分泌功能的类胰岛细胞团后,再通过微囊包裹的方式移植到糖尿病患者体内。2006年,kevin等人建立了将esc诱导为类胰岛细胞团的方法,这项研究首次完成了干细胞在体外的诱导分化,并且得到了能够分泌胰岛素、胰高血糖素、生长抑素等的细胞产品,具有里程碑意义。2014年,douglas等人建立了将ipsc诱导为类胰岛细胞团的方法,并证实该细胞团在移植到小鼠肾被膜下后,可分泌胰岛素进入血液循环。2023年3月10日,美国食品和药物管理局(fda)批准了vx-264启动临床试验,vx-264是一种由免疫保护装置包裹的干细胞衍生胰岛,在不需要使用免疫抑制剂的情况下,具有功能性治愈ⅰ型糖尿病的潜力。
4、但是,无论是胚胎干细胞(esc)还是诱导多能干细胞(ipsc),都存在安全性问题,即潜在的致瘤性。2022年3月,云南省肿瘤医院研究人员报告了一例在接受ipsc衍生细胞治疗后出现不成熟畸胎瘤的病例,且该畸胎瘤比一般的畸胎瘤更具侵袭性。干细胞因其多向分化潜能受到关注和重视,也因其分化不确定性而受到质疑。在2013年,王玲等人提出,esc是一群异质性细胞,分化过程中的残留现象可能是其固有的特性。而ipsc则在制备细胞过程中,就激活了“癌基因”,如c-myc等。除此之外,制备esc细胞时,种子细胞来源还可能涉及伦理学问题。
5、理想的干细胞衍生胰岛应满足以下四个条件:一、作为分化起点的干细胞,应该有充足的来源,容易制备,且不涉及伦理学问题;二、作为分化终点的类胰岛细胞团,应该有充分的安全性保证,不会在移植后致瘤;三、分化过程简洁,可操作性强,各个分化阶段的培养基易于配制;四、分化效果稳定,有充足的证据表明类胰岛细胞团具有分泌胰岛素的功能。然而,目前制备干细胞衍生胰岛的方案,使用的大多是ipsc或esc,存在分化不确定性大,难以定向分化,致瘤风险高,分化步骤多且繁琐,分化效率低等不足之处。
6、中国发明专利申请cn 110423720 a公开了一种利用人羊膜上皮干细胞诱导分化为具有生物功能的胰岛β细胞的方法,包括以下步骤:1)羊膜上皮干细胞的分离、培养、扩增、鉴定;2)体外诱导分化:实验选择第2~3代羊膜上皮干细胞,用含有尼克酰胺的培养基进行诱导分化。经体外14天分化得到能够表达胰岛β细胞特异性标志物及具有正常胰岛β细胞功能的胰岛素分泌细胞;3)体内移植:将诱导产生的胰岛素分泌细胞移植到1型糖尿病小鼠体内,可明显缓解小鼠高血糖状态。其分化使用了两种诱导培养基。
技术实现思路
1、针对上述现有技术,本发明提供了一种诱导间充质干细胞分化为类胰岛细胞团的方法。
2、本发明是通过以下技术方案实现的:
3、一种诱导间充质干细胞分化为类胰岛细胞团的方法,包括以下步骤:
4、(1)取间充质干细胞,接种至培养板中,加入干细胞基础培养基,37℃、5%co2条件下培养1天;
5、(2)上述培养1天后,细胞贴壁,进入分化阶段1,将培养液换为含有10%(体积百分数)胎牛血清(fbs)的dmem/f12培养基,37℃、5%co2条件下共培养3天,培养过程中进行1次换液;
6、(3)上述共培养3天后,进入分化阶段2,换液为神经细胞条件培养基(neuronal-conditioned medium, ncm),37℃、5%co2条件下共培养5天,培养过程中进行1次换液;
7、(4)上述共培养5天后,进入分化阶段3,换液为分化培养基,37℃、5%co2条件下共培养9天,培养过程中每2天进行1次换液,共计加入分化培养基5次;即得类胰岛细胞团;
8、所述分化培养基由以下组分组成:15~20 mm葡萄糖,8~12 mm烟酰胺,8~12 nmexendin-4(艾塞那肽),8~12 nm五肽胃泌素,80~120 pm肝细胞生长因子,8~12μm 5-羟色胺(5-ht),8~12μm丁酰胺,0.08~0.12 mg/ml tpo(促血小板生成素),1%~5%(体积百分数)的b27无血清添加剂,余量为dmem/f12培养基。
9、进一步地,所述步骤(1)中,间充质干细胞为脐带间充质干细胞。
10、进一步地,所述步骤(1)中,接种密度为2×105细胞/孔。
11、进一步地,所述步骤(1)中,每孔加入2 ml的培养基。
12、进一步地,所述步骤(1)中,所述干细胞基础培养基为现有技术中已有的商品化培养基,可以选自达科为的达优间充质干细胞基础培养基(货号:6114011)。
13、进一步地,所述步骤(3)中,神经细胞条件培养基是通过以下方法制备得到的:取大鼠脑,置于含10% fbs的dmem/f12培养基中,匀浆将大鼠脑彻底磨碎,50μm细胞滤网过滤得细胞悬液;细胞悬液在37℃、5%co2条件下培养20~28小时;取出培养的上清,向上清中补加含10% fbs的dmem/f12培养基,37℃、5%co2条件下培养4天;收集培养的上清,离心,过0.22μm细胞滤网,即得神经细胞条件培养基。
14、进一步地,所述步骤(4)中,分化培养基由以下组分组成:17.5 mm葡萄糖,10 mm烟酰胺,10 nm exendin-4,10 nm五肽胃泌素,100 pm肝细胞生长因子,10μm 5-羟色胺,10μm丁酰胺,0.1 mg/ml tpo,2%的b27无血清添加剂,余量为dmem/f12培养基。
15、本发明的诱导间充质干细胞分化为类胰岛细胞团的方法,采用临床上取材方便、来源丰富的脐带间充质干细胞,建立稳定的间充质干细胞分离和分化体系,以间充质干细胞为起点,诱导其分化为类胰岛细胞团。间充质干细胞分化不确定性相对较小,临床应用更加安全,而且提取间充质干细胞的过程也不会违背伦理学原则。尽管研究者也顾虑间充质干细胞的致瘤风险,但多年的临床应用显示,尚未有此类事件发生。以往诱导esc或ipsc分化的操作流程,大多分为4~6个分化阶段,历时一个月左右,每个分化阶段需要分别配制不同的分化培养基,配制过程繁琐。而本发明的诱导间充质干细胞分化的流程,只有3个分化阶段,历时17天即可完成,用时短,只需配制一种分化培养基,操作简便。本发明的诱导间充质干细胞分化为类胰岛细胞团的方法,效果显著,具有良好的应用前景,对糖尿病的细胞替代疗法的发展具有重要意义。
16、本发明使用的各种术语和短语具有本领域技术人员公知的一般含义。
- 还没有人留言评论。精彩留言会获得点赞!