工程化的腺苷脱氨酶及碱基编辑器的制作方法
本公开涉及工程化的腺苷脱氨酶、基于这些腺苷脱氨酶的碱基编辑器以及包含这些碱基编辑器的复合物。本公开还涉及编码工程化的腺苷脱氨酶的多核苷酸、密码子优化的多核苷酸、包含这些核苷酸的载体以及包含这些载体的细胞。本公开还涉及包含所述碱基编辑器、复合物、载体或细胞的药物组合物,以及使用所述碱基编辑器、复合物、载体、细胞或药物组合物治疗疾病的方法和用途。
背景技术:
1、2016年,科学家首次基于crispr-cas9系统结合化学生物学和基因编辑的方法,开发出单碱基编辑(be)技术,可以在不产生dna双链断裂(double strand breaks,dsbs)的情况下精确实现单个碱基的转换,从而有效地规避了由于双链dna断裂后非同源末端连接修复(non-homologous end joining,nhej)和同源重组修复(homology directed repair,hdr)所带来的基因编辑技术的不足。随后,科学家开发出基于e.coli tada(ectada)的新型单碱基编辑器——腺嘌呤单碱基编辑技术(adenine base editor,abe),实现了靶位点a到g和互补链的t到c的精确转换。目前,abe系统在基础生物学和医学领域应用广泛,主要体现在以下几个方面:(1)实现非分裂细胞的精准编辑;(2)基因功能筛选;(3)提前终止密码子的创建和纠正;(4)保守功能氨基酸的鉴定;(5)剪接位点变体的创建;(6)加速单个碱基位点处的功能缺失或功能获得性研究;(7)单碱基突变引起的遗传性疾病的临床治疗及基础理论研究。
2、目前的腺嘌呤碱基编辑器(abe),由rna引导的cas蛋白与作用于单链dna(ssdna)的腺苷脱氨酶融合而成。当融合蛋白在引导rna(如sgrna)的引导下靶向基因组dna时,腺苷脱氨酶可结合到ssdna上,将特定位置的腺嘌呤(a)脱氨变成肌苷(i),i在dna水平会被当做g进行读码与复制,最终实现a·t碱基对至g·c碱基对的直接替换。目前的abe7.10和miniabemax,需要较长时间才能完成反应,效率都很低,运行缓慢;科学家在abe7.10的基础上进一步改进,得到包含单个脱氨酶结构(tada-8e)而能同时对多个腺嘌呤进行脱氨的abe8e。但是,目前此类能高效对多个腺嘌呤进行脱氨的腺苷脱氨酶和碱基编辑器种类较少,限制了其在商业上的应用。
技术实现思路
1、本发明的一个方面提供一种腺苷脱氨酶,其相对于seq id no:1所示序列在以下位点中的一个、多个或全部具有氨基酸取代:w23、y36、p48、h51、l84、a106、d108、v109、k110、t111、d119、g122、h123、s146、f149、r152、h156、k157、e168和e169,并且其氨基酸序列与seq id no:1所示序列具有约70%至约99.5%的序列同一性。
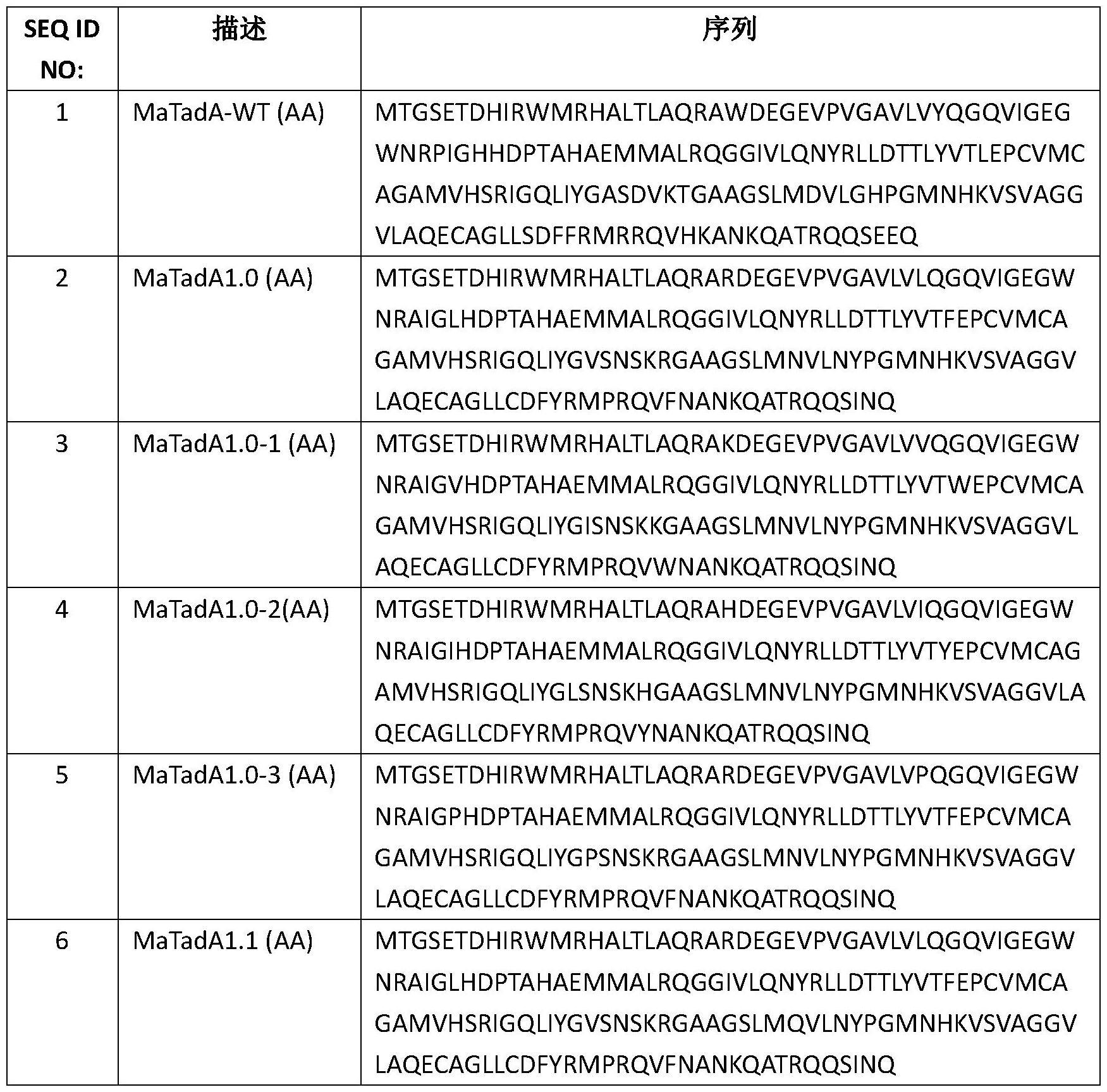
2、本发明的一个方面提供一种腺苷脱氨酶,其包含选自seq id no:2至10任一项所示的氨基酸序列或与它们各自具有至少约80%的序列同一性的氨基酸序列。
3、本发明的一个方面提供一种腺苷脱氨酶,其相对于seq id no:12所示序列在以下位点中的一个、多个或全部具有氨基酸取代:e22、t47、l83、a105、d107、f108、t110、d118、r121、s145、f148、r151、e154、k156、v167和e168,并且其氨基酸序列与seq id no:12所示序列具有约70%至约99.5%的序列同一性。
4、本发明的一个方面提供一种腺苷脱氨酶,其包含选自seq id no:13至16任一项所示的氨基酸序列或与它们各自具有至少约80%的序列同一性的氨基酸序列。
5、本发明的一个方面提供一种腺苷脱氨酶,其相对于seq id no:17所示序列在以下位点中的一个、多个或全部具有氨基酸取代:w22、q35、p47、y50、l83、a105、d107、e108、t110、d118、g121、h122、s145、f148、r151、e154、k155和k156,并且其氨基酸序列与seq idno:17所示序列具有约70%至约99.5%的序列同一性。
6、本发明的一个方面提供一种腺苷脱氨酶,其包含选自seq id no:18至21任一项所示的氨基酸序列或与它们各自具有至少约80%的序列同一性的氨基酸序列。
7、本发明的一个方面提供一种碱基编辑器,其包含本发明提供的任何一种腺苷脱氨酶;以及所述碱基编辑器与引导rna形成的复合物。
8、本发明的其他方面提供编码本发明提供的任何一种腺苷脱氨酶或碱基编辑器的多核苷酸;包含所述多核苷酸的载体;包含所述载体的细胞;以及包含所述碱基编辑器、所述复合物、所述载体或所述细胞的药物组合物。
9、本发明还提供了使用本发明提供的任何一种腺苷脱氨酶或碱基编辑器的多核苷酸;包含所述多核苷酸的载体;包含所述载体的细胞;或包含所述碱基编辑器、所述复合物、所述载体或所述细胞的药物组合物治疗疾病的方法。
10、本发明还提供了本发明提供的任何一种腺苷脱氨酶或碱基编辑器的多核苷酸;包含所述多核苷酸的载体;包含所述载体的细胞;或包含所述碱基编辑器、所述复合物、所述载体或所述细胞的药物组合物在制备治疗疾病中的药物中的应用。
11、本发明还提供了用于治疗疾病的本发明提供的任何一种腺苷脱氨酶或碱基编辑器的多核苷酸;包含所述多核苷酸的载体;包含所述载体的细胞;或包含所述碱基编辑器、所述复合物、所述载体或所述细胞的药物组合物。
技术特征:
1.腺苷脱氨酶,其相对于seq id no:1所示序列在以下位点中的一个、多个或全部具有氨基酸取代:w23、y36、p48、h51、l84、a106、d108、v109、k110、t111、d119、g122、h123、s146、f149、r152、h156、k157、e168和e169,并且其氨基酸序列与seq id no:1所示序列具有约70%至约99.5%的序列同一性。
2.根据权利要求1所述的腺苷脱氨酶,其中:
3.根据权利要求1或2所述的腺苷脱氨酶,其中腺苷脱氨酶包含选自seq id no:2至10任一项所示的氨基酸序列或与它们各自具有至少约80%的序列同一性的氨基酸序列。
4.腺苷脱氨酶,其相对于seq id no:12所示序列在以下位点中的一个、多个或全部具有氨基酸取代:e22、t47、l83、a105、d107、f108、t110、d118、r121、s145、f148、r151、e154、k156、v167和e168,并且其氨基酸序列与seq id no:12所示序列具有约70%至约99.5%的序列同一性。
5.根据权利要求4所述的腺苷脱氨酶,其中:
6.根据权利要求4或5所述的腺苷脱氨酶,其中腺苷脱氨酶包含选自seq id no:13至16任一项所示的氨基酸序列或与它们各自具有至少约80%的序列同一性的氨基酸序列。
7.腺苷脱氨酶,其相对于seq id no:17所示序列在以下位点中的一个、多个或全部具有氨基酸取代:w22、q35、p47、y50、l83、a105、d107、e108、t110、d118、g121、h122、s145、f148、r151、e154、k155和k156,并且其氨基酸序列与seq id no:17所示序列具有约70%至约99.5%的序列同一性。
8.根据权利要求7所述的腺苷脱氨酶,其中:
9.根据权利要求7或8所述的腺苷脱氨酶,其中腺苷脱氨酶包含选自seq id no:18至21任一项所示的氨基酸序列或与它们各自具有至少约80%的序列同一性的氨基酸序列。
10.包含权利要求1至9任一项所述的腺苷脱氨酶的碱基编辑器。
11.根据权利要求10所述的碱基编辑器,其进一步包含胞苷脱氨酶结构域。
12.根据权利要求10所述的碱基编辑器,其进一步包含第二腺苷脱氨酶结构域,所述第二腺苷脱氨酶结构域与权利要求1至9任一项所述的腺苷脱氨酶相同或不同。
13.根据权利要求10至12的任一项所述的碱基编辑器,其进一步包含一个或多个核定位序列。
14.根据权利要求10至13任一项所述的碱基编辑器,其中所述碱基编辑器进一步包括可编程的dna结合结构域,所述可编程的dna结合结构域选自cas9结构域或cas12结构域;优选为dcas9结构域或ncas9结构域。
15.根据权利要求10至14任一项所述的碱基编辑器,其中所述碱基编辑器包含选自seqid no:46至54的氨基酸序列或与seq id no:46至54的氨基酸序列具有至少80%序列同一性的氨基酸序列。
16.包含权利要求14或15所述的碱基编辑器和引导rna的复合物,所述引导rna连接至碱基编辑器的可编程的dna结合结构域。
17.编码权利要求1至9任一项所述的腺苷脱氨酶或权利要求10至15任一项所述的碱基编辑器的多核苷酸。
18.包含权利要求17所述的多核苷酸的载体。
19.包含权利要求18所述的载体的细胞。
20.一种药物组合物,其包含权利要求10至15任一项所述的碱基编辑器、权利要求16所述的复合物、权利要求18所述的载体或权利要求19所述的细胞。
技术总结
本文公开了工程化的腺苷脱氨酶、基于这些腺苷脱氨酶的碱基编辑器以及包含这些碱基编辑器的复合物。所述腺苷脱氨酶及碱基编辑器显示出良好的腺嘌呤编辑效果,实现DNA水平A·T碱基对向G·C碱基对的转变。
技术研发人员:陈柏洪,胡洋,余宇霖,林少芸,谭文琼
受保护的技术使用者:微光基因(苏州)有限公司
技术研发日:
技术公布日:2024/1/15
- 还没有人留言评论。精彩留言会获得点赞!