吡啶二甲酰亚胺化合物的制备方法与流程
本发明涉及医药化工,特别是涉及吡啶二甲酰亚胺化合物的制备方法。
背景技术:
1、盐酸莫西沙星是德国bayer公司研发的第四代喹诺酮类抗菌药,是新一代抗菌谱广的抗生素。该品主要用于治疗患有上下呼吸道感染的成人患者,具有广谱性,抗菌性强,不易产生耐药性以及不良反应少等优点,市场用量大,前景广阔。
2、目前合成盐酸莫西沙星的工艺如下:
3、
4、其中,所述合成盐酸莫西沙星工艺的难点在于其侧链合成工艺复杂,原辅料成本高,反应收率低等方面,从而导致盐酸莫西沙星生产成本较高。
5、吡啶二甲酰亚胺化合物作为合成盐酸莫西沙星侧链工艺的关键中间体,价格昂贵且不易获得。传统的吡啶二甲酰亚胺化合物合成方法以喹啉为原料,先经高锰酸钾等氧化剂氧化成吡啶二酸,再进行缩合反应合成吡啶二酸酐,最后通过内酰胺化反应得到吡啶二甲酰亚胺化合物,合成路线如下所示:
6、
7、然而,目前该合成路线环境污染严重,原料喹啉受原材料价格上涨,价格昂贵且不易获得。因此,发展一种具有原料易得、减少生产成本、反应收率高、环境友好型等特点的吡啶二甲酰亚胺化合物的制备方法,对本技术领域具有重要意义和价值。
技术实现思路
1、基于此,有必要针对上述问题,提供一种吡啶二甲酰亚胺化合物的制备方法,所述制备方法收率高、成本低、原料易得,并且反应条件温和、操作简单、易于实现,有利于工业化生产。
2、一种吡啶二甲酰亚胺化合物的制备方法,包括以下步骤:
3、将式(2)所示的第一化合物与式(3)所示的第二化合物进行反应,得到式(4)所示的吡啶二甲酰亚胺化合物,其中,r1、r2、r3、r4分别独立地选自氢、c1-c6的直链脂肪烷基、c1-c6的支链脂肪烷基、c1-c6的烷氧基或者c6-c10的芳香基;
4、
5、在其中一个实施例中,所述第一化合物与所述第二化合物的摩尔比为1:1.2-1:3.0;
6、及/或,r1、r2、r3、r4分别独立地选自氢、甲基、乙基、正丙基、异丙基、正丁基、异丁基、仲丁基、甲氧基、乙氧基、正丙氧基、异丙氧基、正丁氧基、异丁氧基、苯基、间甲基苯基、对甲基苯基或者苄基。
7、在其中一个实施例中,所述第一化合物与所述第二化合物在氧化剂的存在下进行反应,所述第一化合物与所述氧化剂的摩尔比为1:1.2-1:2.0。
8、在其中一个实施例中,所述第一化合物与所述第二化合物在氧化剂的存在下进行反应的步骤中,温度为60℃-160℃,时间为1h-10h;
9、及/或,所述氧化剂选自过渡金属氧化物、过氧化物或者醌类化合物。
10、在其中一个实施例中,所述第一化合物的制备方法包括以下步骤:
11、将马来酸酐与结构式为r1-nh2的第三化合物进行反应,得到式(1)所示的第一中间产物,其中,r1选自氢、c1-c6的直链脂肪烷基、c1-c6的支链脂肪烷基、c1-c6的烷氧基或者c6-c10的芳香基;
12、将所述第一中间产物进行反应,得到第一化合物;
13、
14、在其中一个实施例中,所述第三化合物与所述马来酸酐的摩尔比为1.2:1-2.0:1。
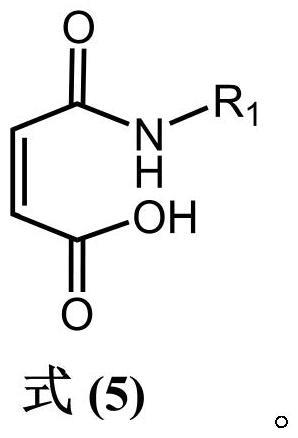
15、在其中一个实施例中,在将马来酸酐与第三化合物进行反应的步骤中,包括:将所述马来酸酐与所述第三化合物进行反应,先得到式(5)所示的第一预产物,然后所述第一预产物在烷基化试剂、碱性水溶液以及相转移催化剂的存在下进行反应,得到式(1)所示的第一中间产物,
16、
17、在其中一个实施例中,所述烷基化试剂、所述碱性水溶液中的溶质、所述相转移催化剂与所述马来酸酐的摩尔比为(1.2-2.0):(1.2-2.0):(0.01-0.08):1;
18、及/或,所述相转移催化剂选自季铵盐类相转移催化剂或者季磷盐类相转移催化剂,所述碱性水溶液中的溶质选自碳酸氢钠、碳酸氢钾、碳酸钠、碳酸钾、氢氧化钠或者氢氧化钾中的至少一种,所述烷基化试剂选自硫酸二烷基酯、芳磺酸烷基酯、磷酸三烷基酯中的至少一种。
19、在其中一个实施例中,将所述马来酸酐与所述第三化合物进行反应的步骤中,温度为0℃-10℃,时间为0.5h-2h;
20、及/或,所述第一预产物在烷基化试剂、碱性水溶液以及相转移催化剂的存在下进行反应的步骤中,温度为25℃-55℃,时间为10h-16h。
21、在其中一个实施例中,将所述第一中间产物进行反应的步骤中,包括:在碱性试剂条件下将所述第一中间产物与羟胺试剂反应,所述第一中间产物与所述羟胺试剂的摩尔比为1:1.0-1:2.0,所述第一中间产物与所述碱性试剂的摩尔比为1:2.0-1:3.0。
22、在其中一个实施例中,在碱性条件下将所述第一中间产物与羟胺试剂反应的步骤中,温度为45℃-70℃,时间为6h-12h;
23、及/或,所述羟胺试剂选自nh2-o-r·hcl,其中,r选自h、c1-c6的直链脂肪烷基或者c1-c6的支链脂肪烷基;
24、及/或,所述碱性试剂选自碳酸氢钠、碳酸氢钾、碳酸钠、碳酸钾、氢氧化钠、氢氧化钾、叔丁醇钾、叔丁醇钠、甲醇钠、甲醇钾中的至少一种。
25、在其中一个实施例中,将所述第一中间产物进行反应的步骤中,包括:
26、将所述第一中间产物与卤素单质进行反应,得到式(6)所示的第二预产物;
27、将所述第二预产物进行反应,得到式(7)所示的第三预产物;
28、将所述第三预产物与胺化剂进行反应,得到所述第一化合物;
29、
30、其中,x选自卤元素。
31、在其中一个实施例中,所述第一中间产物与所述卤素单质的摩尔比为1:1.0-1:2.0;
32、及/或,所述卤素单质选自cl2、br2、i2。
33、在其中一个实施例中,所述第二预产物在有机碱的存在下进行反应,所述第二预产物与所述有机碱的摩尔比为1:0.8-1:1.5,其中,所述有机碱选自胺类或者吡啶类。
34、在其中一个实施例中,所述胺化剂选自氨气或者氨水。
35、在其中一个实施例中,所述胺化剂选自氨气,氨气压力为0.1mpa-1.0mpa;
36、或者,所述胺化剂选自氨水,所述氨水的浓度是18wt%-25wt%,第三预产物与所述氨水中氨的摩尔比为1:3-1:15。
37、在其中一个实施例中,将所述第一中间产物与卤素单质进行反应的步骤中,温度为20℃-100℃,时间为2h-5h;
38、及/或,将所述第二预产物进行反应的步骤中,温度为0℃-80℃,时间为3h-12h;
39、及/或,将所述第三预产物与胺化剂进行反应的步骤中,温度为0℃-120℃,时间为1h-4h。
40、本发明所述的制备方法,利用第一化合物中的胺基与第二化合物中两端的不饱和双键进行环加成反应,构建得到吡啶二甲酰亚胺化合物。与传统工艺相比,本发明所述的制备方法具有(1)原料价格便宜易得,反应收率高;(2)反应条件简单温和,操作简单,工艺容易实现;(3)绿色、环保、经济等多方面优势,有利于工业化大规模生产和下游产品的制备,可以满足终端药物生产的巨大需求。
- 还没有人留言评论。精彩留言会获得点赞!