AZD5305盐酸盐的晶型及其制备方法和用途与流程
本公开涉及药物化学领域。具体而言,本公开涉及azd5305盐酸盐的晶型及其制备方法和用途。
背景技术:
1、多晶型或者多晶现象是某些分子和分子组合物的特有性质,相同的分子可能因不同的排列形式而形成不同晶体,而这些晶体具有不同的结构和物理性质,如溶解度、稳定性、热力学性质、机械性质、纯度和结晶度等。
2、已知不同的固体形式,例如药物活性成分的不同晶型(包括无水物、水合物、溶剂化合物等)可能具有不同的溶解度,会产生更具有加工优势或提供更好理化特性的物质,比如更好的生物利用度、储存稳定、易加工处理、易纯化或作为促进转化为其他晶型的中间体晶型。某些作为药学活性成分用的化合物的某特定晶型也可以帮助改善药物的性能。
3、azd5305是阿斯利康公司开发的第二代parp抑制剂,选择性抑制parp1,临床上单独或联合其他抗肿瘤药物用于治疗癌症如晚期实体瘤,或与新型激素药物(nhas)联合用于治疗转移性前列腺癌。azd5305的化学名称为:5-[4-[(7-ethyl-6-oxo-5h-1,5-naphthyridin-3-yl)methyl]piperazin-1-yl]-n-methylpyridine-2-carboxamide,结构如下式(i)所示:
4、
5、wo2021013735a1公开了azd5305的结晶形式form a,本公开的发明人通过研究发现,form a在室温下水中不能保持原有晶型,form a在0%rh至80%rh环境下,dvs增重约5.7%,form a制备成的片剂溶出差,可见现有技术的form a的稳定性不佳,吸湿性高,溶出低,药物开发价值低。
6、目前尚未公开关于该化合物盐酸盐晶型的相关报道。因此,有必要对azd5305盐酸盐进行全面系统的多晶型筛选,选择具有优良性质的盐酸盐晶型以用于azd5305的制剂产品开发。
技术实现思路
1、本公开提供azd5305盐酸盐及其晶型,其至少具有以下一种改进的特性:稳定性良好,引湿性低,溶解度好,溶出好,纯度高,流动性好,可加工性好例如可压性好、压片后的片剂更稳定,晶体形貌好,抗压性好,能稳定储存,避免药物在开发过程和储存中发生转晶,制备方法简单可靠,具有较大的开发价值。特别地,本公开的azd5305盐酸盐的结晶形式还具有至少以下之一的优点:更低的杂质含量以及更一致的产品品质,即更一致的物理化学特性,例如更一致的颜色、溶解速率、溶解度,更易于处理,以及在制剂中更好的稳定性。
2、本公开的一个方面,在于提供一种azd5305盐酸盐,其结构式如式(ii)所示:
3、
4、所述azd5305盐酸盐为结晶态。
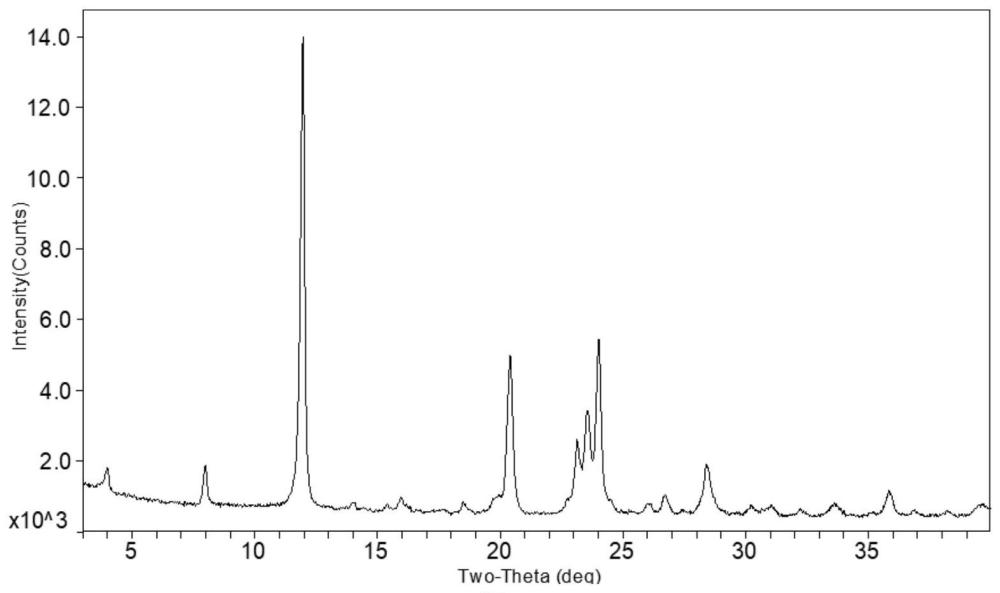
5、本公开的另一个方面,在于提供一种如式(ii)所示的azd5305盐酸盐的晶型i(以下简称晶型i),使用cu-kα辐射,所述晶型i以2θ角度表示的x-射线粉末衍射(xrpd)图谱在12.0°±0.2°、14.0°±0.2°和23.6°±0.2°中的至少一处有特征峰;优选为至少两处或三处有特征峰。
6、本公开优选技术方案中,所述晶型i的xrpd图谱进一步在8.0°±0.2°、15.4°±0.2°和20.4°±0.2°2θ中的至少一处有特征峰。
7、本公开优选技术方案中,所述晶型i的xrpd图谱进一步在18.5°±0.2°、23.1°±0.2°和27.5°±0.2°2θ中的至少一处有特征峰。
8、本公开优选技术方案中,所述晶型i的xrpd图谱进一步在24.0°±0.2°、28.4°±0.2°和31.1°±0.2°2θ中的至少一处有特征峰。
9、另一个方面,使用cu-kα辐射,所述晶型i的xrpd图谱在8.0°±0.2°、12.0°±0.2°、14.0°±0.2°、15.4°±0.2°、18.5°±0.2°、20.4°±0.2°、23.1°±0.2°、23.6°±0.2°、24.0°±0.2°、27.5°±0.2°、28.4°±0.2°和31.1°±0.2°2θ中任意1处、或2处、或3处、或4处、或5处、或6处、或7处、或8处、或9处、或10、或11处、或12处有特征峰。
10、非限制性地,所述晶型i的xrpd图谱在2θ值如下表的位置具有衍射峰:
11、
12、非限制性地,所述晶型i具有基本如图1或图5或图11所示的xrpd图谱。
13、非限制性地,所述晶型i具有基本如图1所示的xrpd图谱。
14、非限制性地,所述晶型i具有基本如图2或图6所示的tga图谱。
15、非限制性地,所述晶型i具有基本如图2所示的tga图谱。
16、非限制性地,所述晶型i具有基本如图3或图7所示的dsc图谱。
17、非限制性地,所述晶型i具有基本如图3所示的dsc图谱。
18、非限制性地,所述晶型i具有基本如图4所示的dvs图谱。
19、非限制的地,所述晶型i具有基本如图8所示的ft-ir图谱。
20、非限制性地,所述晶型i为无水物。
21、本公开的另一方面,提供了一种azd5305盐酸盐晶型i的制备方法,所述制备方法包括:
22、将azd5305在温度高于30℃条件下分散在溶剂1中,然后向其中滴加盐酸,搅拌,分离,干燥,得azd5305盐酸盐晶型i;其中所述溶剂1为与水互溶的溶剂;
23、所述溶剂1选自甲醇、乙醇、丙醇、丙酮、四氢呋喃、1,4-二氧六环、四氢呋喃和乙腈中的一种或多种;优选地为甲醇;
24、优选地,所述盐酸为37%(w/w)的氯化氢水溶液;
25、优选地,所述azd5305与盐酸的摩尔比为1:1-1:1.5;
26、优选地,所述azd5305和溶剂1的质量体积比(mg/ml)为5:1~35:1;更优选为20:1-30:1;
27、优选地,所述盐酸可先采用部分溶剂1稀释成盐酸溶液,再进行滴加操作;
28、优选地,所述分散在溶剂1中的温度为40-70℃;更优选为40-60℃;
29、优选地,所述滴加盐酸在室温环境中操作;所述滴加步骤可同时进行搅拌操作;
30、优选地,所述搅拌时间至少为5min;
31、优选地,所述干燥条件为室温真空干燥。
32、本公开所述azd5305盐酸盐晶型i具有以下有益效果:
33、1)稳定性好。azd5305盐酸盐晶型i分别在25℃/60%rh/敞口、40℃/75%rh/敞口条件下放置14天晶型保持不变,说明azd5305盐酸盐的晶型i具有较好的晶型稳定性;更进一步,azd5305盐酸盐晶型i在25℃/60%rh/敞口条件下至少可以保持晶型稳定45天,储存过程中化学纯度基本保持不变,在99.5%以上。说明晶型i在长期条件下可以保持良好的化学稳定性和晶型稳定性。
34、2)引湿性低。azd5305盐酸盐晶型i的引湿增重仅为现有技术form a的19%,大大优于现有技术的晶型a。晶型i在0%rh至80%rh环境下,增重约1.1%,现有技术azd5305游离态晶型form a的引湿性在相同湿度范围下增重约5.7%。另外,azd5305盐酸盐的晶型i的引湿性还大大优于本技术人制备得到的azd5305硫酸盐晶型和磷酸盐晶型。本技术人制备得到的硫酸盐tga图谱显示在室温至150°c间具有约4.95%的缓慢失重,其吸湿是本技术的晶型i的4倍多。
35、3)易于分散和溶解。以1mg/ml分散在水中时,azd5305盐酸盐晶型i比现有技术的azd5305游离态晶型form a有更好的分散和溶解现象,有利于成药,达到理想的药物生物利用度和药效,满足药用要求。
36、4)溶解度高。azd5305盐酸盐晶型i在水中的溶解度是现有技术form a的111.6倍,在ph4.5醋酸盐缓冲液中的溶解度是现有技术form a的1.4倍。晶型i在水和ph4.5醋酸盐缓冲液中的表观溶解度分别为3570ug/ml和372ug/ml,现有技术form a在水和ph4.5醋酸盐缓冲液中的表观溶解度分别为32ug/ml和260ug/ml。
37、5)溶出好。azd5305盐酸盐晶型i片剂的累积溶出度是现有技术form a片剂的12.1倍,说明azd5305盐酸盐晶型i相较于现有技术具有明显的生物利用度优势。azd5305盐酸盐晶型i片剂在水中120分钟的累积溶出度为80.8%,而现有技术form a仅为6.7%。
38、6)粒径分布均匀。azd5305盐酸盐晶型i可以直接应用于制剂工艺中,避免了复杂的原料药前处理过程,简化工艺过程,降低生产成本,提高药物制剂的均一性,使药物制剂的质量更加可控。
39、7)结晶度好。
40、8)制备方法简单,重复性高,具有可产业化前景。
41、综上,本技术的azd5305盐酸盐晶型i具有预料不到的综合技术效果,在结晶度、稳定性、吸湿性、溶解度、溶出、可压性等各方面都展示其优良的特性。
42、本公开的另一方面,在于提供一种azd5305盐酸盐的晶型ii,使用cu-kα辐射,所述晶型ii具有基本如图14所示的xrpd图谱。
43、非限制性地,所述晶型ii的ft-ir图谱基本如图15所示。
44、本公开的另一个方面,在于提供一种结构式如式(ii)所示的azd5305盐酸盐晶型iii(以下简称晶型iii),使用cu-kα辐射,所述晶型iii以2θ角度表示的x-射线粉末衍射(xrpd)图谱在10.0°±0.2°、18.3°±0.2°、26.0°±0.2°和28.1°±0.2°中的至少一处有特征峰;优选为至少两处或三处或四处有特征峰。
45、本公开优选技术方案中,所述晶型iii的xrpd图谱进一步在9.2°±0.2°、14.8°±0.2°、20.5°±0.2°和22.0°±0.2°2θ中的至少一处有特征峰。
46、本公开优选技术方案中,所述晶型iii的xrpd图谱进一步在15.3°±0.2°、17.5°±0.2°、19.6°±0.2°和32.6°±0.2°2θ中的至少一处有特征峰。
47、另一个方面,使用cu-kα辐射,所述晶型iii的xrpd图谱在9.2°±0.2°、10.0°±0.2°、14.8°±0.2°、15.3°±0.2°、17.5°±0.2°、18.3°±0.2°、19.6°±0.2°、20.5°±0.2°、22.0°±0.2°、26.0°±0.2°、28.1°±0.2°和32.6°±0.2°2θ中任意1处、或2处、或3处、或4处、或5处、或6处、或7处、或8处、或9处、或10、或11处、或12处有特征峰。
48、非限制性地,所述晶型iii的xrpd图谱在2θ值如下表的位置具有衍射峰:
49、
50、非限制性地,所述晶型iii具有基本如图16或图20或图22所示的xrpd图谱。
51、非限制性地,所述晶型iii具有基本如图16所示的xrpd图谱。
52、非限制性地,所述晶型iii为水合物。
53、本公开优选技术方案中,所述晶型iii的ft-ir(傅里叶红外)图谱在3385cm-1±2cm-1、1654cm-1±2cm-1、1579cm-1±2cm-1、1526cm-1±2cm-1、1496cm-1±2cm-1和1464cm-1±2cm-1中的至少一处有谱带。
54、本公开优选技术方案中,所述晶型iii的ft-ir图谱在1407cm-1±2cm-1、1224cm-1±2cm-1、963cm-1±2cm-1、702cm-1±2cm-1、679cm-1±2cm-1和624cm-1±2cm-1中的至少一处有谱带。
55、非限制性地,所述晶型iii具有基本如图19所示的ft-ir图谱。
56、非限制性地,所述晶型iii具有基本如图17或图21所示的tga图谱。
57、非限制性地,所述晶型iii具有基本如图18所示的dsc图谱。
58、非限制性地,所述晶型iii具有基本如图23所示的dvs图谱。
59、本公开的另一个方面,提供了一种azd5305盐酸盐的制备方法,所述制备方法包括使azd5305和盐酸反应。
60、本公开的另一个方面,提供了一种azd5305盐酸盐晶型iii的制备方法,所述制备方法选自以下方法中的任一种:
61、1)将azd5305盐酸盐在水中或含水溶剂中形成混悬液,然后晶浆,离心,干燥,得azd5305盐酸盐晶型iii;
62、优选地,所述含水溶剂选自醇类、酮类、四氢呋喃、1,4-二氧六环和乙腈中的任一种或其混合;
63、优选地,所述醇类选自甲醇、乙醇或丙醇中的任一种或其混合;
64、优选地,所述酮类选自丙酮;
65、优选地,所述azd5305盐酸盐在水中形成混悬液;
66、优选地,所述晶浆的温度≤40℃;优选为-10℃-30℃;
67、优选地,所述晶浆的时间≥0.5h;
68、优选地,所述干燥方式为真空干燥;
69、优选地,制备方法中所述的azd5305盐酸盐选自非晶型iii的其他结晶态或非结晶态;更优选地,所述azd5305盐酸盐为盐酸盐晶型i;
70、2)将azd5305盐酸盐晶型i在一定湿度环境中放置,得到azd5305盐酸盐晶型iii;其中,所述放置时间≥14天;
71、优选地,所述湿度环境是相对湿度为≥80%rh,更优选为85%rh-97%rh。
72、本公开所述azd5305盐酸盐晶型iii具有以下有益效果:
73、1)稳定性好。azd5305盐酸盐晶型iii分别在长期(25℃/60%rh/敞口)、加速(40℃/75%rh/敞口)和高湿(97%rh/敞口)条件下放置14天晶型保持不变,且azd5305盐酸盐晶型iii在水中稳定性好,说明本公开的azd5305盐酸盐晶型iii具有较好的稳定性,更适合制备成固体制剂。更进一步,晶型iii在25℃/60%rh、40℃/75%rh和25℃/97%rh条件下至少可以保持晶型稳定45天,储存过程中化学纯度基本保持不变,在99.5%以上,说明晶型iii不仅在在长期和加速可以保持良好的化学稳定性和晶型稳定性,在更严苛的条件下,也可以保持良好的化学稳定性和晶型稳定性。
74、2)引湿性低。azd5305盐酸盐晶型iii的引湿增重仅为现有技术form a的17.5%,大大优于现有技术form a。晶型iii在0%rh至80%rh dvs检测时,增重约1.0%,而现有技术azd5305游离态晶型form a的引湿性在相同湿度范围下增重约5.7%。另外,azd5305盐酸盐的晶型iii的引湿性还大大优于本技术人制备得到的azd5305硫酸盐晶型和磷酸盐晶型。本技术的晶型iii在40%rh-80%rh的吸附阶段仅吸附0.1%水分,而硫酸盐晶型在40%rh-80%rh的吸附阶段吸附了1%的水分,二者相差10倍;硫酸盐晶型在0%rh-80%rh的范围吸附6.3%的水分,盐酸盐晶型iii的吸湿只有硫酸盐晶型的17%。
75、3)易于分散和溶解。以1mg/ml分散在水中时,azd5305盐酸盐晶型iii比现有技术的azd5305游离态晶型form a有更好的分散和溶解现象,有利于达到理想的药物生物利用度和药效,满足药用要求。
76、4)溶解度好。azd5305盐酸盐晶型iii在水中的溶解度是现有技术form a的128.4倍,在ph4.5醋酸盐缓冲液中的溶解度是现有技术form a的4.4倍。晶型iii在水中的溶解度为4110ug/ml,在ph4.5醋酸盐缓冲液的表观溶解度为1134ug/ml,现有技术form a在水中和ph4.5醋酸盐缓冲液的溶解度分别为32ug/ml和260ug/ml。
77、5)溶出好。azd5305盐酸盐晶型iii片剂的累积溶出度是现有技术form a制剂的12.2倍,说明azd5305盐酸盐晶型iii相较于现有技术form a具有明显的生物利用度优势。azd5305盐酸盐晶型iii片剂在水中120分钟的累积溶出度为81.8%,而现有技术form a仅为6.7%。
78、6)可压性好。azd5305盐酸盐晶型iii制备成的片剂比现有技术form a制备成的片剂具有更优异的可压性。晶型iii的抗张强度可以达到6.99mpa,现有技术的form a抗张强度为5.02mpa。
79、7)粒径分布均匀。azd5305盐酸盐晶型iii可以直接应用于制剂工艺中,避免了复杂的原料药前处理过程,简化工艺过程,降低生产成本,提高药物制剂的均一性,使药物制剂的质量更加可控。
80、8)结晶度好。
81、9)制备方法简单,重复性高,具有可产业化前景。
82、综上,本技术的azd5305盐酸盐晶型iii具有预料不到的综合技术效果,在结晶度、稳定性、吸湿性、溶解度、溶出、可压性等各方面都展示其优良的特性。
83、本公开另一方面,在于提供一种药物组合物,所述药物组合物包含治疗有效量的本公开所述的azd5305盐酸盐、或azd5305盐酸盐晶型i、或azd5305盐酸盐晶型ii、或azd5305盐酸盐晶型iii,或其任意组合,以及至少一种药学上可接受的载体。
84、非限制性地,所述药学上可接受的载体为本领域制剂中常用的辅料,包括但不限于粘合剂、表面活性剂、稀释剂、抗粘附剂、亲水性或疏水性高分子聚合物、安定剂或稳定剂、崩解剂、抗氧化剂、消泡剂、填充剂、助流剂/润滑剂、吸附剂、防腐剂、增塑剂、甜味剂中的任一种及其两种及以上的混合物。
85、非限制性地,当所述制剂为口服固体制剂时,所述填充剂或稀释剂选自乳糖、微晶纤维素、淀粉、预胶化淀粉、硫酸钙、磷酸氢钙、碳酸钙、甘露醇中的任一种或其组合;所述崩解剂选自羧甲基淀粉钠、交联羧甲基纤维素钠、低取代羟丙基纤维素、交联聚乙烯吡咯烷酮中的任一种或其组合;所述润滑剂/助流剂选自硬脂酸镁、滑石粉、微粉硅胶中的一种或其组合。
86、非限制性地,所述药物组合物还可以包含一种或多种ph调整剂或缓冲剂,举例来说:酸,例如乙酸、硼酸、柠檬酸、富马酸、马来酸、酒石酸、苹果酸、乳酸、磷酸、盐酸的任一种或其组合;或者碱,例如氢氧化钠、磷酸钠、硼酸钠、柠檬酸钠、乙酸钠、乳酸钠、三羟甲基氨基甲烷的任一种或其组合物;或者缓冲剂,例如柠檬酸盐/葡萄糖、碳酸氢钠、氯化铵和类似物;用作碱的此类缓冲剂可具有除钠以外的平衡离子,例如钾、镁、钙、铵和其它平衡离子;以及其他将组分的ph维持在可接受范围内所需的量,包含此类酸、碱和缓冲剂的溶液或固体。
87、非限制性地,所述药物组合物可以使用本领域公知技术来制备,制备药物组合物时,将本公开的azd5305盐酸盐晶型iii与至少一种药学上可接受的载体相混合,也可通过直接混合、制粒、压片或溶解等工艺制备成剂型。
88、非限制性地,所述药物组合物的给药途径包括口服、皮下注射、静脉注射给药、肌肉注射、透皮给药、直肠给药、鼻腔给药。
89、本公开的另一方面,还在于提供一种上述azd5305药物组合物制备成的制剂,所述制剂形式包括但不限于口服固体制剂、外用制剂和注射剂。
90、本公开优选技术方案中,所述制剂形式为片剂、胶囊、丸剂、栓剂、颗粒剂、细粒剂、粉末/散剂、缓释制剂、速释制剂、溶液剂、混悬剂、酏剂、气雾剂等。
91、本公开优选技术方案中,所述制剂形式为片剂。
92、本公开的另一方面,在于提供一种上述azd5305盐酸盐、或azd5305盐酸盐晶型i、或azd5305盐酸盐晶型ii、或azd5305盐酸盐晶型iii、或其任意组合,或其所述的药物组合物作为制备治疗癌症药物制剂中的用途。
93、本公开优选技术方案中,所述癌症具有brca1或brca2缺陷表现型。
94、本公开优选技术方案中,所述癌症为parp抑制剂相关的癌症。
95、本公开优选技术方案中,所述癌症选自于乳腺癌、卵巢癌、前列腺癌、血液癌、消化道癌、肺癌、膀胱癌、子宫颈癌和子宫内膜癌;优选地,所述前列腺癌选自转移性前列腺癌,所述消化道选自结直肠癌,胃癌,胆管癌,胰腺癌,所述肺癌选自非小细胞肺癌和小细胞肺癌。
96、本公开的又一方面,在于提供一种治疗或预防疾病的方法,其包括向患者施加有效量的本公开所述的azd5305盐酸盐、或azd5305盐酸盐晶型i、或azd5305盐酸盐晶型ii、或azd5305盐酸盐晶型iii、或其任意组合,或其所述的药物组合物;优选地,所述疾病为癌症。
97、本公开优选技术方案中,所述癌症具有brca1或brca2缺陷表现型。
98、本公开优选技术方案中,所述癌症为parp抑制剂相关的癌症。
99、本公开优选技术方案中,所述癌症选自于乳腺癌、卵巢癌、前列腺癌、血液癌、消化道癌、肺癌、膀胱癌、子宫颈癌和子宫内膜癌;优选地,所述前列腺癌选自转移性前列腺癌,所述消化道选自结直肠癌,胃癌,胆管癌,胰腺癌,所述肺癌选自非小细胞肺癌和小细胞肺癌。
100、本公开优选技术方案中,以游离态化合物计算,所述有效量的本公开所述的azd5305盐酸盐、或azd5305盐酸盐晶型i、或azd5305盐酸盐晶型ii、azd5305盐酸盐晶型iii、或其任意组合为0.001-10mg/kg,优选为0.005-5mg/kg。
101、本公开优选技术方案中,所述方法可以是一天一次,一天两次,一天三次或以上给药;以游离态计,单次剂量可以是0.1mg~500mg/kg,具体的剂量将根据病人的实际情况决定。
102、本公开优选技术方案中,所述方法为每日一次给药。以游离态计,所述单次剂量为口服5mg、10mg、20mg、40mg、60mg、80mg或100mg;更优选为20mg或60mg。
103、本公开的另一方面,在于提供一种azd5305盐酸盐、或azd5305盐酸盐晶型i、或azd5305盐酸盐晶型ii、azd5305盐酸盐晶型iii、或其任意组合,或其药物组合物与其他药物的联合应用。
104、优选地,所述其他药物选自抗肿瘤药物,进一步选自paclitaxel、carboplatin、t-dxd和dato-dxd。
105、优选地,所述其他药物选自新型激素制剂((nhas)),进一步选自enzalutamide、abiraterone acetate和darolutamide。
106、除非特殊注明,本公开所述的“室温”是指10~30℃的温度。
107、所述“分离”可以采用本领域的常规方法,例如离心或过滤。其中减压过滤,一般是在室温下以小于大气压的压力进行抽滤。
108、所述“干燥”,可以采用本领域的常规技术完成,例如常温干燥、鼓风干燥或减压干燥,亦可以在减压或不减压下进行。干燥仪器和方法不受限制,可以是通风橱、鼓风烘箱、喷雾干燥器、流化床干燥或真空烘箱;亦可以在减压或不减压下进行。
109、所述的“相对强度(i%)”,在具体的xrpd图谱中表现为具体数值。一般而言,即使晶型相同,对于每次测量粉末x射线衍射中的衍射角(2θ)的峰强度或半峰宽都不同,这取决于不同的测量条件以及样品的结晶度晶体的各向异性特性、颗粒取向、及本领域技术人员已知的其他因素的变化,并且并不总是显示恒定的峰强度或半峰宽。因此,在粉末x射线衍射图的比较中,即使在相同的衍射角(2θ)处其峰强度或半值宽存在差异,这并不意味着差异来自晶型的不同。该波动不影响同一晶型的判断的常识应该被本领域的技术人员所接受。因此,这意味着相对于本发明的特定晶体的衍射峰特征具有这种差异的晶体(具有粉末x射线衍射图)具有与本发明的晶体相同的晶型。另外,如本文所用,“具有基本如图1所示的xrpd图谱”意指所有显示图1所示的粉末x射线衍射图的晶体与本发明的晶体是相同的晶体,不仅在具有特征衍射峰的粉末x射线衍射图与图1所示粉末x射线衍射图在±0.2°的误差范围内匹配的情况下,而且还在具有不同的峰强度或半峰宽的粉末x射线衍射图的情况下(具有与图1所示的粉末x射线衍射图相匹配的在误差范围为±0.2°的特征衍射角)。
110、所述的“浓盐酸”是指市售的各种氯化氢溶液,一般指浓度为37%(w/w的氯化氢水溶液,本公开中还包括氯化氢丙酮溶液、氯化氢乙醇溶液、氯化氢异丙醇溶液、氯化氢1,4-二氧六环溶液等。
111、如无特殊说明,本公开涉及的比例,液体与固体之间,为质量体积比,液体与液体之间,为体积比。
- 还没有人留言评论。精彩留言会获得点赞!