一种高密度发酵生产单细胞蛋白的方法与流程
本发明属于生物,具体涉及一种高密度发酵生产单细胞蛋白的方法。
背景技术:
1、目前,随着人口的持续增长,人们对于食品、尤其是肉类的消费需求不断增高,预计到2050年,全球肉类的需求将超过4亿吨。中国作为世界第一的人口大国,食品的需求量也在持续增长,2018年中国肉类消费为8829.6万吨,超过欧盟和美国的总和。在肉类消费增长的同时,饲料需求也在持续扩增,饲料产量超过2.4亿吨。饲料的主要成分以淀粉和蛋白为主,其中蛋白的主要来源是植物性蛋白豆粕和动物性蛋白鱼粉。豆粕是大豆提取豆油后得到的副产品,是棉籽粕、花生粕、菜籽粕等12种动植物油粕饲料产品中产量最大、用途最广的一种。豆粕的产量与大豆的产量相关,但是,中国大豆的自给率不足,大约有85%左右依赖进口,大豆的短缺影响了粮食和蛋白安全,需要其他可用于饲料的资源来进行替代。此外,饲料中动物性蛋白鱼粉的供应量也在持续紧缩,2020年全球鱼粉的消耗量为300万吨,预计到2025年,鱼粉的缺口可能达到100万吨。中国鱼粉年产量约为120万吨,自给率约为40%-50%。2020年中国鱼粉进口量为142万吨,进口额150亿。除了短缺难题之外,鱼粉的大量生产和过度捕捞也极大地透支了海洋渔业资源,造成鱼类数量和种群量的减少,为生态健康安全带来较大的影响。基于上述考虑,低蛋白饲料、非常规蛋白替代品成为畜牧业关注的重点,其中最为重要和最有潜力的一种蛋白替代就是单细胞蛋白(scp)。
2、单细胞蛋白又称微生物蛋白,它是用许多工农业废料及石油废料人工培养的微生物菌体。单细胞蛋白不是一种纯蛋白质,而是由蛋白质、脂肪、碳水化合物、核酸、非蛋白质的含氮化合物、维生素和无机化合物等混合物组成的细胞质团,化学组成中一般以蛋白质和脂肪为主。
3、单细胞蛋白在饲料中的应用大约始于上世纪90年代,利用味精菌渣、酵母菌渣等进行了禽畜、水产、生猪等一系列的动物实验,结果表明,菌体蛋白对于动物健康有一定益处,由此开始了单细胞蛋白在饲料领域的应用。目前,酵母菌在禽畜和水产成品饲料中已经有了较为广泛的应用,大约占所有饲料产量的5%-10%,水产饲料中单细胞蛋白的占比更大,大约为10%-20%。随着技术和工艺的发展,乙醇梭菌、甲烷菌蛋白也已经得到开发,这些蛋白虽然有动物实验数据表明其安全性和生物利用度,但是由于技术尚新,目前尚未有添加乙醇梭菌和甲烷菌的饲料产品上市,除此之外,光合细菌和藻类在饲料蛋白上也有一定的应用,但产量比较小,并非主流产品。
4、单细胞蛋白通常采用生物发酵技术制备得到,具体包括:在培养液配制和灭菌完成以后,将其和菌种投放到发酵罐中,控制发酵条件,菌种会迅速进行繁殖;发酵完毕,用离心、沉淀等方法收集菌体,最后经过干燥处理,就制成了单细胞蛋白成品。通过合成生物学发酵方法制备单细胞蛋白,能够利用生物转化的方式固定co2,得到菌体蛋白用于饲料,有利于缓解因较高的肉类需求增长造成的资源短缺,以及鱼粉的过量使用造成的环境污染问题。目前国家正大力推进低蛋白饲料以及非常规蛋白资源,农业和畜牧业的研究人员也在大力推进单细胞蛋白的推广,单细胞蛋白是未来饲料添加剂领域的一个重要发展方向。但是,目前单细胞蛋白的发酵生产周期长,产量和产能都有明显的不足之处,难以满足规模化的应用需求,因此,开发具有更高效率和更高产量的单细胞蛋白的制备方法,是本领域的研究重点。
技术实现思路
1、针对现有技术的不足,本发明的目的在于提供一种高密度发酵生产单细胞蛋白的方法,通过碳源的设计,采用特定的物料和工艺相互复配,使所述方法能够在短时间内实现菌体的高密度发酵和单细胞蛋白的高效合成,极大地提高了单细胞蛋白的生产效率和产量。
2、为达到此发明目的,本发明采用以下技术方案:
3、本发明提供一种高密度发酵生产单细胞蛋白的方法,所述方法包括:将解脂耶氏酵母菌种接种于种子培养基中进行种子培养,得到种子液;将所述种子液接种于发酵培养基中进行高密度发酵,所述高密度发酵的过程中补加乙酸和氮源,得到所述单细胞蛋白;所述种子培养基的碳源包括第一乙酸盐,所述发酵培养基的碳源包括第二乙酸盐和/或酮类化合物。
4、本发明以解脂耶氏酵母菌种作为发酵菌种,其为非基因工程菌,比常规菌体更加安全,已被美国食品药品监督管理局fda认证为一般认可安全的微生物(generallyrecognized as safe,gras),是理想的食品工业用菌。所述方法对种子培养和高密度发酵中的碳源进行设计,在种子培养基中加入乙酸钠,能够促进菌体形成特有的乙酸代谢途径,为后续的高密度发酵过程中添加乙酸生长更快打下基础;同时,发酵培养基的碳源中也包括乙酸钠,进一步诱导和促进菌体的乙酸代谢途径。所述高密度发酵的过程中补加乙酸和氮源,其中,所述乙酸一方面能够中和发酵过程中产生的碱性物质,使菌体处于最佳的中性ph生长环境,另一方面,乙酸作为碳源,其具有很高的碳含量,能够有效促进菌体的快速生长和单细胞蛋白的合成,而且乙酸无需灭菌处理,可直接添加。进一步地,所述发酵培养基中含有酮类发酵促进剂,在乙酸代谢途径中发挥中间产物的催化功能,促进菌体的快速生长,缩短发酵周期。
5、综上所述,本发明提供的方法中,通过在种子培养基的碳源中引入第一乙酸盐,诱导和促进菌体生成特有的乙酸代谢途径,为后续高密度发酵过程中添加乙酸作为碳源、促进菌体快速生长奠定基础;同时发酵培养基的碳源包括第二乙酸盐和/或酮类化合物,促进菌体快速生长;在高密度发酵阶段补加氮源和乙酸,在调控菌体处于最优的中性ph生长环境的同时,为菌体补充合适的营养成分以供菌体持续生长,有效提升了菌体的生长速率和单细胞蛋白的合成速率。通过特定的物料和工艺相互复配,使所述方法能够在短时间内实现菌体的高密度发酵和单细胞蛋白的高效合成,在显著缩短高密度发酵的培养时间的同时,能够获得粗蛋白含量更高的发酵产物,极大地提升了单细胞蛋白的生产效率和产量。
6、以下作为本发明的优选技术方案,但不作为对本发明提供的技术方案的限制,通过以下优选的技术方案,可以更好的达到和实现本发明的目的和有益效果。
7、优选地,所述第一乙酸盐包括乙酸钠、乙酸钾、乙酸铵中的任意一种或至少两种的组合,进一步优选乙酸钠。
8、优选地,所述种子培养基中第一乙酸盐的质量浓度为5-15g/l,例如可以为6g/l、7g/l、8g/l、9g/l、10g/l、11g/l、12g/l、13g/l或14g/l等。
9、优选地,所述种子培养包括依次进行的一级种子培养和二级种子培养。
10、优选地,所述一级种子培养所用的一级种子培养基包括如下组分:第一乙酸盐5-15g/l,葡萄糖1%-3%,酵母粉0.6%-2%,酪蛋白胨1.5%-3.2%。
11、具体地,所述一级种子培养基中第一乙酸盐(优选乙酸钠)的质量浓度为5-15g/l,例如可以为6g/l、7g/l、8g/l、9g/l、10g/l、11g/l、12g/l、13g/l或14g/l等。
12、所述一级种子培养基中葡萄糖(无水葡萄糖)的质量百分含量为1%-3%,例如可以为1.2%、1.5%、1.8%、2%、2.2%、2.5%或2.8%等。
13、所述一级种子培养基中酵母粉的质量百分含量为0.6%-2%,例如可以为0.8%、1%、1.2%、1.5%或1.8%等。
14、所述一级种子培养基中酪蛋白胨的质量百分含量为1.5%-3.2%,例如可以为1.6%、1.8%、2%、2.2%、2.5%、2.8%或3%等。
15、优选地,所述一级种子培养基中的余量为水。
16、优选地,所述一级种子培养的温度为30-33℃,例如可以为30.2℃、30.5℃、30.8℃、31℃、31.2℃、31.5℃、31.8℃、32℃、32.2℃、32.5℃或32.8℃等,进一步优选31.5-32.5℃。
17、优选地,所述一级种子培养的时间为16-18h,例如可以为16.2h、16.5h、16.8h、17h、17.2h、17.5h或17.8h等。
18、优选地,所述一级种子培养在搅拌条件下进行,所述搅拌的转速为100-300rpm,例如可以为120rpm、150rpm、180rpm、200rpm、220rpm、250rpm或280rpm等,进一步优选170-190rpm。
19、优选地,所述一级种子培养至od值为4.2-6.8,例如od值为4.3、4.5、4.8、5、5.2、5.5、5.8、6、6.2、6.5或6.7等,得到一级种子。
20、优选地,所述二级种子培养所用的二级种子培养基包括如下组分:第一乙酸盐5-20g/l,葡萄糖1%-3%,酵母粉0.6%-2%,酪蛋白胨1.5%-3.2%,硫酸镁0.8%-2.4%,盐酸硫铵0.2%-0.8%。
21、具体地,所述二级种子培养基中第一乙酸盐(优选乙酸钠)的质量浓度为5-20g/l,例如可以为6g/l、8g/l、10g/l、11g/l、13g/l、15g/l、17g/l或19g/l等。
22、所述二级种子培养基中葡萄糖(无水葡萄糖)的质量百分含量为1%-3%,例如可以为1.2%、1.5%、1.8%、2%、2.2%、2.5%或2.8%等。
23、所述二级种子培养基中酵母粉的质量百分含量为0.6%-2%,例如可以为0.8%、1%、1.2%、1.5%或1.8%等。
24、所述二级种子培养基中酪蛋白胨的质量百分含量为1.5%-3.2%,例如可以为1.6%、1.8%、2%、2.2%、2.5%、2.8%或3%等。
25、所述二级种子培养基中硫酸镁的质量百分含量为0.8%-2.4%,例如可以为1%、1.2%、1.5%、1.8%、2%或2.2%等。
26、所述二级种子培养基中盐酸硫铵的质量百分含量为0.2%-0.8%,例如可以为0.3%、0.4%、0.5%、0.6%或0.7%等。
27、优选地,所述二级种子培养基中还包括第一微量元素添加剂,所述第一微量元素添加剂的用量为0.8%-2.6%,例如可以为1%、1.2%、1.5%、1.8%、2%、2.2%或2.5%等。本技术中,对所述第一微量元素添加剂的用量的描述中使用的百分数为质量百分数。
28、优选地,所述二级种子培养基中的余量为水。
29、优选地,所述第一微量元素添加剂包括如下组分:硫酸铜4-8g/l,碘化钠0.12-0.16g/l,硫酸锰5-6g/l,钼酸钠0.1-0.2g/l,硼酸0.04-0.08g/l,氯化钴0.6-0.8g/l,氯化锌18-21g/l,硫酸亚铁38-41g/l,生物素0.3-0.5g/l,硫酸3-5.2g/l。
30、具体地,所述第一微量元素添加剂中硫酸铜的质量浓度为4-8g/l,例如可以为4.5g/l、5g/l、5.5g/l、6g/l、6.5g/l、7g/l或7.5g/l等。
31、所述第一微量元素添加剂中碘化钠的质量浓度为0.12-0.16g/l,例如可以为0.125g/l、0.13g/l、0.135g/l、0.14g/l、0.145g/l、0.15g/l或0.155g/l等。
32、所述第一微量元素添加剂中硫酸锰的质量浓度为5-6g/l,例如可以为5.1g/l、5.2g/l、5.3g/l、5.4g/l、5.5g/l、5.6g/l、5.7g/l、5.8g/l或5.9g/l等。
33、所述第一微量元素添加剂中钼酸钠的质量浓度为0.1-0.2g/l,例如可以为0.11g/l、0.12g/l、0.13g/l、0.14g/l、0.15g/l、0.16g/l、0.17g/l、0.18g/l或0.19g/l等。
34、所述第一微量元素添加剂中硼酸的质量浓度为0.04-0.08g/l,例如可以为0.045g/l、0.05g/l、0.055g/l、0.06g/l、0.065g/l、0.07g/l或0.075g/l等。
35、所述第一微量元素添加剂中氯化钴的质量浓度为0.6-0.8g/l,例如可以为0.62g/l、0.65g/l、0.68g/l、0.7g/l、0.72g/l、0.75g/l或0.78g/l等。
36、所述第一微量元素添加剂中氯化锌的质量浓度为18-21g/l,例如可以为18.5g/l、19g/l、19.5g/l、20g/l或20.5g/l等。
37、所述第一微量元素添加剂中硫酸亚铁的质量浓度为38-41g/l,例如可以为38.5g/l、39g/l、39.5g/l、40g/l或40.5g/l等。
38、所述第一微量元素添加剂中生物素的质量浓度为0.3-0.5g/l,例如可以为0.32g/l、0.35g/l、0.38g/l、0.4g/l、0.42g/l、0.45g/l或0.48g/l等。
39、所述第一微量元素添加剂中硫酸的质量浓度为3-5.2g/l,例如可以为3.2g/l、3.5g/l、3.8g/l、4g/l、4.2g/l、4.5g/l、4.8g/l或5g/l等。
40、优选地,所述一级种子培养得到的一级种子以5%-10%的接种量接种于二级种子培养基中进行二级种子培养,一级种子的接种量可以为6%、7%、8%或9%等,进一步优选7%-8%。
41、需要说明的是,术语“接种量”是指移入的种子液体积与接种后培养体系体积的比例。示例性地,接种量为5%-10%即种子液的体积分数为5%-10%。下文中涉及“接种量”描述时,均指代体积分数,简明起见,不再逐一赘述。
42、优选地,所述二级种子培养的过程中通入空气(压缩空气)。
43、优选地,所述二级种子培养的通气速度为0.1-1.3vvm,例如可以为0.2vvm、0.3vvm、0.5vvm、0.7vvm、0.9vvm、1vvm或1.2vvm等。
44、优选地,所述二级种子培养在搅拌条件下进行,所述搅拌的转速为150-900rpm,例如可以为180rpm、200rpm、300rpm、400rpm、500rpm、600rpm、700rpm或800rpm等。
45、作为本发明的优选技术方案,所述二级种子培养的过程中,根据溶氧的不断降低,逐渐提高搅拌的转速和压缩空气的通气速度。
46、示例性地,所述二级种子培养的过程中,初始溶氧为100%,搅拌的转速为160-200rpm,通气速度为0.1-0.3vvm;80%≤溶氧<100%,搅拌的转速为210-230rpm,通气速度为0.4-0.5vvm;60%≤溶氧<80%,搅拌的转速为260-300rpm,通气速度为0.3-0.5vvm;40%≤溶氧<60%,搅拌的转速为300-400rpm,通气速度为0.4-0.6vvm;20%≤溶氧<40%,搅拌的转速为400-500rpm,通气速度为0.5-0.7vvm;10%≤溶氧<20%,搅拌的转速为500-550rpm,通气速度为0.6-0.8vvm;0<溶氧<10%,搅拌的转速为550-650rpm,通气速度为0.7-0.9vvm;溶氧为0,搅拌的转速为700-800rpm,通气速度为0.9-1.2vvm。
47、优选地,所述二级种子培养的温度为30-33℃,例如可以为30.2℃、30.5℃、30.8℃、31℃、31.2℃、31.5℃、31.8℃、32℃、32.2℃、32.5℃或32.8℃等,进一步优选30-32℃。
48、优选地,所述二级种子培养的时间为8-12h,例如可以为8.5h、9h、9.5h、10h、10.5h、11h或11.5h等。
49、优选地,所述二级种子培养至od值为12-16,例如od值为12.5、13、13.5、14、14.5、15或15.5等,得到所述种子液。
50、优选地,所述发酵培养基的碳源包括第二乙酸盐和酮类化合物的组合。
51、优选地,所述第二乙酸盐包括乙酸钠、乙酸钾、乙酸铵中的任意一种或至少两种的组合,优选乙酸钠。
52、优选地,所述发酵培养基中第二乙酸盐的质量浓度为5-15g/l,例如可以为6g/l、7g/l、8g/l、9g/l、10g/l、11g/l、12g/l、13g/l或14g/l等。
53、优选地,所述发酵培养基中酮类化合物的质量百分含量为0.1%-0.6%,例如可以为0.2%、0.3%、0.4%或0.5%等。特定含量的酮类化合物对高密度发酵过程中菌体的乙酸代谢途径的中间产物具有催化功能,有助于提升菌体的生长速率,缩短发酵周期。
54、优选地,所述发酵培养基包括如下组分:第二乙酸盐5-15g/l,葡萄糖1%-3%,酵母粉0.6%-2%,酪蛋白胨1.5%-3.2%,硫酸镁0.8%-1.2%,盐酸硫铵0.6%-1.4%,甜菜碱0.5%-1%,硫酸铵3.5%-6.8%,磷酸二氢钾5%-7%,磷酸氢二钠2%-4%,酮类化合物0.1%-0.6%。
55、具体地,所述发酵培养基中第二乙酸盐(优选乙酸钠)的质量浓度为5-15g/l,例如可以为6g/l、7g/l、8g/l、9g/l、10g/l、11g/l、12g/l、13g/l或14g/l等。
56、所述发酵培养基中葡萄糖(无水葡萄糖)的质量百分含量为1%-3%,例如可以为1.2%、1.5%、1.8%、2%、2.2%、2.5%或2.8%等。
57、所述发酵培养基中酵母粉的质量百分含量为0.6%-2%,例如可以为0.8%、1%、1.2%、1.5%或1.8%等。
58、所述发酵培养基中酪蛋白胨的质量百分含量为1.5%-3.2%,例如可以为1.6%、1.8%、2%、2.2%、2.5%、2.8%或3%等。
59、所述发酵培养基中硫酸镁的质量百分含量为0.8%-1.2%,例如可以为0.85%、0.9%、0.95%、1%、1.05%、1.1%或1.15%等。
60、所述发酵培养基中盐酸硫铵的质量百分含量为0.6%-1.4%,例如可以为0.7%、0.8%、0.9%、1%、1.1%、1.2%或1.3%等。
61、所述发酵培养基中甜菜碱的质量百分含量为0.5%-1%,例如可以为0.6%、0.7%、0.8%或0.9%等。
62、所述发酵培养基中硫酸铵的质量百分含量为3.5%-6.8%,例如可以为3.8%、4%、4.2%、4.5%、4.8%、5%、5.2%、5.5%、5.8%、6%、6.2%或6.5%等。
63、所述发酵培养基中磷酸二氢钾的质量百分含量为5%-7%,例如可以为5.2%、5.5%、5.8%、6%、6.2%、6.5%或6.8%等。
64、所述发酵培养基中磷酸氢二钠的质量百分含量为2%-4%,例如可以为2.2%、2.5%、2.8%、3%、3.2%、3.5%或3.8%等。
65、所述发酵培养基中酮类化合物的质量百分含量为0.1%-0.6%,例如可以为0.2%、0.3%、0.4%或0.5%等。
66、优选地,所述酮类化合物为c3-c10酮类化合物,例如可以为c3、c4、c5、c6、c7、c8、c9、c10酮类化合物,包括脂肪族酮和/或脂环族酮。
67、优选地,所述酮类化合物包括丙酮、甲基乙基酮、环己酮中的任意一种或至少两种的组合,进一步优选丙酮。
68、作为本发明的优选技术方案,所述发酵培养基中含有0.1%-0.6%的丙酮,由于在乙酸代谢途径中,丙酮作用为中间产物的催化功能,因此,丙酮的引入能进一步提升菌体的生长速率,缩短发酵周期。
69、优选地,所述发酵培养基中还包括第二微量元素添加剂,所述第二微量元素添加剂的用量为0.8%-2.6%,例如可以为1%、1.2%、1.5%、1.8%、2%、2.2%或2.5%等。本技术中,对所述第二微量元素添加剂的用量的描述中使用的百分数为质量百分数。
70、优选地,所述发酵培养基中的余量为水。
71、优选地,所述第二微量元素添加剂包括如下组分:硫酸铜4-8g/l,碘化钠0.12-0.16g/l,硫酸锰5-6g/l,钼酸钠0.1-0.2g/l,硼酸0.04-0.08g/l,氯化钴0.6-0.8g/l,氯化锌18-21g/l,硫酸亚铁38-41g/l,生物素0.3-0.5g/l,硫酸3-5.2g/l。
72、具体地,所述第二微量元素添加剂中硫酸铜的质量浓度为4-8g/l,例如可以为4.5g/l、5g/l、5.5g/l、6g/l、6.5g/l、7g/l或7.5g/l等。
73、所述第二微量元素添加剂中碘化钠的质量浓度为0.12-0.16g/l,例如可以为0.125g/l、0.13g/l、0.135g/l、0.14g/l、0.145g/l、0.15g/l或0.155g/l等。
74、所述第二微量元素添加剂中硫酸锰的质量浓度为5-6g/l,例如可以为5.1g/l、5.2g/l、5.3g/l、5.4g/l、5.5g/l、5.6g/l、5.7g/l、5.8g/l或5.9g/l等。
75、所述第二微量元素添加剂中钼酸钠的质量浓度为0.1-0.2g/l,例如可以为0.11g/l、0.12g/l、0.13g/l、0.14g/l、0.15g/l、0.16g/l、0.17g/l、0.18g/l或0.19g/l等。
76、所述第二微量元素添加剂中硼酸的质量浓度为0.04-0.08g/l,例如可以为0.045g/l、0.05g/l、0.055g/l、0.06g/l、0.065g/l、0.07g/l或0.075g/l等。
77、所述第二微量元素添加剂中氯化钴的质量浓度为0.6-0.8g/l,例如可以为0.62g/l、0.65g/l、0.68g/l、0.7g/l、0.72g/l、0.75g/l或0.78g/l等。
78、所述第二微量元素添加剂中氯化锌的质量浓度为18-21g/l,例如可以为18.5g/l、19g/l、19.5g/l、20g/l或20.5g/l等。
79、所述第二微量元素添加剂中硫酸亚铁的质量浓度为38-41g/l,例如可以为38.5g/l、39g/l、39.5g/l、40g/l或40.5g/l等。
80、所述第二微量元素添加剂中生物素的质量浓度为0.3-0.5g/l,例如可以为0.32g/l、0.35g/l、0.38g/l、0.4g/l、0.42g/l、0.45g/l或0.48g/l等。
81、所述第二微量元素添加剂中硫酸的质量浓度为3-5.2g/l,例如可以为3.2g/l、3.5g/l、3.8g/l、4g/l、4.2g/l、4.5g/l、4.8g/l或5g/l等。
82、优选地,所述种子液以3%-6%的接种量接种于发酵培养基中进行高密度发酵,所述种子液的接种量可以为3.5%、4%、4.5%、5%或5.5%等。
83、优选地,所述高密度发酵的过程中补加的氮源,包括尿素、硫酸铵、硝酸铵、氨水中的任意一种或至少两种的组合,进一步优选尿素。
84、作为本发明的优选技术方案,所述高密度发酵的过程中补加的碳源为乙酸,补加的氮源为尿素。由于菌体最佳生长ph为中性环境,但其发酵过程产生碱性物质,ph会逐渐升高,因此,补加乙酸既能中和稳定ph,又可以提供碳源生长,且无需灭菌,可直接添加;而且,乙酸中的碳含量高,补加时无需加水配制溶液,更有利于实现高密度发酵。如果选择需要配制水溶液的碳源(例如葡萄糖),则向发酵体系补加碳源的同时会增加更多水分,增加发酵液的体积,稀释发酵液,难以实现高密度发酵。以尿素作为氮源,其更容易被菌体吸收,有利于合成蛋白质。通过补加的碳源和氮源的设计及其复配,更有效地促进菌体的快速生长和蛋白质的合成。
85、优选地,所述尿素以尿素水溶液的形式进行补加。
86、优选地,所述尿素水溶液中尿素的质量百分含量为30-50%,例如32%、35%、38%、40%、42%、45%或48%等,进一步优选40%。
87、优选地,所述高密度发酵的温度为27-33℃,例如可以为27.5℃、28℃、28.5℃、29℃、29.5℃、30℃、30.5℃、31℃、31.5℃、32℃或32.5℃等,进一步优选28-32℃。
88、优选地,所述高密度发酵的ph值为6.4-7.1,例如可以为6.5、6.6、6.7、6.8、6.9或7等,进一步优选6.5-7。
89、优选地,所述高密度发酵在搅拌条件下进行,所述搅拌的转速为130-800rpm,例如可以为150rpm、200rpm、300rpm、400rpm、500rpm、600rpm、700rpm或750rpm等。
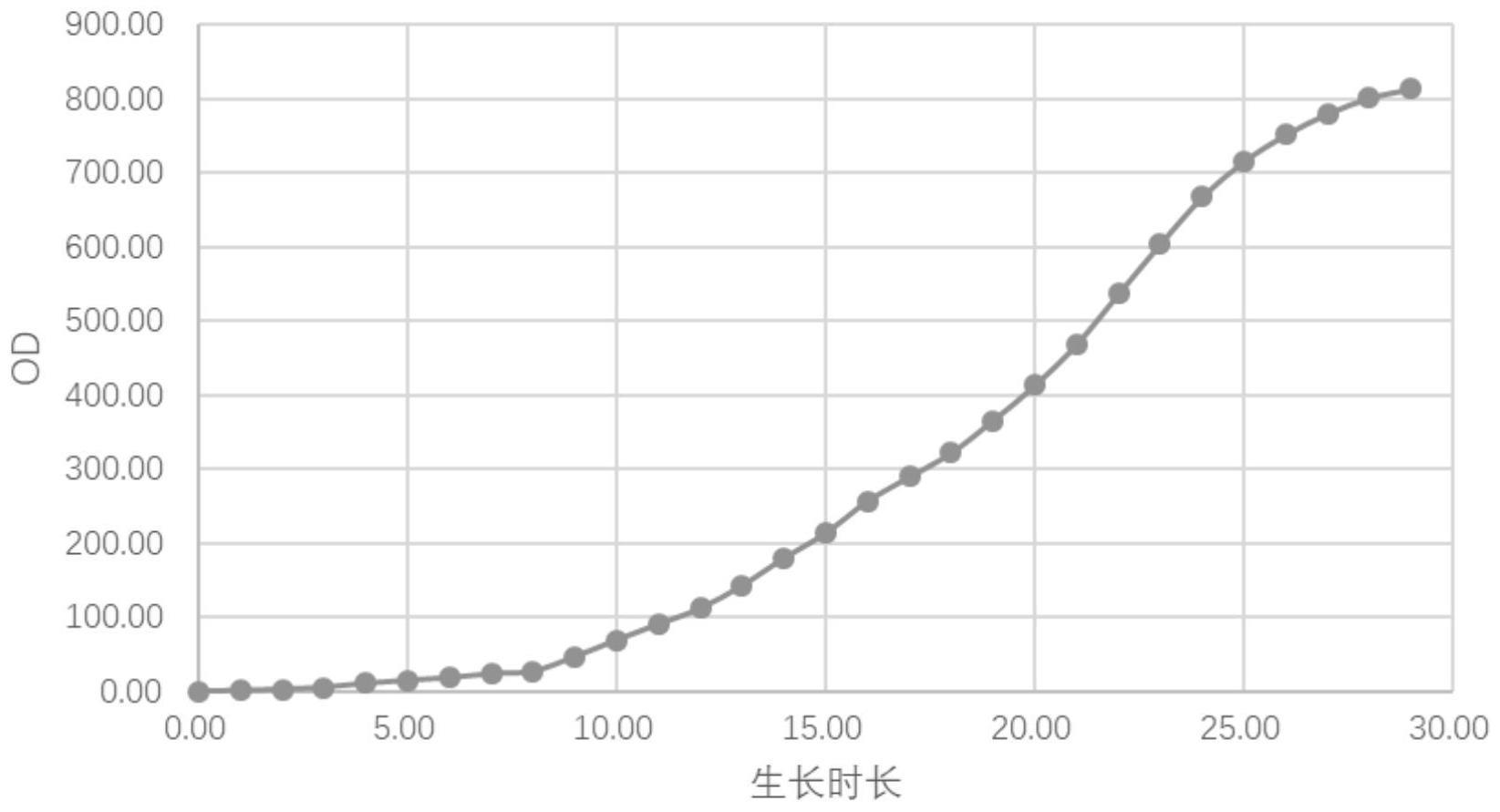
90、优选地,所述高密度发酵的通气速度为0.5-2.4vvm,例如可以为0.6vvm、0.8vvm、1vvm、1.2vvm、1.5vvm、1.8vvm、2vvm或2.2vvm等。
91、优选地,所述高密度发酵的过程中通入的气体包括空气和可选地氧气(纯氧)。
92、作为本发明的优选技术方案,通过对高密度发酵过程中通入的气体组分和通入速度进行调控,更有利于促进菌体的生长和蛋白质的合成,具体地:
93、当od值<300时,通入空气(压缩空气),通气速度为0.6-1vvm;
94、当300≤od值<500时,通入空气和氧气的混合气,空气和氧气的比例为(1.5-2.5):1,例如可以为1.6:1、1.8:1、2:1、2.2:1、2.4:1等,优选2:1;通气速度为0.8-1.2vvm;
95、od值为500-700时,通入空气和氧气的混合气,空气和氧气的比例为(0.8-1.2):1,例如可以为0.9:1、1:1、1.1:1等,优选1:1,通气速度为1.2-1.8vvm;
96、od值>700时,通入空气和氧气的混合气,空气和氧气的比例为1:(1.5-2.5),例如可以为1:1.6、1:1.8、1:2、1:2.2或1:2.4等,优选1:2,通气速度为1.8-2.4vvm。
97、优选地,所述高密度发酵的终点判断方法为:监测高密度发酵的体系od值,连续2h内每小时od值的增加值均≤20,表明菌体生长缓慢,则判断后续不再生长,到达高密度发酵的终点,下罐得到发酵液。
98、本发明中,“od值”是指发酵液(培养体系)的od值,采用紫外分光光度法测试得到,具体为600nm下的od值。
99、优选地,所述高密度发酵至od值为780-820,例如od值为782、785、788、790、792、795、798、800、802、805、808、810、812、815或818等,结束发酵,得到所述单细胞蛋白。
100、优选地,所述高密度发酵包括od值依次升高的第一发酵阶段、第二发酵阶段和第三发酵阶段;
101、所述第一发酵阶段的od值<500,所述第一发酵阶段中补加乙酸和氮源的碳氮比>18,例如碳氮比为20、25、30、35、40、45、50、55、60、65、70、75、80、85、90或100等。
102、所述第二发酵阶段的od值为500-700,所述第二发酵阶段中补加乙酸和氮源的碳氮比为5-18,例如碳氮比为6、7、8、9、10、11、12、13、14、15、16或17等。
103、所述第三发酵阶段的od值>700,所述第三发酵阶段中补加乙酸和氮源的碳氮比<5,例如碳氮比为1、1.5、2、2.5、3、3.5、4或4.5等。
104、作为本发明的优选技术方案,对高密度发酵过程中补加的碳源和氮源的碳氮比进行调控,在od值较低的前期,设置碳氮比>18,该阶段有利于菌体生长旺盛;当od值为500-700时,设置碳氮比为5-18,有利于菌体生长的同时合成蛋白质;至高密度发酵的后期,设置碳氮比<5,菌体生长放慢,同时合成蛋白质的速度增加,充分合成蛋白质,有利于提高发酵产物中粗蛋白的含量。本发明可以通过调节碳氮比,达到菌体生长最快,且粗蛋白含量最高,在缩短发酵培养周期的同时提升了蛋白质的产量,从而实现单细胞蛋白的生产效率和产量的同步提升。
105、本发明中,补加乙酸和氮源的补料速度可根据高密度发酵不同时期的碳氮比进行调控;示例性地,所述乙酸的补料速度为0.6-2.8g/l,例如可以为0.8g/l、1g/l、1.2g/l、1.5g/l、1.8g/l、2g/l、2.2g/l、2.5g/l或2.7g/l等,进一步优选0.8-2.5g/l;所述氮源的补料速度为0.1-3.2g/l,例如可以为0.2g/l、0.5g/l、0.8g/l、1g/l、1.2g/l、1.5g/l、1.8g/l、2g/l、2.2g/l、2.5g/l、2.8g/l或3g/l等。在
106、优选地,高密度发酵的初期,对乙酸和氮源的补料速度进行调控,设置碳氮比>18,使菌体生长旺盛;随着发酵的不断进行,调节乙酸和氮源的补料速度,使碳氮比为5-18,促进菌体快速生长和蛋白快速合成同步进行;进一步调节乙酸和氮源的补料速度,使碳氮比<5,从而更利于合成单细胞蛋白质,提升粗蛋白含量。在整个高密度发酵阶段,通过调控和平衡碳氮比,达到菌体生长速度最快、且粗蛋白含量最高的最优效果。
107、作为本发明的优选技术方案,通过对高密度发酵不同时期的过程调控,包括ph范围、温度、转速、碳氮比、溶氧和通气量的调控,调节菌体生长环境到达菌体的最佳生长条件和单细胞蛋白合成的最佳状态。
108、优选地,所述第一发酵阶段包括依次进行的阶段a、阶段b和阶段c,由此,使所述高密度发酵包括依次进行的阶段a、阶段b、阶段c、第二发酵阶段和第三发酵阶段,具体如下:
109、所述阶段a中,od值<100,温度为31-33℃,ph值为6.4-6.6,通气速度为0.5-0.7vvm,转速为130-170rpm,补加乙酸和氮源的碳氮比>18;
110、进一步优选地,所述阶段a通入空气(压缩空气),控制温度为32℃,ph值为6.5,通气速度为0.6vvm,转速为150rpm,乙酸补料速度为0.8l/h,控制碳氮比>18,此条件下菌体生长快速。
111、所述阶段b中,100≤od值<300,温度为30-32℃,ph值为6.5-6.7,通气速度为0.9-1.1vvm,转速为180-220rpm,补加乙酸和氮源的碳氮比>18;
112、进一步优选地,所述阶段b通入空气(压缩空气),控制温度为31℃,ph值为6.6,通气速度为1vvm,转速为200rpm,乙酸补料速度为1.2l/h,控制碳氮比>18,此条件下菌体生长快速。
113、所述阶段c中,300≤od值<500,温度为29-31℃,ph值为6.6-6.8,通气速度为1.1-1.3vvm,转速为280-320rpm,补加乙酸和氮源的碳氮比>18;
114、进一步优选地,所述阶段c通入空气和氧气的混合气,空气和氧气的比例为(1.5-2.5):1,更优选2:1,控制温度为30℃,ph值为6.7,通气速度为1.2vvm,转速为300rpm,乙酸补料速度为1.6l/h,控制碳氮比>18,此条件下菌体生长快速。
115、所述第二发酵阶段的od值为500-700,温度为28-30℃,ph值为6.7-6.9,通气速度为1.5-1.7vvm,转速为450-550rpm,补加乙酸和氮源的碳氮比为5-18;
116、进一步优选地,所述第二发酵阶段通入空气和氧气的混合气,空气和氧气的比例为(0.8-1.2):1,更优选1:1,控制温度为29℃,ph值为6.8,通气速度为1.6vvm,转速为500rpm,乙酸补料速度为2.2l/h,控制碳氮比5-18,此条件下菌体生长速度正常,同时合成单细胞蛋白。
117、所述第三发酵阶段的od值>700,温度为27-29℃,ph值为6.9-7.1,通气速度为1.9-2.1vvm,转速为650-750rpm,补加乙酸和氮源的碳氮比<5;
118、进一步优选地,所述第三发酵阶段通入空气和氧气的混合气,空气和氧气的比例为1:(1.5-2.5),更优选1:2,控制温度为28℃,ph值为7,通气速度为2.0vvm,转速为700rpm,乙酸补料速度为2.5l/h,控制碳氮比<5,此条件下菌体生长速度缓慢,充分合成单细胞蛋白。
119、至od值为780-820,菌体生长缓慢即可下罐,完成高密度发酵,得到发酵液。
120、优选地,所述高密度发酵完成后还包括后处理的步骤。
121、优选地,所述后处理的方法包括:所述高密度发酵得到的发酵液依次进行固液分离、洗涤和干燥,得到所述单细胞蛋白。
122、优选地,所述固液分离的方法为离心分离。
123、优选地,所述洗涤的洗涤剂为水。
124、优选地,所述干燥的方法包括喷雾干燥。
125、优选地,所述方法具体包括如下步骤:
126、(1)将解脂耶氏酵母菌种接种于一级种子培养基中,于温度30-33℃、转速100-300rpm的条件下培养16-18h,至od值为4.2-6.8,得到一级种子;
127、所述一级种子培养基包括如下组分:乙酸钠5-15g/l,葡萄糖1%-3%,酵母粉0.6%-2%,酪蛋白胨1.5%-3.2%;
128、(2)将所述一级种子以5%-10%的接种量接种于二级种子培养基中,于温度30-33℃、转速150-900rpm、通气速度0.1-1.3vvm的条件下培养8-12h,至od值为12-16,得到二级种子,即所述种子液;
129、所述二级种子培养基包括如下组分:乙酸钠5-20g/l,葡萄糖1%-3%,酵母粉0.6%-2%,酪蛋白胨1.5%-3.2%,硫酸镁0.8%-2.4%,盐酸硫铵0.2%-0.8%,第一微量元素添加剂0.8%-2.6%;
130、所述第一微量元素添加剂包括如下组分:硫酸铜4-8g/l,碘化钠0.12-0.16g/l,硫酸锰5-6g/l,钼酸钠0.1-0.2g/l,硼酸0.04-0.08g/l,氯化钴0.6-0.8g/l,氯化锌18-21g/l,硫酸亚铁38-41g/l,生物素0.3-0.5g/l,硫酸3-5.2g/l;
131、(3)将所述种子液以3%-6%的接种量接种于发酵培养基中进行高密度发酵,所述高密度发酵的过程中补加乙酸和尿素,至od值为780-820,得到所述单细胞蛋白;
132、所述发酵培养基包括如下组分:乙酸钠5-15g/l,葡萄糖1%-3%,酵母粉0.6%-2%,酪蛋白胨1.5%-3.2%,硫酸镁0.8%-1.2%,盐酸硫铵0.6%-1.4%,甜菜碱0.5%-1%,硫酸铵3.5%-6.8%,磷酸二氢钾5%-7%,磷酸氢二钠2%-4%,丙酮0.1%-0.6%,第二微量元素添加剂0.8%-2.6%;
133、所述第二微量元素添加剂包括如下组分:硫酸铜4-8g/l,碘化钠0.12-0.16g/l,硫酸锰5-6g/l,钼酸钠0.1-0.2g/l,硼酸0.04-0.08g/l,氯化钴0.6-0.8g/l,氯化锌18-21g/l,硫酸亚铁38-41g/l,生物素0.3-0.5g/l,硫酸3-5.2g/l;
134、所述高密度发酵包括od值依次升高的第一发酵阶段、第二发酵阶段和第三发酵阶段;
135、所述第一发酵阶段的od值<500,温度为29-33℃,ph值为6.5-6.8,通气速度为0.5-1.3vvm,转速为280-320rpm,补加乙酸和尿素的碳氮比>18;
136、所述第二发酵阶段的od值为500-700,温度为28-30℃,ph值为6.7-6.9,通气速度为1.5-1.7vvm,转速为450-550rpm,补加乙酸和氮源的碳氮比为5-18;
137、所述第三发酵阶段的od值>700,温度为27-29℃,ph值为6.9-7.1,通气速度为1.9-2.1vvm,转速为650-750rpm,补加乙酸和氮源的碳氮比<5。
138、作为本发明的优选技术方案,所述高密度发酵的时间(即发酵周期)为25-60h,例如可以为26h、28h、30h、32h、35h、38h、40h、42h、45h、48h、50h、52h、55h、58h等,进一步优选28-36h,更进一步优选28-32h。
139、优选地,所述单细胞蛋白的总产量(干重)>150g/l,例如可以为155g/l、160g/l、170g/l、180g/l、190g/l、200g/l、210g/l、220g/l、230g/l、240g/l、250g/l或260g/l等,进一步优选≥160g/l,更进一步优选200-250g/l。
140、优选地,所述单细胞蛋白的产量>2.5g/(l·h),例如可以为2.6g/(l·h)、2.8g/(l·h)、3g/(l·h)、3.5g/(l·h)、4g/(l·h)、5g/(l·h)、6g/(l·h)、7g/(l·h)、8g/(l·h)、8.5g/(l·h)、9g/(l·h)或10g/(l·h)等,进一步优选≥3g/(l·h),更进一步优选6-9g/(l·h)。
141、优选地,所述单细胞蛋白中粗蛋白的质量百分含量≥35%,例如可以为38%、40%、42%、45%、48%、50%、52%、55%、58%、60%、62%、65%或68%等,进一步优选≥55%,更进一步优选≥60%。
142、相对于现有技术,本发明具有以下有益效果:
143、(1)本发明提供的高密度发酵生产单细胞蛋白的方法中,通过在种子培养基的碳源中加入第一乙酸盐,诱导和促进菌体生成特有的乙酸代谢途径,为后续高密度发酵中补加乙酸作为碳源、促进菌体快速生长奠定基础;同时发酵培养基中含有第二乙酸盐和/或酮类化合物,促进菌体快速生长;在高密度发酵阶段补加氮源和乙酸,使菌体处于最优的中性ph生长环境,并调控碳氮比,为菌体补充合适的营养成分以供菌体持续生长,有效提升了菌体的生长速率和单细胞蛋白的合成速率。通过特定的物料和工艺相互复配,使所述方法能够在短时间内实现菌体的高密度发酵和单细胞蛋白的高效合成,在显著缩短高密度发酵的培养时间的同时,能够获得粗蛋白含量更高的发酵产物,极大地提升了单细胞蛋白的生产效率和产量。
144、(2)本发明通过对物料和工艺的进一步优化设计,适配培养基组成、特定补料方式和高密度发酵过程中分步过程调控策略,实现菌体的快速生长和单细胞蛋白的快速合成,使高密度发酵的时间(发酵周期)为28-30h,与现有的单细胞蛋白生产时长相比缩短至1/3,同时单细胞蛋白的干重为200-243g/l,产量≥6g/(l·h),相比同类型的产量可提高20倍;粗蛋白含量≥60%,相比于现有技术的可提升50%,从而显著提升了生产单细胞蛋白的产量和产能。
- 还没有人留言评论。精彩留言会获得点赞!