一种坎地沙坦酯纳米晶体的制备方法
本发明涉及医药领域,具体涉及一种坎地沙坦酯纳米晶体的制备方法。
背景技术:
0、技术背景
1、据报道,难溶性药物占据新候选药物的70%,全球销售排名前200名的速释口服药物中,难溶性药物在总药物中的占比接近40%。水溶性差严重影响了原料药溶出度和生物利用度,并最终限制其临床应用。
2、坎地沙坦酯,分子式为c33h34n6o6,属于沙坦类药物,是一种具有高度选择性、长效的非肽类at1受体拮抗剂,广泛用于高血压等心血管疾病的预防和治疗。临床数据显示,沙坦类药物在降压疗效上与受体阻滞剂、钙离子诘抗剂、利尿剂如氢氯噻嗪等抗高血盐药物相当,但其耐受性明显优于上述药物。该类药物为国内的广大高血压病患者提供预防和治疗上的更好选择,有望成为今后治疗高血药物的主角。但由于其水溶性差,属于bcs ii类化合物,生物利用度约为15%,大大限制临床疗效的发挥。因此,提高其溶出度和生物利用度一直是坎地沙坦酯制剂开发的重点领域之一。
3、药物的溶出速度可用noyes-whitney方程描述:公式中为药物的溶出速度,d为药物的扩散系数,s为固体药物的表面积,h为扩散厚度,cs为药物在介质中溶解度,c为t时刻药物在溶出介质中的浓度。由此可见,减小粒径,以增大其表面积或者降低药物的结晶度甚至转变为非晶态可提高难溶性药物的溶出度。cn111888361 b采用溶剂快速移除方式得到坎地沙坦酯与氢氯噻嗪共无定形物,其组合物的溶出度得到显著提升,但采用溶剂快速移除方式的到的产物容易板结,分散稳定性通常很差。cn102342912 a提供了一种坎地沙坦酯纳米乳制备方法,通过超声将溶剂、油和表面活性剂乳化,然后移除有机溶剂得到澄清透明的坎地沙坦酯纳米乳溶液,该法能够提高坎地沙坦酯的溶出度,但是该法需使用大量的乳化剂,收率低,且制备过程需超声辅助,难以放大制备。
4、药物纳米晶体是不溶性药物颗粒在表面活性剂或聚合物的稳定性下形成粒径为1~1000nm的微晶分散体。不同于其他纳米制剂,如脂质体、纳米颗粒和其他作为药物输送“载体”的固体脂质纳米颗粒,药物纳米晶体的成分简单,通常只含有纯药物,不需要载体,仅需少量稳定剂(如表面活性剂)和填充剂(如蔗糖),从而最大限度地减少了与辅料相关的毒性,同时药物纳米晶体高载药量的特点可提高患者的依从性。将坎地沙坦酯制备为纳米晶是提高其溶出度和生物利用度的重要策略之一。
5、目前,难溶性药物纳米晶体的制备方法主要分为两大类,(1)自上而下法,包括介质研磨法、高压匀质法等;(2)自下而上法,包括乳化法、溶液沉淀法等。目前文献中报道的有通过湿介质研磨耦合喷雾干燥技术获得了坎地沙坦酯纳米晶体或使用溶液沉淀技术获得坎地沙坦酯纳米晶体。前者使用锆珠研磨容易引入金属污染,后者由于溶液沉淀过程过饱和度不均获得的纳米颗粒粒度不均,从而发生严重团聚。
6、药物纳米晶体表面自由能大,粒子之间容易相互聚集,极易形成团状或者絮状,同时纳米粒子间强烈的布朗运动加剧了粒子之间不断相互碰撞,加剧了聚集、结块、晶体生长或转晶的可能性,另外,纳米悬浮液在长期稳定性放置期间容易出现晶型转变、溶出行为变化等问题。因此,寻找一种粒度均一、可长期稳定分散和晶型稳定的坎地沙坦酯纳米悬浮液的制备方法及可实现稳健、节能、高效的工业化制备仍然是现有技术未解决的难题。
技术实现思路
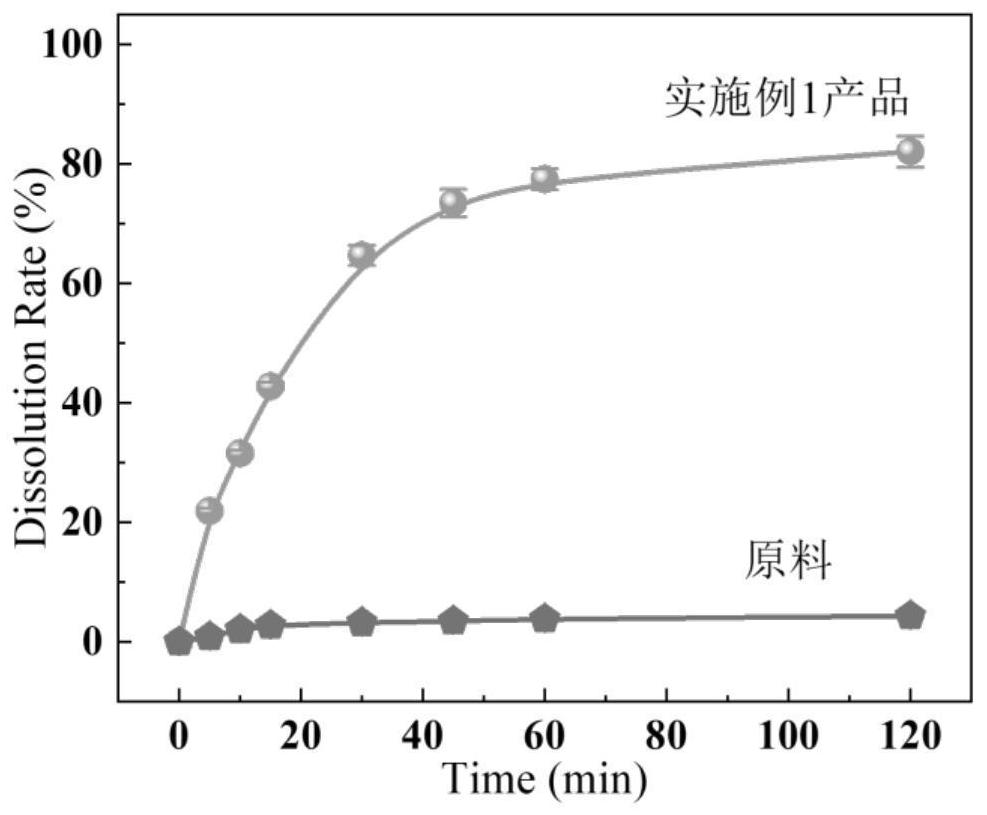
1、为了克服现有坎地沙坦酯纳米晶体制备方法的缺陷,本发明提供了一种利用微液滴淬冷悬浮溶解实现坎地沙坦酯纳米晶体制备的方法,所得坎地沙坦酯纳米晶体为非晶态的球形粒子,平均粒径介于300~800nm,多分散指数介于0.2~0.25,其悬浮液的zeta电位绝对值不低于20mv,可长期维持分散稳定,且溶出性能提升30%~200%。有利于将其开发为纳米混悬剂或纳米片剂,制备工艺稳健,节能环保,可实现规模化生产。
2、本发明的技术方案如下:
3、(1)将坎地沙坦酯和良溶剂的混合溶液雾化为微液滴并快速骤冷至-80~-200℃,例如可以是-80℃、-110℃、-140℃、-170℃或-200℃,微液滴迅速固化为微“复合冰珠”;
4、(2)在搅拌的作用下,将步骤(1)中所述的“复合冰珠”加入到含分散剂的水溶液中,温度控制在-5℃~15℃,例如可以是-5℃、0℃、3℃、6℃、9℃、12℃或15℃,得到坎地沙坦酯纳米晶体。
5、所述步骤(1)中良溶剂为低碳链醇如(甲醇、乙醇、正丙醇、异丙醇、正丁醇或正戊醇等)、四氢呋喃、1,4-二氧六环、甲酸、醋酸、乙酸甲酯、乙酸乙酯、dmso、n-甲基吡咯烷酮、n,n-二甲基甲酰胺、乙腈、二乙二醇乙醚或水中的任意一种或至少两种的组合,坎地沙坦酯的浓度为30mg/ml~100mg/ml。当坎地沙坦酯溶液浓度不在本发明限定范围之内,微液滴骤冷无法获得均一的高过饱和度,在形成的微“复合冰珠”的限阈空间中无法析出纳米尺度的微晶,甚至导致纳米颗粒显著团聚。
6、所述步骤(1)中混合溶液雾化为微液滴,其大小为1μl~100μl,例如可以是1μl、5μl、10μl、20μl、30μl、40μl、50μl、60μl、70μl、80μl、90μl或100μl,骤冷速率为-50℃/min~-100℃/min,例如可以是-50℃/min、-55℃/min、-60℃/min、-70℃/min、-80℃/min、-90℃/min或者-100℃/min,当微液滴体积或者骤冷速率不在本发明限定范围之内时,无法在限阈空间提供高饱和度,促进大量成核并缩短生长时长,进而无法获得非晶态球形纳米晶体,最终不能显著提高难溶性坎地沙坦酯的溶出度。
7、所述步骤(2)中分散剂选自聚乙烯吡咯烷酮、羟丙基纤维素、羟丙基甲基纤维素、聚乙二醇、羧甲基纤维素钠、十八烷基硫酸钠、十二烷基硫酸钠、磺基琥珀酸二辛酯钠、十二烷基纤维素硫酸钠、月桂基甜菜碱、泰洛沙伯、吐温80、司班20、辅酶q10、泊洛沙姆f68、泊洛沙姆f127中的任意一种或至少两种的组合,且所述分散剂用量为所述步骤(1)中坎地沙坦酯质量的1%~80%,例如可以是1%、10%、20%、30%、40%、50%、60%、70%或80%。当所述分散剂的种类或浓度不在本发明限定的范围之内时,分散剂无法润湿悬浮液中的纳米粒子,使得分散剂中的疏水官能团无法在坎地沙坦酯纳米颗粒表面形成强吸附作用,不仅会导致悬浮液中的粒子聚结,粒径和多分散指数增大,同时无法抑制非晶态坎地沙坦酯纳米颗粒转为晶体,降低纳米悬浮液的稳定性,从而降低了难溶性坎地沙坦酯的溶解度和溶出速率。
8、所述步骤(2)中水与所述步骤(1)中坎地沙坦酯混合溶液的体积比为(5~30):1,例如可以是5:1、6:1、7:1、8:1、9:1、10:1、15:1、20:1、25:1或30:1。当所述步骤(2)中水与所述步骤(1)中坎地沙坦酯混合溶液的体积比不在本发明限定范围之内时,要么悬浮液纳米颗粒浓度过低,由于奥斯瓦尔德熟化引发微晶生长,最终粒径过大,无法获得纳米尺度的产品。
9、所述步骤(2)中单位体积的搅拌功率维持在0.15~2.5kw/m3之间,例如可以是0.15kw/m3、0.25kw/m3、0.50kw/m3、0.75kw/m3、1.0kw/m3、1.5kw/m3、2.0kw/m3或2.5kw/m3,当单位体积的搅拌功率不在本发明限定的范围之内时,会导致坎地沙坦酯纳米悬浮液发生絮凝并沉降,使得平均粒径增加,悬浮液难以维持长期稳定。
10、所述步骤(2)中坎地沙坦酯纳米晶体的平均粒径和多分散指数可以通过改变所述步骤(1)中混合溶液的浓度和微液滴淬冷速率有效调节。为了获得纳米晶体,主要是通过促进微液滴骤冷环节晶核瞬间大量析出、减少晶核在生长环节消耗过多的过饱和度实现。调整混合溶液的浓度可使得微液滴淬冷过程获得理想的过饱和度,从而改变坎地沙坦酯成核速率,此外,通过调整微液滴的尺寸或微液滴的淬冷速率,可加速/减缓微液滴传质和传热环节,从而实现坎地沙坦酯纳米颗粒快速/缓慢析出,同时,微液滴的限阈空间同时可阻断晶核之间聚集为更大的晶体,极大地抑制了微晶在微液滴固化为“复合冰珠”阶段生长。所述步骤(2)中坎地沙坦酯纳米晶体的悬浮液的分散稳定性与晶型稳定性可以通过改变所述步骤(2)中分散剂的种类与用量有效调节。“复合冰珠”在悬浮溶解过程,分散剂的疏水基团通过强相互作用吸附在高度疏水的坎地沙坦酯纳米晶体表面,确保了药物颗粒的空间稳定性和均匀分散。同时分散剂的亲水性使得晶体之间产生静电排斥作用,进一步稳定药物纳米晶体分散稳定性。当分散剂与坎地沙坦酯纳米晶体结合能与药物分子自身结合能相近时,可减缓甚至抑制医药纳米晶体晶型发生转变,从而确保纳米晶体获得良好的溶出度和生物利用度。
11、所述制备方法还包括所述步骤(2)中搅拌得到的物质依次进行固液分离、清洗以及干燥。
12、所述固液分离的方式为离心过滤。
13、所述清洗是用水清洗3-5次。
14、所述干燥条件为冷冻干燥,冷冻温度为-85~-105℃,例如可以是-85℃、-90℃、-95℃、-100℃或-105℃,干燥时间24~60h,例如可以是24h、30h、36h、44h、50h或60h。
15、所述坎地沙坦酯纳米晶体为非晶态的球形粒子,平均粒径介于300~800nm,例如300nm、400nm、500nm、600nm、700nm或800nm,多分散指数在0.18~0.23之间,例如可得到多分散指数为0.18、0.19、0.2、0.21、0.22或0.23的产品,其悬浮液的zeta电位绝对值在20~50mv之间,例如可以是-50mv、-40mv、-30mv、-20mv、20mv、30mv、40mv或者50mv,可长期维持稳定分散,溶出率提升18~25倍,例如提升18倍、19倍、20倍、21倍、22倍、23倍、24倍或25倍。有利于将其开发为纳米混悬剂或纳米片剂,制备工艺稳健,节能环保,可实现规模化生产。
16、上述方法中具有以下有益效果:
17、a)本方法得到沙坦酯纳米晶体为球形粒子,平均粒径介于300~800nm,多分散指数在0.18~0.23之间,溶出率提升18~25倍,相比其他增溶的手段(如环糊精包和技术、表面活性剂增溶、固体分散体技术和聚合物纳米粒等),药物纳米晶体稳定性更高,载药量高,最大限度地减少了与辅料相关的毒性。
18、b)本方法所得坎地沙坦酯纳米晶体的悬浮液的zeta电位绝对值介于20~50mv,可长期分散稳定,同时还能确保非晶态的纳米粒子不发生转晶,可进一步改善难溶性药物的溶出度和生物利用度。
19、c)本方法制备工艺稳健,制备效率高,易调控,可通过参数设计获得不同粒径和粒度均一的坎地沙坦酯纳米晶体,并能够保持悬浮液长稳定分散,相较其它微粉制备手段(如湿介质研磨、喷雾干燥或冷冻干燥),更加节能环保,可实现规模化生产。
- 还没有人留言评论。精彩留言会获得点赞!