一种诱导多能干细胞分化为成骨细胞和骨细胞的方法及应用与流程
本发明属于细胞生物学和再生医学领域,涉及一种诱导多能干细胞分化为成骨细胞和骨细胞的方法及应用。
背景技术:
1、骨组织再生受限,治疗大面积颅骨缺损一直是临床的挑战。近年来,随着3d打印技术和生物材料的发展,骨组织工程技术以支架材料、种子细胞和生长因子为基础,研发出生物活性骨植入物,具备出色的生物相容性、骨传导性和骨诱导性,能精确填充颅骨缺损并促进新骨生长(bhushan et al.,2022.bioengineering)。这些生物活性骨植入物不仅规避了自体骨和异体骨的限制、免疫排斥和手术风险,还提供了个性化和高效的治疗方法,为颅骨缺损修复领域带来了突破性进展。
2、然而,如何获得大量的功能性成骨细胞仍然是骨组织工程和动物模型中骨再生效果的关键挑战。传统上,骨髓间充质干细胞(bmscs)是颅骨缺损修复中最常用的种子细胞,它们能够促进颅骨再生和修复(zhao et al.,2021.stem cells int)。然而,bmscs存在来源受限、批次不稳定、细胞老化以及分化异质性等问题(vizoso et al.,2019.int j molsci),难以满足未来骨组织工程的大规模需求。
3、最新的骨组织工程种子细胞来源是诱导多能性干细胞(hipsc),它们可以通过定向诱导分化为成骨细胞和骨细胞,从而促进新骨组织的生成,具有巨大潜力(chen et al.,2022.bioact mater)。hipscs分化为成骨细胞和骨细胞通常包括三个阶段:首先,hipscs经过小分子诱导分化为中胚层间充质干细胞;然后,这些间充质干细胞通过使用含有视黄酸的培养基进一步分化为(前)成骨细胞(具有增殖能力);最后,成骨细胞分泌骨相关蛋白,进一步分化为终末分化的骨细胞,形成矿化的钙结节。常规的hipscs成骨分化培养基的主要基质包括胎牛血清(fbs)、α-mem、地塞米松、β-甘油磷酸盐和维生素c,然而,这类培养基的分化效率非常有限。为了提高体外定向诱导效率,varghese等人通过在常规的诱导培养基中添加腺苷等功能性化合物,进行了连续35天的诱导,但成骨细胞的分化效率仍然较低(varghese et al.,2016sci adv)。kawai等人通过在诱导培养基中添加视黄酸成功将hipscs在10天后诱导为骨样结节,然而,这些终末分化的骨样结节在体外难以继续扩增(kawai et al.,2019nat biomed eng)。由于当前的诱导方法存在分化周期长、分化效率低、成骨细胞难以扩增等问题,严重制约了骨组织工程的应用。因此,需要开发新的方法来高效大量获取成骨细胞和骨细胞。
技术实现思路
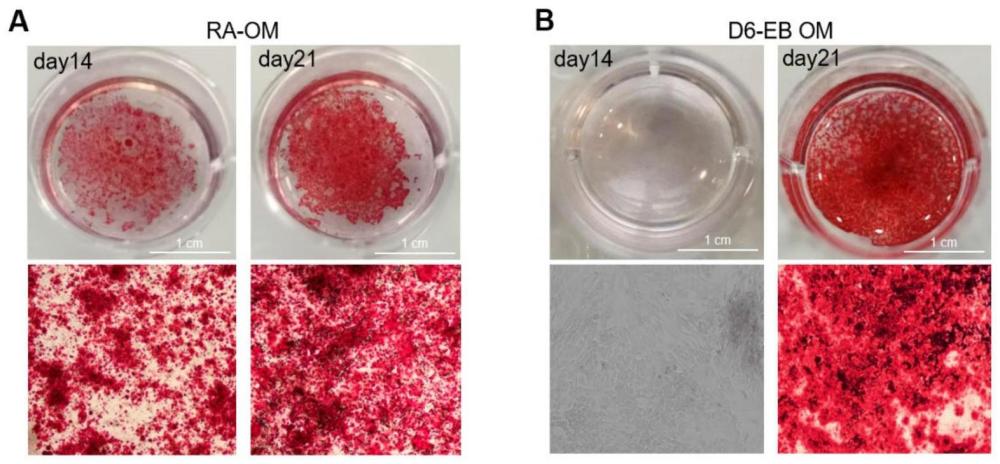
1、为了解决现有技术中存在的问题,本发明提供了一种诱导多能干细胞分化为成骨细胞和骨细胞的方法。本发明的分化方法可将分化时间大大缩短,分化14天即可形成成骨细胞,分化21天即可形成骨细胞。此外,本发明获得的成骨细胞可在体外稳定快速地增殖,传代至p12时依然可以正常扩增且维持标志物表达。
2、本发明通过以下技术方案实现:
3、一种诱导多能干细胞分化为成骨细胞和骨细胞的方法,包括以下步骤:
4、s1:ipsc分化形成拟胚体;
5、s2:拟胚体向肌腱祖细胞分化;
6、s3:肌腱祖细胞向成骨细胞分化;
7、s4:成骨细胞向骨细胞分化。
8、进一步,在s1中,将ipsc消化后用添加了10μm rock抑制剂的e8培养基悬浮培养,形成拟胚体;
9、更进一步,所述rock抑制剂为y27632;
10、更进一步,所述ipsc按照1.5×106cells/ml的细胞密度接种于低吸附6孔板中。
11、进一步,在s2中,先将拟胚体在添加了250nm ldn193189的e8培养基中悬浮培养2天,再在添加了250nm ldn193189、5um chir和100nm agn193109的e8培养基中悬浮培养4天,形成肌腱祖细胞;
12、更进一步,在培养期间每隔一天更换一次新鲜培养基。
13、进一步,在s3中,将肌腱祖细胞接种于预先包被matrigel的孔板中,加入d6-eb om培养基贴壁培养7天,形成成骨细胞;
14、所述d6-eb om培养基由dmem高糖培养基、1%its-g、10%fbs、1mmβ-甘油2-磷酸二钠水合物、50ug/ml l-抗坏血酸2-磷酸、20ng/ml fgf-2、100nm地塞米松、1%glutamax、1%neaa、1% penicilin-streptomycin、1μm视黄酸组成。
15、进一步,在s4中,将成骨细胞在所述d6-eb om培养基中培养7天,形成骨细胞,所述骨细胞有钙结节沉淀。
16、进一步,所述s3后还包含s30:将成骨细胞进行扩增传代培养。
17、更进一步,在s30中,在成骨细胞汇合度达到90%-95%时,用om培养基进行传代培养;
18、所述om培养基由dmem高糖培养基、1%its-g、10%fbs、1mmβ-甘油2-磷酸二钠水合物、50ug/ml l-抗坏血酸2-磷酸、20ng/ml fgf-2、100nm地塞米松、1%glutamax、1%neaa、1% penicilin-streptomycin组成。
19、在一个具体的实施方案中,所述传代培养的步骤如下:待所述成骨细胞汇合度达到90-95%时,用dpbs清洗一遍,并用0.25%trypsin-edta于37℃ 5%co2培养箱消化3min,加入含fbs的培养基终止消化,1200rpm 3min离心收集细胞沉淀,用om培养基重悬并接种细胞。
20、本发明提供了成骨细胞和骨细胞在制备治疗颅骨缺损的药物中的应用。
21、“诱导多能干细胞(ipsc)”指通过人工诱导某些基因的表达从某些成体细胞(如成纤维细胞)获得的具有全能性或多能性的干细胞。在本领域已知的一些方法中,可通过将某些干细胞相关基因转染到非多能细胞如成体成纤维细胞来获得ipsc。转染可以通过使用病毒如逆转录病毒或慢病毒的病毒转导来实现。在一些方法中,转染基因可包括转录因子oct4、sox2、klf4和c-myc,尽管同时转染其他基因有可能提高诱导效率。在另一些方法中,可利用慢病毒系统采用oct4、sox2、nanog和lin28基因转化体细胞。在ipsc中诱导表达的基因包括但不限于oct-3/4;sox基因家族的某些成员(例如soxl、sox2、sox3和sox15);klf家族的某些成员(例如klfl、klf2、klf4和klf5)、myc家族的某些成员(例如c-myc、l-myc和n-myc)、nanog、lin28、tert、fbx15、eras、ecat15-1、ecat15-2、tcl1、β-catenin、ecat1、esg1、dnmt3l、ecat8、gdf3、fth117、sal14、rex1、utf1、stella、stat3、grb2、prdm14、nr5a1、nr5a2或e-cadherin,或其任何组合。目前已经可以从市场上购得用于制备ipsc的各种试剂,如重编程载体、表达盒、培养基等,甚至商业化的ipsc。hipsc指从人体细胞诱导获得的ipsc。一个具体实例中,所用的ipsc是按照中国专利公开cn113462638a中描述的方法(例如采用重编程因子组合oct4、sox2、e6和e7)制备,在此通过引用将该专利文献全文并入本文。
22、术语“成骨细胞”也称骨母细胞,是指从细胞中分泌出骨基质,自发地包裹在骨基质中并且转化为骨细胞的细胞。在本领域已知的一些方法中,成骨细胞由间充质祖细胞分化而来,骨膜存在于成骨细胞群的外部,并且在骨形成后成骨细胞甚至存在于骨膜的内表面,但是在老化的骨中其数量减少。在本发明的一个具体实例中,成骨细胞是由ipsc先分化成肌腱祖细胞再由肌腱祖细胞分化而来。
23、术语“骨细胞”是成熟骨组织的主要细胞,是由成骨细胞分泌的类骨质填充与成骨细胞之间、逐渐将自身包埋而形成。
24、术语“培养基”是本领域公认的,并且通常是指用于培养活细胞的任何物质或制备物。如在提及细胞培养中所使用的术语“培养基”包括细胞周围环境的组分。培养基可以是固体、液体、气体或相和材料的混合物。培养基包括液体生长培养基以及不维持细胞生长的液体培养基。培养基还包括凝胶状培养基,例如琼脂、琼脂糖、明胶和胶原基质。术语“培养基”还指意图用于细胞培养的材料,即使其尚未与细胞接触。换言之,准备用于细菌培养的营养丰富的液体是培养基。
25、本发明的优点和有益效果:
26、(1)本发明解决了成骨细胞分化周期长、分化效率低、不易扩增等难题。
27、(2)传统的分化方法通常涉及将hipscs分化为间充质干细胞(mscs),然后再将其分化成骨细胞和骨细胞。而本发明的方法首先将hipscs分化为肌腱祖细胞(tspcs),然后再分化为成骨细胞和骨细胞,从而显著提高了成骨细胞分化效率,同时可轻松实现这些细胞的大规模扩增。
28、(3)现有技术中从多能干细胞分化为成骨细胞和骨细胞的周期为35天,而本发明的方法分化周期短(21天)且效率高,分化获得的成骨细胞(day14)可以在体外稳定传代和大量扩增,可以在体外快速矿化,为未来骨组织工程和临床骨缺损后修复提供最佳种子细胞。
- 还没有人留言评论。精彩留言会获得点赞!