一种新型的蛋白纯化方法与应用与流程
本发明属于色谱层析领域,具体涉及一种新型的蛋白纯化方法与应用。
背景技术:
1、自1986年第一个治疗性抗体药物进入临床以来,经过30多年的发展,抗体药已成为现代生物医药的重要组成部分,是现代生物制药行业中占比最大、增长最快的子行业,占总生物制剂市场的比重达40%左右。抗体药物主要分为单克隆抗体(mab)、抗体偶联药物(adc)、双特异性抗体(bsab)三类,具有靶向性好、特异性高、治疗效果显著等优点,其中,单克隆抗体被广泛应用于肿瘤及自身免疫疾病的治疗过程,在其中发挥了重要作用。抗体药物行业的蓬勃发展,带动了下游纯化工艺的进步,如何更高效地对抗体蛋白(也称免疫球蛋白)进行纯化,成为了生物制药从业者崭新的挑战。
2、经过多年探索,免疫球蛋白的纯化工艺方法众多,如us5429746a中公开的疏水相互作用层析(hic)纯化免疫球蛋白g(igg)的应用,wo2004076485a1中则公开了运用蛋白a和离子交换色谱法纯化抗体的方法,李菁、林东强等人提供了疏水性电荷诱导色谱分离抗her2单克隆抗体的方法(化工学报10(2014)3931-3937)等。其中以蛋白a亲和层析法对免疫球蛋白进行纯化为主。
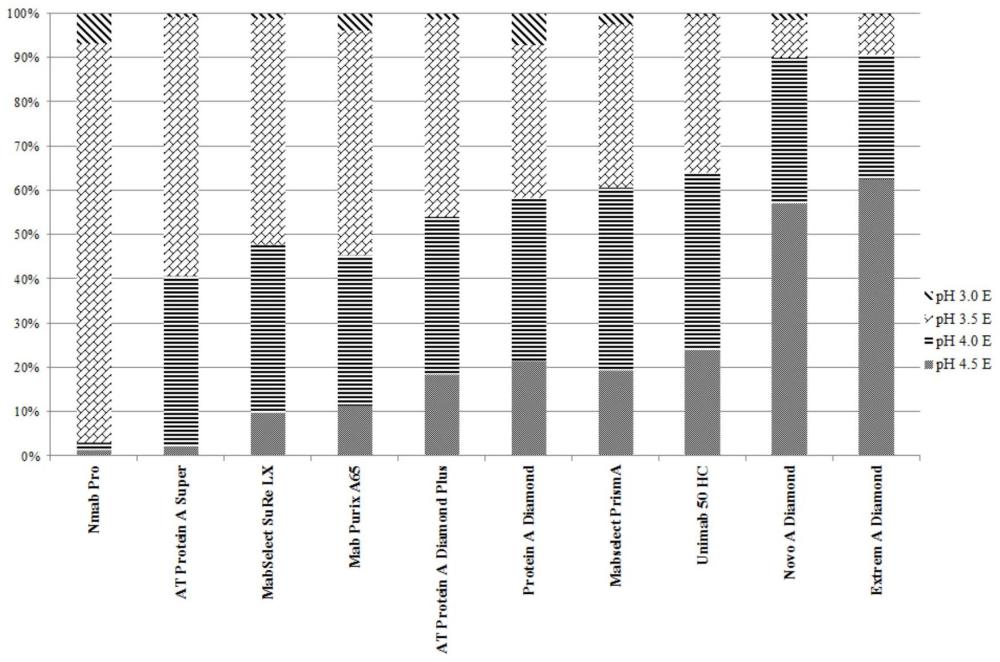
3、蛋白a(protein a)是一种存在于金黄色葡萄球菌中的细胞壁蛋白,能够与抗体蛋白重链稳定区fc特异性结合,尤其是对igg的fc片段具有很强亲和能力。protein a所具备的高特异性、高亲和力、高通用性等优势使其被生物制药行业普遍接受,但在protein a亲和层析法纯化抗体蛋白的过程中,也存在诸多问题。通常情况下,抗体加载后,先用缓冲液淋洗,去除杂质,然后利用酸性缓冲液对proteina上结合的抗体进行洗脱。但是目前市面上常用的亲和层析介质只有ph为3.0-3.5的洗脱条件下才能得到较高的蛋白收率。
4、收率是指从蛋白a亲和层析柱上回收的抗体的量除以装载到柱上的抗体的量,乘以100后得到的百分数,一般行业要求是80%以上,也就是说装载到蛋白a亲和层析柱上100克抗体时,要能回收到至少80克抗体。收率太低造成损耗太高,从而提高生产成本,降低生产效率,增加污染物产生,损害企业利益。市面上多种蛋白a亲和层析介质的洗脱ph要在ph3.5以下时,才能保证收率在80%以上,而ph3.0-3.5的洗脱环境,极易造成蛋白质聚集,形成的聚体可能导致免疫球蛋白丧失活性、增加免疫原性,严重影响纯化产物的质量。因此提供一种不易形成蛋白质聚集的蛋白纯化方法是十分迫切和有必要的。
技术实现思路
1、本发明的目的,提供一种新型的蛋白纯化方法与应用。本发明采用extrem adiamond或novo-a diamond蛋白a亲和层析介质,在ph4.5到ph4.0洗脱条件下可获得较高收率,减少了聚集蛋白的形成、保证抗体质量,可降低生产成本。
2、本发明为解决上述技术问题所采用的技术方案如下:
3、一方面,本发明提供一种蛋白a亲和层析介质纯化蛋白的方法,所述方法包括以下步骤:
4、蛋白a纯化介质装层析柱、平衡、上样、清洗和洗脱液洗脱目标蛋白;
5、其中,所述蛋白a纯化介质选自extrem a diamond或novo-adiamond亲和层析介质;所述洗脱液选自ph值为3.0-4.5的缓冲液。
6、作为优选方式,所述洗脱液选自0.05~0.15m柠檬酸、甘氨酸、醋酸(hac)、盐酸,ph值为3.0-4.5的缓冲液;优选ph值为4.0-4.5的缓冲液。
7、作为优选方式,所述洗脱的方式包括采用ph值从4.5、4.0、3.5、3.0的所述洗脱液依次进行洗脱;优选,采用ph值从4.5、4.0的所述洗脱液依次进行洗脱。
8、作为优选方式,所述洗脱的方式包括采用ph值为4.5或ph值为4.0的缓冲液进行洗脱。
9、作为优选方式,所述目标蛋白包括抗体、抗体片段、adc、双特异性抗体或含有fc的生物活性肽。
10、作为优选方式,所述方法还包括以下步骤:
11、蛋白a纯化介质装层析柱、平衡、上样、清洗和洗脱液洗脱目标蛋白、hac洗杂、naoh在位清洗(cip化学清洗)、平衡、保存层析柱。
12、作为优选方式,所述平衡的平衡缓冲液选自10-100mm磷酸缓冲液(pb)或20-50mmtris缓冲液+0.13~0.17m nacl、ph7.0~ph7.8的缓冲液,优选,20-50mm磷酸缓冲液(pb)或tris缓冲液+0.15m nacl、ph7.4的缓冲液。
13、作为优选方式,所述清洗步骤包括采用缓冲液a、缓冲液b和缓冲液c依次进行清洗;
14、所述缓冲液a选自10-100mm pb+0.13~0.17m nacl、ph7.0~ph7.8的缓冲液,优选,20mm pb+0.15m nacl、ph7.4的缓冲液;
15、所述缓冲液b选自45~55mm柠檬酸钠+0.8~1.2m nacl、ph6.45~ph6.55的缓冲液,优选,50mm柠檬酸钠+1m nacl、ph6.5的缓冲液;
16、所述缓冲液c选自45~55mm柠檬酸钠、ph6.45~ph6.55的缓冲液,优选,50mm柠檬酸钠、ph6.5的缓冲液。
17、作为优选方式,所述方法包括以下步骤:
18、s1,装柱:采用所述extrem a diamond或novo-a diamond亲和层析介质装层析柱;
19、s2,平衡:采用所述平衡缓冲液以一定的流速平衡所述层析柱;
20、s3,上样:步骤s2结束后,样品泵用一定的流速开始上样,上样载量39-40mg/ml;
21、s4,清洗:步骤s3结束后,以一定的流速,依次采用所述缓冲液a、缓冲液b和缓冲液c清洗层析柱;
22、s5,洗脱:步骤s4结束后,以一定的流速,依次采用ph值从4.5到3.0的所述洗脱液进行梯度洗脱;优选,依次采用ph值从4.5到4.0的所述洗脱液进行梯度洗脱层析柱;
23、s6,洗杂:步骤s5结束后,以一定的流速,采用0.5m hac洗杂层析柱;
24、s7,cip化学清洗:步骤s6结束后,以一定的流速,采用0.1m naoh洗脱层析柱;
25、s8,平衡:步骤s7结束后,采用所述平衡缓冲液以一定的流速平衡层析柱;
26、s9,保存层析柱,步骤s8结束后,以一定的流速,采用20%乙醇保存层析柱。其中,一定的流速是指在实际使用过程中会根据纯化量选择柱子的规格和大小,产生不同的流速。
27、另一方面,本发明还提供一种权利要求1所述方法的应用,所述方法应用于抗体及fc融合蛋白的分离纯化中。
28、与现有技术相比,本发明的有益效果如下:
29、1.本发明提供了一种新型的蛋白纯化方法,采用extrem a diamond或novo-adiamond的蛋白a亲和层析介质进行蛋白纯化,使用比同类产品更高ph值的缓冲液(ph4.5到ph4.0)去洗脱结合的抗体,减少了聚集蛋白的形成、从而不形成有害的二聚体和高聚体,提高了抗体质量,保证抗体的安全性和有效性,对于生物制药行业或科研工作都具有巨大价值和意义。
30、2.本发明提供的蛋白纯化方法,在保障抗体质量的洗脱条件下洗脱能够达到80%以上的收率,可以满足生物制药行业纯化要求,避免收率低造成生产损耗过高,从而降低生产成本,提高生产效率。
- 还没有人留言评论。精彩留言会获得点赞!