MIR937基因组拷贝数扩增在卵巢癌诊断和/或治疗中的应用
本发明属于生物医药和分子生物学,具体涉及mir937基因组拷贝数扩增在卵巢癌诊断和/或治疗中的应用。
背景技术:
1、本发明背景技术中公开的信息仅仅旨在增加对本发明的总体背景的理解,而不必然被视为承认或以任何形式暗示该信息构成已经成为本领域一般技术人员所公知的现有技术。
2、卵巢癌(ov)是一种严重威胁女性健康的恶性肿瘤。在ov的各种组织类型中,高级别癌症浆液性癌(hgsoc)最为普遍,每年占新病例的60-80%。据估计,在临床上,超过75%的hgsoc患者被诊断为晚期,这使得它最致命,也最难被干扰。因此,hgsoc的五年生存率不到30%,并且在过去三十年中由于缺乏早期诊断标志物和有效的治疗靶点而没有显著改善。加强了对更严格研究的需求,以增强我们对hgsoc肿瘤起始和进展的理解,从而提供新的干预策略。
3、hgsoc患者的特征是高频率的体细胞拷贝数改变(cnas),包括肿瘤抑制基因的缺失和癌基因的扩增。在大多数情况下,cna通常与基因表达和蛋白质丰度的变化相关。越来越多的证据表明,基因扩增总是导致增殖表型,这归因于特定基因的表达增强或基因收集的累积效应。在hgsoc中,基因扩增在肿瘤发生中的功能获得已被广泛研究。例如,具有基因组扩增uri的ov细胞依赖于增强的uri蛋白来维持其生存。usp13扩增和过度表达重新编程了癌症细胞代谢,并加重了hgsoc的肿瘤进展。此外,扩增的rad21增强了其与yap/tead4的相互作用,以抑制干扰素信号传导,并促进hgsoc细胞的免疫逃避。因此,研究人员一直致力于揭示临床中相关基因组改变的精确医学靶点。her2抗体(曲妥珠单抗)在治疗her2扩增的乳腺癌症方面取得了进展。尽管hgsoc并非如此,但这一成功带来了一种鼓舞人心的可能性,即靶向扩增的肿瘤驱动因素在癌症治疗中具有巨大潜力。不仅对于蛋白质编码基因,小的非编码微小rna(mirna)的cna也代表了一种具有癌症驱动能力的基因组畸变类型。然而,缺乏对mirna扩增在致癌作用中的潜在机制的解释,严重限制了hgsoc治疗的进展。
4、mirna由19-24个核苷酸组成,主要通过信使核糖核酸靶标的互补结合,在细胞存活、增殖和分化方面具有深刻的生物学功能。功能研究证实,mirna也可以作为肿瘤抑制剂或致癌基因,mirna的基因组畸变可以导致mirna失调,并不断与癌症进展相关。这一概念已在hgsoc中得到验证,即mir-569的拷贝数增加通过减弱tp53inp1转录来增加其表达并提高肿瘤存活和增殖。模拟物或抑制剂(具有抗mir功能)对mirna的干预在癌症及相关疾病的临床治疗中显示出巨大的潜力。例如,肿瘤抑制因子mir-16的模拟物(mesomir-1)和靶向mir-155的抗mir(mrg-106)分别达到了治疗恶性胸膜间皮瘤和皮肤t细胞淋巴瘤的i期试验。鉴于mirnacnas在癌症中的普遍性,以及在受体中操纵mirna表达的可行性,这鼓励我们解开hgsoc中扩增mir的功能机制,以提供前瞻性的治疗靶点。
技术实现思路
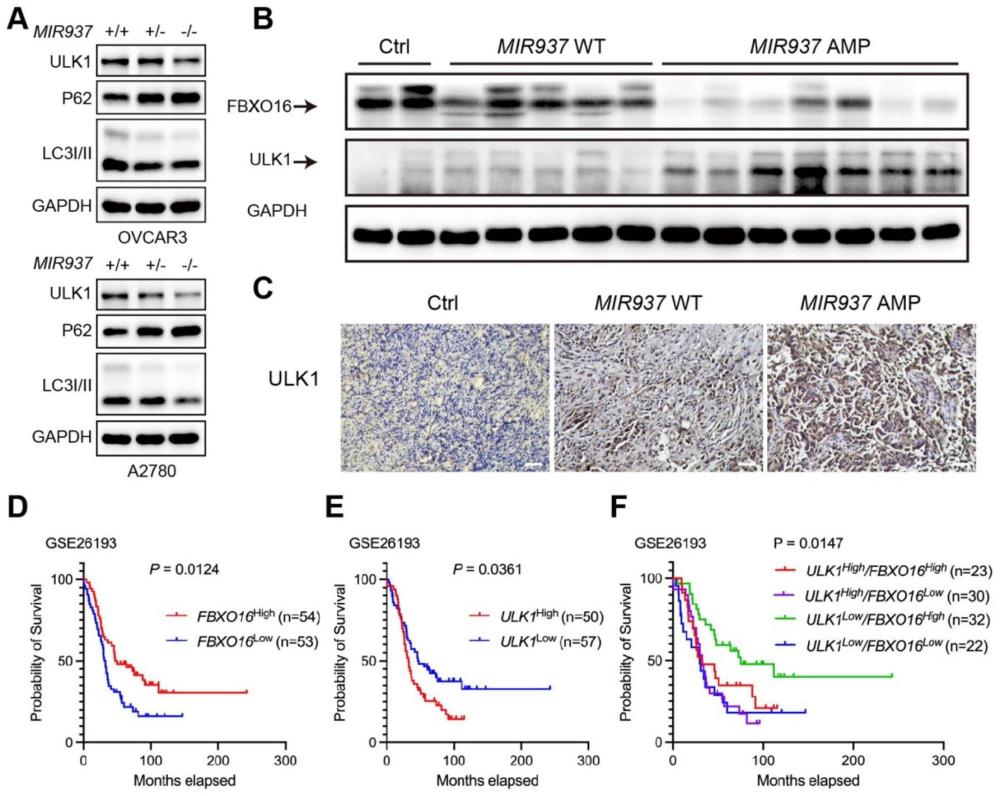
1、针对上述现有技术,本发明的目的在于提供mir937基因组拷贝数扩增在卵巢癌诊断和/或治疗中的应用。具体的,本发明通过tcga数据库筛选了hgsoc患者8q24.3频繁扩增基因座中扩增的mirna,进一步发现mir937扩增可以促进hgsoc细胞的增殖。从机制上讲,mir937扩增增加了mir-937-5p的表达,减少了fbxo16及其对ulk1蛋白的降解作用,从而增强了自噬。本发明研究揭示了hgsoc进展的调节轴,并为患者提供了新的联合治疗靶点。基于上述研究成果,从而完成本发明。
2、具体的,本发明的技术方案如下:
3、本发明的第一个方面,提供检测mir937相关生物元件表达情况的试剂在制备筛查、(辅助)诊断、检测、监测或预测卵巢癌的进展的产品中的应用。
4、其中,所述mir937相关生物元件表达情况包括但不限于mir937基因拷贝数的改变,mir-937-5p表达水平的改变、fbxo16表达水平的改变以及ulk1表达水平的改变。
5、具体的,本发明通过研究发现,mir937在hgsoc患者中基因拷贝数扩增,并进一步增加了mir-937-5p的表达,减少了fbxo16及其对ulk1蛋白的降解作用,即mir937通过mir-937-5p/fbxo16/ulk1调节卵巢癌进展。具体表现为:mir937扩增介导mir-937-5p高表达,进而诱导ulk1高表达和fbxo16的低表达,同时导致hgsoc患者的恶性进展。因此,上述mir937相关生物元件可作为卵巢癌特别是高级别浆液性卵巢癌的诊断以及预后标志物。
6、所述产品可以为试剂盒、检测装置或检测设备等,在此不做具体限定。
7、本发明的第二个方面,提供一种用于筛查、(辅助)诊断、检测、监测或预测卵巢癌的进展的系统,所述系统包括:
8、获取单元,其被配置为:获取受试者待测样品mir937相关生物元件表达情况;
9、评估单元,其被配置为:根据获取单元获得的受试者mir937相关生物元件表达情况判断所述受试者的患病情况。
10、其中,所述mir937相关生物元件表达情况包括但不限于mir937基因拷贝数的改变,mir-937-5p表达水平的改变、fbxo16表达水平的改变以及ulk1表达水平的改变。
11、所述卵巢癌可以为高级别浆液性卵巢癌。
12、所述待测样品可以是卵巢(癌)组织或细胞。
13、本发明的第三个方面,提供mir937相关生物元件作为靶点在制备和/或筛选卵巢癌药物中的应用。
14、可以利用候选药物使用前和使用后对mir937相关生物元件的影响,从而确定候选药物是否可以用于预防或治疗卵巢癌。其中,所述卵巢癌具体为高级别浆液性卵巢癌。
15、具体的,筛选卵巢癌药物的方法包括:
16、1)采用候选物质处理表达和/或含有所述mir937相关生物元件的体系;设置不采用候选物质处理的平行对照;
17、2)完成步骤1)后,检测体系中所述mir937相关生物元件的表达水平;与平行对照相比,如果采用候选物质处理的体系中所述mir937相关生物元件的表达量显著降低或提高,所述候选物质可作为候选的卵巢癌药物。
18、其中,所述mir937相关生物元件包括mir937、mir-937-3p、fbxo16和ulk1中的至少一种。
19、本发明的第四个方面,提供抑制mir937表达或使其活性降低的物质在如下任意一种或多种中的应用:
20、a)抑制mir-937-5p表达或制备抑制mir-937-5p表达的产品;
21、b)抑制ulk1表达或制备抑制ulk1表达的产品;
22、c)促进fbxo16表达或制备促进fbxo16表达的产品;
23、d)抑制卵巢癌细胞自噬或制备抑制卵巢癌细胞自噬的产品;
24、e)抑制卵巢癌细胞增殖或制备抑制卵巢癌细胞增殖的产品;
25、f)抑制卵巢癌生长或制备抑制卵巢癌生长的产品;
26、g)治疗卵巢癌的产品。
27、其中,抑制mir937表达或使其活性降低的物质可以为包括但不限于针对mir937的rna干扰分子或反义寡核苷酸、小分子抑制剂、shrna、sirna,实施慢病毒感染或基因敲除的物质(如基于crispr-cas9技术敲除mir937)。
28、所述卵巢癌可以为高级别浆液性卵巢癌。
29、所述产品可以为药物或者实验试剂,所述实验试剂供基础研究使用。比如该产品可用于在体外调控卵巢癌细胞的增殖,从而制备卵巢癌细胞相关生物模型,从而用于卵巢癌相关机制研究。
30、根据本发明,当所述产品为药物时,所述药物还包括至少一种药物非活性成分。
31、所述药物非活性成分可以是药学上通常使用的载体、赋形剂及稀释剂等。而且,根据通常的方法,可以制作成粉剂、颗粒剂、片剂、胶囊剂、混悬剂、乳剂、糖浆剂、喷雾剂等的口服剂、外用剂、栓剂及无菌注射溶液形式的剂型使用。
32、所述可以包含的载体、赋形剂及稀释剂等非药物活性成分在领域内是熟知的,本领域普通技术人员能够确定其符合临床标准。
33、所述药物施用对象可以是人和非人哺乳动物,如小鼠、大鼠、豚鼠、兔、狗、猴和猩猩,在此不做具体限定。
34、上述一个或多个技术方案的有益技术效果:
35、上述技术方案表明mir937对基因拷贝数扩增的依赖性,该扩增增强了细胞自噬并决定了hgsoc的增殖活性。tcga数据库的数据挖掘显示,mir937扩增与hgsoc的mir937表达和细胞增殖增加相关。hgsoc细胞中mir937的缺失导致自噬受损和细胞增殖迟缓,其抑制作用的程度与mir937拷贝丢失的程度成比例。拯救试验证实mir-937-5p,一种成熟的mir937产物,足以恢复其致癌功能。从机制上讲,mir937扩增提高了mir-937-5p的表达,增强了其与fbxo16转录物3’utr的结合,从而限制了fbxo16对ulk1的降解作用。上述技术方案结果表明,mir937扩增增强了细胞自噬和增殖,并为hgsoc治疗提供了一种mir937/fbxo16/ulk1靶向的替代策略,因此具有良好的潜在实际应用之价值。
- 还没有人留言评论。精彩留言会获得点赞!