一种筛选产醇氧化酶菌株及判断醇氧化酶活力的方法
本发明涉及酶工程,尤其是涉及一种筛选产醇氧化酶菌株及判断醇氧化酶活力的方法。
背景技术:
1、醇氧化酶(aox)能够以fad或铜作为电子受体,以分子氧作为氧化剂催化醇生成羰基化合物。副产物只有h2o2,无需额外添加辅助因子,条件温和,环境友好。醇氧化酶能够催化短链脂肪醇、长链脂肪醇、芳香醇和仲醇等多种底物,部分氧化酶会催化产物醛(以偕二醇的形式)进一步氧化为酸。近几年醇氧化酶成功应用于羟基酸、2,5-呋喃二羧酸、手性仲醇、硫醇等重要工业化学品的制备及构建级联反应(liu j.et al.current opinion inchemical biology 2018,43:77-86;pickl m.etal.applied microbiology andbiotechnology 2015,99:6617-6642;dijkman w.p.et al.acs catalysis 2015,5:1833-1839;martin c.et al angewandte chemie international edition 2020,59:4869-4872;faisca phillips a.m.et al.chemcatchem 2017,9:217-246)。
2、但目前能够用于工业生产的醇氧化酶并不多,天然醇氧化酶往往面临着催化活力低,稳定性差等问题,需要在分子水平对其进行改造。但在对酶分子进行改造时,如何在大量突变体中快速筛选出目标突变体成为了首要挑战,特别是非理性的定向进化改造策略中。
3、醇氧化酶活性可通过偶联辣根过氧化物酶和显色底物进行检测,辣根过氧化物酶催化副产物双氧水氧化显色底物,颜色的变化与双氧水的生成量成正比,从而反映醇氧化酶的活力。4-氨基安替比林,3,5-二氯-2-羟基苯磺酸等是常用的显色底物。目前,比色法测定醇氧化酶的活力需要分光光度计、酶标仪等仪器,在高通量筛选的时候需要用96深孔板培养后,对细胞进行破碎,用酶标仪进行筛选。操作繁琐,工作量大,无法满足包含大量突变体的突变库的快速筛选。
技术实现思路
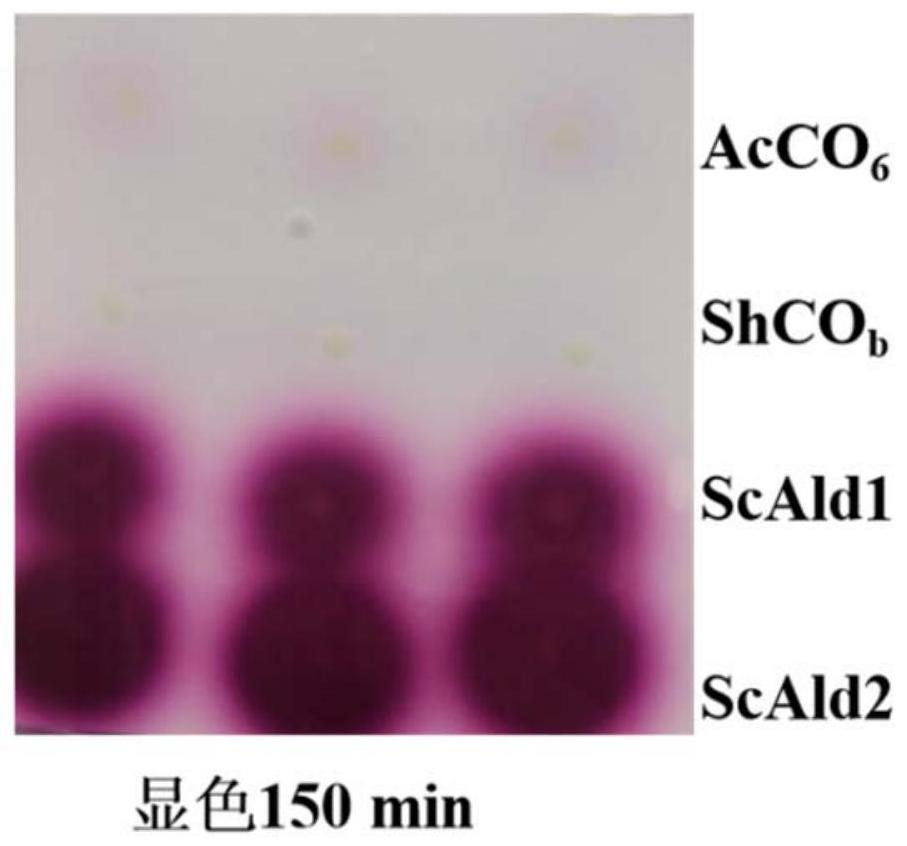
1、本发明的目的就是为了提供一种筛选产醇氧化酶菌株及判断醇氧化酶活力的方法。本发明通过在平板上显色,能快速便捷的筛选出具有活性的醇氧化酶突变体的菌落,并通过显色圈大小和颜色深浅判断不同突变体的醇氧化酶的活力,可应用于醇氧化酶突变体文库的筛选。
2、本发明的目的可以通过以下技术方案来实现:
3、一种筛选产醇氧化酶菌株及判断醇氧化酶活力的方法,具体步骤如下:
4、s1、重组醇氧化酶的表达:将菌株接种于硝酸纤维素膜上培养得到长有菌落的硝酸纤维素膜,将长有菌落的硝酸纤维素膜低温诱导,得到长有表达醇氧化酶菌落的硝酸纤维素膜;
5、s2、将长有表达醇氧化酶菌落的硝酸纤维素膜多次冻融,室温放置;
6、s3、重组醇氧化酶的筛选:将室温放置后的硝酸纤维素膜覆盖于显色琼脂凝胶上,通过显色琼脂凝胶上显色圈的大小及颜色深浅判断醇氧化酶活性高低,显色圈越大,颜色越深,醇氧化酶活性越高。
7、进一步地,步骤s1中,所述菌株包括重组表达arthrobacter cholorphenolicus的醇氧化酶acco6、streptomyces hygrospinosus的醇氧化酶shcob、天蓝色链霉菌的醇氧化酶scald1或scald2的大肠杆菌。
8、进一步地,步骤s1中,所述重组醇氧化酶的表达的具体步骤如下:
9、将单菌落菌株接种于平铺在lb固体平板培养基上的硝酸纤维素膜上,待菌株培养一段时间后得到长有菌落的硝酸纤维素膜,将长有菌落的硝酸纤维素膜转移至含有iptg的lb固体平板培养基上,低温诱导。
10、上述更进一步地,所述培养温度为30℃~37℃。
11、上述更进一步地,所述培养时间为12~20h,优选为16h。
12、上述更进一步地,所述诱导温度为14℃~18℃,优选为16℃。
13、上述更进一步地,所述诱导时间为10~14h,优选为12h。
14、上述更进一步地,lb固体平板培养基的配方为:胰蛋白胨10g/l,酵母提取物5g/l,nacl 10g/l,卡那霉素50mg/l,琼脂15g/l;
15、含有iptg的lb固体平板培养基的配方为:胰蛋白胨10g/l,酵母提取物5g/l,nacl10g/l,卡那霉素50mg/l,琼脂15g/l,诱导剂iptg 0.1mm。
16、进一步地,步骤s2中,将长有表达醇氧化酶菌落的硝酸纤维素膜在-80℃的冰箱反复冻融3次,于室温中放置一段时间,除去细胞内的h2o2。
17、上述更进一步地,每次冻融时间为8~12min,优选为10min。
18、上述更进一步地,所述室温放置时间为0.8~1.2h,优选为1h。
19、进一步地,步骤s3中,所述重组醇氧化酶的筛选的具体步骤如下:
20、将硝酸纤维素膜上长有菌落的一面向下覆盖在显色琼脂凝胶上,反应一段时间后,通过显色琼脂凝胶上显色圈大小及颜色深浅判断醇氧化酶活性高低,显色圈越大,颜色越深,醇氧化酶活性越高。
21、上述更进一步地,所述反应温度为30℃~37℃,优选为30℃。
22、上述更进一步地,所述反应时间为0.5~1h,优选为30min。
23、进一步地,步骤s3中,所述显色琼脂凝胶的配制方法如下:
24、取适量琼脂加入到pbs缓冲液中,加热溶解,室温冷却,加入显色试剂,辣根过氧化物酶及底物,混匀后倒入培养皿中,待冷却即得显色琼脂凝胶。
25、上述更进一步地,所述琼脂的最终浓度为10~20g/l,优选为15g/l;
26、所述显色试剂的最终浓度为0.1~0.8mm,优选为0.5mm;
27、所述辣根过氧化物酶的最终浓度为2~6u,优选为4u;
28、所述底物的最终浓度为2~8mm,优选为5mm。
29、上述更进一步地,所述冷却温度低于45℃。
30、上述更进一步地,所述底物为醇类物质,通过醇氧化酶催化底物测定菌株中醇氧化酶的活力大小。
31、上述更进一步地,所述底物选自香茅醇或木糖醇;
32、所述显色试剂包括4-氨基安替比林和3,5-二氯-2-羟基苯磺酸。
33、与现有技术相比,本发明的有益效果如下所示:
34、现有技术中,醇氧化酶的活性筛选,通常需要在液体培养基中对产醇氧化酶的细胞进行培养后,收集细胞、破碎后进行酶催化反应,利用分光光度计、酶标仪等仪器进行分析。本发明基于平板菌落显色建立了一种筛选产醇氧化酶菌株及判断醇氧化酶活力的方法,快速筛选具有不同醇氧化酶活力菌株的方法。
35、本发明将长有表达醇氧化酶的重组大肠杆菌的硝酸纤维素膜覆盖在含有底物、辣根过氧化物酶及显色底物的显色琼脂上,通过显色圈大小及颜色深浅可判断醇氧化酶活性高低。显色圈越大,颜色越深,醇氧化酶活性越高。
36、本发明建立的醇氧化酶筛选方法简便高效,无需繁琐的菌体培养、破碎等流程,不需要借助分析仪器,可快速对不同醇氧化酶的活性进行比较,方便开展高通量筛选。
- 还没有人留言评论。精彩留言会获得点赞!