甘油酸、甘油酸酯及其组合物的制作方法
本说明书涉及药物化学领域,具体涉及甘油酸、甘油酸酯及其组合物。
背景技术:
1、甘油酸和/或甘油酸酯在人体新陈代谢中发挥积极作用。例如,体内的甘油酸和/或甘油酸酯可以加速乙醛的氧化,从而加速体内乙醇的代谢。这些化合物具有多种有益于人类健康的应用。因此,需要提供有效且高效的方法来生产不同形式的甘油酸和/或甘油酸酯及其组合物。
技术实现思路
1、本说明书的一方面提供了一种d-甘油酸钙的晶型,其结构式为(i):
2、
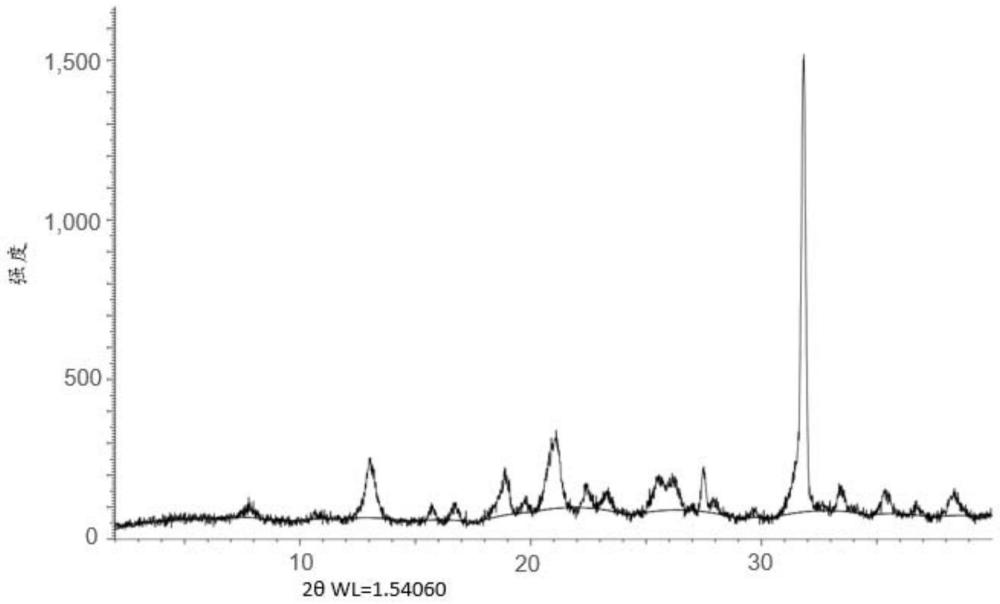
3、所述晶型通过在12.9±0.2、20.9±0.2和31.7±0.2处±具有x射线粉末衍射图(xrpd)衍射峰(2θ度)表征。
4、本说明书的另一方面提供了一种制备式(i)的d-甘油酸钙晶型的方法。所述方法包括:将d-甘油酸与钙盐混合,形成第一溶液;以搅拌速率搅拌第一溶液并以冷却速率将第一溶液冷却至一定温度;在一定温度下,对第一溶液陈化处理一定时间段;过滤第一溶液,得到第一甘油酸钙样本,并对第一甘油酸钙样本进行干燥处理;将干燥后的第一甘油酸钙样本在第二温度下重新溶解以形成第二溶液;以及过滤第二溶液,得到第二甘油酸钙样本,并对第二甘油酸钙样本进行干燥处理,得到甘油酸钙的晶型。
5、本说明书的另一方面提供了一种制备式(i)的d-甘油酸钙晶型的方法。所述方法包括:将d-甘油酸与钙盐混合,形成第一溶液;向第一溶液中加入溶剂,并以搅拌速率进行搅拌,形成第二溶液;将第二溶液陈化一定时间段;过滤第二溶液,得到第一甘油酸钙样本,干燥第一甘油酸钙样本;将干燥后的第一甘油酸钙样本重新溶解,形成第三溶液;过滤第三溶液,得到第二甘油酸钙样本,并干燥第二甘油酸钙样本,得到甘油酸钙的晶型。
6、本说明书的另一方面提供了一种d-甘油酸钙的晶型,其结构式为(ii)
7、
8、所述晶型通过在15.4±0.2、17.0±0.2和27.1±0.2处具有x射线粉末衍射图(xrpd)衍射峰(2θ度)表征。
9、本说明书的另一方面提供了一种制备式(ii)的d-甘油酸钙晶型的方法。所述方法包括:将d-甘油酸与钙盐混合,形成第一溶液;调节第一溶液的ph至一定ph范围;将甲醇加入第一溶液中,形成第二溶液;将第二溶液在第一温度下回流第一时间段;停止回流,搅拌并自然冷却第二溶液;将第二溶液冷却至第二温度后,向第二溶液中加入溶剂并搅拌,形成第三溶液;将第三溶液陈化第二时间段;将第三溶液过滤,得到甘油酸钙样本,并将甘油酸钙样本干燥,得到甘油酸钙的晶型。
10、本说明书的另一方面提供了一种制备式(iii)的无定形d-甘油酸钙的方法
11、
12、所述方法包括:将晶型甘油酸钙与溶剂在第一温度下搅拌第一时间段以形成悬浮液;维持第一温度并过滤悬浮液,形成过饱和溶液;以搅拌速率搅拌过饱和溶液,并以冷却速率冷却过饱和溶液;将过饱和溶液冷却至第二温度后,维持第二温度,将过饱和溶液陈化第二时间段,并过滤过饱和溶液;在一定压力和第三温度下,将过滤物干燥第三时间段,获得无定形甘油酸钙。
13、本说明书的另一方面提供了一种制备式(iii)的无定形d-甘油酸钙的方法。所述方法包括:将晶型甘油酸钙与溶剂在第一温度下搅拌第一时间段以形成悬浮液;维持第一温度并过滤悬浮液,形成过饱和溶液;以搅拌速率搅拌过饱和溶液,并以冷却速率冷却过饱和溶液;将过饱和溶液冷却至第二温度后,维持第二温度,将过饱和溶液陈化第二时间段,并过滤过饱和溶液;在一定压力和第三温度下,将过滤物干燥第三时间段,获得无定形甘油酸钙。
14、本说明书的另一方面提供了一种制备纯化的甘油酸样本的方法。所述方法包括:基于微生物发酵技术获得甘油酸发酵液;对发酵液进行固液分离操作,以从发酵液中过滤出第一杂质,第一杂质包括细菌残渣、细胞残渣以及高分子物质;使用磁性纳米吸附剂和铝/铁凝结剂从发酵液中过滤出第二杂质,第二杂质包括蛋白质、单宁、粘糖和色素;进行萃取操作,以从发酵液中过滤出第三杂质,得到纯化甘油酸样本,第三杂质包括甘油和二羟基丙酮。
15、本说明书的另一方面提供了一种组合物。所述组合物包括:甘油酸物质,其包括d-甘油酸或d-甘油酸盐;和赋形剂,其包括nad+前体、矿物质或维生素中的至少一种。
技术特征:
1.一种d-甘油酸钙的晶型,其结构式为(i):
2.如权利要求1所述的晶型,其特征在于,所述晶型进一步通过在25.4±0.2和26.1±0.2处具有xrpd衍射峰(2θ度)表征。
3.如权利要求1或2所述的晶型,其特征在于,所述晶型进一步通过在15.6±0.2、16.6±0.2、18.8±0.2、22.3±0.2、23.1±0.2、27.4±0.2、27.8±0.2、33.3±0.2、35.2±0.2和38.2±0.2处具有xrpd衍射峰(2θ度)表征。
4.如权利要求1至3中任一项所述的晶型,其特征在于,所述晶型通过以下方式制备:
5.如权利要求4所述的晶型,其特征在于,
6.如权利要求1至3中任一项所述的晶型,其特征在于,所述晶型通过以下方法制备:
7.如权利要求6所述的晶型,其特征在于,
8.一种制备晶型d-甘油酸钙的方法,所述晶型d-甘油酸钙的结构式为(i):
9.如权利要求8所述的晶型,其特征在于,
10.如权利要求8或9所述的方法,其特征在于,
11.一种制备晶型d-甘油酸钙的方法,所述晶型d-甘油酸钙的结构式为(i):
12.如权利要求11所述的晶型,其特征在于,
13.如权利要求1或12所述的方法,其特征在于,
14.一种d-甘油酸钙的晶型,其结构式为(ii):
15.如权利要求14所述的晶型,其特征在于,所述晶型进一步通过在23.8±0.2、28.6±0.2和32.0±0.2处具有xrpd衍射峰(2θ度)表征。
16.如权利要求14或15所述的晶型,其特征在于,所述晶型进一步通过在12.9±0.2、19.1±0.2、19.5±0.2、21.2±0.2、22.3±0.2、36.4±0.2、37.6±0.2和39.5±0.2处具有xrpd衍射峰(2θ度)表征。
17.如权利要求14至16中任一项所述的晶型,其特征在于,所述晶型通过以下方法制备:将d-甘油酸与钙盐混合,形成第一溶液;
18.如权利要求17所述的晶型,其特征在于,
19.一种制备晶型d-甘油酸钙的方法,所述晶型d-甘油酸钙的结构式为(ii):
20.如权利要求19所述的方法,其特征在于,
21.如权利要求10或20所述的方法,其特征在于,
22.一种制备无定形d-甘油酸钙的方法,所述无定形d-甘油酸钙的结构式为(iii)
23.如权利要求22所述的方法,其特征在于,
24.如权利要求1或23所述的方法,其特征在于,
25.如权利要求22-24中任一项所述的方法,其特征在于,
26.如权利要求22至25中任一项所述的方法,其特征在于,
27.如权利要求22至26中任一项所述的方法,其特征在于,所述晶型d-甘油酸钙具有结晶式(i)或(ii):
28.一种制备纯化甘油酸样本的方法,其特征在于,包括:
29.如权利要求28所述的方法,其特征在于,所述使用磁性纳米吸附剂和铝/铁凝结剂从所述发酵液中滤除第二杂质包括:
30.如权利要求28或29所述的方法,其特征在于,所述磁性纳米吸附剂通过以下方式制备:将铁盐与溶剂混合以制备溶液;
31.如权利要求30所述的方法,其特征在于,所述磁性纳米吸附剂的制备在厌氧状态下进行,并引入氮气以去除氧气。
32.如权利要求30或31所述的方法,其特征在于,
33.如权利要求28至32中任一项所述的方法,其特征在于,所述进行萃取操作以从所述发酵液滤出第三杂质包括:
34.如权利要求33所述的方法,其特征在于,
35.一种组合物,其特征在于,包含:
36.如权利要求35所述的组合物,其特征在于,所述甘油酸物质与所述赋形剂的质量比为(0.01-300):1。
37.如权利要求35或36所述的组合物,其特征在于,所述赋形剂包括所述nad+前体、所述矿物质和所述维生素的混合物。
38.如权利要求37所述的组合物,其特征在于,所述甘油酸物质、所述nad+前体、所述矿物质和所述维生素的质量比为100:(0.01-100):(0.01-100):(0.01-100)。
39.如权利要求38的组合物,其特征在于,所述nad+前体包括烟酰胺核糖(nr)、烟酰胺单核苷酸(nma)、烟酸、色氨酸和烟酰胺的混合物,所述nr、所述nma、所述烟酸、所述色氨酸、所述烟酰胺的质量比为(1-3):(1-3):(0.5-2):(0.5-2):1。
40.如权利要求35至39中任一项所述的组合物,其特征在于,
41.如权利要求40所述的组合物,其特征在于,
42.如权利要求35至41中任一项所述的组合物,所述维生素包括维生素b1、维生素b2、维生素b6和维生素c的混合物,所述维生素b1、所述维生素b2、所述维生素b6和所述维生素c的质量比为(0.5-2):(0.5-2):(0.5-2):1。
43.如权利要求35至42中任一项所述的组合物,所述组合物以软胶囊、硬胶囊、微胶囊、片剂、粉末、丸剂、乳液或悬浮液的形式使用。
44.如权利要求35至43中任一项所述的组合物,所述d-甘油酸盐具有结晶式:
技术总结
本说明书提供了式为(I)的D‑甘油酸钙的晶型(I),以及制备式为(I)的D‑甘油酸钙晶型的方法。该晶型通过在12.9±0.2、20.9±0.2和31.7±0.2处具有X射线粉末衍射图(XRPD)衍射峰(2θ度)表征。
技术研发人员:甄明,刘梦静,王丽,刘启月,陈必钦,王炳荣,李丹,吴轶,詹光煌
受保护的技术使用者:内蒙古金达威药业有限公司
技术研发日:
技术公布日:2024/4/29
- 还没有人留言评论。精彩留言会获得点赞!