一种高产T4N5的酿酒酵母工程菌及其构建方法和应用
本发明属于基因工程领域,涉及一种高产t4核酸内切酶v(t4n5)的酿酒酵母工程菌及其构建方法和应用。
背景技术:
1、t4核酸内切酶v(t4 endonuclease v,t4n5)是一种来源于t4噬菌体的核酸内切酶,分子量约为16.1kda,最初由tanaka等人于1975年从感染了t4噬菌体的大肠杆菌中分离出来。t4核酸内切酶v与因紫外照射造成的dna的损伤修复有关,它是一种包含嘧啶二聚体-dna糖苷酶与脱嘌呤-脱嘧啶内切酶两种活性的双功能酶。t4核酸内切酶v可以特异性识别dna中因紫外照射而形成的环丁烷嘧啶二聚体(cyclobutane pyrimidine dimer,cpd),当其识别到cpd后会将其切开,在这个过程中首先会由嘧啶二聚体-dna糖苷酶将cpd中5’嘧啶与脱氧核糖间的糖苷键切开,形成脱嘧啶位点,再由脱嘌呤-脱嘧啶内切酶将脱嘧啶位点中的两个相邻的脱氧核糖间的磷酸二酯键切开,形成缺刻dna。
2、紫外线是诱发皮肤癌的重要因素。当长时间暴露于阳光下时,紫外线的辐射将可能会诱使皮肤细胞中的dna形成嘧啶二聚体,造成dna损伤。一些实验已经证明,t4核酸内切酶v可以有效的降低皮肤癌的患病几率。例如,wolf等的一项小鼠研究表明,t4n5脂质体可以作为防晒霜的有效辅助剂,减少晒伤细胞的形成。
3、国内外均已有报道重组t4核酸内切酶v的生产案例,目前的主流生产方式是以大肠杆菌作为表达宿主进行生产。以大肠杆菌作为宿主生产t4核酸内切酶v往往会引起包涵体的形成,导致后续纯化工艺复杂,限制了其大规模生产。
4、酿酒酵母(saccharomyces cerevisiae)是一种广泛研究的单细胞真核微生物,已被大量用于各类天然化合物的生物合成,其具有复杂的细胞壁结构。酿酒酵母细胞壁厚度约100~300nm,类似“三明治”结构,主要由β-d葡聚糖(β-d-glucan)、α-d-甘露聚糖(α-d-mannose)和少量的几丁质(chitin)组成。sed1基因存在于酿酒酵母基因组中,其翻译的蛋白sed1p经过糖基化形成甘露糖蛋白,甘露糖蛋白与葡聚糖通过共价键结合最终锚定在细胞壁外侧(shimoi h,et al.sed1p is a major cell wall protein of saccharomycescerevisiae in the stationary phase and is involved in lytic enzymeresistance.j bacteriol,1998,180:3381-7.)。因为甘露糖蛋白分布在细胞壁的外侧,所以部分研究学者将外源蛋白与sed1p蛋白融合表达,使外源蛋白展示在细胞表面(kurodak,et al.enhancement of display efficiency in yeast display sys-temby vectorengineering and gene disruption.appl microbiol biotechnol,2009,82:713–9.)。sed1p蛋白可以维持细胞壁和线粒体基因组的稳定性,同时敲除sed1基因不但不会影响细胞的正常生长,反而还会提高酵母细胞对乳酸的耐受性(phadnis net al.role of theputative structural protein sed1p in mitochondrial genome maintenance.jmoliol,2004,342(4):1115-29;toshihiro s,et al.disruption of multiple geneswhose deletion causes lactic-acid resistance improves lactic-acid resistanceand productivity in saccharomyces cerevisiae.j biosci bioeng,2013,115(5):467-474)。
5、因此,得到一株能够高产t4n5并快速释放胞内蛋白的菌株对工业生产具有重要的意义。
技术实现思路
1、为了克服现有技术的缺点与不足,本发明的目的在于提供一种高产t4n5的酿酒酵母工程菌。
2、本发明的另一目的在于提供一株高产t4n5的酿酒酵母工程菌的构建方法。
3、本发明的再一目的在于提供上述高产t4n5的酿酒酵母工程菌的应用。
4、本发明以酿酒酵母作为底盘细胞,对其进行位点挖掘。通过在位点xiv-68上整合不同报告基因(gus或ypet)并进行表征,确定了xiv-68位点为酿酒酵母中的高表达位点。将t4核酸内切酶v(t4n5)表达盒敲入至xiv-68位点后,实现了重组t4n5的高效表达;进一步敲除酿酒酵母基因组中的sed1基因,得到的突变菌株可以高效裂解细胞壁,释放细胞内物质至胞外,以亲和层析法、脱盐完成了重组t4n5的有效纯化,本发明中生产的t4n5对由紫外照射而形成dna损伤(即嘧啶二聚体的dna)有着良好的修复作用。
5、本发明的目的通过下述技术方案实现:
6、酿酒酵母染色体xiv-68位点在以酿酒酵母为底盘细胞高表达外源代谢产物中的应用。
7、优选的,酿酒酵母染色体xiv-68位点的核苷酸序列包括xiv-68位点的grna靶序列及上下游各500bp以内的序列;
8、进一步优选的,酿酒酵母染色体xiv-68位点的核苷酸序列包括xiv-68位点的grna靶序列及上下游各100bp以内的序列。
9、其中,xiv-68位点的grna靶序列为5′-aaagaatcatagatcgtcaa-3′。
10、通过在酿酒酵母染色体xiv-68位点中整合β-葡萄糖苷酸酶基因(gus)、ypet荧光报告基因或t4n5基因,验证了xiv-68位点具有较高的表达强度,说明xiv-68位点是酿酒酵母的高表达位点。
11、一种高产t4n5的酿酒酵母工程菌,以酿酒酵母为出发菌株,将t4n5基因整合至酿酒酵母染色体xiv-68位点中,获得整合了t4n5基因的高产t4n5的酿酒酵母工程菌。
12、为了进一步提高t4n5的收获效率,需要提高酿酒酵母的裂解效率,在上述酿酒酵母工程菌的基础上,对sed1基因进行敲除。
13、进一步的,还包括:且敲除酿酒酵母基因组中sed1基因,获得整合了t4n5基因并敲除sed1基因的高产t4n5的酿酒酵母工程菌。
14、其中,t4n5基因编码的氨基酸序列如np_049733.1所示。
15、优选的,所述t4n5基因的核苷酸序列如seq id no.1第37~450bp所示。
16、进一步的,为了纯化方便,在t4n5基因的5′端加上组氨酸标签和/或蛋白酶酶切位点对应编码核酸序列;
17、优选的,所述组氨酸标签为由4-10个组氨酸串联成的组氨酸标签;进一步优选为6个组氨酸串联成的组氨酸标签(6×his标签),其核苷酸序列如seq id no.1第4~21bp所示。
18、优选的,所述蛋白酶酶切位点为肠激酶酶切位点ddddk,其核苷酸序列如seq idno.1第22~36bp所示。
19、进一步优选的,5′端依次加上组氨酸标签和蛋白酶酶切位点对应编码核酸序列的t4n5基因的核苷酸序列如seq id no.1所示。
20、进一步的,将t4n5基因的表达盒整合至酿酒酵母染色体xiv-68位点中。
21、优选的,所述t4n5基因的表达盒包括启动子、t4n5基因、终止子;具体选自组成型的强启动子(pccw12、ptdh3、ppdc1和ptef1中的至少一种)与终止子(trpl3、tpgk1、tbna4和tfba1中的至少一种)来与目的基因组合表达。
22、进一步优选的,所述t4n5基因的表达盒为ptdh3-524-t4n5-tfba1,其核苷酸序列如seqid no.2第41~1428bp所示。
23、一种高产t4n5的酿酒酵母工程菌的构建方法,包括如下步骤:
24、1)根据酿酒酵母染色体xiv-68位点,设计grna靶序列;
25、2)根据步骤1)的grna靶序列构建重组载体;
26、3)制备包含t4n5基因的供体dna;
27、4)将步骤2)的重组载体和步骤3)的包含t4n5基因的供体dna同时转化到已转入cas9基因的酿酒酵母中,实现t4n5基因的整合,获得整合了t4n5基因的高产t4n5的酿酒酵母工程菌。
28、为了进一步提高t4n5的收获效率,需要提高酿酒酵母的裂解效率,在上述酿酒酵母工程菌的基础上,对sed1基因进行敲除。
29、进一步的,还包括:
30、5)再敲除步骤4)的酿酒酵母工程菌基因组中sed1基因,实现t4n5基因的整合及sed1基因的敲除,获得整合了t4n5基因并敲除sed1基因的高产t4n5的酿酒酵母工程菌。
31、优选的,步骤1)中的grna靶序列为5′-aaagaatcatagatcgtcaa-3′。
32、优选的,步骤2)中的重组载体包括gxiv-68表达框,所述gxiv-68表达框的核苷酸序列,可为gxiv-68表达框的任意序列,进一步优选如seq id no.3所示。
33、用于构建所述重组载体的出发载体可为任意一种酿酒酵母载体,优选p426(addgene公司的商业化质粒p426-snr52p-grna.can1.y-sup4t)出发载体,构建的重组载体为p426-gxiv-68。
34、优选的,步骤3)中的包含t4n5基因的供体dna包括grna靶序列的上游40-100bp(优选40bp)同源序列、t4n5基因或t4n5基因的表达盒、grna靶序列的下游40-100bp(优选40bp)同源序列;进一步优选如seq id no.2所示。
35、优选的,步骤4)中的已转入cas9基因的酿酒酵母是通过转入带有cas9基因的质粒得到;具体是通过转入p414质粒(addgene公司的商业化质粒p414-tef1p-cas9-cyc1t)得到。
36、优选的,步骤4)中的酿酒酵母为酿酒酵母bj5464,酿酒酵母by4741或酿酒酵母cen.pk2-1ca,但并不限于此。
37、优选的,步骤4)中的酿酒酵母工程菌为酿酒酵母bj5464/xiv-68::ptdh3-524-t4n5-tfba1、酿酒酵母by4741/xiv-68::ptdh3-524-t4n5-tfba1或酿酒酵母cen.pk2-1ca/xiv-68::ptdh3-524-t4n5-tfba1。
38、优选的,步骤5)中,敲除步骤4)的酿酒酵母工程菌基因组中sed1基因,包括如下步骤:
39、a)根据基因组中sed1基因,设计grna靶序列;
40、b)根据步骤a)的grna靶序列构建重组载体;
41、c)将步骤b)的重组载体和供体dna同时转化到已转入cas9基因的步骤4)的酿酒酵母工程菌中,实现t4n5基因的整合及sed1基因的敲除。
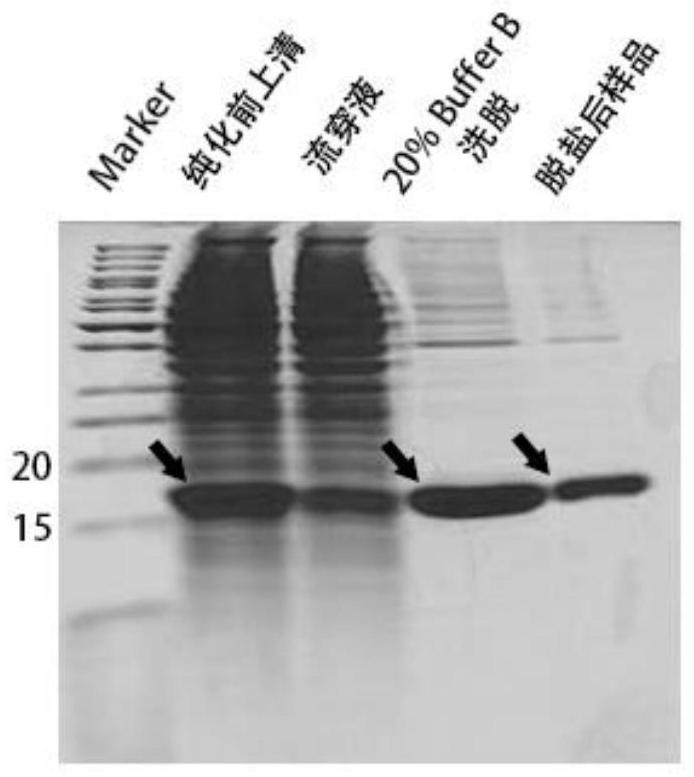
42、优选的,步骤a)中的grna靶序列为5′-agaggaggaagtgacatcgg-3′。
43、优选的,步骤b)中的重组载体包括gsed1表达框,所述gsed1表达框的核苷酸序列,可为gxiv-68表达框的任意序列,进一步优选如seq id no.4所示。
44、优选的,步骤c)中的供体dna核苷酸序列,可为供体dna的任意序列,进一步优选如seq id no.5所示。
45、用于构建所述重组载体的出发载体可为任意一种酿酒酵母载体,优选p426(addgene公司的商业化质粒p426-snr52p-grna.can1.y-sup4t)出发载体,构建的重组载体为p426-gsed1。
46、优选的,步骤c)中的已转入cas9基因的步骤4)的酿酒酵母工程菌是通过转入带有cas9基因的质粒得到;具体是通过转入p414质粒(addgene公司的商业化质粒p414-tef1p-cas9-cyc1t)得到。
47、优选的,步骤5)中的酿酒酵母工程菌为酿酒酵母bj5464/xiv-68::ptdh3-524-t4n5-tfba1/δsed1、酿酒酵母by4741/xiv-68::ptdh3-524-t4n5-tfba1/δsed1或酿酒酵母cen.pk2-1ca/xiv-68::ptdh3-524-t4n5-tfba1/δsed1。
48、上述酿酒酵母工程菌在高产t4n5中的应用。
49、进一步,一种生产t4n5的方法,将所述的酿酒酵母工程菌活化;将活化后的菌株接种于发酵培养基发酵培养,发酵培养后收集菌体细胞提取t4n5。
50、优选的,所述生产t4n5的方法为将所述的酿酒酵母工程菌接入种子培养基在30±2℃、220±20rpm活化12±2h,转接至新鲜的种子培养基,在30±2℃、220±20rpm发酵30±2h,收集菌体后经破碎裂解、ni亲和层析、脱盐等步骤,获得较高纯度的重组t4n5蛋白;其中,所述种子培养基为ypd。
51、本发明相对于现有技术具有如下的优点及效果:
52、本发明在酿酒酵母菌株中以葡萄糖为碳源实现t4n5的生物合成,在重组酿酒酵母菌株中,将优化后的t4n5基因表达盒整合至基因组xiv-68位点,实现生产t4n5的目的。进一步敲除酿酒酵母基因组中的sed1基因,得到的突变菌株可以高效裂解细胞壁,释放细胞内物质至胞外。利用本发明所述重组酿酒酵母菌株生产t4n5能够有效解决药源问题,具有节省物质资源,保护环境的优点。
- 还没有人留言评论。精彩留言会获得点赞!