造血干细胞体外扩增培养体系及其制备方法与流程
本发明涉及生物,具体涉及一种造血干细胞体外扩增培养体系及其制备方法。
背景技术:
1、造血干细胞(hemopoietic stem cell hsc)是存在于造血组织和血液中的一类成体干细胞,能够通过不断自我更新长期存在,并可多向分化发育为血液系统中各种细胞类型。在胚胎和迅速再生的骨髓中,造血干细胞多处于增殖周期之中;而在正常骨髓中,则多数处于静止期(g0期),当机体需要时,其中一部分分化成熟,另一部分进行分化增殖,以维持造血干细胞的数量相对稳定。
2、目前在临床应用上,对于化疗效果不佳及复发白血病或其他难治性血液病,造血干细胞移植仍是最为有效的治疗手段。但由于配型困难极大,大部分的病人无法获得人类白细胞抗原(humanleukocyte antigen,hla)全相合的供体,难以进行移植。临床上为了安全地在短期内重建一个遍布全身并具有一定功能的血液和免疫系统,则需要获得相当数量的造血干细胞才能进行成功的移植。目前临床获得造血干细胞的途径有4种,分别是骨髓来源、外周血来源、脐带血来源、胎盘来源。脐带血中具有重建能力的造血干细胞数量极低,单份脐带血来源的造血干细胞数量不足以支持成年人和体重较大儿童的治疗;人外周血中的造血干细胞数量同样极低,需要采用粒细胞集落刺激因子(gm-csf)刺激骨髓释放造血干细胞到外周血中,可使外周血造血干细胞增加20~30倍,但临床中常出现刺激效果不佳的情况,释放的造血干细胞数量无法达到治疗要求;直接从骨髓中采集造血干细胞,同样会出现采集数量有限的困难,同时也会有手术难度大、创伤面大等问题;胎盘组织中造血干细胞的含量是脐带血中造血干细胞含量的8~10倍,能提供给1~2个成人患者的治疗,但是目前胎盘干细胞不能用于临床,仅处于科研试验阶段,干细胞提纯技术尚存在争议。因此,体外能够扩增足够数量的造血干细胞是治疗临床血液相关疾病的重要手段。传统的造血干细胞体外扩增培养体系包括以下两种:①imdm培养体系中包含10%马血清、10%人ab血清、10%胎牛血清、2mmol/l谷氨酰氨,1×10-4mol/ml 2-巯基乙醇,其中细胞因子为:scf50ng/ml,il-35ng/ml,il-650ng/ml,g-csf 50ng/ml,gm-csf 50ng/ml。②细胞体外扩增dmem培养体系含20%的胎牛血清,浓度为0.25μg/l干细胞因子,0.25μg/l白细胞介素-3,0.5μg/l白细胞介素-6,0.25μg/l粒-巨噬细胞集落刺激因子,0.8μg/l粒细胞集落刺激因子,0.05μg/l血小板生成素,0.8μg/l flt-3配基。另外,由于造血干细胞数量非常有限,然而上述传统体外培养方法又会损失其分化潜能,导致其体外相关研究也存在非常大的局限性。如果能够建立体外培养、扩增造血干细胞的培养系统,适度扩增造血干细胞数量同时又保存其分化潜能,势必会大大缓解hla全相合的供体缺乏且可以迅速推动造血干细胞领域研究。
3、由于传统方法体外培养hscs需要添加多种细胞因子和胎牛血清等。在体外培养过程中造血干细胞扩增倍数有限,并会损失掉大部分分化潜能,细胞存在分化谱系偏移,分化能力减弱,无法有效进行体内移植后的重建。因此,找到一种可以体外扩增、培养干细胞的体系,同时又可以维持其分化潜能,将有望真正改善造血干细胞的临床应用和基础研究。
技术实现思路
1、本发明的目的在于提供一种造血干细胞体外扩增培养体系及其制备方法,以解决上述背景技术中提出的问题。
2、本发明的目的是通过以下技术方案来实现的:
3、本发明提供一种造血干细胞体外扩增培养体系,所述培养体系包括无血清培养基、细胞因子组合、嘧啶吲哚类小分子化合物。
4、所述无血清培养基为therapeaktmx-vivotm15培养基。
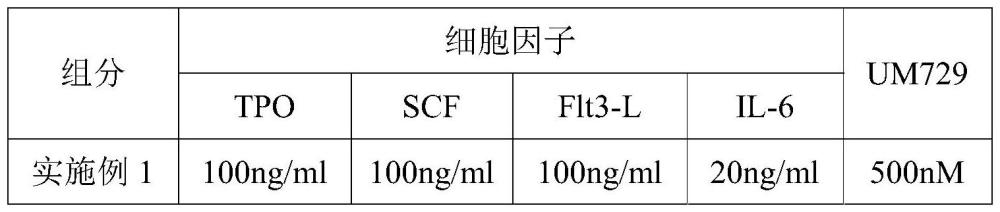
5、所述细胞因子组合包括:重组人促血小板生成素tpo、重组人干细胞生长因子scf、重组人flt3配体flt3-l、重组人白细胞介素6il-6。
6、在所述培养体系中,重组人促血小板生成素tpo的含量为50-200ng/ml;重组人干细胞生长因子scf的含量为50~200ng/ml;重组人flt3配体flt3-l的含量为50~200ng/ml;重组人白细胞介素-6的含量为5-100ng/ml。
7、所述嘧啶吲哚类小分子化合物包括um729。
8、在所述培养体系中,所述um729的含量为100-1000nm。
9、造血干细胞体外扩增培养体系的制备方法,包括如下步骤:在无血清培养基的基础上添加细胞因子组合和嘧啶吲哚类小分子化合物,制得所述造血干细胞体外扩增培养体系。
10、进一步,先将无血清培养基和um729混合,混匀后再和细胞因子组合混合。
11、所述无血清培养基为therapeaktmx-vivotm15培养基。
12、所述细胞因子组合包括:重组人促血小板生成素tpo、重组人干细胞生长因子scf、重组人flt3配体flt3-l、重组人白细胞介素6il-6;所述重组人促血小板生成素tpo的含量为50-200ng/ml;重组人干细胞生长因子scf的含量为50~200ng/ml;重组人flt3配体flt3-l的含量为50~200ng/ml;重组人白细胞介素-6的含量为5-100ng/ml;所述嘧啶吲哚类小分子化合物包括um729;所述um729的含量为100-1000nm。
13、tpo是一种促进血小板生成的细胞因子,对巨核细胞的生长及分化具有很好的刺激作用;
14、scf能够促进早期造血前体细胞的增殖与分化,与tpo配合使用,可以显著扩增造血干细胞;
15、flt3-l由骨髓基质干细胞及其他细胞分泌,并可协同其他生长因子,促进干细胞的增殖;
16、il-6能够调节多种细胞的生长与分化,具有调节免疫应答、急性期反应及造血功能;
17、um729是一种嘧啶诱导蛋白球蛋白衍生物,可以增强体外人造血干细胞的自我更新。
18、um729并不抑制芳基烃受体(ahr)途径,但已被证明可以与ahr拮抗剂合作,防止培养中急性髓系白血病(aml)细胞的分化。维护干细胞再生,增强体外人造血干细胞的自我更新。
19、与现有技术相比,本发明具有如下的有益效果:
20、1、本发明的目的在于弥补现有造血干细胞培养基的缺陷,通过在基础培养基中添加多种细胞因子替代血清功能,培养基化学成分明确含重组人胰岛素、人转铁蛋白和白蛋白、l-谷氨酰胺,不需要额外添加血清,配方简单,性能优异,可以显著提高造血干细胞的扩增能力,造血干细胞培养至65小时可扩增2倍以上,收获时细胞活率可达97%以上,显著保存了长期造血干细胞的阳性比例。
21、2、本发明调整不同细胞因子组合来培养造血干细胞,通过培养后的细胞计数结果以及细胞流式结果来获得最佳细胞体外扩增培养体系。
22、3、本发明的造血干细胞培养基不含动物来源和人来源的蛋白成分,排除了动物来源和人源提取物可能存在的诸如疯牛病、艾滋病、乙肝等传染性疾病的致病风险。使用gmp级别重组细胞因子,成分明确,低风险,对人体安全,通过本发明培养基获得的造血干细胞适合于进一步的科学研究及临床应用研究。
23、4、本发明的造血干细胞培养基性能优异,终末细胞活率可达97%以上,cd34+细胞阳性比例90%以上,可在体外较好的维持长期造血干细胞的稳态与干性,培养后cd34+cd90+、cd34+cd49f+、cd34+cd49f+cd90+各表型组分干细胞比例均在25%以上。
24、5、本发明在进一步研究中发现,先将x-vivo无血清培养基和um729混合,混匀后再和细胞因子组合混合时,x-vivo无血清培养基和小分子化合物um729有更长的混匀时间,且细胞因子后期加入可减少细胞因子混匀时间,有利于细胞因子活性维持;反之先将x-vivo无血清培养基和细胞因子混合,再与um729混合会导致造血干细胞干性维持受一定影响,因为相同混匀时间下,细胞因子混匀时间较长,活性浓度占比降低;如果先将um729和细胞因子混合,再加入到x-vivo无血清培养基中,增加了细胞因子的混匀时间;因为小体积内混匀细胞因子,细胞因子受到的剪切力更大,从而影响其活性浓度。
- 还没有人留言评论。精彩留言会获得点赞!