一种氮硫共掺杂碳纳米粒子及在2,4,6-三硝基苯酚检测中的应用的制作方法
本发明涉及2,4,6-三硝基苯酚检测领域,具体涉及一种氮硫共掺杂碳纳米粒子及在2,4,6-三硝基苯酚检测中的应用。
背景技术:
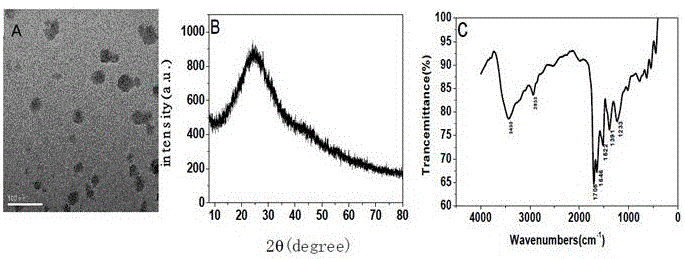
:在国土安全、军事应用和矿场开采上,化学炸药的检测已经成为当下面临的紧迫问题。近几年来的分析表现出有许多方法可以用于探测爆炸物,如红外和拉曼光谱,质谱,固相微萃取,X射线成像技术,表面增强拉曼光谱,离子迁移谱和脉冲快/热中子分析等。与上述方法相对比,荧光检测法由于仪器操作简单、检测变得非常流行,成本低,快速和高灵敏度。到目前为止,荧光法已被证实对硝基芳烃化合物的灵敏度非常高。由于对硝基芳烃的缺电子性,富电子荧光物质可以形成非荧光π堆积配合物或与硝基芳烃形成络合物。目前,许多研究都集中在2,4,6-三硝基苯酚(TNP)的选择性检测。TNP是一种重要的芳香化合物,常用于工业、民用、军用炸药,它的爆炸性比其它炸药更具有爆炸性,其当量相当于TNT的105%。此外,TNP由于毒性和生物降解性差,已成为一种重要的环境污染物,与人类的健康问题息息相关,当人们吸入、摄入或接触它时,会产生如皮肤刺激,贫血、肝功能异常和损害呼吸器官等健康问题。由于上述危害,TNP的检测显得十分重要,根据文献,TNP能淬灭许多荧光分子的发射,例如有机分子,共轭聚合物,金属络合物和金属有机框架等,但是荧光分子往往能同时猝灭多种硝基芳烃,特别是三硝基甲苯(TNT)和TNP同时出现时,因为它们都具备极强的亲电子性,所以在应对TNT和TNP同时出现时的选择性,单独检测出TNP仍然是一个挑战。技术实现要素:为解决上述问题,本发明提供了一种氮硫共掺杂碳纳米粒子及在2,4,6-三硝基苯酚检测中的应用。为实现上述目的,本发明采取的技术方案为:一种氮硫共掺杂碳纳米粒子,通过以下方法制备所得:以油酸为反应媒介,L-半胱氨酸和一水合柠檬酸为原料,通过溶剂热方法一步合成,具体包括如下步骤:将L-胱氨酸和一水合柠檬酸按质量比1:1于150mL三颈烧瓶内混合,加入40mL油酸,于220℃下以1200r/min磁力搅拌反应30min,冷却后,以正己烷充分洗涤析出的产物,用超纯水溶解配制并以8000rpm/min高速离心10min,将上清液真空干燥,即得。经申请人研究发现,TNP可以显著地猝灭所述氮硫共掺杂碳纳米粒子(NS-CNPs)的荧光且具有优异的灵敏度和高效的选择性,因此,上述的氮硫共掺杂碳纳米粒子可用于水样中TNP的检测,该检出限在水相下可以达到47.0nm。本发明以油酸为反应媒介,L-半胱氨酸和一水合柠檬酸为原料,通过溶剂热方法合成了一种可用于2,4,6-三硝基苯酚检测的氮硫共掺杂碳纳米粒子,其具有优异的灵敏度和高效的选择性,为2,4,6-三硝基苯酚的检测提供了一种便捷、快速的检测途径。附图说明图1为本发明实施例中NS-CNPs的TEM图(A)、XRD图(B)和IR光谱图(C)。图2为本发明实施例中NS-CNPs的X射线光电子能谱表征:图中:(A)全谱;(B)碳谱;(C)硫谱;(D)氮谱。图3为本发明实施例中NS-CNPs的光谱图;图中:(A)NS-CNPs的紫外-可见吸收光谱图和荧光光谱图(插图为溶液在日光灯(左)和365nm紫外灯(右)下的照射图);(B)激发波长依赖性荧光光谱图图4为pH、时间对NS-CNPs的影响示意图;图中:(A)pH对NS-CNPs的影响;(B)时间对NS-CNPs的影响。图5为不同因素对NS-CNPs体系和NS-CNPs-TNP体系的干扰示意图;图中:(A)常见离子对NS-CNPs体系的干扰;(B)常见离子对NS-CNPs-TNP体系的干扰;(C)不同的芳族化合物对NS-CNPs和NS-CNPs-TNP体系的干扰。图6为TNP浓度对NS-CNPs荧光强度的影响图。图7为TNP浓度对NS-CNPs荧光荧光猝灭率关系图。具体实施方式下面结合具体实施例对本发明进行详细说明。以下实施例将有助于本领域的技术人员进一步理解本发明,但不以任何形式限制本发明。应当指出的是,对本领域的普通技术人员来说,在不脱离本发明构思的前提下,还可以做出若干变形和改进。这些都属于本发明的保护范围。实施例试剂L-胱氨酸(AR,天津阿法埃莎化学有限公司);抗坏血酸(AA)(AR,均购自西陇化工股份有限公司);油酸、正己烷(AR,均购自西陇化工汕头市达濠精细化学品公司);硫酸奎宁、实验用超纯水(18.2МΩcm)以及本实施例中用到的其他试剂均为分析纯试剂,纯度均大于99%NS-CNPs的制备本实施例采用溶剂热法一步合成制备NS-CNPs。将L-胱氨酸和一水合柠檬酸按质量比1:1于150mL三颈烧瓶内混合,加入40mL油酸,于220℃下以1200r/min磁力搅拌反应30min。冷却后,以正己烷充分洗涤析出的产物,用超纯水溶解配制并以8000rpm/min高速离心10min,将上清液真空干燥,备用。NS-CNPs的结构特征透射电镜(TEM,图1A)分析表明,合成的氮硫共掺杂碳纳米粒子分散度较高,粒径大部分为20-30nm,高分辨透射电镜(HRTEM)分析表明没有明显的晶格。X射线衍射(XRD)谱图(图1B)显示在25°处有一个宽峰,进一步说明合成的产物为无定型形态。红外光谱图(FT-IR,图1C)证实了这些基团的存在。3430和2850cm-1处的宽峰可归属于-OH和-NH的伸缩振动;1705cm-1和1646cm-1处的高强度峰可归属于C=O的伸缩振动;1391cm-1和1233cm-1处的吸收峰可归属于C-N和C-O的伸缩振动;1522cm-1尖峰为硫酯基团C-S的振动峰。由于硫酯基团的存在导致一些振动峰都发生了偏移。综上结果可知,L-半胱氨酸和一水合柠檬酸在油酸介质中发生了类似脱水聚合的反应,之后发生大量的碳化,但是产物表面保留了较多的极性基团如羟基、氨基等基团,并赋予合成产物较好的水溶性。温度越高碳化也越严重,水溶性也就越差,如果只用L-半胱氨酸为前驱体反应不会获得可以产生荧光产物,同样只用一水柠檬为反应也未获得荧光产物,所以产生荧光的物质为L-半胱氨酸和一水合柠檬酸共同反应的产物。为了更加全面的分析合成的产物的化学组成,对其采用X射线光电子能谱(XPS)进行了表征。如图2(A)所示,在XPS全谱中出现了4个主峰,分别对应于S2p(170.9eV)C1s(296.9eV)、N1s(408.9eV)和O1s(540.9eV),表明产物中含有C、N、S和O元素。其中图2(B)C1s谱图2(B)可分解成284.47、285.32、285.97和286.66和288.03eV,分别对应于sp2C=C,C=O,和N-C=N或sp3C-C,C-N,C-O和C-S键;图2(C)S2p谱可分解成2个峰,分别对应C-S-C(163.53eV)和S-(C)3(164.42eV);图2(D)N1s谱分解说明三种化学键的存在:C-N-C(399.26eV)、N-(C)3(399.93eV)和N-H(400.53eV)。元素分析结果进一步验证了产物的化学组成,其中碳为38.97%,氮占15.59%,氢元素比例为6.7%,剩下氧元素占38.74%(按重量计)。结果表明产物中含有大量的氧元素及氮元素,而含氧、氮的官能团如羟基,氨基则赋予产物较好的水溶性。NS-CNPs的光学性质图3(A)中,345cm-1处的紫外吸收峰是由于表面电子跃迁而形成的,NS-CNPs的荧光光谱随激发波长的变化而变化,具有稳定的波长依赖性。最佳激发波长位于340nm处,此时其发射峰在425nm处且荧光强度最大,NS-CNPs的水溶液在日光下呈透明澄清,而在365nm紫外光照射下呈蓝色(图3A,插图)。由图3(B)表明,NS-CNPs具有激发波长依赖性。激发波长从280到350nm时,发射峰几乎没有发生位移,这表明碳纳米粒子的粒径较均匀,存在类似的能级。NS-CNPs对TNP的检测将NS-CNPs用超纯水配制成一定浓度的溶液。在10mL比色管中依次加入NS-CNPs溶液和不同浓度的2,4,6-三硝基苯酚水溶液,超纯水定容后,测定荧光光谱(激发波长为340nm,扫描范围为350-650nm)。根据国际纯粹和应用化学联合会(IUPAC)的规定:检出限以浓度(或质量)表示,是指由特定的分析步骤能够合理地检测出的最小分析信号L求得的最低浓度(或质量)。可用下式计算:L=KSb/S其中,建议K值的取值为3。L代表该分析方法的最低检出浓度或质量;Sb代表空白样品多次测量的标准偏差(吸光度);S代表该方法的灵敏度(即校准矫正曲线的斜率)。空白测定次数必须至少20次。NS-CNPs-TNP体系的反应条件优化为了考察pH对测定结果的影响,取NS-CNPs储备液100μl,然后加浓度为50μM的TNP,稀释溶液至刻度,调节体系pH测其荧光强度。从图4(A)可看出,体系在不同pH环境下对于体系有一定的影响,NS-CNPs在中性体系中较稳定。然后为了研究时间对于NS-CNPs-TNP体系是否有影响,取NS-CNPs储备液100μl,然后加浓度为50μM的TNP,稀释溶液至刻度,调节体系pH=7,测定不同时间点的荧光强度变化,如图4B所示,结果可以说明测定随着时间的推移,NS-CNPs-TNP体系仍保持一个较为稳定的状态,故实验所需溶液无需现配现用。不同物质对NS-CNPs-TNP体系荧光强度的干扰为了进一步研究TNP对NS-CNPs的选择性,分别在NS-CNPs溶液中加入100µM的不同无机离子及有机物并在激发波长340nm下扫描荧光光谱(其中F0为初始荧光强度,F是加入某物质后荧光强度测量值),依次研究TNP对NS-CNPs选择性。从图5(A)和(C)可以看出,TNP对NS-CNPs的荧光猝灭明显,猝灭率为95.53%并且选择性良好,其中邻硝基甲苯(DNT)与间邻硝基甲苯(2,4-DNT)对NS-CNPs的荧光强度有一定作用。而其它常见离子对NS-CNPs的荧光强度影响较小,说明TNP对NS-CNPs的选择性比较好。并且做了TNP对NS-CNPs荧光猝灭的干扰实验。如图5(B)及表1所示,15种常见共存离子及一些有机物对TNP猝灭NS-CNPs荧光均未产生较大的影响。结果表明,天然水体中常见的一些共存离子对NS-CNPs和TNP相互作用的影响均比较小,说明本方法对于测定水中的TNP含量有着选择性良好,受干扰影响较小的特点,可以有效的测定出TNP的实际含量。表1干扰物质的影响干扰离子干扰浓度误差(%)干扰离子干扰浓度误差(%)Cl-1mM-0.20Na+500μM-0.20ClO3-1mM1.52Mg2+500μM1.27NO3-1mM-0.04Ca2+500μM0.02H2PO4-1mM-0.08Cu2+100μM0.69CO32-1mM0.62F-1mM2.28HPO42-1mM-0.41DHE100μM1.34SO42-1mM-0.43PNT100μM-0.88NH4+500μM-0.43TNT100μM-3.13Br-1mM2.65DNT100μM2.21Ba2+500μM1.282,4-DNT100μM1.85AC-500μM0.40MB100μM1.11TNP对NS-CNPs的荧光猝灭图6表明,NS-CNPs的荧光强度随TNP浓度的增大而逐渐减弱,TNP浓度大于50μM时,NS-CNPs的荧光水平达到完全猝灭。图7表明,NS-CNPs的荧光强度的猝灭程度与TNP的浓度呈现良好的线性关系,线性范围为0-40μM,R2=0.99301,并根据公示计算出此方法的检测限为0.043μM,检出限低于此前报道的相关文献(表2)。表2不同探针测定TNP的检出限的比较实际水样中TNP的检测表3实际水样中TNP的加标回收率(n=3)为了进一步确定NS-CNPs检测TNP的可行性,采用标准加入法测定3种不同水样中的TNP浓度。实验前水样通过简单的过滤预处理,加标回收率均为3次测定的平均值。由表3中的分析结果可得,往水样中分别加入0.5、2.5和1.0μMTNP后,加标回收率范围分别为102~106%、92.8~104%及92.9~99.8%,相对标准偏差范围为1.8%~3.8%、2.8%~4.3%及5.2%~6.3%,相对标准偏差均小于6.3%。由此可见该法加标回收率较好,精确度较好,对于定量检测水体样品中的TNP含量具有一定的应用前景。以上对本发明的具体实施例进行了描述。需要理解的是,本发明并不局限于上述特定实施方式,本领域技术人员可以在权利要求的范围内做出各种变化或修改,这并不影响本发明的实质内容。在不冲突的情况下,本申请的实施例和实施例中的特征可以任意相互组合。当前第1页1 2 3
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1