碳量子点及其用途的制作方法
碳量子点及其用途
发明领域
1.本发明的领域是与肿瘤成像和向肿瘤递送治疗剂相关的化合物、组合物和方法,以及制备新化合物的方法。该方法和组合物涉及常用作碳量子点(cqds)的多环芳香族结构。发明背景
2.癌症是最具毁灭性的疾病之一,每年新增病例超过1400万。癌症的发病率预计将继续上升,到2030年估计每年将有2170万新病例。在目前的临床实践中,癌症患者通常通过手术切除(如果适用)与化学药物治疗和放射治疗相结合的方法治疗。随着过去几十年外科和医学的巨大进步,这种联合治疗的方法显著增加了患者的生存时间和生活质量。然而,由于无法对肿瘤进行选择性成像和治疗,这些方法的进一步改进受到阻碍。这一挑战限制了我们在不引起明显副作用的情况下实现最大手术切除或递送化疗剂和放疗的能力。
1-7
3.为了增强肿瘤特异性成像和药物递送,最近的努力集中在设计一类通过识别在癌细胞或肿瘤微环境中表达的“受体”分子的配体的成像或治疗剂。越来越多的证据表明,这种方法有几个主要的局限性。首先,仅在癌细胞表面表达的受体分子很少见,且大多数也存在于正常组织中。因此,无法避免负载物在正常组织中的积累。其次,癌症是一类高度异质性的疾病,不同组织来源的癌症或肿瘤内的不同位置通常具有不同的基因型和表型。因此,仅使用单一配体不能成功的靶向肿瘤。由于这些限制,目前尚未获得一种策略可以不管肿瘤的来源和位置而能对其进行选择性成像和药物递送。
4.肿瘤特异性成像和药物递送的一种有前景的方法是利用癌细胞中差异上调的特异性载体转运蛋白。这种转运蛋白的例子包括大型中性氨基酸转运蛋白1(lat1)、丙氨酸、丝氨酸、半胱氨酸优先转运蛋白2(asct2)和葡萄糖转运蛋白。
8-11
其中,介导大型中性氨基酸转运的lat1是十分有趣的。lat1已被证明在多种肿瘤中高度表达;而与此形成鲜明对比的是,根据mrna的表达结果,lat1在正常组织中的分布仅限于少数器官,包括胎盘、血脑屏障、脾脏、睾丸和结肠。
10
lat1抑制剂曾被用于靶向lat1来进行癌症的化疗,例如使用2-氨基双环-(2,2,1)-庚烷-2-羧酸(bch)。
12
不幸的是,由于缺乏效力和特异性,bch介导的化疗在很大程度上失败了。bch可抑制所有的四种具有不同的生理功能的lat,包括lat1、lat2、lat3和lat4。在治疗时使用所需的高剂量bch通常会引发显著的毒性。
12
lat1也被用于增强化疗药物向肿瘤的靶向递送。结果表明,结合天冬氨酸后使lat1介导的递送成为可能,将阿霉素(dox)在肿瘤中的积累量提高了3-6倍。
13
5.cqds在近年来已成为用于各种生物医学应用的一类有前途的成像剂和药物载体,源于其优异的生物相容性、光学性质、药物负载能力和低毒性。然而,大多数先前报道的cqds对肿瘤细胞和非肿瘤细胞都会产生非选择性地相互作用,并且没有达到使它们可用于选择性靶向肿瘤细胞的肿瘤特异性水平。
14,15
发明总结
6.本发明提供了结构类似大氨基酸的化合物和包含这些化合物的结构类似大氨基
酸的碳量子点(laam cqds),它们可用于对表达latl的组织的选择性成像、药物递送和/或可检测的标记。由于许多癌细胞表达lat1的水平远高于大多数人体组织,因此这些化合物和cqds可用于肿瘤成像和向肿瘤细胞的药物递送,而无论肿瘤的来源和位置如何,却很少或几乎不递送至正常组织中的细胞。
7.本发明的laam化合物是具有被α-氨基羧酸取代的大芳香族或部分芳香族核的多环化合物。该化合物的核是由8个或更多的6元环组成的多环阵列,每个环都是芳香族或部分芳香族或部分不饱和的。多环核被一个或多个,通常两个或多个,并且在许多实施例中三个或四个或更多个数的烷基取代,每个烷基被一个羧酸和与羧酸在相同的碳上的一个氨基取代,即α-氨基羧酸部分。氨基可以是-nh2或其取代形式。烷基也可具有一个或多个额外的取代基。
8.本发明的laam化合物能够组装成用作碳量子点(laam cqds)的聚集体。laam cqds有一个α-氨基羧酸部分,该部分会触发多价相互作用,从而与lat1紧密结合。不受理论的束缚,这些化合物和laam cqds对lat1表现出的高选择性亲和力解释了它们选择性靶向肿瘤细胞以进行肿瘤成像和将负载物(例如治疗剂和细胞毒性剂)递送至肿瘤细胞的能力。本发明提供的一些cqds,包括本发明所述的laam tc-cqds,表现出近红外(nir)荧光(fl)和光声(pa)成像的能力,这使得它们可以对肿瘤进行成像。因为它们被选择性地内化到癌细胞或组织中,例如通过与lat1相关的内吞作用或由lat1转运进入表达lat1的细胞中,所以本发明的化合物和cqds还可以用作将化疗药物递送至肿瘤的载体。本发明公开的laam cqds,包括使用1,4,5,8-四氨基蒽醌(taaq)和柠檬酸(ca)合成的laam cqds,提供了用于选择性肿瘤和某些其他特定类型细胞的成像,以及用于选择性向这些细胞和肿瘤递送治疗剂或标记剂的新组成和新方法。
9.在一方面,本发明提供了具有有用的荧光特性、且可溶于水和具有生物相容性的碳量子点。本发明的碳量子点可形成尺寸为约0.2-10nm的有机(碳基)颗粒,且它们碳含量通常至少约为重量的20%或40%,优选地至少约为重量的50%。它们的荧光特性、水溶性和生物相容性使它们在体内是有益处的,并且本发明中选择性结合lat1的laam cqds在本发明描述的用于对肿瘤成像的方法中特别有用。
10.在另一方面,本发明提供了通过本发明所述的方法形成的溶剂分解产物,其可被有效地内化到细胞中,例如通过内吞作用或由latl转运,并且被肿瘤细胞选择性摄取,尤其是在表达latl的肿瘤中。这些溶剂分解产物包含多环芳香族或部分芳香族核环体系,并且可以被分离并用作大小约为0.2-10nm可充当碳量子点的颗粒。使用溶剂分解制备碳量子点是本领域已知的。通过本发明方法制备的这些化合物和颗粒可用于肿瘤成像或作为一类可递送如标记剂或治疗剂等负载物至表达lat1的肿瘤细胞的表面,或递送至此类细胞内部的载体。在一些实施例中,溶剂分解产物形成包含一种或多种本发明公开的laam化合物的颗粒,其充当为碳量子点,因此可用于表达lat1转运蛋白的肿瘤成像或肿瘤靶向。
11.在另一方面,本发明提供制备上述化合物和laam cqds的方法。
12.在另一方面,本发明提供了使用化合物和含有它们的cqds对表达lat1的组织进行成像,尤其是对体内表达lat1的肿瘤进行成像的方法。
13.在另一方面,本发明提供包含上述化合物和cqds的共轭物,以及使用这些共轭物将成像剂、治疗剂和细胞毒性剂选择性递送至包括肿瘤细胞在内的表达lat1的细胞的方
法。
14.在另一方面,本发明提供了一种药物组合物,其包含上述化合物并掺有至少一种药物学上可接受的载体或辅料。
15.在又一方面,本发明提供了一种使用本发明的laam化合物和laam cqds对表达lat1的肿瘤或组织成像的方法。
16.在又一方面,本发明提供了一种将本发明的laam化合物和laam cqds用于制造药品的用途。
17.在又一方面,本发明提供了包含本发明的laam化合物或laam cqds的共轭物,所述laam化合物或laam cqds以共价或非共价方式连接负载物并将其递送到或递送进表达lat1的细胞。由于lat1在许多肿瘤中表达,这些共轭物可用于选择性地将标记剂或化疗剂递送至肿瘤细胞,而很少或几乎不递送至正常细胞。
18.在又一方面,本发明提供了使用本发明的共轭物对表达lat1的肿瘤进行成像和/或治疗的方法。
19.鉴于以下实施例和进一步描述,本发明的产品、组合物和方法的其他方面和优点对于技术人员来说将是显而易见的。附图简要说明
20.图1a是laam tc-cqds合成的示意图和假设步骤(虚线)。
21.图1b显示了laam tc-cqds的tem和hrtem图像(插图)。
22.图1c显示了laam tc-cqds的紫外-可见吸收光谱图和在日光下的外观照片(插图)。
23.图1d显示了laam tc-cqds在365nm紫外光下的荧光发射光谱图和外观照片(插图)。
24.图1e显示了laam tc-cqds在浓度为2μg/ml的光声(pa)信号强度和成像图(插图)。
25.图2a显示了代表性细胞,包括hela细胞和非癌性ccc-esf-1细胞与laam tc-cqds孵育后的激光共聚焦扫描显微镜(lcsm)成像图。比例尺为100μm。
26.图2b:通过流式细胞仪定量癌细胞和非癌细胞中的细胞摄取结果。
27.图2c提供了在指定时间点接受静脉注射laam tc-cqds后代表性荷瘤小鼠的近红外荧光(nir fl)成像图。
28.图2d显示了注射后8小时图2c的小鼠中laam tc-cqds分布的3d重建图。
29.图2e显示了注射laam tc-cqds后8小时图2c的小鼠中指定器官和肿瘤的离体nir fl成像图。
30.图2f提供了在指定时间点接受laam tc-cqds静脉注射的代表性荷瘤小鼠中指定肿瘤(圆圈)的横截面光声(pa)成像。
31.图3a提供了用leu、phe、gly或2-氨基双环-(2,2,1)-庚烷-2-羧酸(bch,一种已知的lat1抑制剂)预处理,随后与laam tc-cqds孵育的hela细胞lcsm成像图。比例尺为25μm。
32.图3b-d显示了crispr/cas9对lat1表达的下调减少了laam tc-cqds的细胞摄取(下图)。图3b中的箭头表示sgrna靶向序列。sanger测序(b,上图)和wb测试(c)证实了lat1的成功靶向。lat1下调细胞的lcsm成像图显示在图3d中。
33.图3e显示lat1表达与laam tc-cqds的细胞摄取的相关性。
34.图4a:hela和ccc-esf-1细胞与tptc、laam tc-cqds或tptc/laam tc-cqds孵育后的lcsm成像图。
35.图4b:hela和ccc-esf-1细胞用tptc、laam tc-cqds或tptc/laam tc-cqds处理后的细胞存活率。
36.图4c显示了当以游离药物形式或与tptc/laam tc-cqds一起递送时,tptc的血清浓度随时间的变化。数据表示为总注射剂量的百分比(%id)。
37.图4d显示了tptc和tptc/laam tc-cqds在指定器官中的生物分布。
38.图4e显示了接受指定治疗的荷瘤小鼠的代表性图像。
39.图4f:从在治疗后第15天接受指定治疗的小鼠中获得的肿瘤代表性图像。
40.图4g:接受指定治疗的小鼠中肿瘤体积随时间的变化(n=5)。
41.图5a:形成laam tc-cqds的选定化合物的分子结构,包括无nh2和无cooh的laam tc-cqds、2,6-cqds、1,4-cqds和1,5-cqds和phe-cqds。
42.图5b显示了图5a中所示laam tc-cqds的细胞摄取/渗透的成像图。
43.图5c:用指定的cqds处理后hela或ccc-esf-1细胞中fl强度的流式细胞仪定量结果。
44.图6:tc-cqds的尺寸分布。
45.图7:tc-cqds的拉曼光谱图。
46.图8a:tc-cqds在硅基底上的afm图像。
47.图8b:图8a中沿所示线的高度剖面。
48.图9:laam tc-cqds的xrd图谱。
49.图10:laam tc-cqds的xps全谱图。
50.图11:laam tc-cqds的c1s谱图。
51.图12:laam tc-cqds的n1s谱图。
52.图13:laam tc-cqds的ft-ir光谱图。
53.图14:laam tc-cqds的
13
c-nmr谱图。
54.图15:tc-cqds水溶液在激发波长从560-660nm的荧光发射光谱图。
55.图16:laam tc-cqds的一个fl单元的优化基态(a)和激发态(b)结构的主要几何参数从密度泛函理论计算(b3lyp/6-31g(d,p))获得的tc-cqds的优化电子离域分子轨道(mo)图(c,d)及其能带位置图(e)。
56.图17a:在650nm激光照射(0.5w/cm2)下,每30秒记录一次不同浓度(0-10μg/ml)的tc-cqds的光热曲线。插图是650nm激光照射(0.5w/cm2)5分钟后tc-cqds(0-10μg/ml)的ir热成像图。
57.图17b:laam tc-cqds(10μg/ml)在5个激光开/关循环(650nm激光照射,0.5w/cm2)下的温度变化。
58.图17c:tc-cqds水溶液在650nm激光(0.5w/cm2)照射下的光热效应。照射5分钟后关闭激光。
59.图17d:冷却时间与从冷却阶段(如图17c所示)获得的温度驱动力的负自然对数的关系图。系统传热的时间常数确定为τs=83.86s。
60.图18:laam tc-cqds在浓度范围为0-10μg/ml的光声(pa)信号强度。
61.图19:laam tc-cqds在浓度范围为2-10μg/ml的pa信号强度和成像图。
62.图20:从mda-mb-231细胞中分类的侧群细胞的表征。来自用同种型对照染色的细胞(a);来自用抗人cd44-fitc和cd24-pe抗体染色的细胞(b)。用流式细胞术分析cscs细胞。
63.图21:不同类型癌细胞与laam tc-cqds共孵育后的lcsm成像图。比例尺为100μm。
64.图22:不同类型正常细胞与laam tc-cqd共孵育的lcsm成像图。比例尺为100μm。
65.图23:通过流式细胞仪分析获得的20种癌细胞中laam tc-cqds的摄取结果。
66.图24:通过流式细胞仪分析获得的18种正常细胞中laam tc-cqds的摄取结果。
67.图25:用laam tc-cqds处理不同时间(1-10小时)的hela细胞的lcsm成像图。比例尺为25μm。
68.图26:用laam tc-cqds处理不同时间(1-48小时)的ccc-esf-1细胞的lcsm成像图。比例尺为25μm。
69.图27:laam tc-cqds在荷瘤小鼠中由主要器官和肿瘤的平均fl强度确定的半定量生物分布图。
70.图28:不同时间肿瘤区域的pa信号强度。
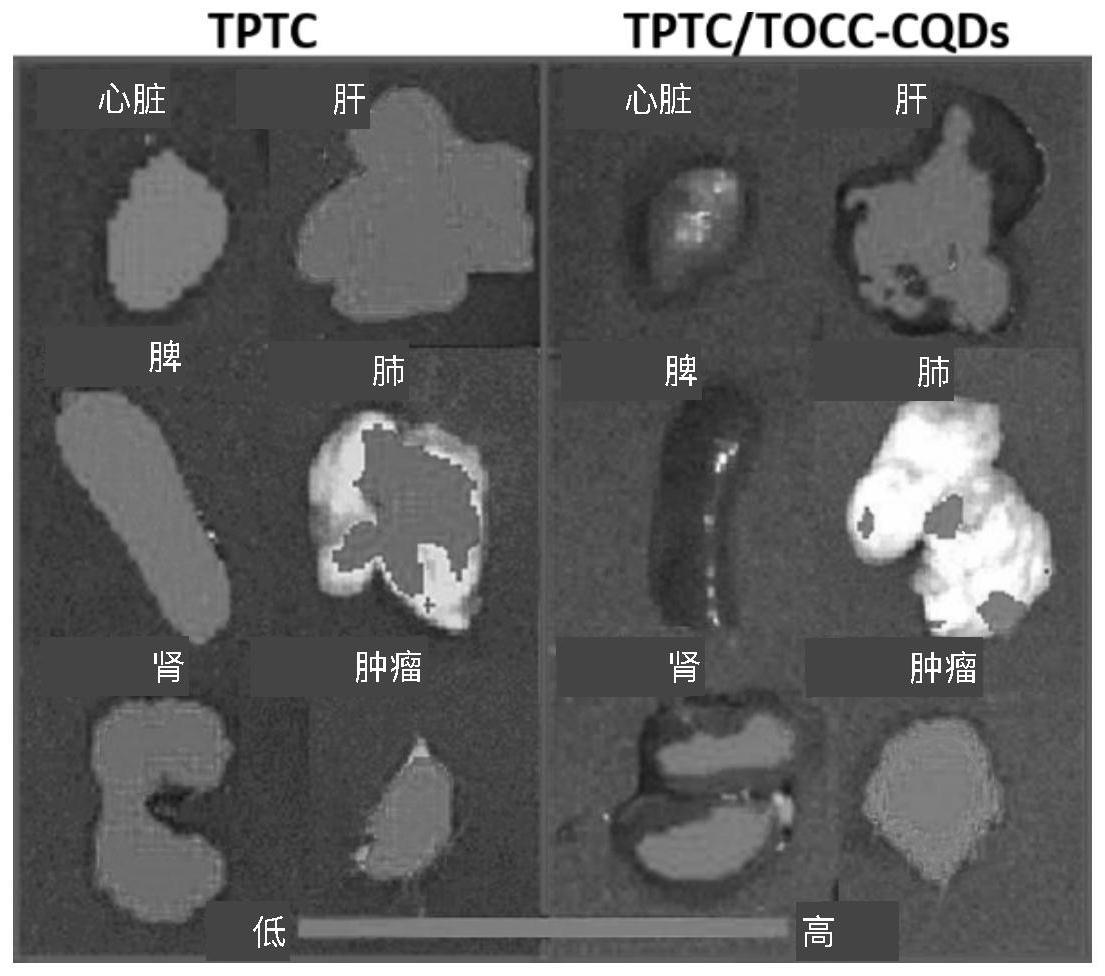
71.图29:静脉注射laam tc-cqds后10小时内,源自a549(a)、panc-1(b)、mcf-7(c)和md-mba-231(d)细胞的皮下肿瘤异种移植裸鼠的nir fl成像图。
72.图30:源自a549(a)、panc-1(b)、mcf-7(c)和md-mba-231(d)细胞的皮下肿瘤异种移植裸鼠的主要器官(心脏、肝脏、脾脏、肺和肾脏)和肿瘤在注射laam tc-cqds后8小时的离体nir fl成像图。
73.图31:在静脉注射laam tc-cqds后10小时内,a549肿瘤(左侧)和hela肿瘤(右侧)的荷瘤裸鼠的nir fl成像图。
74.图32:在注射laam tc-cqds后8小时,a549肿瘤(左侧)和hela肿瘤(右侧)的荷瘤裸鼠的主要器官(心脏、肝脏、脾脏、肺和肾脏)和肿瘤的离体nir fl成像图。
75.图33:分别用g-cqds、y-cqds、b-cqds和b,s-cqds处理后的hela和ccc-esf-1细胞的lcsm成像图。比例尺为100μm。注:g-cqds是指柠檬酸热解合成的绿色荧光cqds;y-cqds是指在碱性条件下电解石墨并在室温下用肼还原生成的黄色荧光cqds;b-cqds是指石墨在硼砂水溶液中电解合成的硼(b)掺杂的cqds;b,s-cqds是指通过对甲苯磺酸钠(tsona)在乙腈溶液中电解石墨棒合成硼(b)和硫(s)共掺杂的cqds。
76.图34:hela和ccc-esf-1细胞中g-cqds、y-cqds、b-cqds和b,s-cqds的摄取结果。
77.图35:注射g-cqds后8小时肿瘤中g-cqds分布的三维重建图。
78.图36:注射g-cqds后8小时主要器官(心脏、肝脏、脾脏、肺和肾脏)和肿瘤的离体nir fl成像图(a)。注射后g-cqds后8小时g-cqds在荷瘤小鼠中由主要器官和肿瘤的平均fl强度确定的半定量生物分布图(b)。
79.图37:静脉注射fa-g-cqds后10小时内,a549肿瘤(左侧)和hela肿瘤(右侧)的荷瘤裸鼠的nir fl成像图。
80.图38:注射表面结合叶酸(fa)的fa-g-cqds后8小时主要器官(心脏、肝脏、脾脏、肺和肾脏)和肿瘤的离体nir fl成像图。
81.图39:laam tc-cqds(对照)、leu、phe、gly和bch预处理后的laam tc-cqds在hela、a549、panc-1、mcf-7、mda-mb-231和cscs细胞中的摄取结果。
82.图40:laam tc-cqds分别在野生型hela细胞、sglat1-1和sglat1-2 hela细胞中的摄取结果。
83.图41:wb测试测量不同类型细胞中lat1的相对表达。对于癌细胞,从左到右依次为hela、a549、panc-1、mcf-7、mda-mb-231、mkn-45、a498、hepg2、htb-9、ec109、pc-3、sk-mel-1、nci-h1975、t84、cal-27、sh-sy5y、hep-2、h460、jurkat、乳腺干细胞;对于正常细胞,从左到右依次为ccc-esf-1、huvec、ccd-1095sk、hl-7702、rwpe-1、hacat、hs578bst、mcf 10a、beas-2b、mrc-5、wish、hkc、1301、hlf-a、ccc-hek-1、ccc-hpe-2、ccc-hie-2、hbmscs细胞。
84.图42:laam tc-cqds、tptc和tptc/laam tc-cqds(a),tc-cqds、dox和dox/laam tc-cqds(b),和laam tc-cqds、hcpt和hcpt/laam tc-cqds水溶液(c)的紫外-可见吸收光谱。
85.图43:tptc的fl发射光谱。
86.图44:使用image-pro plus 6.0软件计算的核中tptc和tptc/laam tc-cqds的平均fl强度。
87.图45:hela、a549、panc-1、mcf-7和mda-mb-231细胞用laam tc-cqd、tptc或tptc/laam tc-cqds处理后的细胞存活率。
88.图46:在静脉注射tptc或tptc/laam tc-cqds后10小时内,hela肿瘤的荷瘤裸鼠的nir fl成像图。
89.图47:在静脉注射tptc或tptc/laam tc-cqds后8小时内,hela肿瘤的荷瘤裸鼠的主要器官(心脏、肝脏、脾脏、肺和肾脏)和肿瘤的离体nir fl成像图。
90.图48:不同条件处理后小鼠的相对存活率。
91.图49:治疗后不同天数不同组的a549肿瘤(左侧)和hela肿瘤(右侧)的裸鼠的代表性成像图。
92.图50:用生理盐水、tptc或tptc/laam tc-cqds治疗的小鼠的a549肿瘤(a)和hela肿瘤(b)的生长曲线(相对体积随天数变化)。
93.图51:用生理盐水、tptc或tptc/laam tc-cqds治疗的小鼠的15天评估期内测量的体重。
94.图52:用生理盐水、tptc或tptc/laam tc-cqds治疗的小鼠的主要器官的组织学评估。每个器官切片已经被h&e染色。比例尺为200μm。
95.图53:来自健康对照和治疗小鼠的全血面板数据,包括wbc(a)、rbc(b)、hgb(c)、hct(d)、mcv(e)、mch(f)、mchc(g)、plt(h)、rdw(i)、pdw(j)、mpv(k)和pct(l)。血液分析各项指标均在正常范围内。在对照组和治疗组之间没有注意到所有血液测试数据的显著差异。误差棒基于每组5只小鼠。
96.图54:血清生化参数测量。通过来自健康对照和治疗小鼠的血液样本评估三个指标,包括用于肝功能的alt、ast和alp(a),以及用于肾功能的另外两个指标,urea(b)和crea(c)。
97.图55:无nh2的laam tc-cqds和无cooh的laam tc-cqds的制备过程。
98.图56:无nh2的laam tc-cqds(a)和无cooh的laam tc-cqds(b)的fl发射光谱。laam tc-cqds(λex=600nm)、无nh2的laam tc-cqds(ex=580nm)和无cooh的laam tc-cqds(ex=600nm)的归一化fl发射光谱图(c)。
99.图57:无nh2的laam tc-cqds(a)和无cooh的laam tc-cqds(b)的ft-ir光谱图。
100.图58:laam tc-cqds、无nh2的laam tc-cqds和无cooh的laam tc-cqds通过流式细胞仪分析获得的在hela和ccc-esf-1细胞中的摄取结果。
101.图59:分别通过水热处理ca和1,4-daaq、1,5-daaq和2,6-daaq制备的1,4-cqds(a)、1,5-cqds(b)和2,6-cqds(c)。
102.图60:1,4-cqds(a)、1,5-cqds(b)和2,6-cqds(c)的tem图像。1,4-cqds(d)、1,5-cqds(e)和2,6-cqds(f)在硅基底上的afm图像。图d-f中的插图是沿所示线的高度剖面。
103.图61:1,4-cqds、1,5-cqds和2,6-cqds的拉曼(a)、xrd(b)和ft-ir光谱图。
104.图62:1,4-cqds、1,5-cqds和2,6-cqds的xps全谱图(a)、c1s(b、c、d)和n1s(e、f、g)谱图。
105.图63:1,4-cqds、1,5-cqds和2,6-cqds紫外可见吸收光谱图(a),1,4-cqds(b)、1,5-cqds(c)和2,6-cqds(d)的和fl光谱图。
106.图64:从密度泛函理论计算(b3lyp/6-31g(d,p))获得的1,4-cqds(a),1,5-cqds(b)和2,6-cqds(c)的一个荧光单元的优化电子离域分子轨道(mo)图。
107.图65:通过流式细胞仪分析获得的laam tc-cqds、1,4-cqds、1,5-cqds和2,6-cqds在hela和ccc-esf-1细胞中的摄取结果。
108.图66:使用phe和乙醇作为前驱体,通过溶剂热法制备phe-cqds。
109.图67:phe-cqds的tem(a)和hrtem(b)图像。
110.图68:phe-cqds的ft-ir(a)、xps全谱(b)、c1s(c)、n1s(c)和o1s(e)谱图。
111.图69:phe-cqds的紫外-可见光吸收(a)和fl发射(b)光谱图。
112.图70:通过流式细胞仪分析获得laam tc-cqds和phe-cqds在hela和ccc-esf-1细胞中的摄取结果。
113.图71a:hela和ccc-esf-1细胞用laam tc-cqds、tptc或tptc/laam tc-cqds处理后的细胞存活率。
114.图71b:在hela肿瘤的荷瘤小鼠中,当以游离药物形式或与tptc/laam tc-cqds一起递送时,tptc的血清浓度随时间的变化(n=5)。数据表示为总注射剂量的百分比(%id)。
115.图71c:tptc和tptc/laam tc-cqds在从hela肿瘤的荷瘤小鼠中分离的指定器官中的生物分布(n=5)。
116.图71d:在携带hela肿瘤的小鼠中接受指定治疗后小鼠的肿瘤体积随时间的变化(n=5)。
117.图71e:a549细胞用laam tc-cqds、tptc或tptc/laam tc-cqds处理后的细胞存活率。
118.图71f:当以游离药物形式或与tptc/laam tc-cqds一起递送时,tptc在a549荷瘤肿瘤的小鼠中血清浓度随时间的变化(n=5)。
119.图71g:tptc和tptc/laam tc-cqds在a549荷瘤肿瘤的小鼠中分离的指定器官中的生物分布(n=5)。
120.图71h:接受指定治疗的a549荷瘤小鼠中肿瘤体积随时间的变化(n=5)。
121.图72:laam tc-cqds在选定ph值下的fl发射光谱图(a)。在氨基酸(asp、glu、met、phe、tyr和gly)或mmp-2存在下laam tc-cqds的fl发射光谱图(b)。
图73:laam tc-cqds在长时间储存或辐照后的光稳定性。新鲜制备的laam tc-cqds溶液(黑色曲线)和室温下储存三个月后的laam tc-cqds(灰色曲线)的pl光谱图(a)。在指定时间点(f)照射后laam tc-cqds的pl强度与新鲜laam tc-cqds(f0)随时间变化的pl强度比(b)。
122.图74:365nm紫外线照射5小时对laam tc-cqds影响的表征。laam tc-cqds在紫外线照射前(黑色曲线)和紫外线照射后(灰色曲线)的fl发射光谱图(a)。使用茚三酮处理后,紫外线照射前(黑色曲线)和照射后(灰色曲线)的laam tc-cqds的紫外-可见光吸收光谱图(b)。hela和ccc-esf-1细胞中对照和紫外线照射处理的laam tc-cqds的流式细胞仪分析的细胞摄取结果(c)。
123.图75:新鲜laam tc-cqds的大小分布(a),和在含有10%fbs的pbs缓冲液中孵育30天后的laam tc-cqds(b)。在指定时间点(f),在含有10%fbs的pbs缓冲液中孵育laam tc-cqds后的pl强度与新鲜laam tc-cqds(f0)随时间变化的pl强度比(c)。详细说明一般定义
124.除非另外定义,否则本文使用的所有技术和科学术语的含义具有与本发明所属领域的普通技术人员通常理解的含义相同。在本发明中提及的所有专利、专利申请、公开的专利申请和其他出版物均通过全文引用并入本文。如果本节中所阐述的定义与在此通过引用并入本文的专利、专利申请或其他出版物中阐述的定义相反或不一致,则本节中所阐述的定义优先于通过引用并入本文的定义。
125.如本文所用,“一”或“一个”是指“至少一个”或“一个或多个”。
126.如本文所用,术语“烷基”是指呈直链、支链或环状构型或其任何组合的饱和烃基,并且特别地考虑包括具有十个或更少碳原子数的烷基,尤其是具有1-6个碳原子的烷基和具有1-4个碳原子的低级烷基。示例性的烷基是甲基、乙基、丙基、异丙基、丁基、仲丁基、叔丁基、戊基、异戊基、己基、环丙基甲基等。
127.烷基可以是未取代的,或者它们可以被取代到在化学上有意义的这种取代程度。典型的取代基包括但不限于卤素、=o、=n-cn、=n-ora、=nra、-ora、-nr
a2
、-sra、-so2ra、-so2nr
a2
、-nraso2ra、-nraconr
a2
、-nracoora、-nracora、-cn、-coora、-conr
a2
、-oocra、-cora和-no2,其中每个ra独立地是h、c
1-c8烷基、c
2-c8杂烷基、c
3-c8杂环基、c
4-c
10
杂环烷基、c
1-c8酰基、c
2-c8杂酰基、c
2-c8烯基、c
2-c8杂烯基、c
2-c8炔基、c
2-c8杂炔基、c
6-c
10
芳基或c
5-c
10
杂芳基,且每个ra任选地被卤素、=o、=n-cn、=n-orb、=nrb、orb、nr
b2
、srb、so2rb、so2nr
b2
、nrbso2rb、nrbconr
b2
、nrbcoorb、nrbcorb、cn、coorb、conr
b2
、oocrb、corb和no2取代,其中每个rb独立地为h、c
1-c8烷基、c
2-c8杂烷基、c
3-c8杂环基、c
4-c
10
杂环烷基、c
1-c8酰基、c
2-c8杂酰基、c
6-c
10
芳基或c
5-c
10
杂芳基。烷基、烯基和炔基也可以被c
1-c8酰基、c
2-c8杂酰基、c
6-c
10
芳基或c
5-c
10
杂芳基取代,其中的每一个都可以被适合于该特定基团的取代基取代。如果取代基在相同或相邻原子上包含两个ra或rb基团(例如,-nr
b2
或-nr
b-c(o)rb),则这两个ra或rb基团可以任选地与取代基中的原子一起连接形成5-8元环,该环可以在ra或rb本身允许的情况下被取代,并且可以包含一个额外的杂原子(n、o或s)作为环原子。
128.如本文所用,术语“环烷基”是指环状烷烃(即一个烃的碳原子的一个链形成一个环),优选地包括3-8个碳原子。因此,示例性的环烷烃包括环丙基、环丁基、环戊基、环己基、
环庚基和环辛基。环烷基还包括一个或两个双键,由此形成“环烯基”基团。环烷基可以任选地被本文所述的适合于烷基取代的基团取代。
129.如本文所用,术语“芳基”或“芳香族部分”是指芳香族环体系,其可进一步包括一个或多个非碳原子。这些通常是5-6元孤立环或8-10元双环基团,并且可以被取代。因此,考虑的芳基包括(例如,苯基、萘基等)和吡啶基,并且吡啶酮环被认为是本文讨论的芳香族。进一步考虑的芳基可以与一个或两个5-或6-元芳基或杂环基团稠合(即与第一个芳香环上的2个原子共价结合),因此被称为“稠合芳基”或“稠合芳族”。
130.如本文所用,术语“部分芳香族的”是指与芳香环稠合并共享至少一个键的一个环。部分芳香族稠环体系是其中每个环是芳香族或部分芳香族的那些稠环体系。
131.如本文所用,术语“部分不饱和”是指在环内至少含有一个双键的一个环,而环不是芳香族的。注意,一个部分芳香族的环共用一个芳香族键,由于这个芳香族环,它被认为是部分不饱和的,同时也是部分芳香族的。
132.含有一个或多个杂原子(通常为n、o或s)作为环原子的芳基可称为杂芳基或芳杂环基。典型的杂芳基包括单环c
5-c6芳基,比如吡啶基、嘧啶基、吡嗪基、噻吩基、呋喃基、吡咯基、吡唑基、噻唑基、恶唑基、异噻唑基、异恶唑基和咪唑基以及稠合双环基团,这些双环基团是通过将这些单环基团中的一个与苯环或任意杂环单环基团稠合从而形成8-10元双环基团,例如吲哚基、苯并咪唑基、吲唑基、苯并三唑基、异喹啉基、喹啉基、苯并噻唑基、苯并呋喃基、吡唑并吡啶基,吡唑并嘧啶基、喹唑啉基、喹喔啉基、噌啉基等。在整个环体系的电子分布方面具有芳香性特征的任何单环或稠环双环体系均包括在该定义中。它还包括双环基团,其中至少直接连接到分子其余部分的环具有芳香性特征。通常,环体系包含5-12个环原子。
133.如本文还使用的,术语“杂环”和“杂环的”是指其中多个原子通过多个共价键形成一个环的任何化合物,其中该环包括至少一个碳原子以外的原子作为环原子。特别考虑的杂环包括以氮、硫或氧为非碳原子的5元和6元环(例如咪唑、吡咯、三唑、二氢嘧啶、吲哚、吡啶、噻唑、四唑等)。通常,这些环包含0-1个氧或硫原子,至少一个且通常为2-3个碳原子,以及最多4个氮原子作为环原子。进一步考虑的杂环可与一个或两个碳环或杂环稠合(即与第一杂环上的两个原子共价结合),因此如本文所用的被称为“稠合杂环”或“稠合杂环的”或“稠合杂环基团”。如果环是芳香族,则这些在本文中可称为“杂芳基”或“芳杂环基”。
134.非芳香族杂环基团可被本文所述的适合于烷基取代的基团取代。
135.芳基和杂芳基可在允许的情况下被取代。合适的取代基包括但不限于卤素、-ora、-nr
a2
、-sra、-so2ra、-so2nr
a2
、-nraso2ra、-nraconr
a2
、-nracoora、-nracora、-cn、-coora、-conr
a2
、-oocra、-cora和-no2,其中每个ra独立地为h、c
1-c8烷基、c
2-c8杂烷基、c
3-c8杂环基、c
4-c
10
杂环烷基、c
1-c8酰基、c
2-c8杂酰基、c
2-c8烯基、c
2-c8杂烯基、c
2-c8炔基、c
2-c8杂炔基、c
6-c
10
芳基或c
5-c
10
杂芳基,且每个ra任选地被卤素、=o、=n-cn、=n-orb、=nrb、orb、nr
b2
、srb、so2rb、so2nr
b2
、nrbso2rb、nrbconr
b2
、nrbcoorb、nrbcorb、cn、coorb、conr
b2
、oocrb、corb和no2取代,其中每个rb独立地为h、c
1-c8烷基、c
2-c8杂烷基、c
3-c8杂环基、c
4-c
10
杂环烷基、c
1-c8酰基、c
2-c8杂酰基、c
6-c
10
芳基或c
5-c
10
杂芳基。烷基、烯基和炔基也可以被c
1-c8酰基、c
2-c8杂酰基、c
6-c
10
芳基或c
5-c
10
杂芳基取代,其中的每一个都可以被适合于该特定基团的取代基取代。如果取代基在相同或相邻原子上包含两个ra或rb基团(例如,-nr
b2
或-nr
b-c(o)
rb),则这两个ra或rb基团可以任选地与取代基中的原子一起连接形成5-8元环,该环可以在ra或rb本身允许的情况下被取代,并且可以包含一个额外的杂原子(n、o或s)作为环原子。
136.如本文所用,术语“烷氧基”是指通过氧原子连接的烃基团,例如-o-hc,其中烃部分hc可具有任意数量的碳原子,通常为1-10个碳原子,可进一步包括双键或三键,并可在烷基链中包含一个或两个氧、硫或氮原子,并且可以被芳基、杂芳基、环烷基和/或杂环基取代。例如,合适的烷氧基包括甲氧基、乙氧基、丙氧基、异丙氧基、甲氧乙氧基、苄氧基、烯丙氧基等。类似地,术语“烷硫基”指通式为-s-hc的烷基硫化物,其中烃部分hc如烷氧基部分所述。例如,考虑的烷硫基包括甲硫基、乙硫基、异丙硫基、甲氧基乙硫基、苄硫基、烯丙硫基等。
137.如本文所用,术语“氨基”指的是-nh2基团。术语“烷氨基”是指其中一个或两个氢原子被如上所述的烃基hc取代的氨基,其中氨基氮“n”可以被一个或两个如上述的用于烷氧基所述的烃基hc取代。示例性的烷氨基包括甲氨基、二甲氨基、乙氨基、二乙氨基等。此外,术语“取代氨基”指其中一个或两个氢原子被如上所述的烃基hc取代的氨基,其中氨基氮“n”可被一个或两个如上述的用于烷氧基所述的烃基hc取代。
138.如本文所用,术语“卤素”是指氟、氯、溴和碘。当作为取代基存在时,卤素或卤代通常指f或cl或br,更典型地是指f或cl。
139.术语“卤代烷基”是指如上所述的烷基,其中该烷基上的一个或多个氢原子已被卤代基团取代。此类基团的实例包括但不限于氟烷基,例如氟乙基、三氟甲基、二氟甲基、三氟乙基等。
140.术语“卤代烷氧基”是指烷基-o-基团,其中烷基上的一个或多个氢原子已被卤代基团取代,例如,包括诸如三氟甲氧基等的基团。
141.应进一步认识到,所有上述定义的基团可进一步被一个或多个取代基取代,这些取代基可进一步依次被羟基、氨基、氰基、c
1-c4烷基、卤素或c
1-c4卤代烷基取代。例如,烷基或芳基中的氢原子可被氨基、卤素或c
1-c4卤代烷基或烷基取代。
142.如本文所用,术语“取代”是指用一个官能团替换未取代的基团上的一个氢原子,并且特别考虑的官能团包括亲核基团(例如-nh2,-oh,-sh,-cn等)、亲电基团(例如c(o)或c(x)oh等)、极性基团(例如-oh)、非极性基团(例如杂环、芳基、烷基、烯基、炔基等)、离子基团(例如-nh
3+
)和卤素(例如-f、-cl)、nhcor、nhconh2、och2cooh、och2conh2、och2conhr、nhch2cooh、nhch2conh2、nhso2r、och
2-杂环、po3h、so3h、氨基酸及其所有化学上合理的组合。此外,术语“取代”还包括多个程度的取代,并且在公开或要求保护多个取代基的情况下,取代的化合物可独立地被一个或多个公开或要求保护的取代基部分取代。
143.除本文公开内容外,在特定实施例中,被取代的基团具有1、2、3或4个取代基、1、2或3个取代基、1或2个取代基或1个取代基。
144.据了解,在上述定义的所有取代基团中,通过定义具有对自身的进一步取代基的取代基而得到的化合物(例如,具有取代芳基作为取代基的取代芳基,其本身被取代芳基取代,其进一步被取代芳基取代等)不打算包含在本文中。在这种情况下,此类取代基的最大数量为三个。例如,本文具体考虑的取代芳基的系列取代仅限于取代芳基-(取代芳基)-取代芳基。
145.除非另有说明,本文中未明确定义的取代基命名法是通过命名官能团的末端部
分,然后是朝向连接点的相邻官能团来实现的。例如,取代基“芳基烷基氧羰基”指(芳基)-(烷基)-o-c(o)-。
146.对于本文所述的含有一个或多个取代基的任何基团,当然应理解,此类基团不包含任何空间上不切实际和/或合成上不可行的取代或取代方式。此外,目标化合物包括这些化合物取代产生的所有立体化学异构体。
147.术语“药物学上可接受的盐”是指可接受给患者(如哺乳动物,如人类)服用的盐(对于给定剂量方案具有可接受的哺乳动物安全性的抗衡离子盐)。此类盐可从药物学上可接受的无机或有机碱以及药物学上可接受的无机或有机酸中衍生得到。“药物学上可接受的盐”是指化合物的药物学上可接受的盐,该盐衍生自本领域众所周知的各种有机和无机反离子,包括并且仅作为示例,钠、钾、钙、镁、铵、四烷基铵等;以及当分子含有碱性官能团时,有机或无机酸的盐,例如盐酸盐、氢溴酸盐、甲酸盐、酒石酸盐、苯磺酸盐、甲磺酸盐、醋酸盐、马来酸盐、草酸盐等。
148.本发明的化合物和cqds具有至少一个α-氨基羧酸部分,因此能够通过质子化(加酸)或去质子化形成盐;此外,它们可以作为两性离子存在,如本领域已知的氨基酸化合物。应理解,为方便起见,除非另有规定,否则每次提及本发明化合物和本发明cqds时,该物质可以作为药物学上可接受的盐或两性离子以任何合适的质子化状态被制备、分离和使用。在使用或溶液中,质子化状态在很大程度上取决于其环境的ph值,并且质子化状态的相互转换是很好理解的。此外,如果本发明的化合物或cqds具有一个以上的α-氨基酸羧酸部分,取决于环境的影响,则每个α-氨基酸部分可以是这些形式中的任何一种,因此该化合物可以包含盐和/或两性离子部分的内部混合物。
149.术语“含盐物”是指当酸的质子被阳离子取代时形成的化合物,例如金属阳离子或有机阳离子等;或碱性基团,例如氮原子(尤其是sp3杂化的氮)接受质子以形成带正电基团(例如铵),在这种情况下,带正电的化合物伴随着阴离子抗衡离子,例如卤化物阴离子。在适用的情况下,该盐是药物学上可接受的盐,尽管对于不打算给患者服用的中间体化合物的盐不是必须的。举例来说,本发明化合物的盐包括其中化合物被无机或有机酸质子化以形成阳离子的部分,而无机或有机酸的共轭碱为盐的阴离子组分。
150.术语“多肽”、“寡肽”、“肽”和“蛋白质”在本文中互换使用,是指任意长度的氨基酸聚合物,例如,至少5、6、7、8、9、10、20、30、40、50、100、200、300、400、500、1000或更多氨基酸。聚合物可以是线性的或支链化的,它可以包含修饰的氨基酸,并且可以被非氨基酸打断。这些术语还包括已自然或通过干预改性的氨基酸聚合物;例如,二硫键形成、糖基化、脂质化、乙酰化、磷酸化或任何其他操作或修饰,例如与标记成分结合。定义中还包括,例如,含有一种或多种氨基酸类似物的多肽(包括,例如非天然氨基酸等)以及本领域已知的其他修饰。
151.如本文所用,术语“变体”用于指与母体多肽序列具有一定程度氨基酸序列同一性的多肽。变体与母体序列相似,但其氨基酸序列中至少有一处取代、缺失或插入,使它们在序列上与母体多肽不同。此外,变体可保留母体多肽的功能特征,例如,至少维持母体多肽50%、60%、70%、80%、90%、95%、98%或99%的生物活性。
[0152]“抗体”是一种免疫球蛋白分子,能够通过位于免疫球蛋白分子可变区的至少一个抗原识别位点特异性结合到靶标,如碳水化合物、多核苷酸、脂质、多肽等,并且可以是任何
类别的免疫球蛋白,例如igg、igm、iga、igd和ige。igy是鸡等禽类的主要抗体类型,也包括在定义中。如本文所用,该术语不仅包括完整的多克隆或单克隆抗体,还包括其片段(例如fab、fab'、f(ab')2、fv)、单链(scfv)、其突变体、自然发生的变体、包含具有所需特异性的抗原识别位点的抗体部分的融合蛋白、人源化抗体、嵌合抗体,以及包含所需特异性的抗原识别位点的免疫球蛋白分子的任何其他修饰构型。
[0153]
如本文所用,术语“抗原”是指通过抗体的抗原识别位点与抗体特异性结合的靶标分子。抗原可以是单价或多价的,即,它可能具有一种或多种抗体识别的一个或多个表位。可被抗体识别的抗原种类包括多肽、低聚糖、糖蛋白、多核苷酸、脂质等。
[0154]
如本文所用,术语“表位”是指抗原的一部分,例如至少约3至5个、优选地约5至10或15个且不超过约1000个氨基酸(或其间的任何整数)的一个肽序列,其定义了单独或作为较大序列一部分的一个序列,与响应于该序列而产生的抗体结合。片段的长度没有临界上限,例如,片段可以几乎包含抗原序列的全部长度,或者甚至包含来自目标抗原的两个或多个表位的融合蛋白。用于本发明的表位不限于具有衍生自其母体蛋白部分的确切序列的肽,还包括与天然序列相同以及对天然序列修改的序列,例如删除、添加和替换(保守性质)。
[0155]
如本文所用,术语“特异性结合”是指特定结合对的结合特异性。在存在其他潜在靶标的情况下,抗体识别特定靶标是这种结合的一个特征。特异性结合涉及两个不同的分子,其中一个分子通过化学或物理方式与第二个分子特异性结合。这两个分子之间的联系在于,它们之间的结合使得它们能够将它们的结合伙伴与具有类似特征的其他成分区分开来。结合组分对的成员称为配体和受体(反配体)、特异性结合对(sbp)成员和sbp伙伴等。分子也可以是分子聚集的sbp成员;例如,针对第二抗体及其对应抗原的免疫复合物产生的抗体可被认为是该免疫复合物的sbp成员。
[0156]“多核苷酸”或“核酸”,在本文中互换使用,指任何长度的核苷酸聚合物,包括dna和rna。核苷酸可以是脱氧核糖核苷酸、核糖核苷酸、修饰的核苷酸或碱基、和/或它们的类似物,或可通过dna或rna聚合酶并入聚合物的任何底物。多核苷酸可包含修饰的核苷酸,例如甲基化核苷酸及其类似物。如果存在,可在聚合物组装前后对核苷酸的结构进行修饰。核苷酸序列可能被非核苷酸成分中断。多核苷酸在聚合后可进一步被修饰,例如通过与标记成分结合。其他类型的修饰包括,例如,“加帽”,用类似物替换一个或多个天然存在的核苷酸,核苷酸间修饰,例如,具有不带电荷键的(例如,磷酸甲酯、磷酸三酯、磷酸酰胺、氨基甲酸酯等)和带电荷键的(例如,硫代磷酸酯、二硫代磷酸酯等),含有侧链部分的,例如,蛋白质(如核酸酶、毒素、抗体、信号肽、多聚-l-赖氨酸等),具有插层剂的(例如吖啶、补骨脂素等)、含有螯合剂的(例如金属、放射性金属、硼、氧化金属等)、含有烷基化剂的、具有修饰键的(例如α-异聚核酸等)以及未修饰形式的多核苷酸。此外,糖中通常存在的任何羟基都可被例如膦酸基团、磷酸基团取代,被标准保护基团保护,或被活化以制备与附加核苷酸的附加连接物,或可与固体载体结合。5'和3'端oh可以被磷酸化或被胺或被1到20个碳原子的有机封端基团取代。其他羟基也可衍生成标准保护基团。多核苷酸还可包含本领域中通常已知的类似形式的核糖或脱氧核糖糖,包括例如2'-o-甲基-2'-o-烯丙基、2'-氟-或2'-叠氮-核糖、碳环糖类似物、α-异聚糖、差向异构糖,如阿拉伯糖、木糖或来苏糖、吡喃糖、呋喃糖、景天庚酮糖、无环类似物和无碱基核苷类似物,如甲基核苷。一个或多个磷酸二酯键可以被
替代的连接基团取代。这些替代的连接基团包括但不限于的实施例,其中磷酸基团被p(o)s(“硫代酯”)、p(s)s(“二硫代酯”),“(o)nr2(“酰胺”)、p(o)r、p(o)or'、co或ch2(“甲缩醛”)取代,其中每个r或r'独立地为h或经取代或未经取代的烷基(1-20c)任选包含醚键(-o-)、芳基、烯基、环烷基、环烯基或芳醛基。并非多核苷酸中的所有连接都需要相同。前面的描述适用于本文提及的所有多核苷酸,包括rna和dna。
[0157]
如本文所用,“寡核苷酸”通常是指短的、通常为单链的、通常为合成的多核苷酸,其长度通常,但不一定,小于约200个核苷酸。术语“寡核苷酸”和“多核苷酸”并不相互排斥。上述对多核苷酸的描述同样完全适用于寡核苷酸。
[0158]
如本文所用,术语“同源物”是指通过对天然存在的核酸进行微小修改而不同于天然存在的核酸(例如,“原型”或“野生型”核酸),但保持天然存在形式的基本核苷酸结构的核酸。此类变化包括但不限于:一个或几个核苷酸的变化,包括缺失(例如,核酸的截短体)、插入和/或替换。与天然存在的核酸相比,同源物可具有增强、降低或基本相似的性质。同源物可以与天然存在的核酸互补或匹配。可以使用本领域已知的用于生产核酸的技术来生产同源物,包括但不限于重组dna技术、化学合成等。
[0159]
如本文所用,“基本互补或基本匹配”是指两个核酸序列具有至少90%的序列同一性。优选地,两个核酸序列具有至少95%、96%、97%、98%、99%或100%的序列同一性。或者,“基本互补或基本匹配”意味着两个核酸序列可以在高严格条件下杂交。
[0160]
一般来说,杂化物的稳定性是离子浓度和温度的函数。通常,杂交反应是在较低严格度的条件下进行的,随后是不同但更高的严格度的洗涤。中等严格的杂交是指允许核酸分子(如探针)结合互补核酸分子的条件。杂交核酸分子通常具有至少60%的同一性,包括例如70%、75%、80%、85%、90%或95%同一性中的至少任何一个。中等严格条件相当于在50%甲酰胺,5
×
的denhardt's溶液,5
×
的sspe,0.2%十二烷基硫酸钠在42℃,然后在0.2
×
的sspe,0.2%十二烷基硫酸钠在42℃中洗涤的条件下进行杂交。高严格度的条件可以提供,例如,通过在50%甲酰胺,5
×
的denhardt's溶液,5
×
的sspe,0.2%十二烷基硫酸钠在42℃,然后在0.1
×
的sspe,0.1%十二烷基硫酸钠在65℃中洗涤的条件下进行杂交。低严格度杂交是指相当于在10%甲酰胺,5
×
的denhardt's溶液,6
×
的sspe,0.2%十二烷基硫酸钠在22℃,然后在1
×
的sspe,0.2%十二烷基硫酸钠在37℃中洗涤的条件下进行杂交。denhardt's溶液含有1%的ficoll、1%的聚乙烯吡咯烷酮和1%的牛血清白蛋白(bsa)。20
×
sspe(氯化钠、磷酸钠、乙二胺四乙酸(edta))含有3m氯化钠、0.2m磷酸钠和0.025m(edta)。其他合适的中等严格度和高严格度杂交缓冲液和杂交条件是本领域技术人员众所周知的。
[0161]
如本文所用,术语“rna干扰”或“rnai”通常指双链rna分子或短发夹式rna分子减少或抑制核酸序列表达的过程,其中双链或短发夹式rna分子与该核酸序列具有大部分或全部同源性。术语“短干扰rna”或“sirna”或“rnai试剂”是指引发rna干扰的包含约10-50个核苷酸(或核苷酸类似物)的rna(或rna类似物)序列。见kreutzer等人,wo 00/44895;zernicka-goetz等人,wo 01/36646;fire,wo 99/32619;mello&fire,wo01/29058。如本文所用,sirna分子包括包含化学修饰的核苷酸和非核苷酸的rna分子。术语“ddrnai试剂”是指从外源载体转录的dna导向的rnai试剂。术语“短发夹rna”或“shrna”指具有双链区和环区的rna结构。在某些实施例中,ddrnai试剂最初表示为shrnas。
[0162]“治疗”或“疗法”或“缓解”是指治疗处理,其目的是在如果不能治愈目标病理状况或机体紊乱或防止病情复发的情况下,则减慢(减轻)。如果受试者在接受治疗剂量的治疗剂或治疗后,表现出可观察和/或可测量的特定疾病的一种或多种体征和症状的减少或不存在,则该受试者被成功“治疗”。患者也可以感觉到疾病体征或症状的减轻。如果患者病情稳定,也可考虑对其进行治疗。在一些实施例中,使用治疗剂的治疗有效地使得患者在治疗后3个月、优选6个月、更优选1年、甚至更优选2年或更长时间内无病。这些用于评估成功治疗和疾病改善的参数容易通过本领域具有适当技能的医生熟悉的常规程序来测量。在一些实施例中,“疗法”是指改善或以其他方式有益地改变病症、机体紊乱或疾病的症状的任何方式。疗法还包括本文所述组合物的任何药物学用途。在一些实施例中,通过施用特定药物组合物对特定机体紊乱的“改善”是指可归因于组合物的施用或与组合物的施用相关联的任何减轻,无论是永久的还是暂时的、持久的或暂时的。
[0163]
如本文所用,术语“预测”或“预后”是指患者会对一种药物或一组药物产生有利或不利反应的可能性,或疾病的可能结果。在一个实施例中,预测与那些响应或结果的程度有关。在一个实施例中,预测涉及患者是否和/或在治疗后存活或改善(例如使用特定治疗剂治疗),并且在一定时间段内没有疾病复发的概率。本发明的预测方法可通过为任何特定患者选择最合适的治疗模式而在临床上用于做出治疗决定。本发明的预测方法是预测患者是否可能对治疗方案产生有利反应的有价值工具,例如给定治疗方案,包括例如给定治疗剂或组合的施用、外科干预、类固醇治疗等。
[0164]
如本文所用,“通过重组手段生产”是指使用重组核酸方法的生产方法,该方法依赖于众所周知的分子生物学方法来表达由克隆核酸编码的蛋白质。
[0165]
应理解,本文描述的本发明的方面和实施例包括“包括”和/或“基本上包括”方面和实施例。
[0166]
贯穿在本发明,本发明的各个方面以范围格式呈现。应当理解的是,范围格式的描述仅仅是为了方便和简洁,并且不应当被解释为对本发明范围的不灵活限制。因此,应当认为范围的描述已经具体地公开了所有可能的子范围以及该范围内的单个数值。例如,对诸如从1到6的范围的描述应被视为具有具体公开的子范围,诸如从1到3、从1到4、从1到5、从2到4、从2到6、从3到6等,以及该范围内的单个数值,例如,1、2、3、4、5和6。这适用于任何范围的宽度。
[0167]
如本文所用,“药物学上可接受的载体”一词旨在包括与药物管理相容的任何及所有溶剂、分散介质、涂料、等渗剂和吸收延迟剂等。此类介质和试剂用于药物学上活性物质的用途在本领域是众所周知的。例如,见remington,《药学科学与实践》,第20版,(lippincott,williams&wilkins,2003年)。除非任何常规介质或试剂与活性化合物或物质不相容,否则在组合物中的使用可以被考虑。
[0168]
如本文所用,术语“治疗有效剂量”或“有效剂量”是指单独或与附加治疗剂组合施用于细胞、组织或受试者时有效预防或改善受试对象疾病或机体紊乱的治疗剂量。治疗有效剂量还指足以导致症状改善的治疗剂的量,例如,相关医疗状况的治疗、愈合、预防或改善,或增加此类状况的治疗、愈合、预防或改善的速度。当应用于单独施用单个活性成分时,治疗有效剂量指的是单独施用该成分。当应用于组合物时,治疗有效剂量指产生治疗效果的活性成分的总量,无论是组合、连续或同时施用。在一些实施例中,“用于治疗特定疾病的
化合物或物质的有效剂量”是指足以改善或以某种方式减少与该疾病相关症状的剂量。该剂量可作为单一剂量施用,或可根据方案施用,凭借其是有效的。该剂量可以治愈疾病,但通常是为了改善疾病症状而施用的。为了达到预期的症状改善,可能需要反复给药。
[0169]
如本文所用,“前药”是一种化合物,其在体内给药后代谢或以其他方式转化为该化合物的生物、药物学或治疗活性形式。为了产生前药,对药物活性化合物进行修饰,使活性化合物通过代谢过程再生。前药可被设计成改变药物的代谢稳定性或转运特性、掩盖副作用或毒性、改善药物口味或改变药物的其他特性或性质。凭借药效学过程和体内药物代谢的知识,本领域技术人员一旦知道药物活性化合物,就可以设计该化合物的前药(例如,参见nogrady(1985)《药物化学-生物化学方法》,牛津大学出版社,纽约,第388-392页)。
[0170]
本文所述化合物和组合物可施用于需要治疗细胞增殖障碍的受试者,例如癌症,特别是从白血病、淋巴瘤、肺癌、结肠癌、黑色素瘤、卵巢癌、肾癌、前列腺癌、乳腺癌、头颈癌和胰腺癌中选择的癌症。受试者通常是被诊断为需要治疗一种或多种此类增殖障碍疾病的哺乳动物,且受试者通常是人类。所述方法包括施用至少一种本发明化合物的有效剂量;任选地,该化合物可与一种或多种附加治疗剂组合施用,特别是已知可用于治疗折磨特定受试者的癌症或增殖障碍疾病的治疗剂。
[0171]
本发明的碳量子点是将具有合适尺寸和电子特性的颗粒用作量子点,并且由至少20%重量的碳组成,优选地至少50%重量的碳组成。当cqds被描述为“包含”特定结构的化合物时,应理解是这些碳量子点不一定由单一纯化合物组成。cqds颗粒可在碳核内包含其他材料,且该碳核可产生或影响量子点的性质(荧光、光声);但颗粒仍然含有特定的化合物,并且其有价值的生物特性(与lat1结合、内化到细胞中、对肿瘤或相对于其他细胞特异性表达lat1细胞的选择性)可归因于指定的化学结构,如本文所示的数据所示,该数据显示对实施例和权利要求书的cqds的特定化学结构的修饰导致这些有价值的生物特性降低。因此,例如,如本文关于特定化学结构所描述和要求保护的cqds是包含至少一个生物相关量的特定化学结构的颗粒,并且可以包含重量百分比为5%或10%的特定化学结构。当然,cqds也可以包括或基本上包括特定实施例或权利要求中的指定化合物。类似地,本文所述方法可产生含有所述产品中所含化合物的至少5%或至少10%(按重量计)的组合物。这些产物可以作为颗粒获得,或者能够形成具有碳量子点性质的颗粒,但是还应当理解,本发明的化合物和组合物,包括通过所述和权利要求保护的方法制备的产物,并且包含这些化合物和组合物的颗粒有望表现出对lat1的有用亲和力,并且能够通过lat1选择性地内化到表达lat1的细胞中,即使其大小不足以作为cqds发挥作用。因此,这些化合物和组合物可用于将标记物或治疗剂内化到表达lat1的细胞中,从而显示出有价值的药物学、成像和治疗用途;因此,如果本文中的材料未明确描述为碳量子点,则本发明包括本文中描述的化合物、组合物和产品,无论它们是否以具有碳量子点的功能颗粒形式存在。
[0172]
以下列举的实施例代表了本发明的一些方面。1.一种碳量子点,其:a)包含一个由6元环的稠合多环阵列组成的核结构,每个稠合多环阵列均为芳香族或不饱和的,其中所述6元环的多环阵列被至少一个被羧基和氨基取代的c
1-c3烷基取代;或b)包含一个含6元环的稠合多环系统,其中每个环是芳香族的或不饱和的,并且多
的基团取代的c
1-c3烷基,虚线键指示所述化学式a的基团与所述稠合多环系统相连接的位置。在这些化合物和cqds中,多环系统可任选地被一个或多个选自c
1-4
烷基、苯基、c
1-4
烷氧基、卤素、coor*、-oh、cn和nr*2的基团取代,其中每个r*独立地选自h和c
1-3
烷基,每个c
1-3
烷基可任选性地被一到三个选自-oh,-cooh、-nh2和c
1-2
烷基的基团取代。此外,被至少一个羧基和氨基取代的c
1-c3烷基可任选地进一步被c
1-c2基团取代,该c
1-c2基团可任选地被一到三个选自-oh、-cooh、-nh2和c
1-2
烷基的基团取代。在这些化合物和cqds的优选实例中,r1为h、甲基或-ch2cooh。
[0175]
在实施例1的一些示例中,碳量子点包含至少10个稠合6元环的一个多环芳香族或部分芳香环系统,其中所述多环芳香族或部分芳香环系统稠合至化学式b中至少一个亚基:其中:r1为h或任选地被一个或两个选自卤素、-oh、-ome、-sme、-cooh和-conh2的基团取代的c
1-c3烷基,z1为nr2或c(r2)2,其中每个r2独立地从h和c
1-c3烷基中选择,且其中虚线键指示化学式b与多环芳香族系统相稠合的位置。在这些化合物和cqds中,多环系统可进一步任选地被一个或多个选自c
1-4
烷基、苯基、c
1-4
烷氧基、卤素、coor*、-oh、cn和-nr*2的基团取代,其中每个r*独立地选自h和c
1-3
烷基,其中每个c
1-3
烷基可任选地被一到三个选自-oh、-cooh、-nh2和c
1-2
烷基的基团取代。此外,被至少一个羧基和氨基取代的c
1-c3烷基可任选地进一步被c
1-c2基团取代,该c
1-c2基团可任选地被一到三个选自-oh、-cooh、nh2和c
1-2
烷基的基团取代。
[0176]
在实施例1的一些示例中,包括这些实施例的前述示例,碳量子点经配置以选择性进入表达大型中性氨基酸转运蛋白(lat1)或其亚单位的细胞。在这些示例中,cqds优先适于或配置为选择性摄取到细胞中,具有至少90%的摄取率,例如,至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或更高。
[0177]
在实施例1的一些示例中,包括这些实施例的前述示例,碳量子点经配置以选择性地进入肿瘤或癌细胞。在这些例子中,肿瘤或癌细胞表达识别并结合碳量子点的转运体。2.根据实施例1所述的碳量子点,其包含一个由6元环的稠合多环阵列组成的核结构,每个稠合多环阵列均为芳香族或不饱和的,其中所述6元环的多环阵列被至少一个被羧基和氨基取代的c
1-c3烷基取代。3.根据实施例2所述的碳量子点,其包含至少5个稠合6元芳香环或不饱和核环。4.根据实施例2或3所述的碳量子点,其中所述6元环的多环阵列被至少两个c
1-c3烷基取代,其中每个c
1-c3烷基被羧基和氨基取代,并且进一步任选地被一个或两个选自-oh、甲基、苯基、-ome、-nh2、-sme、-cooh和-conh2的基团取代。5.根据实施例2-4中任一项所述的碳量子点,其中核结构中6元芳香环或不饱和环
的数量与c
1-c3烷基的数量之比至少为2。6.根据实施例5所述的碳量子点,其中核结构中6元芳香环或不饱和环的数量与c
1-c3烷基的数量之比约为2到70,例如,2、3、4、5、6、7、8、9、10、15、20、25、30、35、40、45、50、55、60、65或70,或其任何子范围。7.根据实施例1所述的碳量子点,其包含一个含6元环的稠合多环系统,其中每个环是芳香族的或不饱和的,并且多环系统被至少一组化学式a取代:其中r1为h或由一个或两个选自-oh、-ome、-sme、-cooh和-conh2的c
1-c3烷基取代,虚线键指示所述式(a)基团连接到所述稠合多环系统的位置。8.根据实施例7所述的碳量子点,其中r1为h。9.根据实施例7所述的碳量子点,其中r1为c
1-c3烷基基团。10.根据实施例9所述的碳量子点,其中r1为任选地被一个或两个选自卤素、-oh、-ome、-sme、-cooh和-conh2的基团取代的c
1-c3烷基。11.实施例1的碳量子点,其包含至少10个稠合6元环的一个多环芳香族或部分芳香环系统,其中所述多环芳香族或部分芳香环系统稠合至化学式b中至少一个亚基:其中:r1为h或任选地被一个或两个选自卤素,-oh、-ome、-sme、-cooh和-conh2的基团取代的c
1-c3烷基,z1为nr2或c(r2)2,其中每个r2独立地从h和c
1-c3烷基中选择,且其中虚线键指示化学式b与多环芳香族系统相稠合的位置。12.根据实施例11所述的碳量子点,其中r1为h。13.根据实施例11所述的碳量子点,其中r1为c
1-c3烷基基团。14.根据实施例11所述的碳量子点,其中r1为任选地被一个或两个选自卤素、-oh、-ome、-sme、-cooh和-conh2的基团取代的c
1-c3烷基。15.根据实施例11-14中任一项所述的碳量子点,其中z1为nr2,例如nh。16.根据实施例11-14中任一项所述的碳量子点,其中z1为c(r2)2,例如ch2。17.根据实施例15或16所述的碳量子点,其中r2为h。18.根据实施例15或16所述的碳量子点,其中r2为c
1-c3烷基基团。19.根据实施例11-18中任一项所述的碳量子点,其包含至少两个化学式b的亚基,例如,四个化学式b的亚基稠合到多环芳香族或部分芳香环系统。20.根据实施例11-19中任一项所述的碳量子点,其具有约500至约500000的分子
量,例如约500、1000、2000、3000、4000、5000、6000、7000、8000、9000、10000、20000、30000、40000、50000、60000、70000、80000、90000、100000、200000、300000、400000、500000或其任何子范围。21.根据实施例1-20中任一项所述的碳量子点,其由至少两种不同的前驱体,至少一种包含羧基和羟基的前驱体以及至少另一种包含多个6元芳香环和至少两个氨基的前驱体反应而成。22.根据实施例21所述的碳量子点,其中至少一种包含羧基和羟基的前驱体是柠檬酸(ca)。23.根据实施例21或22所述的碳量子点,其中包含多个6元芳香环的前驱体是1,4,5,8-四氨基蒽醌(taaq)、1,4-二氨基蒽醌(1,4-daaq)或1,5-二氨基蒽醌(1,5-daaq)。24.根据实施例1-20中任一项所述的碳量子点,由至少两种不同的前驱体反应形成,至少一种前驱体包含α-氨基羧酸化合物或α-羟基羧酸化合物,第二种前驱体包含c
1-c8醇。25.根据实施例24所述的碳量子点,其中包含α-氨基羧酸化合物的前驱体是苯丙氨酸(phe)。26.根据实施例24或25所述的碳量子点,其中第二个前驱体是乙醇。27.根据实施例1-26中任一项所述的碳量子点,其经配置以选择性进入表达大型中性氨基酸转运蛋白(lat1)或其亚单位的细胞。28.根据实施例27所述的碳量子点,其中lat1包含由slc3a2(溶质载体家族3成员2)基因编码的4f2hc/cd98重亚基蛋白质及由slc7a5基因编码的cd98轻亚基蛋白质。29.根据实施例27或28所述的碳量子点,其中细胞对大型中性氨基酸的相对摄取率至少为90%,或细胞的lat1表达水平至少比正常人骨髓基质细胞高10倍。例如,细胞对大型中性氨基酸具有至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或以上的相对摄取率,或其任何子范围。在另一实例中,该细胞的lat1表达水平具有至少高于正常人骨髓基质细胞的10
×
、15
×
、20
×
、25
×
、30
×
、35
×
、40
×
、45
×
或50
×
倍数,或其任何子范围。30.根据实施例27-29中任一项所述的碳量子点,其中所述细胞的lat1基因表达水平与另一基因(例如,管家基因如gapdh)的表达水平之间的比例至少为0.5。例如,细胞的lat1基因表达水平与另一基因(例如,管家基因如gapdh)的表达水平之间的比例至少为0.5、0.6、0.7、0.8、0.9、1.0或更高,或其任何子范围。31.根据实施例27-30中任一项所述的碳量子点,其中所述lat1优先内化支链氨基酸和/或芳香族氨基酸。32.根据实施例31所述的碳量子点,其中该支链氨基酸是蛋白原性支链氨基酸,例如亮氨酸、异亮氨酸或缬氨酸。33.根据实施例31所述的碳量子点,其中该支链氨基酸是非蛋白原性支链氨基酸,例如2-氨基异丁酸。34.根据实施例31所述的碳量子点,其中该芳香族氨基酸是蛋白原性氨基酸,例如苯丙氨酸、酪氨酸、精氨酸、色氨酸或组氨酸。35.根据实施例31所述的碳量子点,其中该芳香族氨基酸是非蛋白原性芳香族氨
基酸,例如甲状腺素、5-羟基色氨酸(5-htp)或左旋多巴(l-dopa)。36.根据实施例27-35中任一项所述的碳量子点,其中相对于受试者(例如哺乳动物)的其他组织,lat1在靶器官中优先或高度表达。37.根据实施例27-35中任一项所述的碳量子点,其中相对于受试者(例如哺乳动物)的其他组织或细胞,lat1在肿瘤或癌细胞中优先或高度表达。38.根据实施例1-37中任一项所述的碳量子点,其掺杂有n、s、p、b和/或o。39.根据实施例1-38中任一项所述的碳量子点,其平均尺寸或粒径范围为约0.2nm至约10nm,例如约0.2nm、0.3nm、0.4nm、0.5nm、0.6nm、0.7nm、0.8nm、0.9nm、1nm、2nm、3nm、4nm、5nm、6nm、7nm、8nm或9nm至约10nm,或其任何子范围。在许多实施例中,碳量子点具有介于1nm和5nm之间或介于2nm和4nm之间的平均尺寸。40.根据实施例1-39中任一项所述的碳量子点,其激发波长范围为约300nm至约900nm,例如约300nm、400nm、500nm、600nm、700nm、800nm、900nm或其任何子范围。41.根据实施例1-40中任一项所述的碳量子点,其发射波长范围为约400nm至约1000nm,例如约400nm、500nm、600nm、700nm、800nm、900nm、1000nm或其任何子范围。42.根据实施例41所述的碳量子点,其发射近红外(nir)荧光(fl)。43.根据实施例1-42中任一项所述的碳量子点,其被配置在辐射时可进行光声(pa)成像。44.根据实施例43所述的碳量子点,在激发波长范围从约600nm至约900nm(例如,约600nm、650nm、700nm、750nm、800nm、850nm或900nm)或其任何子范围内的辐射下,该碳量子点产生超声波。45.根据实施例44所述的碳量子点,其中该超声波经配置以形成pa图像。46.根据实施例43-45中任一项所述的碳量子点,其在约0.1μg/ml至约10μg/ml的浓度下具有线性递增关系,例如,约0.1μg/ml、0.5μg/ml、1μg/ml、2μg/ml、3μg/ml、4μg/ml、5μg/ml、6μg/ml、7μg/ml、8μg/ml、9μg/ml、10μg/ml或其任何子范围。47.根据实施例1-46中任一项所述的碳量子点,其发射近红外(nir)荧光(fl)并且被配置为在辐射时可进行光声(pa)成像。48.根据实施例47所述的碳量子点,其被配置用于深部组织、肿瘤或癌症成像。49.根据实施例1-48中任一项所述的碳量子点,其经配置以选择性地进入肿瘤或癌细胞。50.根据实施例49所述的碳量子点,其经配置以选择性地进入肿瘤或癌细胞的细胞核。51.根据实施例49或50所述的碳量子点,其中所述肿瘤或癌症选自肉瘤、表皮样癌、纤维肉瘤、宫颈癌、胃癌、皮肤癌、白血病、淋巴瘤、肺癌、非小细胞肺癌、结肠癌、黑色素瘤、卵巢癌、肾癌、前列腺癌、乳腺癌、肝癌、头颈癌、胰腺癌、膀胱癌、食道癌、舌癌和皮肤恶性黑色素瘤。52.根据实施例1-51中任一项所述的碳量子点,其经配置以选择性地进入从肉瘤、表皮样癌、纤维肉瘤、宫颈癌、胃癌、皮肤癌、白血病、淋巴瘤、肺癌、非小细胞肺癌、结肠癌、黑色素瘤、卵巢癌,肾癌、前列腺癌、乳腺癌、肝癌、头颈癌、胰腺癌、膀胱癌、食管癌、舌癌和皮肤恶性黑色素瘤中选择的一种或多种肿瘤或癌症的细胞。
cooh、-nh2和c
1-2
烷基的基团取代。此外,被至少一个羧基和氨基取代的c
1-c3烷基可任选地进一步被c
1-c2基团取代,该c
1-c2基团可任选地被一到三个选自-oh、-cooh、-nh2和c
1-2
烷基的基团取代。56.根据实施例55所述的方法,其中该方法包含用至少一种含α-氨基羧酸化合物或α-羟基羧酸化合物为前驱体及至少另一种包含多个6元芳香族环为前驱体的溶剂热合成法。57.根据实施例56所述的方法,其中包含α-羟基羧酸化合物的前驱体是柠檬酸(ca)。58.根据实施例56或57所述的方法,其中包含多个6元芳香环的前驱体是1,4,5,8-四氨基蒽醌(taaq)、1,4-二氨基蒽醌(1,4-daaq)或1,5-二氨基蒽醌(1,5-daaq)。59.根据实施例55所述的方法,其中该方法包含使用至少一种包含苯丙氨酸或苯丙氨酸类似物及c
1-c8醇为前驱体的溶剂热合成法。60.根据实施例59所述的方法,其中包含苯丙氨酸或苯丙氨酸类似物的前驱体是苯丙氨酸。61.根据实施例59或60所述的方法,其中c
1-c8醇为乙醇。62.根据实施例55-61中任一项所述的方法,该方法包括将前驱体分子溶解或分散于溶剂中以形成溶液或混合物,并在约100℃至约300℃的温度下将溶液或混合物加热约10分钟至约72小时,例如约10分钟、20分钟、30分钟,40分钟、50分钟、1小时、2小时、3小时、4小时、5小时、6小时、7小时、8小时、9小时、10小时、20小时、30小时、40小时、50小时、60小时、70小时、72小时或其任何子范围。在一些实施例中,温度介于约100℃、150℃、200℃、250℃、300℃或其任何子范围。63.根据实施例62所述的方法,其中该溶剂是水、c
1-10
醇(例如乙醇)、酰胺(例如甲酰胺、n,n-二甲基甲酰胺、二甲基乙酰胺或n-甲基吡咯烷酮)、酮(例如丙酮或2-丁酮)或亚砜(例如二甲基亚砜)。64.根据实施例55-63中任一项所述的方法,其进一步包括分离或纯化碳量子点。在一些实施例中,碳量子点在近红外区域中发出荧光。任选地,cqds具有约1nm到5nm之间的平均尺寸,例如约1nm、2nm、3nm、4nm或5nm,或其任何子范围。65.根据实施例64所述的方法,其中该碳量子点经由过滤、离心、色谱法(例如柱层析、凝胶电泳或透析)的方法进行分离或纯化。。66.根据实施例55-65中任一项所述的方法,其包括:1)将一种包含α-氨基羧酸化合物或α-羟基羧酸化合物(例如柠檬酸(ca))的前驱体与另一种包含多个6元芳香环的前驱体(例如taaq、1,4-daaq或1,5-daaq)在水中混合以形成混合物;2)在约180℃下加热混合物约2小时;3)将混合物冷却至较低温度,例如室温;和4)从混合物中分离或纯化碳量子点,例如通过色谱、溶剂-溶剂萃取和/或结晶的方法。67.根据实施例65或66所述的方法,其进一步包括通过在真空干燥下除去所述溶剂以获得分离或纯化的碳量子点。
68.一种碳量子点,其通过实施例55-67中任一项所述的方法制备。69.根据实施例1-54和68中任一项所述的碳量子点,其进一步包括可释放的负载物,例如,碳量子点能够与可释放的负载物通过共价或非共价连接。在一些实施例中,负载物是治疗剂、化疗剂或标记剂。在一些实施例中,负载物是芳香族化疗药物,例如拓扑替康(tptc)、阿霉素(dox)或羟基喜树碱(hcpt)。
[0179]
在一些实施例中,碳量子点可任选地通过一种释放连接物与治疗剂共轭。在这些组合物和共轭物中可使用任何合适的治疗剂。例如,治疗剂可以是小分子治疗剂、大分子治疗剂或其组合或复合物。示例性大分子治疗剂可以是肽、多肽、蛋白质,例如,重组蛋白、抗体、抗体片段或衍生物、多核苷酸或核酸,例如dna、rna、pna、反义寡核苷酸或多核苷酸,或rnai寡核苷酸或多核苷酸、脂质、糖或碳水化合物,或其组合或复合物。70.根据实施例69所述的碳量子点,其中所述可释放负载物的释放是由所述碳量子点与靶细胞、组织、器官或受试者之间的接触、或由酶裂解、或由所述碳量子点周围的物理和/或化学参数的改变而触发的。71.根据实施例69或70所述的碳量子点,其中该可释放负载物为治疗剂、预防剂、诊断剂、标记剂或标记物、预后剂、成像剂或其组合。72.根据实施例71所述的碳量子点,其中该可释放负载物为治疗剂。合适的治疗药物包括拓扑替康(tptc)、阿霉素(dox)或羟基喜树碱(hcpt)。73.根据实施例72所述的碳量子点,其中该治疗剂包括小分子(例如分子量在200至2000之间的有机化合物)、大分子(例如多肽或多核苷酸)、细胞治疗剂、共轭物或其组合。74.根据实施例72或73所述的碳量子点,其中该治疗剂包括抗肿瘤或抗癌剂。75.根据实施例74所述的碳量子点,其中该抗癌剂是指化疗药物,例如盐酸拓扑替康(tptc)、阿霉素(dox)或羟基喜树碱(hcpt)或激酶抑制剂。76.根据实施例69-75中任一项所述的碳量子点,所述治疗剂被配置用于治疗癌症或肿瘤。77.根据实施例76所述的碳量子点,其中所述治疗剂被配置用于治疗从肉瘤、表皮样癌、纤维肉瘤、宫颈癌、胃癌、皮肤癌、白血病、淋巴瘤、肺癌、非小细胞肺癌、结肠癌、黑色素瘤、卵巢癌、肾癌、前列腺癌、乳腺癌、肝癌、头颈癌、胰腺癌、膀胱癌、食管癌、舌癌和皮肤恶性黑色素瘤中选择的一种或多种肿瘤或癌症。78.一种组合物,其包含实施例1-54和68中任一项所述的碳量子点,其是包含实施例1-54和68中任一项的碳量子点和至少一种药物学上可接受的载体或辅料混合形成的一种任选的药物组合物。79.根据实施例78所述的组合物,其经配置以用作治疗剂、预防剂、诊断剂、传感剂、标记剂、预后剂、成像应用或其组合,例如通过将碳量子点连接或可释放地连接至治疗剂上(例如用于治疗癌症的治疗剂),例如盐酸拓扑替康(tptc)、阿霉素(dox)或羟基喜树碱(hcpt)或激酶抑制剂。80.一种试剂盒,其包含实施例1-54和68-77中任一项所述的碳量子点或实施例78或79所述的组合物,以及使用所述碳量子点或组合物的说明书。81.一种用于传感、标记或成像受试者中的靶细胞、组织或器官的方法,该方法包括:
a)向需要的受试者施用有效量的如实施例1-54和68-77中任一项所述的碳量子点或如实施例78或79所述的组合物;和b)评估用于传感、标记或成像所述受试者中的靶细胞、组织或器官的所述碳量子点。在这些实施例中,评估所述碳量子点的步骤可包括检测由所述碳量子点产生的近红外荧光。82.根据实施例81所述的方法,其中该碳量子点不包括可释放负载物。83.根据实施例81所述的方法,其中该碳量子点包括可释放负载物。84.根据实施例81-83中任一项所述的方法,其用于传感、标记或成像受试者中的靶细胞、组织或器官。85.根据实施例81-83中任一项所述的方法,其用于传感、标记或成像受试者中的异常或患病细胞、组织或器官。86.根据实施例85所述的方法,其用于传感、标记或成像受试者中的肿瘤或癌细胞、组织或器官。87.根据实施例85所述的方法,其用于传感、标记或成像受试者中的肿瘤。88.根据实施例85-87中任一项所述的方法,其用于对受试者的疾病或机体紊乱进行诊断、预后、分级、风险评估或治疗监测。89.根据实施例88所述的方法,其中所述疾病或机体紊乱是从肉瘤、表皮样癌、纤维肉瘤、宫颈癌、胃癌、皮肤癌、白血病、淋巴瘤、肺癌、非小细胞肺癌、结肠癌、黑色素瘤、卵巢癌、肾癌、前列腺癌、乳腺癌、肝癌、头颈癌、胰腺癌、膀胱癌、食道癌、舌癌和皮肤恶性黑色素瘤中选择的一种或多种肿瘤或癌症。90.根据实施例85-87中任一项所述的方法,其用于协助或指导对受试者疾病或机体紊乱的治疗或疗法。91.根据实施例90所述的方法,其中该治疗或疗法包含对受试者的疗程或手术。92.根据实施例91所述的方法,其用于协助或指导对受试者肿瘤或癌症的疗程或手术。93.根据实施例91所述的方法,其用于协助或指导受试者的辐射治疗。94.使用有效量的实施例1-54和68-77中任一项所述的碳量子点,或实施例78或79所述的组合物来制造用于传感、标记或成像所需受试者中的靶细胞、组织或器官的组合物。95.一种药物复合物,其包含有效量的实施例1-77中任一项所述的碳量子点,例如,实施例72-77、或实施例78或79所述的组合物,以及药物学上可接受的载体或辅料。在一些实施例中,该药物组合物进一步包括用于治疗癌症的治疗剂,例如盐酸拓扑替康(tptc)、阿霉素(dox)或羟基喜树碱(hcpt)或激酶抑制剂,其中治疗剂可任选地可释放地连接到碳量子点上。96.一种治疗或预防受试者疾病或病症的方法,其包括向所需受试者施用有效量的实施例1-77中任一项所述的碳量子点,例如实施例72-77、实施例78或79所述的组合物或实施例95所述的药物组合物。97.根据实施例96所述的方法,其用于治疗或预防受试者的肿瘤或癌症。98.根据实施例96所述的方法,其用于治疗受试者的肿瘤。
99.根据实施例96-98中任一项所述的方法,其中该碳量子点、组合物或药物组合物是由经口、经鼻、经吸入、经亲代、经静脉、经腹腔、经皮下、经肌肉、经皮内、经局部或经直肠途径施用。100.根据实施例81-93和96-99中任一项所述的方法,其中该受试者是哺乳动物。101.根据实施例100所述的方法,其中该哺乳动物是非人类哺乳动物。102.根据实施例100所述的方法,其中该哺乳动物是人类。103.使用有效量的实施例1-54和68-77中任一项所述的碳量子点或实施例78或79所述的组合物来制造用于治疗或预防所需受试者中疾病或病症的药品,或用于检测所需受试者中癌细胞或组织的存在与否的药品。104.根据实施例103所述的用途,其中所述药品用于治疗或预防受试者中的肿瘤或癌症。105.根据实施例103所述的用途,其中所述药物用于治疗受试者中的肿瘤。106.根据权利要求78或79所述的组合物,其中该碳量子点是附着或固定在固体表面或支持物上。107.根据权利要求106所述的组合物,其被配置为用于检测和/或从样品中分离靶细胞。108.根据权利要求107所述的组合物,其中该样本是生物样本,例如血液或尿液样本。109.根据权利要求107或108所述的组合物,其经配置用于从样本中检测和/或分离肿瘤或癌细胞。110.根据权利要求109所述的组合物,其经配置用于从生物样本(例如血液或尿液样本)检测和/或分离循环肿瘤或癌细胞。111.根据权利要求106-110中任一项所述的组合物,其中所述固体表面或支持物是一个容器、一根管、一块板、一块微量滴定板的一部分,例如,一块微量滴定板的一个孔、一个盘、一张芯片、一个膜或一个收集和/或分析装置。112.根据权利要求106-110中任一项所述的组合物,其中所述固体表面或支持物是用于从酶联免疫吸附剂测定(elisa)、免疫印迹、免疫沉淀、放射免疫分析(ria)、免疫染色、乳胶凝集、间接血凝试验(iha)、补体固定、间接免疫荧光分析(ifa)、散射比浊法、流式细胞术分析、等离子体共振分析、化学发光分析、侧向流式免疫分析、u-捕获测定、抑制试验和亲和力测定中选择的试验装置的一部分。113.一种用于从样品中检测和/或分离肿瘤或癌细胞的方法,该方法包括在适当条件下将含有或疑似含有肿瘤或癌细胞的样品与根据权利要求106-110中任一项所述的组合物接触,以允许所述肿瘤或癌细胞(如果存在于所述样品中)与附着或固定在所述固体表面或支持物上的所述碳量子点结合。114.根据权利要求113所述的组合物,其用于从生物样本(例如血液或尿液样本)检测和/或分离循环肿瘤或癌细胞。115.根据权利要求81-90中任一项所述的方法,其用于从生物样本(例如血液或尿液样本)检测和/或分离循环肿瘤或癌细胞。116.用于治疗的是实施例1-54和68-77中任一项所述的碳量子点,或实施例78或
79所述的组合物。117.根据实施例116所述的碳量子点,其中所述治疗用途为治疗或检测癌症或肿瘤。118.根据实施例116所述的碳量子点,其中所述治疗用途为治疗肿瘤。119.根据实施例106-110中任一项所述的组合物,其中所述固体表面或支持物是一个容器、一根管、一块板、一块微量滴定板的一部分,例如,一块微量滴定板的一个孔、一个盘、一张芯片、一个膜或一个收集和/或分析装置。120.根据实施例106-110中任一项所述的组合物,其中所述固体表面或支持物是用于从酶联免疫吸附剂测定(elisa)、免疫印迹、免疫沉淀、放射免疫分析(ria)、免疫染色、乳胶凝集、间接血凝试验(iha)、补体固定、间接免疫荧光分析(ifa)、散射比浊法、流式细胞术分析、等离子体共振分析、化学发光分析、侧向流式免疫分析、u-捕获测定、抑制试验和亲和力测定中选择的试验装置的一部分。121.一种用于从样品中检测和/或分离肿瘤或癌细胞的方法,该方法包括在适当条件下将含有或疑似含有肿瘤或癌细胞的样品与根据实施例106-110中任一项所述的组合物接触,以允许所述肿瘤或癌细胞(如果存在于所述样品中)与附着或固定在所述固体表面或支持物上的所述碳量子点结合。122.根据实施例113所述的组合物,其用于从生物样本(例如血液或尿液样本)检测和/或分离循环肿瘤或癌细胞。123.根据实施例81-90中任一项所述的方法,其用于从生物样本(例如血液或尿液样本)检测和/或分离循环肿瘤或癌细胞。
[0180]
以下示例性化合物以及包含这些化合物的碳量子点或颗粒是本发明的优选实施例,并且制备和使用这些示例性化合物的方法是本发明的优选实施例。典型化合物
[0181]
本文所述的化合物、颗粒和组合物可用于任何合适的目的。在一些实施例中,本文所述的化合物、颗粒和组合物可用于治疗,例如用于治疗表达lat1的肿瘤。本发明还提供包含本文所述化合物和颗粒的共轭物,其也适用于治疗。在一些实施例中,治疗是指治疗肿瘤,尤其是表达lat1的肿瘤。
[0182]
在另一方面,所述化合物可用于成像细胞、组织、器官或肿瘤,通常为表达lat1的细胞、组织、器官或肿瘤。因此,本发明包括将化合物、颗粒和组合物用作成像剂或标记剂的方法,并包括包含本文所述化合物和颗粒的适合于在这些方法中使用的共轭物。
[0183]
在另一方面,本发明化合物包括碳量子点与负载物的共轭物,负载物通常是用于治疗或成像表达lat1的细胞、组织、器官或肿瘤的治疗剂。与cqds相连接的负载物是可释放的;在一些实施例中,负载物可任意地通过与cqds的氨基或羧基之间形成的酰胺或酯键共价连接到cqds。在其他实施例中,负载物被物理吸附到本发明的颗粒或cqds上,并且负载物在细胞内的释放是被动发生的。这种运载负载物的方法对于多环芳烃负载物,或具有强pi堆积能力的负载物(例如拓扑替康或伊立替康、阿霉素和柔红霉素)特别有效。
[0184]
本文公开了多环化合物和包含这些化合物的颗粒,包括选择性结合或内化到肿瘤或癌细胞的一些碳量子点。在不受理论约束的情况下,认为它们的选择性来源于它们可被大型氨基酸转运蛋白识别。
[0185]
laam cqds和证明laam cqds允许了以前所未有的特异性和效率对不同来源和位置的肿瘤进行成像和药物递送(图2、4)。通过结合遗传学和药理学方法,我们发现肿瘤特异性相互作用是通过lat1介导的(图3)。laam cqds与先前的成像和递送试剂相比,具有三个独特且显著的优势:
[0186]
首先,与之前报道的cqds一样,laam cqds具有用于成像的固有光学特性,因此可用于肿瘤成像,而无需进一步共轭成像探针。我们对laam tc-cqds(首选laam cqds之一)进行了表征,发现它允许最适合深部组织成像的nir fl/pa双模式成像。由于其对肿瘤的高度特异性,laam tc-cqds在肿瘤成像以及成像引导手术中具有巨大的潜力。
[0187]
第二,laam tc-cqds允许以高度特异性向肿瘤靶向药物递送,这是不能通过肿瘤靶向配体结合的传统方法实现的。最近的一项分析表明,尽管付出了巨大努力,但传统方法无法显著提高肿瘤靶向效率。与这一发现一致,我们发现配体的结合增强了cqds对某些肿瘤的传递,但对其他肿瘤没有,并且不能显著减少其在正常组织的非特异性积累(图37、38)。配体结合方法之前已经通过天冬氨酸结合测试了lat1介导的药物向肿瘤递送
13
。研究发现,lat1靶向可使肿瘤中的dox积累量增加3-6倍。然而,在肝脏中也发现了相当数量的dox。相比之下,我们发现通过laam tc-cqds递送可使tptc在肿瘤中的积累量增加16.7倍,而tptc在肝脏中的积累减少到几乎无法检测的水平(肿瘤中的1.8%)(图4d)。两项研究之间观察到的差异可能是因为laam tc-cqds和天冬氨酸作为药物载体对lat1具有不同的亲和力。laam tc-cqds含有4对α-羧基和氨基。我们发现laam cqds的特异性与核上成对的α-羧基和氨基的数量相关(图5)。似乎α-羧基和氨基的局部高密度触发了与lat1的强多价相互作用。因此,通过laam tc-cqds递送显著增强了tptc对肿瘤细胞的渗透。由于大多数正常组织不表达lat1,laam tc-cqds不容易渗透正常细胞,并且在缺乏活性转运体的情况下优先从循环系统中消除(图2b)。与laam cqds不同,天冬氨酸只含有一对α-羧基和氨基。由于没有多价性,天冬氨酸结合的dox与lat1之间的相互作用很弱。因此,天门冬氨酸结合的dox对肿瘤细胞的亲和力较低,并且可以非特异性地渗透正常细胞,导致在正常器官中的积累
13
。
[0188]
综上所述,laam cqds具有一套理想的用于肿瘤特异性成像和药物递送的特性。由于它们能够无论肿瘤的来源和位置而选择性地靶向肿瘤,在大多数正常组织中的积累量最小、毒性最小,具有固有的成像能力以及负载和递送化疗药物的能力,laam cqds在临床转化应用方面具有巨大的潜力,如成像和将药物递送到各种肿瘤中。laamtc-cqds的合成和表征
[0189]
laam tc-cqds是通过将1,4,5,8-四氨基蒽醌(taaq)与柠檬酸(ca)在水溶液中混合,然后在180℃下水热处理2小时合成的(图1a)。反应物用硅胶柱色谱法进行纯化,得到了澄清透明的蓝色溶液。透射电子显微镜(tem)分析表明,laam tc-cqds分散性良好,平均直径为2.45nm(图1b和图6)。高分辨率tem(hrtem)分析显示了一个分辨率很高的晶格,晶面间距为0.21nm(图1b插图),对应于石墨烯的(100)晶格条纹
16
。拉曼光谱分析证实了高度的结晶性,其中1605cm-1
处的结晶g带强于1365cm-1
处的无序d带,g与d的强度比(ig/id)为1.4(图7)。原子力显微镜(afm)分析发现,典型的拓扑高度为0.943nm(图8),这表明大多数laam tc-cqds由2-3个石墨烯层组成。x射线粉末衍射(xrd)图谱显示了在约26
°
一个较宽的(002)峰(图9),证实了laam tc-cqds的石墨烯结构。
[0190]
通过x射线光电子能谱(xps)、傅里叶变换红外(ft-ir)和
13
c-核磁共振谱(nmr)对laam tc-cqds的化学组成和表面官能团进行了表征。xps全谱分析表明laam tc-cqds中存在原子百分比分别为72.43%、12.25%和15.32%的c、n和o元素(图10)。c1s去卷积谱图显示有三种不同类型的碳原子,包括石墨化/脂肪族(c=c/c-c)、含氧(c-o、c=o和o-c=o)和
含n(c-n、c=n和n-c=o)的碳(图11)。n1s去卷积谱图显示在399.0、399.9和400.8ev处有三个峰(图12),分别对应于c-n、n-h和c=n。ft-ir光谱分析确定了n-h(3298和3190cm-1
)、c=o(1720cm-1
)、c=n(1624cm-1
)、c-n(1387cm-1
)和c-o(1158cm-1
)键的伸缩振动(图13),表明多环芳香烃结构的形成以及在laam tc-cqds的边缘存在自由的羧基和氨基。在
13
c-nmr谱中,120.0和140.0ppm之间的峰可归因于芳香族官能团和共轭双键(c=c和c=n),而173.6、170.2和53.3ppm的峰分别与o-c=o、n-c=o和c-n有关(图14)。综合来看,所获得的结构信息表明laam tc-cqds可能是通过两个步骤形成的。在水热条件下的第一步,一个分子的taaq与两个分子的ca反应,产生一个由三个苯环与四个吡啶环稠合的刚性碳骨架。随后,作为构件的骨架经历了脱水和脱羧过程,导致在大的刚性π共轭结构中具有高度n掺杂,且边缘有自由的α-羧基和氨基的laam tc-cqds的形成(图1a)。
[0191]
laam tc-cqds的uv-vis吸收光谱图,除了在230和280nm处出现的两个分别被指认为芳香族c=c键的π-π*转换和含有c=o和c=n键的芳香族sp2系统的n-π*转换的cqds典型吸收峰外,在约650nm处展现出强特征吸收带(图1c)14,17-19。表征了不同激发波长下的荧光(fl)光谱图(图1d,图15)。laam tc-cqds水溶液在700nm处展现出了一个近红外荧光(nir fl)发射峰,并且fl发射波长几乎是激发不依赖的。积分球法测定laam tc-cqds的绝对fl量子产率为6.8%。
[0192]
使用b3lyp/6-31g(d,p)基组的密度泛函理论(dft)模拟证实,laam tc-cqds具有生成近nir fl的局部结构。该图16a,b和表1显示了laam tc-cqds的基态和激发态的优化笛卡尔坐标和主要几何参数。从理论计算中得到的一个fl结构单元的电子离域分子轨道(mo)图显示,最高占分子轨道(homo)位置和最低未占分子轨道(lumo)位置之间的能量间隙(eg)是2.14ev(图16c-e)。模拟预测的激发波长为580nm,振子强度为0.1092,对应的荧光波长为692nm,振子强度为0.1003;这些值非常接近实验测量的激发/发射波长(λex=600nm,λem=700nm,图15)。表1.fl结构单元的基态和激发态的优化笛卡尔坐标
[0193]
除fl性质外,laam tc-cqds还被发现具有光声(pa)成像的能力。图17和表2的结果显示,在650nm激光(0.5w/cm2)的辐射下,laam tc-cqds吸收nir光,导致热诱导的压力跃迁。由此产生的超声波可以被一个声学检测器接收以形成pa图像
20
。监测充满laam tc-cqds(0-10μg/ml)的琼脂糖凝胶模型在不同激发波长下的pa谱图。图1e和图18中位于约650nm的峰值对应于图1c所示观察到的laam tc-cqds的nir吸收带,在2-10μg/ml的浓度范围内,pa信号随着的laam tc-cqds浓度增加而线性增加(r2=0.9989)(图19)。表2.从高到低排列的实验确定的不同ptcas的光热转换效率(η)的示例。
[0194]
nir具有比可见光更有效地穿透生物组织的优势。与光子相比,超声波的散射程度较低;因此,pa成像可以克服光学成像达到几厘米的穿透限制21。有了这种独特的结合了光
学成像高对比度和超声高空间分辨率的nir fl/pa双模式成像能力,laam tc-cqds代表了一种可以进行深部组织成像的有前途探针。laam tc-cqds在体外和体内选择性地靶向癌细胞
[0195]
我们研究了laam tc-cqds和一大批细胞培养物之间的相互作用,包括27个不同来源的癌细胞系,一个从mda-mb-231细胞中分离出来的类似癌症干细胞的侧群(sp)(图20)
22,12
和18个非癌细胞系。表3包括了本研究中使用的细胞的详细清单。使用激光共聚焦扫描显微镜(lcsm),我们发现laam tc-cqds可渗透所有测试的癌细胞,无论其起源或干性。相反,它们渗透非癌细胞的能力有限,这一点被流式细胞仪分析所证实(图2a,图21-24)。定量分析显示,约99%的癌细胞(除了一个比率为95%的bcsc系)对laam tc-cqds呈阳性,而非癌细胞的阳性率仅限于《30%(平均为13%)(图2b和表3)。进一步的lcsm分析发现,从laam tc-cqds的fl与染色细胞核的4,6-二脒基-2-苯基吲哚(dapi)fl的重叠图中可以看出,相当一部分laam tc-cqds进入了细胞核。为了确定细胞渗透和核定位的动力学,我们将hela细胞与laam tc-cqds孵育,并监测laam tc-cqds随时间在细胞内的位置(图25)。在1小时的时间点,大多数laam tc-cqds位于细胞膜上。随后,laam tc-cqds渗入细胞并定位在细胞质中。6小时后,相当一部分laam tc-cqds进入细胞核。到8小时,laam tc-cqds在细胞核中的浓度超过了细胞质中的浓度。我们用同样的程序来监测laam tc-cqds与非癌性ccc-esf-1细胞的相互作用(图26)。与lcsm和流式细胞仪分析的观察结果一致,在整个48小时的时间窗内,我们没有检测到laam tc-cqds与代表性非癌性ccc-esf-1细胞之间的相互作用。表3.tc-cqds在指定细胞的流式细胞仪分析的摄取结果。
[0196]
我们评估了laam tc-cqds是否在体内保持观察到的高度肿瘤特异性。将laam tc-cqds以5mg/kg的剂量静脉注射到hela肿瘤的荷瘤小鼠体内。在注射后0、2、4、6、8和10小时,对小鼠进行fl/pa成像。图2c显示,肿瘤区域的fl随时间逐渐增加,并在8小时达到峰值,而其他区域没有观察到fl。fl成像的三维(3d)重建图证实laam tc-cqds选择性地对肿瘤而不是正常组织进行成像(图2d)。这种高度选择性通过分离的器官和肿瘤的离体成像得到验证,这表明肿瘤中的fl信号明显大于正常器官的信号(图2e和图27)。与fl成像的发现一致,肿瘤中的平均pa强度随时间持续增加,直到注射后8小时,pa信号主要集中在肿瘤中(图2f
和图28)。
[0197]
为了排除观察到的肿瘤特异性是hela肿瘤所特有的可能性,我们在另外四个来自a549细胞、panc-1细胞、mcf-7细胞和md-mba-231细胞的肿瘤异种移植中评估了laam tc-cqds。我们发现laam tc-cqds在所有测试的模型中均可对肿瘤进行成像,其动力学和特异性与在hela模型中观察到的相似(图29和30)。为了进一步验证肿瘤的特异性,我们在左腹有a549肺癌、右腹有hela卵巢肿瘤的小鼠中评估了laam tc-cqds。如图31和32所示,laam tc-cqds以相似的特异性穿透两种肿瘤。
[0198]
我们使用传统的cqds研究是否可以实现观察到的高度肿瘤特异性。合成了g-cqds
17
、y-cqds
19
、b-cqds
23
和b,s-cqds
14
作为例子。将这四种之前报道的cqds与一组癌细胞和非癌细胞进行孵育,并使用流式细胞仪分析测定其特异性。如图33和34所示,所有测试的cqds都能无选择性地渗透癌细胞和非癌细胞。渗透细胞后,大部分cqds定位在细胞质中。挑选出g-cqds并在hela肿瘤的荷瘤小鼠中进一步评估。实验是按照与laam tc-cqds研究中使用的相同程序进行的。fl成像的3d重建图表明,fl信号在除肿瘤外的肝脏、肺和肾脏中也会出现(图35)。离体成像显示,肺部和肾脏的fl强度明显大于肿瘤中的fl强度(图36)。我们评估了传统cqds是否可以通过连接肿瘤靶向配体来达到在laam tc-cqds中观察到的肿瘤特异性的程度。我们根据我们最近发表的程序
18
合成了表面连接叶酸(fa)的g-cqds。由此产生的cqds,称为fa-g-cqds,在hela和a549肿瘤的荷瘤小鼠身上进行了评估。hela肿瘤,但不是a549肿瘤,已知会过度表达fa受体
21,24
。果然,我们发现fa的连接增强了fa-g-cqds在hela肿瘤中的积累,但没有在a549肿瘤中积累(图37),这表明连接配体的方法主要增强了cqds对受体表达肿瘤的靶向效率。尽管hela肿瘤中的fl信号大于其他器官,但我们在离体成像证实肝脏、肺和肾脏中可观察到大量fl信号(图38)。
[0199]
综上所述,这些数据表明laam tc-cqds具有选择性与无论来源的癌细胞相互作用的独特能力,但与非癌细胞的相互作用能力有限。由于其独特的nir fl/pa双模式成像能力,laam tc-cqds能够以最小的背景对肿瘤进行体内成像。lat1介导laam tc-cqds在癌细胞的内化
[0200]
为了研究laam tc-cqds的细胞摄取机制,我们在加入laam tc-cqds之前用过量的亮氨酸(leu)、苯丙氨酸(phe)或甘氨酸(gly)处理hela细胞。除了gly,leu和phe都是已知的lat1的高亲和力底物
27
。如图3a所示,leu和phe明显抑制了laam tc-cqds的细胞摄取,而gly则没有。这一观察结果导致了laam tc-cqds至少有一部分是通过与lat1的相互作用渗透到癌细胞的假设。这一假设的机制得到了一些证据的支持。首先,用lat1抑制剂2-氨基双环-(2,2,1)-庚烷-2-羧酸(bch)进行预处理,大大减少了hela细胞对laam tc-cqds的摄取(图3a)。流式细胞仪的定量结果显示,在所有测试的细胞系中,包括hela、a549、panc-1、mcf-7、mda-mb-231和mda-mb-231sp细胞,bch的预处理将细胞摄取率从~99%降至~20%(图39)。第二,使用crispr/cas9技术产生的lat1基因敲除,并通过测序和蛋白免疫印迹(wb)验证,hela细胞对laam tc-cqds的摄取明显减少了约80%(图3b-d和图40)。第三,在各种细胞中,lat1的表达水平与渗透细胞的laam tc-cqds的数量相关(图3e、图41和表4)。与之前的报告一致,lat1在癌细胞中的表达水平明显高于非癌细胞
8,10,11
。表4.进行测试的各类癌细胞和正常细胞中的相对lat1表达和对tc-cqds的摄取情况。
(注:不同类型细胞的相对lat1表达量是通过图37的wb测试测得的,tc-cqds的摄取量是通过图17和18得到的)。取量是通过图17和18得到的)。
[0201]
综上所述,我们的结果表明laam tc-cqds与癌细胞之间的相互作用是由lat1介导的。用于肿瘤特异性药物递送的laam tc-cqds
[0202]
传统化疗相关的主要限制包括对正常组织的显著不良毒性以及由于多药耐药性atp结合盒(abc)转运蛋白的过度表达而导致的内在或获得性耐药性。通过与细胞核内的dna相互作用而发挥作用的dna损伤化疗药物的功效通常会因其有限的渗透细胞核能力而进一步降低
28
。使用laam tc-cqds作为药物载体可以克服这些限制。首先,laam tc-cqds具有巨大的肿瘤特异靶向性,可以避免全身毒性。其次,laam tc-cqds由于其纳米尺寸不会被
abc转运蛋白去除。第三,laam tc-cqds可有效地渗透细胞核,使dna损伤化疗药物疗效的最大化成为可能。
[0203]
我们评估了laam tc-cqds作为药物载体递送dna损伤化疗药物的情况。laam tc-cqds具有大的π-共轭结构,可以通过π-π堆叠作用负载芳香族化疗药物,如盐酸拓扑替康(tptc)、多柔比星(dox)和羟基喜树碱(hcpt)(图42)。我们进一步评估了tptc负载的laam tc-cqds,命名为tptc/tc-cqds,它是通过将laam tc-cqds与tptc过夜混合,然后进行大量透析而合成的。成功负载tptc的证据是在390nm处出现了其特征性的uv-vis吸收峰,该吸收峰叠加在laam tc-cqds的吸收光谱图上(图42a)。tptc的吸收峰在负载后有轻微的红移,这归因于tptc和laam tc-cqds之间的π-π堆叠作用。tptc/tc-cqds具有双fl发射,对应于tptc(黄色通道,图43)和laam tc-cqds(红色通道,图1d)。我们表征了tptc/tc-cqds与一组癌细胞和非癌细胞之间的相互作用。如图4a所示,tptc/tc-cqds保持了对癌细胞的选择渗透性,而通过laam tc-cqds的递送消除了tptc对非癌细胞的渗透。特别是,根据fl强度,通过laam tc-cqds的递送使tptc在细胞核中的积累增加了4.5倍(图44)。通过laam tc-cqds递送明显增强了tptc对癌细胞的毒性,但降低了其对非癌细胞的毒性。在相当于5μg/ml tptc的浓度下,tptc/tc-cqds杀死了所有hela细胞,但对非癌性ccc-esf-1细胞没有表现出毒性(图4b)。相比之下,相同浓度的游离tptc对两种细胞有相当的抑制效率。对癌细胞毒性的明显增强作用不是hela细胞所独有的,在其他癌细胞,包括a549、panc-1、mcf-7和mda-mb-231细胞中也有类似程度的增强(图45)。这清楚地表明,本发明的laam cqds可用于将化疗药物选择性地携带到癌细胞中,大大增强了细胞毒治疗剂的疗效和安全性。
[0204]
我们确定了tptc/tc-cqds在hela肿瘤的荷瘤小鼠中的药代动力学。以相当于10mg/kg tptc的剂量静脉注射tptc或tptc/tc-cqds,并在不同时间点收集血液。通过高效液相色谱法(hplc)对血浆中的tptc进行定量。如图4c所示,通过laam tc-cqds递送明显增强了tptc的血液循环和生物利用率,tptc的半衰期从5分钟增加到40分钟,曲线下面积(auc)从13.4增加到138.1。第二组接受相同治疗的小鼠,根据tptc的荧光对tptc的生物分布进行了特征分析。正如预期的那样,游离的tptc没有特异性地广泛在身体上分布。相比之下,tptc/tc-cqds表现出与laam tc-cqds类似的动力学特性(图46)。到8小时后,tptc只能在肿瘤中被检测到。分离的器官的离体成像证实,laam tc-cqds能够以高特异性将tptc递送到肿瘤中(图47)。基于tptc fl强度的定量结果显示,通过laam tc-cqds递送的tptc在肿瘤中的浓度增加了13.8倍,同时显著减少了tptc在其他器官的积累(图4d)。
[0205]
我们使用hela肿瘤的荷瘤小鼠评估了tptc/tc-cqds用于癌症治疗。当肿瘤体积达到约100mm3时,小鼠被随机分组并在第1、4、8和12天接受生理盐水、tptc(10mg/kg)或tptc/tc-cqds(相当于10mg/kg tptc)的静脉注射。15天后,接受tptc/tc-cqds治疗的小鼠的肿瘤缩小到检测不到的水平;相比之下,接受游离tptc的小鼠的肿瘤持续增长,尽管其速度慢于对照组小鼠(图4e-g)。所有接受tptc/tc-cqds治疗的小鼠都存活60天以上;相反,接受tptc和生理盐水治疗的小鼠分别存活了40天和20天(图48)。tptc/tc-cqds的显著抗肿瘤作用并不是hela肿瘤所独有的;我们对左腹a549肿瘤和右腹hela肿瘤的小鼠进行了同样的治疗处理。治疗20天后,两测肿瘤都被根除(图49和50)。
[0206]
tptc/tc-cqds对小鼠的毒性很小。如图51所示,在整个研究过程中,用tptc/tc-cqds治疗没有引起明显的体重减轻。相比之下,在接受游离tptc治疗的组中观察到体重减
轻。与该发现一致,从接受tptc/tc-cqds治疗的小鼠分离的主要器官的h&e分析未检测到炎症浸润或病理损伤(图52)。然而,游离tptc治疗的小鼠出现明显的心肌纤维断裂、肝细胞弥漫性气球样变性、肺充血和局灶性肾小管坏死。全血细胞计数分析表明,与生理盐水对照小鼠相比,接受tptc/tc-cqds治疗的小鼠的标准参数,包括白细胞(wbc)、红细胞(rbc)、血红蛋白(hgb)、血细胞比容(hct)、平均红细胞体积(mcv)、平均红细胞血红蛋白(mch)、平均红细胞血红蛋白浓度(mchc)、血小板(plt)、红细胞分布宽度(rdw)、血小板分布宽度(pdw)、血小板体积(mpv)和血小板比容(pct),均在正常范围内(图53),表明tptc/tc-cqds是血液相容性的。血清生化分析,包括丙氨酸氨基转移酶(alt)、天冬氨酸氨基转移酶(ast)和碱性磷酸酶(alp)检测肝功能,尿素氮(urea)和肌酐(crea)检测肾功能,未检测到tptc/tc-cqds治疗的小鼠的异常(图54)。
[0207]
总体而言,这些数据表明laam cqds可作为一种安全的载体用于肿瘤特异性化疗药物的递送,通过laam cqds的递送明显增强治疗效果,同时减少负载治疗剂的系统毒性。laamcqds作为一类新型用于肿瘤特异性成像和药物递送的cqds
[0208]
为了确定解释在laam tc-cqds中观察到的肿瘤特异性的分子结构,我们系统地分析了一系列tc-cqds类似物。首先,我们确定是否羧基、氨基或两者是必需的。我们分别通过水合肼(nh
2-nh2)还原
19
和碳二亚胺(edc)/n-羟基琥珀酰亚胺(nhs)与乙酸的偶联反应
18
,去除laam tc-cqds边缘的羧基和氨基(图55-56)。在hela和ccc-esf-1细胞中评估了所合成的无nh2和cooh的laam tc-cqds。如图5a、b所示,羧基或氨基的去除消除了laam tc-cqds的肿瘤特异性渗透性,并且由此产生的cqds无选择性地渗透癌细胞和非癌细胞。流式细胞仪分析(图58)显示,与未修饰的laam tc-cqds相比,无nh2基团和cooh基团的laam tc-cqds在hela中的吸收分别降低了46%和48%,并且摄取增加了414%和613%非癌性ccc-esf-1细胞摄取(图5c)。接下来,我们测试了是否在相同α位置上存在羧基和氨基是必不可少的。使用2,6-二氨基蒽醌(2,6-daaq)和ca合成具有相同数量羧基和氨基的2,6-cqds,并对其结构和光学性质进行表征(图59-64和表5)。2,6-cqds的所有羧基和氨基都位于laam tc-cqds中不同的位置。lcsm和流式细胞仪分析表明,改变的羧基和氨基位置导致肿瘤特异性渗透性完全丧失;2,6-cqds以相当的效率渗透hela和ccc-esf-1细胞(图5a-c和图65)。我们评估了是否配对α-羧基和氨基的数量与肿瘤特异性渗透性相关。1,4-cqds和1,5-cqds在与laam tc-cqds相同的条件下合成,而taaq被1,4-二氨基蒽醌(1,4-daaq)或1,5-二氨基蒽醌(1,5-daaq)取代。两种cqds的结构和光学特性都被表征(图59-64和表5)。1,4-cqds在结构上与laam tc-cqds相似,但具有一半的配对组,可保持肿瘤特异性渗透性(图5a)。然而,它们的渗透效率显著降低,仅为laam tc-cqds的61%(图5b、c)。1,5-cqds在结构上也与laam tc-cqds相似并具有相同数量的配对组,以与laam tc-cqds相当的效率渗透hela细胞(图5a-c)。最后,我们确定了laam tc-cqds的骨架结构是否重要。使用phe合成phe-cqds,其在α位置带有成对的α-羧基和氨基,但具有与laam tc-cqds显著不同的骨架,对其结构和光学性质进行表征(图65-69)。对hela和ccc-esf-1细胞的评估发现phe-cqds保持肿瘤特异性渗透性,尽管hela细胞中phe-cqds的摄取是laam tc-cqds的36%(图5a-c和图70)。phe-cqds较低的渗透性可能归因于phe-cqds较差的水溶性,不能很好地分散在溶液中,从而降低了细胞摄取。表5. 1,4-cqds、1,5-cqds和2,6-cqds的一个fl结构单元在基态和激发态下的优
化笛卡尔坐标化笛卡尔坐标
[0209]
总之,我们发现观察到的高度肿瘤特异性并不是laam tc-cqds所独有的,而是一类带有成对的α-羧基和氨基的cqds。似乎α-羧基和氨基的锚定将cqds伪装成大氨基酸,从而触发lat1介导的肿瘤特异性相互作用。我们将带有成对的α-羧基和氨基的cqds指定为“模拟cqds的大型氨基酸”或laam cqds。在结构上,羧基和氨基的位置和数量决定了laam tc-cqds的肿瘤特异性和细胞渗透效率。药物组合物、组合物及其他相关用途
[0210]
本文公开的化合物和cqds可作为用于成像或治疗的药物使用。当这样使用时,它们可以与一种或多种药物学上可接受的载体或辅料混合。
[0211]
因此,本发明提供了一种药物组合物,包括本文所述的化合物、颗粒或cqd(s),与至少一种药物学上可接受的载体或辅料混合。可选的是,该药物组合物包括至少两种药物学上可接受的载体或辅料。用于治疗用途或成像用途的这些化合物的药物组合物的合适辅料和载体是本领域已知的。由于本发明的化合物和cqds通常是水溶性的,它们通常被配制成水溶液/悬浮液,例如,在无菌水中,或含有生理盐水、葡萄糖、乳糖等的等渗水溶液。为了成像的目的,它们通常是经肠外途径给药,并相应地进行配制。
[0212]
在又一方面,本发明提供如上所述的化合物和颗粒用于制造药品的用途。
[0213]
在一方面,本发明提供用于治疗的包含本文所述化合物或cqds的药物组合物。在一些实施例中,治疗中的用途是用于治疗肉瘤、表皮癌、纤维肉瘤、宫颈癌、胃癌、皮肤癌、白血病、淋巴瘤、肺癌、非小细胞肺癌、结肠癌、黑色素瘤、卵巢癌、肾癌、前列腺癌、乳腺癌、肝癌、头颈癌、胰腺癌、膀胱癌、食道癌、舌癌和皮肤恶性黑色素瘤中选择的一种或多种肿瘤或癌症。配方
[0214]
可以制备本发明所述的化合物的任何合适的配方。一般来说,见remington'spharmaceutical sciences,(2000)hoover,j.e.editor,20th edition,lippincott williams and wilkins publishing company,easton,pa.,pages 780-857。选择适合适当给药途径的配方。在化合物的碱性或酸性足以形成稳定的无毒酸或碱盐的情况下,以盐的形式施用化合物可能是合适的。药物学上可接受的盐的实例是与形成生理学上可接受阴离子的酸形成的有机酸加成盐,例如甲苯磺酸盐、甲磺酸盐、乙酸盐、柠檬酸盐、丙二酸盐、酒石酸盐、琥珀酸盐、苯甲酸盐、抗坏血酸盐、α-酮戊二酸盐和α-甘油磷酸盐。也可以形成合适的无机盐,包括盐酸盐、硫酸盐、硝酸盐、碳酸氢盐和碳酸盐。药物学上可接受的盐是用本领域众所周知的标准程序获得的,例如,通过足够碱性的化合物如胺与合适的酸,提供生理学上可接受的阴离子。还制备羧酸的碱金属(例如钠、钾或锂)或碱土金属(例如钙)盐。
[0215]
当考虑的化合物在药物组合物中施用时,考虑的是该化合物可以与药物学上可接受的辅料和/或载体混合配制。例如,所考虑的化合物可以作为中性化合物或药物学上可接受的盐类口服,或在生理盐水中静脉注射。传统的缓冲剂,如磷酸盐、碳酸氢盐或柠檬酸盐可用于此目的。当然,本领域的普通技术人员可以在说明书的教导范围内修改配方,为特定给药途径提供多种配方。特别地,可以对所考虑的化合物进行修饰使其更易溶于水或其他媒介,例如,可以通过本领域普通技术人员的细微修饰(盐制剂、酯化等)轻松实现。修饰特定化合物的给药途径和剂量方案以管理当前化合物的药代动力学,使其对病人产生最大有益效果,也是本领域的普通技术。
[0216]
本领域的普通技术人员可以在说明书的教导范围内修改配方,为特定给药途径提供多种配方。特别地,可对化合物进行修饰使其更易溶于水或其他媒介。修饰特定化合物的给药途径和剂量方案以管理当前化合物的药代动力学,使其对病人产生最大有益效果,也是本领域的普通技术。药物组合
[0217]
本发明实施例的方法包括施用有效量的至少一种本发明公开的示例性化合物;任选地,该化合物可以与一种或多种额外的治疗剂联合施用,特别是通过本发明方法进行治的折磨受试者的病症或疾病的已知可用治疗剂。
[0218]
额外的活性成分可以与本发明的至少一种示例性化合物分开的药物组合物给药,或者可以与本发明的至少一种示例性化合物一起包含在单一药物组合物中。额外的活性成分可以与至少一种本发明的示例性化合物同时、之前或之后给药。使用示例性化合物及其药物组合物的方法
[0219]
为了实施本发明的方法,具有配方的化合物及其药物组合物可以通过口服、肠外、吸入、局部、直肠、鼻腔、口腔、阴道、通过植入的储存器或其他给药方法给药。本文所用的术语“肠外”包括皮下、皮内、静脉内、肌肉内、关节内、动脉内、鞘内、脑内、鞘内和颅内注射或输液技术。
[0220]
当本发明的碳量子点用于对受试者的肿瘤或组织进行成像时,它们通常以肠外给药,并经常通过静脉注射或输液。用于此类给药的合适配方和方法在本领域中是已知的。
[0221]
无菌注射组合物,例如无菌注射水或油性悬浮液,可根据本领域中的已知技术并使用适当的分散剂或润湿剂和悬浮剂(如果需要的话)配制。无菌注射制剂也可以是一个在无毒肠外可接受的稀释剂或溶剂中的无菌注射溶液或悬浮液。本发明的cqds的首选载体是
无菌水,可通过添加适当的缓冲剂和其他辅料来改变。可采用的可接受载体包括甘露醇、水、林格氏溶液和等渗氯化钠溶液。合适的载体和其他药物组合成分通常都是无菌的。
[0222]
此外,无菌固定油通常被用作溶剂或悬浮介质(例如,合成单甘油酯或双甘油酯)。脂肪酸,如油酸及其甘油酯衍生物,在制备注射剂时很有用,药学上可接受的油,如橄榄油或蓖麻油,尤其是其聚氧乙烯形式。这些油类溶液或悬浮液还可以含有长链乙醇稀释剂或分散剂,或羧甲基纤维素或类似的分散剂。常用于制造药物学上可接受的固体、液体或其他剂型的各种乳化剂或生物利用度增强剂也可用于制剂。
[0223]
用于口服的组合物可以是任何口服可接受的剂型,包括但不限于片剂、胶囊、乳化剂和水悬浮剂、分散剂和溶液。在口服用药片的情况下,常用的载体包括乳糖和玉米淀粉。还可以添加润滑剂,如硬脂酸镁。对于口服的胶囊形式,有用的稀释剂包括乳糖和干燥的玉米淀粉。当口服水悬浮液或乳化剂时,活性成分可以与乳化剂或悬浮剂一起悬浮或溶解在油性相中。如果需要,可以添加某些甜味剂、调味剂或着色剂。鼻腔气雾剂或吸入组合物可根据制药配方技术中众所周知的技术来制备,并可在例如生理盐水中制备成溶液,采用适当的防腐剂(例如苯甲醇)、吸收促进剂以提高生物利用度,和/或本领域中已知的其他增溶剂或分散剂。
[0224]
此外,本发明的化合物和组合物可单独或与其他例如抗癌剂的治疗剂联合施用,以治疗可使用本发明的化合物和组合物治疗的各种癌症或肿瘤。本发明的联合疗法包括施用至少一种本发明的示例性化合物和至少一种其他药物学活性成分。本发明的化合物和其他药物学活性成分可以单独或一起施用。活性成分和药物学活性剂的数量以及相对的施用时间将被选择以达到所需的联合治疗效果。例子材料和试剂
[0225]
1,4-二氨基蒽醌(1,4-daaq,90%),1,5-二氨基蒽醌(1,5-daaq,90%)、2,6-二氨基蒽醌(2,6-daaq,90%)、1,4,5,8-四氨基蒽醌(taaq,90%)和柠檬酸(ca,99.8%)均从sigma-aldrich购买。二氯甲烷(99.5%)和甲醇(99.5%)由北京化学试剂有限公司提供。细胞计数试剂盒-8(cck-8)由dojindo实验室(日本)提供。实验中所有使用的水都是通过millipore系统(ulupure,中国成都)净化的。所有balb/c雌性小鼠均购自北京实验动物研究中心,每只小鼠的体重为18-20g。tc-cqds的合成
[0226]
首先将0.04g ca和0.03g taaq在10ml纯水中混合,然后将溶液转移到聚四氟乙烯内衬的反应釜中(25ml)。在180℃的烘箱中加热2小时后,自然冷却至室温,得到蓝色悬浮液。然后用硅胶柱色谱法纯化粗品,使用二氯甲烷和甲醇(10:1)的混合物作为洗脱剂。在除去溶剂并在真空下进一步干燥后,最终可以得到纯化的tc-cqds,产率为25wt%。表征
[0227]
透射电子显微镜图像(tem)是在jeol jem 2100透射电子显微镜(fei)上拍摄。原子力显微镜(afm)图像由multimode v spm(veeco)获得。x射线衍射(xrd)图案是用cu-kα辐射的x射线衍射进行的(xrd,panalytical x'pert pro mpd)。拉曼光谱是用激光共聚焦显微拉曼光谱仪(labram aramis)测量的。x射线光电子能谱(xps)是用vg scientific的escalab 250xi电子能谱仪以300w al kα辐射进行测量的。紫外-可见吸收和荧光光谱分别
在uv-2600分光光度计和perkinelmer-ls55荧光光谱仪上记录。傅里叶变换红外光谱(ft-ir)使用nicolet 380光谱仪测量。
13
c核磁共振谱在400mhz的bruker advance iii光谱仪上以cd3od为溶剂记录,化学位移值以百万分之一为单位。计算方法
[0228]
通过密度函数理论(b3lyp/6-31g(d))的理论计算,得到了cqds的一个荧光结构单元的基态和第一激发态。基态的几何参数在b3lyp/6-31g(d)水平进行了优化和验证,第一激发态的几何参数用td-b3lyp/6-31g(d)进行了优化。
[0229]
细胞培养和材料。除bcscs外的细胞在含有10%胎牛血清(invitrogen)、100unit ml-1
青霉素和100μg ml-1
链霉素(invitrogen)的dmem或rpmi培养基(invitrogen)中在含5%二氧化碳的37℃培养箱中培养。人bcsc的富集和培养如之前所报道
34
。除非另有说明,否则所有化学品均购自sigma-aldrich。lat1抗体购自novus biologicals。
[0230]
cqd的合成。laam tc-cqds通过ca与taaq在水溶液中在180℃下处理2小时合成,得到的laam tc-cqds用硅胶柱色谱法纯化。
[0231]
laam tc-cqds水溶液的光热效应。为了评估在水溶液中的光热效应,将不同浓度(0-10μg/ml)的laam tc-cqds水溶液暴露在650nm激光照射下(0.5w/cm2),照射方向从比色皿的顶部到底部,持续5分钟。在同样的激光照射下以等量的纯水作为对照。实时温度由红外热像仪每30秒记录一次。
[0232]
鉴于其有效的nir吸收特性,研究了tc-cqds水溶液的光热性能。使用红外热像仪在连续激光照射(650nm,0.5w/cm2)下监测不同浓度(0-10μg/ml)的tc-cqds水溶液的温度,如图13a所示。在纯水的对照样品中没有观察到明显的温度升高,而tc-cqds(10μg/ml)可以在短时间(5分钟)的光照射下迅速触发温度升高,并表现出浓度依赖性热疗(42℃以上),导致对肿瘤细胞不可逆损伤
7,8
。为了进一步研究tc-cqds的光热稳定性和转导效率,tc-cqds水溶液(10μg/ml,3ml)被650nm激光(0.5w/cm2)连续照射,直到达到稳态温度,此时停止激光照射,让悬浮液自然冷却。对加热-冷却过程中的温度变化进行5个周期的监测,得出如图13b所示的发热-散热曲线。在每个激光开/关循环期间,温度升高几乎相等为25.6℃,表明tc-cqds与广泛使用的具有表面等离子体共振的有机染料和无机纳米材料相比,具有更好的光热稳定性
3-15
。使用以下方程式计算tc-cqds的光热转换效率(η):
[0233][0234]
其中h是传热系数,s是容器的表面积,t
max
是系统最高温度,t
surr
是周围的环境温度,q
dis
是样本池输入的基线能量,i是入射激光功率和a
650
是tc-cqds在波长为650nm的吸光度。根据图13c,(t
max-t
surr
)是25.6℃,i是0.5w/cm2且a
650
是1.4908。q
dis
表示石英样品池自身吸收的光所散发的热量,使用含有纯水且不含tc-cqds的石英试管单独测量其为37.2mw。因此,只有hs在计算η时是未知的。
[0235]
为了得到hs,引入了无量纲的驱动力温度(θ)和样品系统时间常数τs。
[0236]
[0237][0238]
其中m和c
p
分别是水的质量和热量容量。当θ和τs代入以下的系统的总能量平衡方程(4)时,得到方程(5)。
[0239][0240]
其中q
nc
是ir780/cqds-fa输入的能量,而q
surr
是热量通过空气从系统表面传导出去。
[0241][0242]
在ir780/cqds-fa的水分散系的冷却阶段,关闭光源,且q
nc
+q
dis
=0。
[0243][0244]
t=-τslnθ
ꢀꢀꢀ
(7)
[0245]
因此,通过应用冷却周期(300s后)与驱动力温度负自然对数的线性时间数据,确定系统传热的时间常数为τs=83.86s(图13d)。此外,m是0.3g,c
p
是4.2j/g。因此,根据方程式(3),hs推导出是16.1mw/℃。将hs为16.1mw/℃代入方程式(1),tc-cqds的η可以计算出为77.4%,可与之前报道的光热转化剂(ptca)相媲美,如金钟花(74%)、金纳米笼(64%)、金纳米棒(55%)、多巴胺-黑色素纳米球(40%)、碳点(38.5%)、cu9s5纳米晶体、cu
2-x
se纳米晶体(22%)等
s3-s15
。
[0246]
流式细胞仪。根据我们之前报道的方法
22
对mda-mb-231sp细胞进行分类
22
。简而言之,在大约85%汇合时收获的细胞以1
×
106个细胞/ml的密度重新悬浮在补充有2%胎牛血清(fbs)的rpmi-1640中,并在37℃下用浓度为5μg/ml的hoechst 33342进行孵育。90分钟后,将细胞以1
×
106个细胞/ml浓度悬浮在冷的pbs中,通过40μm的细胞过滤器过滤除去细胞聚集物,用1μg/ml的碘化丙啶(pi)染色,并使用facsdiva(becton dickinson,美国)进行分析和分类。为了表征sp细胞,将新鲜分选的sp细胞悬浮在冷的pbs中,用抗人cd44-fitc和cd24-pe或其适当的同种型对照物在冰上染色30分钟。用冷pbs洗3次细胞,将细胞重新悬浮在400ml冷pbs中,用facscan流式细胞仪(bd,ann arbor,mi)进行分析。为了表征cqds和细胞之间的相互作用,将选定的细胞放在6孔板上,用10μg/ml的laam tc-cqds处理。没有cqds处理的细胞作为对照。12小时后,将细胞用新鲜培养基清洗,胰蛋白酶化,重新悬浮在含0.5%fbs的pbs中,并使用bd facscalibur(bd biosciences,美国)进行分析。用flowjo 7.6进行数据分析。
[0247]
激光共聚焦扫描显微镜成像。为了确定cqds的摄取,将细胞置于玻璃载玻片上,用10μg/ml的laam tc-cqds处理。8小时后,用pbs清洗两次细胞,用4%多聚甲醛在室温下固定30分钟,然后加入dapi进行细胞核染色。最后,将载玻片清洗三次,固定,用盖玻片密封,用激光共聚焦扫描显微镜(leica tcs-sp8,德国)进行成像,其中激发/发射为:561/700。为了确定leu、phe、gly或bch对cqds摄取的影响,放置hela细胞并用leu、phe、gly或bch处理。4小
时后,将laam tc-cqds加入细胞中。再过8小时后,对细胞进行清洗、固定,并进行成像。
[0248]
laam tc-cqds的pa成像。将不同浓度(0、2、4、6、8和10μg/ml)的laam tc-cqds加入琼脂糖管中(37℃),并使用pa成像仪进行扫描(模式:itheramedical co.most in vision 128;激发波长范围为640-840nm,间隔5nm)。记录pa信号。
[0249]
细胞毒性试验。将细胞以每孔1
×
104个细胞的密度放入96孔板中,用不同浓度的laam tc-cqds、tptc、或tptc/tc-cqds处理。12小时后,去除培养基,并用pbs清洗。在每个孔中加入100μl含有10μl cck-8(sigma)的新鲜培养基。在37℃下培养2小时后,用酶标仪测量450nm处的吸光度。
[0250]
laam tc-cqds在体内的nir fl成像。雌性balb/c裸鼠保持在无菌环境中并用于laam tc-cqds的体内成像。该项目得到了北京师范大学动物使用委员会和耶鲁大学iacuc的批准。为了建立hela肿瘤的荷瘤小鼠,我们准备了2
×
106个hela细胞并皮下接种到雌性balb/c小鼠体内。当肿瘤体积达到约~100mm3,laam tc-cqds(5mg/kg)被静脉注射到小鼠体内。使用动物光学成像系统(ivis lumina iii,caliper life sciences)在1、2、4、6、8和10小时采集ntr fl图像。
[0251]
laam tc-cqds在体内的pa成像。在静脉注射laam tc-cqds之前,获得激发波长为640至840nm的预对比数据。用剂量为5mg/kg的laam tc-cqds处理荷瘤小鼠。在注射后2、4、6、8和10小时获得对比后数据。通过改良的反投影算法,使用每个视图的所有128个传感器获得的数据重建pa图像。
[0252]
在荷瘤小鼠中的治疗评价。将hela细胞皮下接种到雌性balb/c小鼠体内。当肿瘤体积达到约100mm3时,对小鼠静脉注射生理盐水、tptc或tptc/tc-cqds(n=5)。每天监测肿瘤体积和体重的变化。肿瘤的体积是根据以下公式计算的:v=d
×
d2/2(其中d和d分别是用游标卡尺测量的肿瘤的最长和最短直径)。相对肿瘤体积按v/v0计算(v0是开始治疗时的初始肿瘤体积)。
[0253]
在小鼠中的毒性评价。对雌性balb/c小鼠静脉注射tptc(10mg/kg,每只小鼠0.05ml)或tptc/tc-cqds(10mg/kg tptc,每只小鼠0.05ml)(n=5)。用生理盐水处理的小鼠作为对照。在选定的时间点,将血样样品收集在肝素化微量红细胞压积管中,并以3000rpm的速度离心10分钟。在研究结束时,小鼠被安乐死。切除主要器官固定在福尔马林中并进行分析,包括心脏、肝脏、脾脏、肾脏和肺。
[0254]
tptc/laam tc-cqds用于治疗hela肿瘤。通过laam tc-cqds递送明显增强了tptc对hela细胞的毒性,但降低了其对非癌细胞的毒性(见图71a)。在相当于5μg/ml tptc的浓度下,tptc/laam tc-cqds杀死了所有hela细胞,但对非癌性ccc-esf-1细胞没有表现出毒性。我们确定了tptc/laam tc-cqds在hela肿瘤的荷瘤小鼠中的药代动力学。为了比较,使用hspc:胆固醇:peg 2000-dspe(摩尔比56:39:5)合成了负载tptc的脂质体,指定为tptc/脂质体。同样的脂质成分被用于几个fda批准的脂质体配方,包括。静脉注射剂量相当于2mg/kg tptc的tptc/laam tc-cqds和对照组的游离tptc或tptc/脂质体。在不同的时间点收集血液。通过高效液相色谱法(hplc)对血浆中的tptc进行定量。如图71b,通过laam tc-cqds的递送明显增强了tptc的血液循环时间和生物利用度,tptc的半衰期从5.4分钟增加到40.1分钟,曲线下面积(auc)从13.4增加到138.1。相比之下,tptc/脂质体的半衰期和auc分别为11.8分钟和55.1(图71b)。
[0255]
接下来,我们在接受同样治疗的第二组小鼠中检查了tptc的生物分布。正如预期的那样,游离的tptc在体内广泛分布,没有特异性。相比之下,tptc/laam tc-cqds表现出与laam tc-cqds类似的动力学特性。到8小时后,tptc只能在肿瘤中被检测到。基于tptc的fl强度的量化显示,通过laam tc-cqds递送的tptc在肿瘤中的浓度增加了16.7倍,同时明显减少了tptc在其他器官的积累。在肿瘤中积累的laam tc-cqds的数量占总注射剂量的15.3%。相比之下,在肝脏中发现了大量的tptc/脂质体。脂质体递送使肿瘤中的tptc浓度增加了6.7倍(图71c)。
[0256]
我们还评估了tptc/laam tc-cqds对hela肿瘤的治疗。当肿瘤体积达到约100mm3时,小鼠被随机分组,并在第1、4、8和12天接受生理盐水、tptc(2mg/kg)、tptc/脂质体或tptc/laam tc-cqds(均为相当于2mg/kg tptc的剂量)的静脉注射。15天后,接受tptc/laam tc-cqds治疗的小鼠的肿瘤缩小到无法检测的水平。相反,接受游离tptc或tptc/脂质体治疗的小鼠肿瘤持续增长,尽管其速度慢于对照组小鼠(图71d)。所有用tptc/laam tc-cqds治疗的小鼠都存活了50天以上。然而,用生理盐水、tptc和tptc/脂质体处理的小鼠的中位生存期分别限于25、30和35天。
[0257]
我们使用a549肿瘤重复了特征研究。实验按照上述相同的程序进行。与hela肿瘤中的研究结果类似,我们发现通过laam tc-cqds的递送明显增强了tptc对a549细胞的毒性(图71e),使tptc在血液循环中的半衰期和auc分别增加5.5倍(半衰期从5.9分钟到32.5分钟)和13.9倍(auc从15.9到221.5)(图71f)。它还使tptc在肿瘤中的积累增加了10.3倍,同时减少了tptc在其他器官中的积累(图71h),并明显地抑制了肿瘤的增长,延长了荷瘤小鼠的生存期(图71h)。肿瘤的总体递送效率为15.8%。一致的是,用tptc/脂质体治疗未能达到与加入laam tc-cqds所达到的抑制作用或治疗效果相当的程度(图71f-h)。
[0258]
表征laam tc-cqds在癌症成像中的稳定性。肿瘤微环境是酸性的(ph值在6.2至6.9之间),并且由于如蛋白酶和氨基酸
28,29
等各种分子的存在,而进一步复杂化。因此,我们表征了laam tc-cqds在ph值为6-8、有氨基酸或基质金属蛋白酶-2(mmp-2)存在的情况下的fl稳定性。我们发现,laam tc-cqds的fl发射光谱在所有测试条件下都保持不变(图72)。接下来,我们表征了laam tc-cqds在长时间储存或辐照后的光稳定性。图75和76中的结果显示,所有的测试条件,包括在室温下储存3个月,用500w氙灯连续照射12小时,以及在365nm下连续紫外线照射5小时,都没有明显改变fl发射光谱。最后,我们评估了在血清中长时间孵育对laam tc-cqds的尺寸和fl发射的影响。我们发现,laam tc-cqds的直径和fl发射强度在血清中培养30天后没有变化(图75)。统计分析
[0259]
所有数据均以一式三份收集,并以平均值和标准偏差报告。两个条件的比较用非配对t检验评估。进行单因素方差分析以确定与生存率相关的治疗的统计学意义。p《0.05(*),0.01(**),和0.0001(****)被认为是显著的。
[0260]
上文的详细描述是为了帮助本领域的技术人员实施本发明而提供的。然而,本发明所描述和权利要求的发明在范围上不受本发明所公开的具体实施例的限制,因为这些实施例旨在说明本发明的几个方面。任何等同的实施例都是为了在本发明的范围内。事实上,除了本文所示和描述的那些,本发明的各种修改对于本领域的技术人员来说将上述描述变得显而易见,这些修改并没有偏离本发明的精神或范围。这样的修改也是为了属于所附权
利要求的范围。
[0261]
本技术中引用的所有出版物、专利、专利申请和其他参考文献在所有目的上均以引用的方式全部并入本技术,其程度如同每个单独的出版物、专利、专利申请或其他参考文献明确且单独地表示为所有目的的通过引用将其全部合并。在此引用参考文献不应解释为承认其为本发明的现有技术。参考文献:1siegel,r.l.,miller,k.d.&jemal,a.cancer statistics,2016.ca cancer j clin 66,7-30,doi:10.3322/caac.21332(2016).2kim,s.m.,faix,p.h.&schnitzer,j.e.overcoming key biological barriers to cancer drug delivery and efficacy.journal of controlled release:official journal of the controlled release society 267,15-30,doi:10.1016/j.jconrel.2017.09.016(2017).3tringale,k.r.,pang,j.&nguyen,q.t.image-guided surgery in cancer:astrategy to reduce incidence of positive surgical margins.wiley interdiscip rev syst biol med,doi:10.1002/wsbm.1412(2018).4wilhelm,s.et al.analysis of nanoparticle delivery to tumours.nature reviews materials 1,12(2016).5park,k.facing the truth about nanotechnology in drug delivery.acs nano 7,7442-7447,doi:10.1021/nn404501g(2013).6zhou,j.,atsina,k.b.,himes,b.t.,strohbehn,g.w.&saltzman,w.m.novel delivery strategies for glioblastoma.cancer j 18,89-99,doi:10.1097/ppo.0b013e318244d8ae(2012).7deeken,j.f.&loscher,w.the blood-brain barrier and cancer:transporters,treatment,and trojan horses.clinical cancer research:an official journal of the american association for cancer research 13,1663-1674,doi:10.1158/1078-0432.ccr-06-2854(2007).8nakanishi,t.&tamai,i.solute carrier transporters as targets for drug delivery and pharmacological intervention for chemotherapy.j pharm sci 100,3731-3750,doi:10.1002/jps.22576(2011).9liu,r.et al.glut1-mediated selective tumor targeting with fluorine containing platinum(ii)glycoconjugates.oncotarget 8,39476-39496,doi:10.18632/oncotarget.17073(2017).10jin,s.e.,jin,h.e.&hong,s.s.targeting l-type amino acid transporter 1 for anticancer therapy:clinical impact from diagnostics to therapeutics.expert opinion on therapeutic targets 19,1319-1337,doi:10.1517/14728222.2015.1044975(2015).11bodoy,s.,fotiadis,d.,stoeger,c.,kanai,y.&palacin,m.the small slc43 family:facilitator system l amino acid transporters and the orphan eeg1.mol aspects med 34,638-645,doi:10.1016/j.mam.2012.12.006(2013).
nanoshells.acs nano 8,6372-6381(2014).[s6]cole,j.r.et al.photothermal efficiencies of nanoshells and nanorods for clinical therapeutic applications.j.phys.chem.c 113,12090-12094(2009).[s7]santos,g.m.,zhao,f.,zeng,j.&shih,w.-c.characterization of nanoporous gold disks for photothermal light harvesting and light-gated molecular release.nanoscale 6,5718-5724(2014).[s8]chen,h.et al.understanding the photothermal conversion efficiency of gold nanocrystals.small 6,2272-2280(2010).[s9]pattani,v.p.&tunnell,j.w.nanoparticle-mediated photothermal therapy:a comparative study of heating for different particle types.lasers surg.med.44,675-684(2012).[s10]liu,y.et al.dopamine-melanin colloidal nanospheres:an efficient near-infrared photothermal therapeutic agent for in vivo cancer therapy.adv.mater.25,1353-1359(2012).[s11]ge,j.et al.red-emissive carbon dots for fluorescent,photoacoustic,and thermal theranostics in living mice.adv.mater.27,4169-4177(2015).[s12]vankayala,r.et al.gold nanoshells-mediated bimodal photodynamic and photothermal cancer treatment using ultra-low doses of near infra-red light.biomaterials 35,5527-5538(2014).[s13]tian,q.et al.hydrophilic cu9s
5 nanocrystals:a photothermal agent with a 25.7%heat conversion efficiency for photothermal ablation of cancer cells in vivo.acs nano 5,9761-9771(2011).[s14]hessel,c.m.et al.copper selenide nanocrystals for photothermal therapy.nano lett.11,2560-2566(2011).[s15]tian,q.et al.sub-10 nm fe3o4@cu
(2-x)
s core-shell nanoparticles for dual-modal imaging and photothermal therapy.j.am.chem.soc.135,8571-8577(2013).[s16]roper,d.k.,ahn,w.&hoepfner,m.microscale heat transfer transduced by surface plasmon resonant gold nanoparticles.j.phys.chem.c 111,3636-3641(2007).gillies,r.j.the tumour microenvironment:causes and consequences of hypoxia and acidity.introduction.novartis found symp 240,1-6(2001).vaupel,p.,kallinowski,f.&okunieff,p.blood-flow,oxygen and nutrient supply,and metabolic microenvironment of human-tumors-a review.cancer research 49,6449-6465(1989).bulbake,u.,doppalapudi,s.,kommineni,n.&khan,w.liposomal formulations in clinical use:an updated review.pharmaceutics 9,1-33,doi:unsp
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1