一种非对称双酯基取代苯并菲类盘状液晶及其合成方法与应用
1.本发明涉及含盘状液晶基团的高分子化合物及其制备的技术领域,具体涉及一种非对称双酯基取代苯并菲类盘状液晶及其合成方法与应用。
背景技术:
2.1977年印度科学家chandrasekhar首次合成发现了盘状液晶材料,而后,诸多盘状液晶材料如雨后春笋般涌现出来:譬如卟啉、酞菁、六苯并蔻、苯并菲等等及其衍生物。盘状液晶一般具有如下结构与性能:由一个大的芳香硬核桥接若干柔性脂肪链形成硬的内核和软的外层结构,其可以通过芳香硬核之间的π-π堆叠自组装形成柱状相或者近晶相,该结构有利于提高载流子传输速率,从而成为优秀的电荷传输材料潜在候选者。
3.苯并菲作为盘状液晶材料是1978年首次合成,其优异的光电导性能于1994年被d.haarer等人在 nature上首次报道。其后,由于其成本低廉、纯化简易、相态结构丰富、在电极间易于自发有序排列、热学稳定性良好和电荷传输性能优秀等特点作为光电子材料在光电器件例如oled、opc、tft以及solar cell 中展示出了广泛的应用前景。
4.当前,国内外关于苯并菲类液晶的种类相对较少,且大都采用了较为复杂的制备工艺,因此获得具有优异性能的苯并菲类盘状液晶材料及其简便高效的制备方法,已经成为了该领域发展的迫切需要。而现有的苯并菲类液晶的柱状相仅在较高温度下才能稳定存在,在室温下趋于多晶。而多晶材料中晶界处广泛存在的缺陷会捕获大量的电荷载流子,使得其不存在光电导,进而严重阻碍其实际应用。
技术实现要素:
5.本发明的目的在于提供一种非对称双酯基取代的新型苯并菲类盘状液晶及其合成方法,可用作光电元件的电荷传输有机薄膜材料以及oled显示屏功能层的载流子传输材料。
6.为了实现上述发明目的,本发明采用以下技术方案:
7.一种非对称双酯基取代苯并菲类盘状液晶,其特征在于具有如图15所示的化学结构:
8.有通式(i)、(ii)、(iii)或(iv)所示的化学结构:
9.通式(i)的非对称双酯基取代苯并菲类盘状液晶的双酯取代基在2、3位;
10.通式(ii)的非对称双酯基取代苯并菲类盘状液晶的双酯取代基在2、6位;
11.通式(iii)的非对称双酯基取代苯并菲类盘状液晶的双酯取代基在2、7位;
12.通式(iv)的非对称双酯基取代苯并菲类盘状液晶的双酯取代基在3、6位;
13.上述通式(i)、(ii)、(iii)和(iv)中,n=3-12,代表碳原子数在3-12的烷基链,r代表的是烷基链或环状刚性基团。
14.在本发明一实施例中,所述r代表的烷基链为饱和脂肪烃基。优选的,所述饱和脂
肪烃基可以为具有 1至11个碳原子的直链烷烃或支链烷烃。进一步,直链烷烃优选甲烷、乙烷、丙烷、丁烷、戊烷、己烷或庚烷;支链烷烃优选新戊烷。
15.在本发明另一实施例中,所述环状刚性基团为脂环烃基。优选的,所述脂环烃基可以为具有3至8 个碳原子的单环烃基。所述单环烃基为环烷烃或环烯烃或环炔烃,进一步,环烷烃优选环丙烷、环丁烷、环戊烷、环己烷、环庚烷或环辛烷。
16.优选的,所述脂环烃基也可以为双环或多环烃基。多环烃基优选金刚烷。
17.在本发明另一实施例中,所述环状刚性基团为杂环化合物基团。所述杂环化合物基团包括o、n、s原子中的一种或多种。进一步,杂环化合物优选为五元杂环和六元杂环化合物。五元杂环化合物优选为呋喃、噻吩、吡咯。六元杂环化合物优选为吡啶、吡喃。
18.本发明中非对称双酯基取代苯并菲类盘状液晶的合成步骤,具体如下:
19.在氮气的保护下,向装有球形冷凝管、磁力搅拌棒的三口烧瓶中加入加入2,3或2,6或2,7或3,6
‑ꢀ
双羟基四烷氧基苯并菲化合物18.43g,无水二氯甲烷10~30ml,0.1~5wt%摩尔量的二环己基碳二亚胺和0.5~6倍摩尔量的4-二甲基氨基吡啶,磁力搅拌20~60分钟后,缓慢将1-8倍摩尔量的烷基或刚性基团羧酸化合物注入三口烧瓶中,并立即放入45℃~60℃的油浴锅中,反应12~48h;待反应完全后,将混合物减压过滤,除去n,n-二环己基脲,旋蒸除溶剂,最后通过柱层析提纯,乙醇重结晶,得到产物,该步骤中的所述摩尔量以双羟基四烷氧基苯并菲化合物为基准。
20.进一步,上述步骤中的2,3-双羟基-6,7,10,11-四烷氧基苯并菲、2,6-双羟基-3,7,10,11-四烷氧基苯并菲、2,7-双羟基-3,6,10,11-四烷氧基苯并菲和3,6-双羟基-2,7,10,11-四烷氧基苯并菲化合物的制备方法可以参考文献(liquid crystals.vol.41.no.8.(2014)1173-1178.journal of materials chemistryc.vol.7.no.45.(2019)12463-12469.polymer chemistry.vol.7.no.17.(2016)3013-3025.)制得。
21.进一步,非对称双酯基取代苯并菲类盘状液晶产率为76.6%~90%。
22.本发明提供了一种新型的非对称双酯基取代苯并菲类盘状液晶,该苯并菲盘状液晶产物的合成方法简单,易制成,产率高,污染小;且引入的不对称酯极性刚性基团,不仅可以提升液晶清凉点,拓宽液晶相变区间,而且可以抑制结晶使柱状相稳定保持至室温,从而使材料在室温亦具有光导特性;使得化合物能够在室温同时具有优异的液晶性能、成膜性能、电荷及载流子传输性能,可作为有机薄膜应用于晶体管、有机太阳能电池等光电器件的电荷传输上,以及可作为oled显示屏功能层上载流子传输材料,广泛应用于光电领域。
附图说明
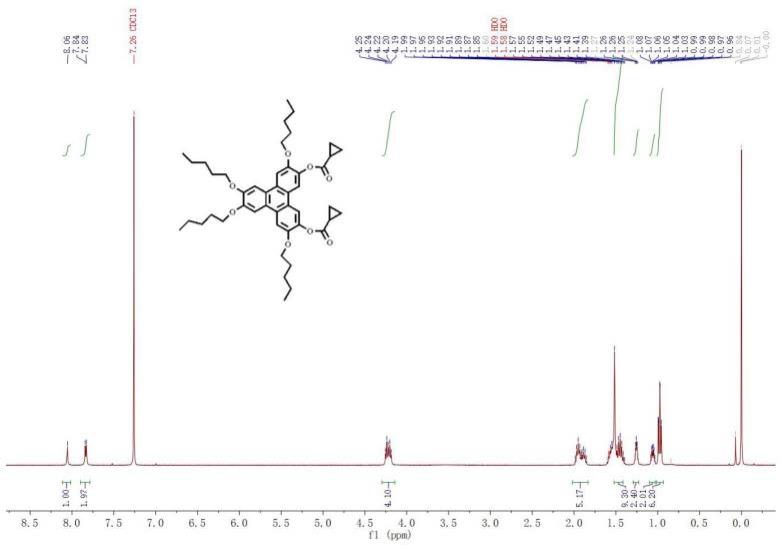
23.图1~图6分别为本发明实施例t5c36-c3、t5c36-c4、t5c36-c5、t5c36-c6、t5f36、t5a36的核磁共振氢谱图;
24.图7~图12分别为本发明实施例t5c36-c3、t5c36-c4、t5c36-c5、t5c36-c6、t5f36、t5a36的dsc 图和x射线衍射图。
25.图13为非对称双酯基取代苯并菲类盘状液晶及化合物具体反应过程。
26.图14为非对称双酯刚性基团取代苯并菲采用渡越时间法(tof)进行载流子迁移率进行测试表。
27.图15为非对称双酯基取代苯并菲类盘状液晶(i)、(ii)、(iii)和(iv)四种结构。
具体实施方式
28.下面给出实施例以对本发明进行具体描述,有必要在此指出的是以下实施例只用于对本发明进行进一步说明,不能理解为对本发明保护范围的限制,本领域技术人员根据本发明的内容对本发明作出一些非本质的改进和调整仍属于本发明的保护范围。且本发明实施例中的原材料,如无特殊合成说明,均可通过常规的商业途径购得或参考文献(liquid crystals.vol.41.no.8.(2014)1173-1178.journal of materialschemistry c.vol.7.no.45.(2019)12463-12469.polymer chemistry.vol.7.no.17.(2016)3013-3025.) 合成制得。
29.下面所述实施方法为具体化合物的实施方法,基于前面对2、3位,2、6位,2、7位和3、6位-非对称双酯基取代苯并菲类盘状液晶合成方法的说明,现具体以上述通式中n=5的戊烷为例,对几种3、6 位-非对称双酯基取代苯并菲类盘状液晶及化合物性能进行详细说明。
30.具体反应过程如图13。
31.t代表苯并菲,5代表侧链是戊醚,c36代表酯基取代位在3,6位,-m代表不同碳原子数,-t5是新戊烷,-c3是环丙烷,-c4是环丁烷,以此类推,f和a分别代表呋喃和金刚烷。
32.具体反应步骤和条件如下:
33.第一步:4,4'-二戊醚基联苯的合成
34.将无水碳酸钾55.3g,联苯二酚37.2g、100ml丙酮,100ml乙醇,依次加入装入带有球形冷凝管和机械搅拌器的500ml三口烧瓶中,并在最后加入催化剂十六烷基三甲基溴化铵和碘化钾。升温至70℃搅拌 30min,加入溴代正戊烷90.6g,升温至80℃继续回流24h,薄板层析检测反应。待反应完全,将混合物倒入布氏漏斗进行减压过滤,冲洗滤饼,旋蒸,乙醇重结晶,获得白色片状固体为60.6g,产率93%。
35.第二步:3,3'-二碘-4,4'-二戊醚基联苯的合成
36.将化合物(1)32.6g、单质碘25.4g、100ml三氯甲烷、冰乙酸100g、碘酸17.59g、100ml去离子水和浓硫酸(98%,3.8g)依次加入带有机械搅拌器和球形冷凝管的三口烧瓶中。置于110℃左右的油浴加热24h,薄板层析检测反应。待反应完全后,将混合物倒入饱和的亚硫酸钠溶液洗涤3次,去离子水洗涤1次。然后用三氯甲烷进行萃取,放入无水硫酸镁进行干燥。用乙醇重结晶,得到白色针状固体55.5g,产率为96%。
37.第三步:3,3'-双羟基-4,4'-二戊醚基联苯的合成
38.在氮气保护下,将化合物(2)29g、240ml聚乙二醇400、60ml去离子水和氢氧化钾固体33.6g,依次加入带有机械搅拌器、球形冷凝管、三口烧瓶的反应装置中。经机械搅拌0.5h后,加入碘化亚铜28.6g,再将反应升温140℃,继续搅拌36h,薄板层析检测反应。待反应结束后,将三口烧瓶内的混合物倒入烧杯中冷却至室温。通过稀硫酸(1mol/l)酸化,使反应混合物的ph=2-3,后用乙酸乙酯萃取,无水硫酸镁除水,旋蒸除溶剂。而后短柱子柱层析除去聚乙二醇,再用长柱子柱层析,分离出目的产物,得白色片状固体5.5g,产率为31%。
39.第四步:3,3'-二异丙基-4,4'二戊醚基联苯的合成
40.在氮气环境下,将化合物(3)35.8g、碳酸钾55.3g、200ml丙酮、微量的催化剂十六烷基三甲基溴化铵和碘化钾依次加入装有机械搅拌器、球形冷凝管及500ml三口烧瓶的反应装置中。将温度升至60℃回流1h,然后加入2-溴丙烷37g,升温至回流24h,薄板层析检测
反应。待原料反应完后,将三口烧瓶内的混合物倒入布氏漏斗进行减压过滤、二氯甲烷冲洗滤饼,旋蒸除去多余溶剂。最后通过乙醇重结晶,得到白色片状固体为36.14g,产率82.1%。
41.第五步:3,6-双羟基2,7,10,11四戊氧基苯并菲的合成
42.将化合物(4)22.12g、邻苯二戊醚1~4倍摩尔量和150~300ml除水二氯甲烷依次加入到三口烧瓶中。对反应装置进行三次换气操作排除装置中的空气。在磁力搅拌下,缓慢加入无水三氯化铁3~6倍摩尔量,室温搅拌2~8h,薄板层析检测反应。待原料反应完全后,将三口烧瓶内的底物倒入冰甲醇中,析出浅黄色固体,减压过滤,乙醇冲洗滤饼。最后通过柱层析纯化,旋蒸除去多余溶剂,乙醇重结晶,得到白色固体。该制备方法中的所述摩尔量以3,3'-二异丙基-4,4'二烷氧基联苯为基准。
43.第六步:3,6位-非对称双酯刚性基团取代苯并菲类盘状液晶的合成
44.在氮气的保护下,向装有球形冷凝管、磁力搅拌棒的50ml三口烧瓶中加入步骤(5)所得化合物18.43g,无水二氯甲烷10~30ml,0.1~5wt%摩尔量催化剂量的二环己基碳二亚胺和0.5~6倍摩尔量的4-二甲基氨基吡啶。磁力搅拌30分钟后,用注射器缓慢将对应的1~8倍摩尔量的刚性基团化合物注入三口烧瓶中,并立即放入45℃~60℃的油浴锅中,反应12~48h,薄板色谱检测反应。待反应完全后,将混合物倒入布氏漏斗中减压过滤,除去n,n-二环己基脲,旋蒸除溶剂。最后通过柱层析提纯,乙醇重结晶,得到产物。该步骤中的所述摩尔量以3,6-双羟基2,7,10,11四烷氧基苯并菲化合物为基准。
45.对所得化合物进行红外光谱分析和核磁氢谱共振分析(附图1-6),得到如下数据:
46.其中,t5c36-m(1-7)和t5c36-t5采用烷基羧酸与3,6-双羟基2,7,10,11四戊氧基苯并菲制备而成:
47.t5c36-1 1
h-nmr(300mhz,cdcl3):δ8.10(s,2h),7.91(s,4h),4.27-4.33(m,8h),2.46(s,6h,), 1.97-2.03(m,8h),1.51-1.64(m,16h),1.03-1.07(m,12h).ft-ir(kbr,cm-1
):1755(c=o).
48.t5c36-2 1
h-nmr(300mhz,cdcl3):δ8.04(s,2h),7.84-7.85(d,4h),4.12-4.27(m,8h), 2.65-2.72(dd,4h),1.86-1.98(m,8h),1.32-1.52(m,22h),0.94-1.00(t,12h).ft-ir(kbr,cm-1
): 1753(c=o).
49.t5c36-3 1
h-nmr(300mhz,cdcl3):δ7.96-8.02(d,2h),7.83-7.85(d,4h),4.19-4.27(m,8h), 2.62-2.67(t,4h),1.81-2.01(m,12h),1.26-1.62(m,16h),1.10-1.15(t,6h),0.95-1.01(m,12h,). ft-ir(kbr,cm-1
):1749(c=o).
50.t5c36-4 1
h-nmr(300mhz,cdcl3):δ8.03(s,2h),7.84-7.85(d,4h),4.19-4.27(m,8h), 2.64-2.69(t,4h),1.78-2.01(m,12h),1.43-1.52(m,20h),0.89-1.04(m,18h).ft-ir(kbr,cm-1
): 1747(c=o).
51.t5c36-5 1
h-nmr(300mhz,cdcl3):δ8.06(s,2h),7.82-8.00(m,4h),4.18-4.26(m,8h), 2.62-2.67(t,4h),1.79-2.00(m,12h),1.44-1.62(m,24h),0.94-1.00(m,18h).ft-ir(kbr,cm-1
): 1747(c=o).
52.t5c36-6 1
h-nmr(300mhz,cdcl3):δ7.99(s,2h),7.81-7.94(dd,4h),4.18-4.26(m,8h), 2.62-2.67(t,4h),1.81-2.00(m,12h),1.37-1.78(m,28h),0.91-1.00(m,18h).ft-ir(kbr,cm-1
): 1749(c=o).
53.t5c36-7 1
h-nmr(300mhz,cdcl3):δ8.01(s,2h),7.83-7.85(d,4h),4.19-4.27(m,8h), 2.63-2.68(t,4h),1.79-2.01(m,12h),1.36-1.63(m,32h),0.90-1.01(m,18h).ft-ir(kbr,cm-1
): 1747(c=o).
54.t5c36-t5 1
h-nmr(300mhz,cdcl3),δ8.04-7.85(m,6h),4.25-4.23(m,8h),2.40(s,6h) 1.97-1.90(m,8h),1.54-1.46(m,16h),0.99(m,12h).ft-ir(kbr,cm-1
):1749(c=o).
55.t5c36-c3采用环丙烷羧酸与3,6-双羟基2,7,10,11四戊氧基苯并菲制备而成,终产率为90%,红外和核磁氢谱数据(附图1)如下:
56.ft-ir(cm-1
):2962,2936,2868,1745,1521,1267,1170。
[0057]1h-nmr(400mhz,chloroform-d)δ8.06(s,2h),7.84(d,j=6.1hz,4h),4.22(dt,j=3.4,6.4hz,8h), 1.99
–
1.84(m,10h),1.44(dq,j=14.7,7.5hz,14h),1.25(s,10h),0.97(dd,j=7.7,6.6hz,12h)。
[0058]
t5c36-c4采用环丁烷羧酸与3,6-双羟基2,7,10,11四戊氧基苯并菲制备而成,终产率为87.8%,红外和核磁氢谱数据(附图2)如下:对产物进行红外光谱分析和核磁氢谱共振分析,得到如下数据:
[0059]
ft-ir(cm-1
):2961,2932,2866,1742,1521,1268,1143。
[0060]1h-nmr(400mhz,chloroform-d)δ8.02(s,2h),7.84(d,j=9.3hz,4h),4.22(dt,j=16.4,6.4hz,8h), 3.56
–
3.40(m,2h),2.67
–
2.30(m,8h),2.19
–
1.82(m,12h),1.56
–
1.37(m,16h),0.97(q,j=7.2hz, 12h)。
[0061]
t5c36-c5采用环戊烷羧酸与3,6-双羟基2,7,10,11四戊氧基苯并苯制备而成,终产率为86.3%,红外和核磁氢谱数据(附图3)如下:
[0062]
ft-ir(cm-1
):2960,2937,2874,1743,1520,1269,1141。
[0063]1h-nmr(400mhz,chloroform-d)δ8.03(s,2h),7.83(d,j=12.1hz,4h),4.22(dt,j=18.4,6.5hz,8h), 3.10(p,j=8.0hz,2h),2.09(ddd,j=7.5,4.9,2.5hz,8h),1.95(dd,j=8.3,6.5hz,4h),1.91
–
1.76(m,8h), 1.73
–
1.61(m,4h),1.53
–
1.35(m,16h),0.97(td,j=7.2,6.1hz,12h)。
[0064]
t5c36-c6采用环巳烷羧酸与3,6-双羟基2,7,10,11四戊氧基苯并苯制备而成,终产率为85%,红外和核磁氢谱数据(附图4)如下:
[0065]
ft-ir(cm-1
):2962,2936,2858,1743,1521,1268,1035。
[0066]1h-nmr(400mhz,chloroform-d)δ7.93(s,2h),7.76(d,j=12.6hz,4h),4.16(dd,j=16.3,9.6hz,8h), 2.60(tt,j=11.1,3.7hz,2h),2.12
–
2.05(m,4h),1.89(q,j=7.1hz,4h),1.84
–
1.75(m,10h),1.69
–
1.58 (m,6h),1.55
–
1.22(m,20h),0.95
–
0.88(m,12h)。
[0067]
t5f36(呋喃)采用呋喃甲酸与3,6-双羟基2,7,10,11四戊氧基苯并苯制备而成,终产率为81.2%,红外和核磁氢谱数据(附图5)如下:
[0068]
ft-ir(cm-1
):2960,2938,2866,1745,1519,1268,1174。
[0069]1h-nmr(400mhz,chloroform-d)δ8.17(s,2h),7.88(d,j=8.3hz,4h),7.44(dd,j=3.5,0.9hz,2h),6.62 (dd,j=3.5,1.8hz,2h),4.24(dt,j=11.9,6.4hz,8h),1.89(dt,j=59.4,7.3hz,8h),1.52
–
1.32(m,16h), 0.92(dt,j=49.7,7.2hz,12h)。
[0070]
t5a36(金刚烷)采用1-金刚烷甲酸与2-羟基-3,6,7,10,11-五戊氧基苯并苯制备而成,终产率为76.6%,红外和核磁氢谱数据(附图6)如下:
[0071]
ft-ir(cm-1
):2955,2910,2860,1740,1520,1270,1060。
[0072]1h-nmr(400mhz,chloroform-d)δ7.99(s,2h),7.82(d,j=18.6hz,4h),4.21(dt,j=23.5,6.4hz,8h), 2.22
–
2.07(m,18h),2.00
–
1.78(m,20h),1.57
–
1.37(m,16h),0.97(td,j=7.2,4.3hz,12h)。
[0073]
其他2、3位,2、6位,2、7位的非对称双酯基取代苯并菲类盘状液晶,首先参照文献(liquidcrystals.vol.41.no.8.(2014)1173-1178.journal of materials chemistry c. vol.7.no.45.(2019)12463-12469.polymer chemistry.vol.7.no.17.(2016)3013-3025.)制备对应不同双取代位的双羟基四烷基氧基苯并菲,然后按照如上步骤即可制得对应非对称双酯基取代苯并菲类盘状液晶。
[0074]
另外,图7~图12分别示出了t5c36-c3、t5c36-c4、t5c36-c5、t5c36-c6、t5f36、t5a36这6种3,6 位-非对称双酯刚性基团取代苯并菲的dsc和x射线衍射测试数据。通过dsc数据可以看出,所有化合物的液晶相均可以在室温下保持。进一步x-射线衍射测试表明其为有序六方柱状相,有利于实现较高的室温载流子迁移率。
[0075]
对上述6种t5c36-c3、t5c36-c4、t5c36-c5、t5c36-c6、t5f36、t5a36这6种3,6位-非对称双酯刚性基团取代苯并菲采用渡越时间法(tof)进行载流子迁移率进行测试,具体如图14:
[0076]
本发明中的苯并菲盘状液晶产物的合成方法简单,易制成,产率高,污染小;且引入的不对称酯极性刚性基团,不仅可以提升液晶清凉点,拓宽液晶相变区间,而且可以抑制结晶使柱状相稳定保持至室温,从而使材料在室温亦具有光导特性;使得化合物能够在室温同时具有优异的液晶性能、成膜性能、电荷及载流子传输性能,可作为有机薄膜应用于晶体管、有机太阳能电池等光电器件的电荷传输上,以及可作为 oled显示屏功能层上载流子传输材料,广泛应用于光电领域。
[0077]
以上对本发明所提供的非对称双酯基取代苯并菲类盘状液晶及其合成方法与应用进行了详细介绍,本文中应用了具体个例对本发明的原理及实施方案进行了阐述,以上实施例的说明只是用于帮助理解本发明的原理及其核心思想;同时,对于本领的一般技术人员,依据本发明的思想,在具体实施方式及应用范围上均会有改变之处,综上所述,本说明书内容不应理解为对本发明的限制。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1