一种膜状多层量子点荧光材料、其制备方法及免疫层析应用与流程
1.本发明属于荧光免疫层析技术领域,尤其涉及一种膜状多层量子点荧光材料、其制备方法及免疫层析应用。
背景技术:
2.横向流动免疫分析法(lfa)具有快速、易用、便携、低成本和多目标检测能力等特点,被认为是最有前途的点对点检测(poct)技术,广泛应用于临床检查、个人健康自检和食品安全监测等领域。
3.免疫层析技术的特点在于:(1)不需要专业操作人员,可广泛用于医院、社区医疗机构、机场、车站、学校、家庭等不同场所。(2)无需复杂仪器,可直接、快速(一般《20min)提供检测结果。(3)lfa技术通过在一条条带上设置多条测试线,可以在一次测试中分析多个目标,有效地简化了检测过程。然而,由于传统的球形纳米标记和呼吸道样品(唾液、咽拭子、痰等)成分复杂,检测呼吸道病毒的性能不佳(如不稳定、信号强度低、弥散性差或尺寸大),目前发展的lfa方法在检测呼吸道病毒时仍表现出定量能力有限、灵敏度低(一般为》0.1ng/ml)和低通量(≤2)。迄今为止,虽然已经提出了许多基于胶体金的lfa试剂盒和灵敏度更高的lfa技术,包括基于荧光的、基于化学发光的和基于拉曼信号的策略,用于新冠病毒(sars-cov-2)和甲型流感病毒的检测,但这些方法仍然不能同时敏感地检测多种呼吸道病毒。为了满足呼吸道病毒多重检测的需要,需要开发一种具有信号放大能力、免疫结合效率和稳定性的新型lfa系统。
4.近年来,二维(2d)薄膜型纳米材料,如石墨烯及其衍生物、二硫化钼、黑磷等,由于其独特的结构特征(如大表面积、超薄结构、丰富的表面活性基团)以及非凡的电子和光学性质,在快速诊断领域显示出巨大的潜力。因此,本发明考虑提供一种膜状多层荧光纳米标签并将其引入免疫层析系统用于呼吸道病毒的检测,从而实现在一根试纸条对多种常见呼吸道病毒进行快速、超灵敏和定量分析。
技术实现要素:
5.有鉴于此,本发明要解决的技术问题在于提供一种膜状多层量子点荧光材料、其制备方法及免疫层析应用,该膜状多层量子点荧光材料可用于在复杂的生物标本中超灵敏和同时检测三种目标呼吸道病毒(sars-cov-2、甲型流感病毒和人腺病毒),解决了现有纳米标签材料用于免疫层析检测性能不足的问题,尤其是应用于多种呼吸道病毒同时检测时灵敏度不够的问题。
6.本发明提供了一种膜状多层量子点荧光材料,包括膜状载体与设置于膜状载体上的荧光层;所述荧光层包括依次叠加设置的阳离子聚合物自组装层与负电性量子点层,且所述荧光层中的阳离子聚合物自组装层与膜状载体相接触。
7.优选的,所述荧光层中阳离子聚合物自组装层与负电性量子点层的层数均大于等于2,且阳离子聚合物自组装层与负电性量子点层相间设置。
8.优选的,所述膜状载体为单层氧化石墨烯;所述阳离子聚合物自组装层为聚乙烯亚胺自组装层;所述负电性量子点层为羧基化硒化镉/硫化锌核壳量子点自组装层或3-巯基丙酸包覆硒化镉/硫化锌量子点自组装层。
9.本发明还提供了一种膜状多层量子点荧光材料的制备方法,包括以下步骤:
10.s1)将膜状载体与阳离子聚合物溶液混合超声,得到包含负载阳离子聚合物自组装层的膜状载体的溶液;
11.s2)将负电性量子点溶液与包含负载阳离子聚合物自组装层的膜状载体的溶液混合超声,得到膜状多层量子点荧光材料。
12.优选的,所述膜状载体按照以下方法制备得到:
13.将单层氧化石墨烯分散液超声处理,离心,收集沉淀重悬于水中,得到膜状载体;所述单层氧化石墨烯分散液中单层氧化石墨烯的厚度为1~2nm;片径大于200nm;所述超声处理的功率为500~1000w;所述离心的转速为10000~20000g。
14.优选的,所述阳离子聚合物溶液中阳离子聚合物的浓度为0.1~5mg/ml;所述阳离子聚合物溶液中阳离子聚合物的分子量为3000~100000;
15.所述负电性量子点溶液的浓度为1~50ng/ml;所述阳离子聚合物溶液与负电性量子点溶液的体积比为(300~800):1。
16.优选的,所述步骤s1)与步骤s2)中混合超声的功率为500~1000w;混合超声的时间为10~60min。
17.优选的,步骤s2)中混合超声后,离心收集沉淀后,以其替代膜状载体重复步骤s1)与步骤s2);重复的次数为1~5次。
18.本发明还提供了上述膜状多层量子点荧光材料在免疫层析中的应用。
19.本发明还提供了一种膜状多层量子点纳米标签,包括上述的膜状多层量子点荧光材料与修饰在膜状多层量子点荧光材料表面的检测抗体。
20.本发明提供了一种膜状多层量子点荧光材料,包括膜状载体与设置于膜状载体上的荧光层;所述荧光层包括依次叠加的阳离子聚合物自组装层与负电性量子点层,且所述荧光层中的阳离子聚合物自组装层与膜状载体相接触。与现有技术相比,本发明提供的膜状多层量子点荧光材料为三维荧光纳米膜,与传统的球形荧光标记相比,具有更大的表面积、更高的荧光信号、更好的分散性和稳定性,从而大大提高了试纸条的检测灵敏度,使所构建的荧光lfa生物传感器能够同时、灵敏地定量sars-cov-2、甲型流感病毒和人腺病毒,检测限低,检测时间短,重现性好,准确性高。
附图说明
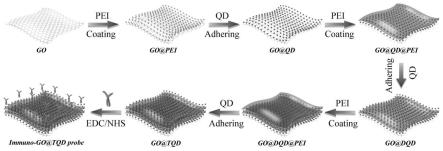
21.图1为本发明提供的膜状多层量子点荧光材料的制备方法及抗体修饰方法示意图;
22.图2为本发明实施例1中膜状多层量子点荧光材料制备过程中各种结构表征数据,其中a、b、c、d分别为go、go@qd、go@dqd和go@tqd纳米片的透射电子显微镜图;e、f、g分别为go@qd、go@dqd和go@tqd纳米片局部形态的放大tem图像;h、i、j分别为go@qd、go@dqd和go@tqd的扫描电子显微镜图像;k为go@tqd的元素面扫分析结果;m、n、o为qd、go、go@qd、go@dqd和go@tqd纳米片的荧光性能对比;l为go、go@qd、go@dqd和go@tqd纳米片的粒径分布结果
图;
23.图3为本发明实施例1中得到的膜状多层量子点荧光材料的稳定性测试结果图,其中a图为高盐稳定性测试结果图;b图为酸碱稳定性测试结果图;c图为时间稳定性测试结果图;
24.图4为本发明实施例2中不同qd外壳层数的三种膜状多层量子点材料(go@qd、go@dqd和go@tqd)在免疫层析体系上的性能对比,其中a图为基于三种膜状材料的免疫层析检测不同浓度的新冠病毒np蛋白的试纸条可视化荧光结果图;b图为基于三种膜状材料的免疫层析检测不同浓度的新冠病毒np蛋白的试纸条荧光分析结果及其线性范围图;
25.图5为本发明实施例3的膜状多层量子点荧光材料作为高性能膜状荧光标签与免疫层析系统联用检测新冠病毒、甲型流感病毒和乙型流感病毒的实验流程图;
26.图6为本发明实施例3中基于膜状多层量子点标签的免疫层析系统检测新冠病毒、甲型流感病毒和乙型流感病毒的结果图,其中a图为同时检测三种病毒的荧光照片结果;b图为荧光光谱仪记录的3条检测线的荧光数值;c图为检测三种病毒的荧光数值-病毒浓度拟合曲线结果。
具体实施方式
27.下面将结合本发明实施例,对本发明实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例仅仅是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
28.本发明提供了一种膜状多层量子点荧光材料,包括膜状载体与设置于膜状载体上的荧光层;所述荧光层包括依次叠加设置的阳离子聚合物自组装层与负电性量子点层,且所述荧光层中的阳离子聚合物自组装层与膜状载体相接触。
29.在本发明中,所述膜状载体的厚度优选为1~2nm;所述膜状载体的片径优选为500~800nm;所述膜状载体优选为单层氧化石墨烯(go)。二维单层氧化石墨烯作为载体面积大且具有较好的柔性。
30.所述膜状载体上设置有荧光层;所述荧光层包括依次叠加设置的阳离子聚合物自组装层与负电性量子点层;所述阳离子聚合物自组装层优选为聚乙烯亚胺自组装层;所述负电性量子点层优选为羧基化硒化镉/硫化锌核壳量子点(cdse@zns-cooh qd)自组装层或3-巯基丙酸包覆硒化镉/硫化锌量子点(cdse@zns-mpa qd)自组装层。
31.在本发明中,所述荧光层中阳离子聚合物自组装层与负电性量子点层的层数均优选大于等于2,更优选为2~5,再优选为2~4,最优选为3;且阳离子聚合物自组装层与负电性量子点层相间设置。多层阳离子聚合物自组装层作为夹层可大大提高纳米片的分散性,并有效吸附大量负电性量子点;多层设置的负电性量子点层包含数千个负电性量子点,这些量子点产生的荧光信号比单个量子点产生的荧光信号大数千倍,并提供大量的抗体偶联表面位点。与常用的球形荧光材料相比,本发明提供的膜状多层量子点荧光材料具有更大的表面积、更优越的荧光性能、更好的分散性和稳定性,从而大大提高了试纸条的检测灵敏度。
32.本发明还提供了一种上述膜状多层量子点荧光材料的制备方法,包括以下步骤:
s1)将膜状载体与阳离子聚合物溶液混合超声,得到包含负载阳离子聚合物自组装层的膜状载体的溶液;s2)将负电性量子点溶液与包含负载阳离子聚合物自组装层的膜状载体的溶液混合超声,得到膜状多层量子点荧光材料。
33.其中,本发明对所有原料的来源并没有特殊的限制,为市售即可。
34.在本发明中,所述膜状载体优选按照以下方法制备:将单层氧化石墨烯分散液超声处理,离心,收集沉淀重悬于水中,得到膜状载体;所述单层氧化石墨烯分散液中单层氧化石墨烯的厚度优选为1~2nm;片径优选大于200nm;所述单层氧化石墨烯分散液的浓度优选为0.5~3mg/ml,更优选为1~2mg/ml;所述超声处理的功率优选为500~1000w,更优选为600~900w,再优选为700~800w;所述超声处理的时间优选为5~30min,更优选为10~20min,再优选为15min;通过超声处理可使氧化石墨烯完全分散;所述离心的转速优选为10000~20000g,更优选为11000~16000g,再优选为11000~14000g,最优选为12000g;所述离心的时间优选为3~10min,更优选为5~8min,再优选为6min;通过离心可除去上清中片径过小的氧化石墨烯(《400nm),分选出片径均一的氧化石墨烯纳米片;收集沉淀重悬于水中,即可得到片径在500~800nm范围的氧化石墨烯纳米片;重悬所用的水的体积与单层氧化石墨烯分散液的体积比优选为1:(0.5~2),更优选为1:(0.8~1.5),再优选为1:1。
35.将膜状载体与阳离子聚合物溶液混合超声;所述膜状载体以悬浮于水中的形式与阳离子聚合物溶液混合;悬浮有膜状载体的水的体积与阳离子聚合物溶液的体积比优选为1:(0.5~2),更优选为1:(0.8~1.5),再优选为1:1;所述阳离子聚合物溶液中阳离子聚合物的浓度优选为0.1~5mg/ml,更优选为0.5~3mg/ml,再优选为1~2mg/ml;所述阳离子聚合物溶液中阳离子聚合物的分子量优选为3000~100000;所述阳离子聚合物优选为聚乙烯亚胺,更优选为多氨基的支链聚乙烯亚胺;所述超声混合的功率优选为500~1000w,更优选为600~900w,再优选为700~800w;所述超声混合的时间优选为10~60min,更优选为20~40min,再优选为30min;通过剧烈超声使阳离子聚合物快速自组装在单层氧化石墨烯表面,得到包含负载阳离子聚合物自组装层的膜状载体的溶液。
36.将负电性量子点溶液与包含负载阳离子聚合物自组装层的膜状载体的溶液混合超声;所述负电性量子点溶液的浓度优选为1~50ng/ml,更优选为5~50ng/ml,再优选为10~40ng/ml,最优选为20~30ng/ml;所述阳离子聚合物溶液与负电性量子点溶液的体积比优选为(300~800):1,更优选为(400~700):1,再优选为(500~600):1,最优选为500:1;所述超声混合的功率优选为500~1000w,更优选为600~900w,再优选为700~800w;所述超声混合的时间优选为10~60min,更优选为20~40min,再优选为30min;在此过程中,负电性量子点通过静电吸附作用被大量吸附到聚乙烯亚胺自组装层的表面。
37.超声混合后,优选离心,即可得到荧光层具有单层阳离子聚合物自组装层与单层负电性量子点层的膜状多层量子点荧光材料;所述离心的转速优选为4000~8000g,更优选为5000~7000g,再优选为6000g;所述离心的时间优选为3~10min,更优选为5~8min,再优选为6min。
38.在本发明中,离心收集沉淀后,以其替代膜状载体重复步骤s1)与步骤s2);重复的次数优选为1~5次,更优选为1~4次,再优选为1~3次,最优选为2次。通过重复多次步骤s1)与步骤s2)可根据需要利用阳离子聚合物介导的层层自组装继续包覆更多层数的负电性量子点层。
39.本发明采用超声介导的静电吸附法制备膜状多层量子点荧光材料,通过静电吸附介导的层层自组装,将三层致密的负电性量子点依次涂覆在二维单层氧化石墨烯薄片表面。该方法将二维纳米结构转化为三维荧光纳米膜,与传统的球形荧光标记相比,具有更大的表面积、更高的荧光信号、更好的分散性和稳定性。所构建的荧光lfa生物传感器能够同时、灵敏地定量sars-cov-2、甲型流感病毒和人腺病毒,检测限低,检测时间短,重现性好,准确性高。
40.本发明还提供了一种上述膜状多层量子点荧光材料在免疫层析中的应用,优选的作为荧光免疫层析的纳米标签的应用。
41.本发明还提供了一种膜状多层量子点纳米标签,包括上述膜状多层量子点荧光材料与修饰在膜状多层量子点荧光材料表面的检测抗体;所述检测抗体优选为单克隆抗体;所述检测抗体优选为新冠病毒、甲型流感病毒与乙型流感病毒中的一种或多种的抗体;所述检测抗体可通过羧基活化试剂活化膜状多层量子点荧光材料直接偶联修饰;所述羧基活化试剂为本领域技术人员熟知的羧基活化试剂即可,并无特殊的限制,本发明中优选为edc/nhs.
42.本发明将检测抗体修饰的膜状多层量子点荧光材料引入免疫层析体系中,可提供优于球形量子点微球的荧光性能、稳定性、分散性及反应界面,可实现免疫层析体系中目标物的高灵敏、快速、定量检测。
43.本发明提供的膜状多层量子点纳米标签可按照以下方法制备:在膜状多层量子点荧光材料表面分别修饰上待测目标物的(新冠病毒、甲型流感病毒和乙型流感病毒)的抗体后滴加到玻璃纤维膜上,冻干,作为免疫层析的荧光纳米标签。分别将三种目标病毒的捕获抗体喷在硝酸纤维素膜(nc膜)上构建三条检测线(t1,t2,t3),用以捕获相应的病毒-膜状标签免疫复合物。山羊抗鼠igg同时喷涂到nc膜的质控线上,以固定多余的-膜状标签;将所述nc膜和样品垫、吸水垫、底板组装成免疫层析试纸条;将待测样本与运行缓冲液混匀,滴加到所述免疫层析试纸条的样品垫上,15~20min后读取免疫层析试纸条的3条t线处的荧光信号,实现对新冠病毒、甲型流感病毒和乙型流感病毒的同时、高灵敏检测。
44.与现有技术相比,本发明的优势在于:
45.(1)从性能上看,本发明提出的膜状多层量子点荧光材料集成了单层go纳米片优异的分散性、柔性结构和多层量子点外壳的强荧光发射能力,总体的光稳定性、荧光强度、分散性和稳定性远超其他荧光微球材料,可以显著提升免疫层析检测的灵敏度;
46.(2)从结构上看,本发明提出的膜状多层量子点荧光材料为典型的膜状多层纳米结构,相对于球形纳米颗粒具有更大的相对表面积、更大的反应界面及更轻的重量,可以轻易的在层析试纸条上流动,十分适用于多通道免疫层析体系的构建;
47.(3)本发明提出采用超声介导的静电吸附法实现qd外壳在go纳米片表面的层层自组装,方法简单、可靠性高、可实现大规模稳定生产;
48.(4)本发明提出的静电吸附介导的层层自组装法制备膜状多层量子点材料是一种膜状多层结构的制备方法,通过控制反应次数,可以实现go表面qd外壳的连续包覆,qd外壳的层数可以不断叠加,进而继续增大单个结构的量子点载量;
49.(5)膜状多层量子点荧光材料的表面羧基可用于直接修饰抗体、适配体、抗生素、多肽等生物识别分子,便于实现生物功能化;
50.(6)本发明提出的膜状多层量子点荧光材料具有广阔的应用前景,包括在现场快速检测领域、生物传感、体内成像、临床检验、食品分析等多个领域应用;
51.(7)本发明提出的膜状多层量子点荧光材料作为高性能膜状荧光标签用于免疫层析检测,可以提供更强和稳定的荧光信号、更好的稳定性与分散性以及更多的表面活性位点,因此可以有效提高荧光免疫层析技术的检测性能和检测通量。
52.综上,本技术发明的静电吸附介导的层层自组装法制备膜状多层量子点标签具有结构新、性能好、方法简单高效的特点。制备出的膜状多层量子点荧光材料相对于球形荧光材料具有更高的量子点载量、更大的表面积、更优异荧光性能及更好的稳定性和分散性,在现场快速检测领域特别是高灵敏荧光免疫层析检测方面具有广阔的应用前景。
53.为了进一步说明本发明,以下结合实施例对本发明提供的一种膜状多层量子点荧光材料、其制备方法及免疫层析应用进行详细描述。
54.以下实施例中所用的试剂均为市售;实施例中np蛋白购自义翘神州,货号catalog#40588-v08b;甲型流感病毒抗体及乙型流感病毒抗体均购自于中美歆新生物科技有限公司,其中,甲流:catalog#flua-001;flua-002;乙流:catalog#flub-001;flub-002。
55.实施例1
56.本发明制备的膜状多层量子点荧光材料主要通过三个步骤制备,首先是go纳米片的离心分选,其次通过静电吸附的层层自组装作用以一层pei一层qd的形式制备出go@qd、go@dqd和go@tqd,最后利用膜状多层量子点材料表面的羧基通过酰胺键将抗体偶联在go@tqd表面。
57.一种上述本实施例的膜状多层量子点材料的制备方法及抗体偶联方法,如图1所示,包括以下步骤:
58.(1)制备go纳米片:
59.将10ml go纳米片的水溶液(浓度1mg/ml)超声15分钟,通过12000g离心6分钟后收集沉淀并重悬于10ml的去离子水中,获得粒径在500~800nm范围的go纳米片水溶液待用。
60.(2)制备go@qd纳米片:
61.在超声处理下,10mlgo纳米片与10ml浓度为1mg/ml的pei溶液混合后,800w剧烈超声反应半小时使pei快速自组装在go表面。随后加入20μl羧基化qd(20ng/ml的cdse@zns-cooh qd溶液),继续剧烈超声半小时。在此过程中,羧基化qd通过静电吸附作用被大量吸附到go@pei表面,形成go@qd纳米片;通过6000g离心6分钟时间收集go@qd,分散到10ml去离子水中待用。
62.(3)制备go@dqd纳米片:
63.go@qd纳米片与10ml浓度为1mg/ml的pei溶液混合后,800w剧烈超声反应半小时使pei快速自组装在go@qd表面。随后加入20μl羧基化qd(20ng/ml的cdse@zns-cooh qd溶液),继续剧烈超声半小时。在此过程中,羧基化qd通过静电吸附作用被大量吸附到go@qd@pei表面,形成go@dqd纳米片;通过6000g离心6分钟收集go@dqd,分散到10ml去离子水中待用。
64.(4)制备go@tqd纳米片:
65.将制备的go@dqd纳米片与10ml浓度为1mg/ml的pei溶液混合后,800w剧烈超声反应半小时使pei快速自组装在go@dqd表面。随后加入20μl羧基化qd(20ng/ml的cdse@zns-cooh qd溶液),继续剧烈超声半小时。在此过程中,羧基化qd通过静电吸附作用被大量吸附
到go@dqd@pei表面,形成go@tqd纳米片;通过6000g离心6分钟收集go@tqd,分散到10ml去离子水中待用。
66.(5)制备抗体修饰的go@tqd荧光标签:
67.首先,将1ml的go@tqd离心并重悬于500微升的1ml 2-(n-吗啉)乙磺酸缓冲液(0.1m,ph5.5)中。随后加入10μl n-羟基琥珀酰亚胺溶液和5μl碳二亚胺溶液,孵育活化15分钟。通过离心作用从溶液中收集活化的go@tqd,并重新悬浮在200μl的pbs(0.01m,ph 7.4)中。分别加入10μg的新冠病毒np抗体、甲型流感病毒抗体和乙型流感病毒抗体,继续孵育振荡2小时。随后加入100μl 10%bsa(w/v)封闭1小时。最后通过离心作用将三种抗体修饰的go@tqd重悬于保存液中,并滴加至玻璃纤维膜上冻干,用于后续免疫层析试纸条的组装。
68.图2为本实施例步骤(1)制得的go纳米片,步骤(2)制得的go@qd纳米片,步骤(3)制得的go@dqd纳米片,步骤(4)制得的go@tqd纳米片的高分辨透射电镜图(hrtem)和扫描电镜结果;制备得到的go@tqd纳米片的元素面扫描分析结果;制备的膜状多层量子点与普通量子点的荧光性能对比结果及粒径分布结果。
69.本实施例所制得的膜状多层量子点荧光材料稳定性表征结果如图3所示。本发明提出的膜状多层量子点荧光材料展现出优异的盐稳定性、酸碱稳定性及长期稳定性。如图3a所示,制备的膜状go@tqd的荧光信号在高盐溶液(0~1000mm nacl)中保持稳定(室温条件下放置24h)。如图3b所示,膜状go@tqd618 nm波长的荧光信号在ph4~14的环境中保持稳定(在水中加入的浓度为1mg/ml,不同ph值水溶液由hcl或naoh提供,室温放置24小时);如图3c所示,室温条件下膜状go@tqd618 nm波长的荧光信号在60天内(避光条件保存)保持稳定。
70.实施例2
71.本发明提出的膜状多层量子点荧光材料表面修饰抗体后,可用于免疫层析检测。负载更多层数的qd可以有效提升膜状多层量子点在免疫层析上的检测性能。负载1~3层的膜状多层量子点标签(go@qd、go@dqd和go@tqd)用于免疫层析的性能如图4所示。普通qd(即cdse@zns-cooh)和go@qd、go@dqd、go@tqd作为荧光标签用于免疫层析检测新冠病毒np蛋白的可视化荧光信号依次为0.5、0.5、0.05、0.01ng/ml。使用商用荧光分析仪对所有测试条带的荧光强度进行量化,然后用这些值绘制4个检测平台的校准曲线(图4b)。计算出基于普通qd和go@qd、go@dqd、go@tqd的试纸条检测限依次为111、52、16和8pg/ml。此结果证实了使用具有多个qd层的go@tqd作为荧光标记可以有效提高lfa的检测灵敏度。
72.实施例3
73.本发明提出的膜状多层量子点荧光材料表面修饰目标呼吸道病毒抗体后可作为高性能膜状荧光标签用于多通道免疫层析系统。本实施例采用新冠病毒np蛋白抗体、甲型流感病毒抗体及乙型流感病毒抗体。
74.修饰的膜状go@tqd标签作为免疫层析系统标签,检测含有不同浓度的三种目标病毒的混合样品。图5为本实施例所示的膜状go@tqd标签与免疫层析系统联用快速检测三种目标呼吸道病毒的实验流程图。图6为基于膜状多层量子点荧光材料的三通道免疫层析系统检测三种目标呼吸道病毒的测试分析结果。根据试纸条的荧光信号和相应的拟合曲线结果计算,基于膜状go@tqd标签的免疫层析同时检测新冠病毒np蛋白、甲型流感病毒及乙型
流感病毒的检测限可分别达到8pg/ml、471copies/ml和488copies/ml。
75.以上所述只为说明本发明的技术构思和特点,其目的在于让熟悉此项技术的人士能够了解本发明的内容并据以实施,所作的任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1