一种磁性氧化剂MnxZn1-xFe2O4/δ-MnO2的制备方法与流程
本发明涉及一种磁性氧化剂mnxzn1-xfe2o4/δ-mno2的制备方法,属于无机氧化材料技术领域。
背景技术:
二氧化锰是一种性能稳定的过渡金属的氧化物,属于n型半导体材料,它具有良好的催化性能、吸附性能、氧化性能,优越的电化学性能、能量储存,优异的离子交换性、环境友好性等,同时还具备比表面积大、表面活性基团多、价态可变、制备简单和生产成本低(锰元素大量存在于土壤和矿物中储量大)等特点,且可通过改变产物合成反应的温度、浓度、ph、电压等关键因素来调控其表面形貌、结晶度、纯度等性质及结构,因此一直以来二氧化锰被广泛应用于催化、吸附和电池等重要领域,在环境中有机污染废水的处理也有着重要的作用。二氧化锰晶型主要有α、β、γ、δ和ε等,制备方法主要有水热法、氧化还原法、热分解法、电沉积法和溶胶凝胶法等。二氧化锰作为氧化剂,主要用于醇氧化制醛、不饱和烯醇氧化后与胺反应制端炔、氰基转化为酰胺、氧化胺制甲酰胺和、重氮化合物、α-羟基酸的裂解、二芳基甲烷氧化、二芳基酮的转化、醛到羧酸的转化、由硫制备二硫化物、由磷制备磷化物或是由胺制备酮等。但因二氧化锰为两性氧化物,除具有氧化性外也具有还原性,主要受反应条件所控制,这导致了二氧化锰氧化剂的效率极差,同时也不便于回收利用。目前尚未见到关于磁性二氧化锰氧化剂的制备报道。
纯二氧化锰的催化性能较差,同时无论是将mno2作为催化剂还是吸附剂,但作用过程及结束后光固体mno2悬浮于溶液中,难以实现固液分离,不利于回收利用且会造成mno2对环境的二次污染,因此对mno2与磁性物质的复合开始受到了研究者的青睐。如《synthesisofathin-layermno2nanosheet-coatedfe3o4nanocompositeasamagneticallyseparablephotocatalyst》一文(对比文件1),制备的mno2/fe3o4复合磁性催化剂虽然可以实现回收利用,但是该方法仍然存在一些不足:(1)复合催化剂对污染物的处理效果不佳,0.01g复合催化剂降解50ml浓度为20mg/l的亚甲基蓝,在3h内的降解率只有89%左右,并且未考察对较难降解的染料如罗丹明b的作用效能;(2)催化时,需要光的参与,而且对ph的要求较高,限制条件太多,不利于广泛应用。又如专利cn106215948b“一种二氧化锰复合磁性催化剂的制备方法”(对比文件1),先采用焙烧方法制备磁性基体锰锌铁氧体,然后采取共氧化还原方法制备得到了二氧化锰复合磁性催化剂(β-mno2/mnxzn1-xfe2o4),可以实现回收再利用。但该方法仍存在一些不足:(1)焙烧法制备锰锌铁氧体(mnxzn1-xfe2o4)的温度为1200℃,能耗高,且制备的样品颗粒尺寸较大,比表面积较小,不利于mnxzn1-xfe2o4与β-mno2的充分结合,无法保证复合物的稳定性;(2)采用高锰酸钾氧化硫酸锰的方法制备β-mno2,锰元素未能得到充分利用,且因原料种类增加而导致了β-mno2纯度有限,影响了β-mno2的活性;(3)催化活性不高,5mg二氧化锰复合磁性催化剂,在双氧水作用下,降解100ml浓度为10mg/l的罗丹明b,1h内的降解率仅93.9%;(4)焙烧法制备的mnxzn1-xfe2o4矫顽力较小,磁性保持能力有限,不利于mnxzn1-xfe2o4/β-mn2o2的回收利用。
技术实现要素:
本发明的目的是针对纯二氧化锰难回收和氧化活性不高的问题,提出采用mnxzn1-xfe2o4对mno2进行改性和赋磁以提高其氧化活性,且便于回收再利用性,即提出了一种磁性氧化剂mnxzn1-xfe2o4/δ-mno2的制备方法,该制备工艺方法简单,生产成本低,周期短,氧化活性高,且便于通过外加磁场从液相悬浮体系中分离和回收,避免了氧化化剂可能带来的二次污染。
本发明磁性氧化剂mnxzn1-xfe2o4/δ-mno2的制备方法如下:
(1)磁性基质mnxzn1-xfe2o4的制备
按照zno:mno:fe2o3摩尔比为13.3:32.8:53.9,分别称取适量的znso4·7h2o、mnso4·h2o、fe2(so4)3,用去离子水充分溶解得到混合溶液;称取适量的naoh配制为2mol/l的naoh溶液;在磁力搅拌下,将naoh溶液缓慢滴加到混合溶液中至产生棕色的絮凝状产物,此时快速滴加naoh溶液,直至反应溶液ph为13,继续搅拌0.5h后,将反应液转入反应釜中,200℃水热反应5h,反应完毕后冷却至室温,利用磁铁的磁性吸引用力,用蒸馏水和无水乙醇洗涤烧杯中的样品多次,然后置于70℃的干燥箱中干燥12h,研磨后即可得到mnxzn1-xfe2o4粉末样品。
(2)磁性氧化剂mnxzn1-xfe2o4/δ-mno2的制备
称取0.5140g的高锰酸钾,加入65ml蒸馏水中,机械搅拌直至完全溶解后,缓慢滴加1ml盐酸(37wt%),机械搅拌均匀得到高锰酸钾溶液;按照mnxzn1-xfe2o4与δ-mno2的质量比10~30﹕100,称取适量的mnxzn1-xfe2o4加入高锰酸钾溶液中,机械搅拌30min后,将混合溶液转入100ml的水热反应釜中,密封后保持160℃下反应24h,反应完毕后自然冷却至室温,除去上层液体;固体部分用蒸馏水和无水乙醇离心洗涤至溶液呈无色,然后置于70℃的烘箱中干燥12h,即得到磁性氧化剂mnxzn1-xfe2o4/δ-mno2。
本发明采用上述技术方案,主要有以下效果:
(1)本发明方法制备的磁性氧化剂mnxzn1-xfe2o4/δ-mno2有较高的氧化活性,0.01g制备的磁性氧化剂mnxzn1-xfe2o4/δ-mno2分散于100ml、浓度为10mg/l的罗丹明b溶液中,在ph为1时15min对rhb的降解率达到99.4%。
(2)本发明方法制备的磁性氧化剂mnxzn1-xfe2o4/δ-mno2能在外加磁场作用下实现固液分离,回收再利用。
(3)本发明采用水热-自氧化法制备,制备操作简单,所需设备少,能耗低。
附图说明
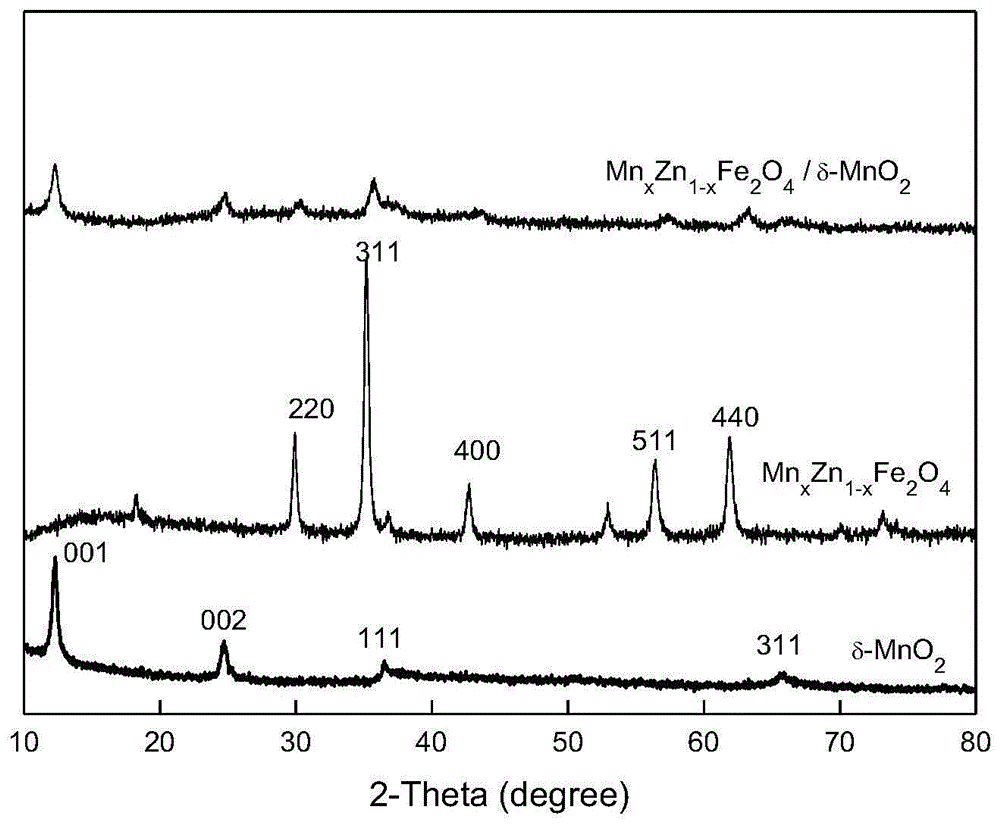
图1为mnxzn1-xfe2o4、δ-mno2和mnxzn1-xfe2o4δ-mno2的x射线衍射图。
图2为δ-mno2和mnxzn1-xfe2o4/δ-mno2的红外光谱图。
图3为mnxzn1-xfe2o4/δ-mno2降解ph为1rhb溶液时的uv-vis吸收图。
具体实施方式
下面结合具体实施方式,进一步说明本发明。
实施例1
一种磁性氧化剂mnxzn1-xfe2o4/δ-mno2的制备方法,具体步骤如下:
(1)磁性基质mnxzn1-xfe2o4的制备
按照zno:mno:fe2o3摩尔比为13.3:32.8:53.9,分别称取适量的znso4·7h2o、mnso4·h2o、fe2(so4)3,用去离子水充分溶解得到混合溶液;称取适量的naoh配制为2mol/l的naoh溶液;在磁力搅拌下,将naoh溶液缓慢滴加到混合溶液中至产生棕色的絮凝状产物,此时快速滴加naoh溶液,直至反应溶液ph为13,继续搅拌0.5h后,将反应液转入反应釜中,200℃水热反应5h,反应完毕后冷却至室温,利用磁铁的磁性吸引用力,用蒸馏水和无水乙醇洗涤烧杯中的样品多次,然后置于70℃的干燥箱中干燥12h,研磨后即可得到mnxzn1-xfe2o4粉末样品。
(2)磁性氧化剂mnxzn1-xfe2o4/δ-mno2的制备
称取0.5140g的高锰酸钾,加入65ml蒸馏水中,机械搅拌直至完全溶解后,缓慢滴加1ml盐酸(37wt%),机械搅拌均匀得到高锰酸钾溶液;按照mnxzn1-xfe2o4与δ-mno2的质量比10﹕100,称取适量的mnxzn1-xfe2o4加入高锰酸钾溶液中,机械搅拌30min后,将混合溶液转入100ml的水热反应釜中,密封后保持160℃下反应24h,反应完毕后自然冷却至室温,除去上层液体;固体部分用蒸馏水和无水乙醇离心洗涤至溶液呈无色,然后置于70℃的烘箱中干燥12h,即得到磁性氧化剂mnxzn1-xfe2o4/δ-mno2。
实施例2
一种磁性氧化剂mnxzn1-xfe2o4/δ-mno2的制备方法,具体步骤如下:
(1)同实施例1中(1)。
(2)磁性氧化剂mnxzn1-xfe2o4/δ-mno2的制备
称取0.5140g的高锰酸钾,加入65ml蒸馏水中,机械搅拌直至完全溶解后,缓慢滴加1ml盐酸(37wt%),机械搅拌均匀得到高锰酸钾溶液;按照mnxzn1-xfe2o4与δ-mno2的质量比20﹕100,称取适量的mnxzn1-xfe2o4加入高锰酸钾溶液中,机械搅拌30min后,将混合溶液转入100ml的水热反应釜中,密封后保持160℃下反应24h,反应完毕后自然冷却至室温,除去上层液体;固体部分用蒸馏水和无水乙醇离心洗涤至溶液呈无色,然后置于70℃的烘箱中干燥12h,即得到磁性氧化剂mnxzn1-xfe2o4/δ-mno2。
实施例3
一种磁性氧化剂mnxzn1-xfe2o4/bivo4/δ-mno2的制备方法,具体步骤如下:
(1)同实施例1中(1)。
(2)磁性氧化剂mnxzn1-xfe2o4/δ-mno2的制备
称取0.5140g的高锰酸钾,加入65ml蒸馏水中,机械搅拌直至完全溶解后,缓慢滴加1ml盐酸(37wt%),机械搅拌均匀得到高锰酸钾溶液;按照mnxzn1-xfe2o4与δ-mno2的质量比30﹕100,称取适量的mnxzn1-xfe2o4加入高锰酸钾溶液中,机械搅拌30min后,将混合溶液转入100ml的水热反应釜中,密封后保持160℃下反应24h,反应完毕后自然冷却至室温,除去上层液体;固体部分用蒸馏水和无水乙醇离心洗涤至溶液呈无色,然后置于70℃的烘箱中干燥12h,即得到磁性氧化剂mnxzn1-xfe2o4/δ-mno2。
实验结果
实施例1制备的磁性氧化剂mnxzn1-xfe2o4/δ-mno2催化降解活性最佳。为方便对比,制备了δ-mno2样品。δ-mno2的制备方法为实施例1步骤(2)中不加入mnxzn1-xfe2o4。
δ-mno2、mnxzn1-xfe2o4、mnxzn1-xfe2o4/δ-mno2的xrd图谱如图1所示。可以看出,所制备的mno2与pdf卡片(jcpds80-1098)中的衍射峰对应,晶面指数分别为(001)、(002)、(111)、(311),表明所制备的样品为δ-mno2;制备的mnxzn1-xfe2o4衍射峰与pdf卡片(jcpd24-7400)吻合,在(111)、(220)、(311)、(222)、(400)、(422)、(511)和(440)晶面处出现了较强的衍射峰,表面所制备的样品为四方晶型mnxzn1-xfe2o4;mnxzn1-xfe2o4/δ-mno2的衍射峰中存在δ-mno2和mnxzn1-xfe2o4的衍射峰,在(001)、(002)、(111)晶面处均对应了δ-mno2的衍射峰,在(220)、(311)(440)处对应mnxzn1-xfe2o4的衍射峰,说明mnxzn1-xfe2o4和δ-mno2已成功负载,且负载后二者的晶体结构和物相没有受到相互影响影响,保证了mnxzn1-xfe2o4/δ-mno2的磁性能和催化性能,磁性测试表明,mnxzn1-xfe2o4的饱和磁化强度(ms)为70.61emu·g-1,磁性氧化剂mnxzn1-xfe2o4/δ-mno2的饱和磁化强度值为7.70emu·g-1,水溶液中分散的复mnxzn1-xfe2o4/δ-mno2在10秒内能被磁铁吸引收集。
δ-mno2、mnxzn1-xfe2o4/δ-mno2的ft-ir图谱如图2所示。可以看出,在3423.78cm-1为δ-mno2样品中的结构水分子和骨架羟基的伸缩振动峰,1619.24cm-1可能为吸附水中羟基的弯曲振动峰,452.06cm-1和509.04cm-1处的峰对应的是mno2中mn-o键的振动峰;在mnxzn1-xfe2o4/δ-mno2的光谱中,3200~3500cm-1是样品中o-h的振动峰,在400~600cm-1范围内对应的fe-o键或feo4化学键的振动峰,其中mn-o键和fe-o键官能团对应的特征峰范围相同,磁性氧化剂mnxzn1-xfe2o4/δ-mno2中mnxzn1-xfe2o4与δ-mno2可能二者共享了相似的官能团。
磁性氧化剂mnxzn1-xfe2o4/δ-mno2对rhb的降解情况如图3所示。可见,当rhb溶液ph值为1,15min时的降解率达99.4%以上。
- 还没有人留言评论。精彩留言会获得点赞!