基因HAH_1662在制备多糖中的应用的制作方法
本发明涉及生物技术领域,尤其涉及一种基因hah_1662在制备多糖中的应用。
背景技术:
微生物产生多糖来适应各种环境条件,胞外多糖可以帮助微生物生长,如粘附,存储营养,保护层,是形成生物被膜的重要组成组分。细菌产生的多糖,在许多领域具有非常广泛的应用价值,如作为抗氧化剂,金属螯合剂,乳化剂,增稠剂等。而极端古菌产生的多糖被研究与报道的并不多,嗜盐古菌的生存环境很极端,其产生的多糖,也许更具价值。目前报道的可以产生胞外多糖的几种嗜盐古菌有haloferax、halococcus、haloarcula、natronococcus、haloterrigena和halobacterium,只有五种来自嗜盐古菌的多糖,其组成与结构被报道,而关于嗜盐古菌多糖的生物合成途径,知之甚少。对于嗜盐古菌多糖及其生物合成途径的研究,可以丰富人类对古菌的认识,并且开发出更具价值的多糖。
技术实现要素:
本发明的一个目的是蛋白hah_1662或其编码基因或含有所述编码基因的表达盒、重组载体或重组菌的用途。
本发明提供了蛋白hah_1662或其编码基因或含有所述编码基因的表达盒、重组载体或重组菌在如下1)-3)任一中的应用:
1)提高目的菌中多糖产量;
2)在制备促进目的菌产多糖的产品中的应用;
3)在制备与嗜盐古菌产多糖相关的产品中的应用。
上述应用中,所述蛋白hah_1662来源于嗜盐古菌。
上述应用中,所述蛋白hah_1662为如下1)或2):
1)由序列表中序列2所示的氨基酸序列组成的蛋白质;
2)在1)所示蛋白两端添加标签序列得到的蛋白。
上述应用中,所述蛋白hah_1662的编码基因为如下1)-3)中任一种:
1)序列表中序列1所示的dna分子;
2)在严格条件下与1)所限定的dna分子杂交且编码由序列表中序列2所示的氨基酸序列组成的蛋白质的dna分子;
3)与1)所限定的dna分子至少具有70%、至少具有75%、至少具有80%、至少具有85%、至少具有90%、至少具有95%、至少具有96%、至少具有97%、至少具有98%或至少具有99%同源性且编码由序列表中序列2所示的氨基酸序列组成的蛋白质的dna分子。
上述严格条件可为在6×ssc,0.5%sds的溶液中,在65℃下杂交,然后用2×ssc,0.1%sds和1×ssc,0.1%sds各洗膜一次。
上述应用中,所述重组载体为将所述蛋白hah_1662的编码基因插入表达载体中得到的载体;
或所述重组菌为所述重组载体导入目的菌中,得到的菌。
上述应用中,所述目的菌为嗜盐古菌。
上述应用中,所述多糖为酸性多糖;
或,所述多糖包括或为如下几种组分形成的聚合物:1)甘露糖、2)半乳糖、3)葡萄糖、4)1)-3)中至少一种的硫酸化修饰产物;
或,所述多糖包括或为如下几种组分形成的聚合物:1)甘露糖、2)半乳糖、3)葡萄糖、4)1)-3)中至少一种的硫酸化修饰产物;
所述甘露糖、所述半乳糖和所述葡萄糖的摩尔比为55.9:43.2:0.9;
所述多糖中硫酸根的质量百分含量为26%;
所述多糖中碳水化合物的质量百分含量为51%。
本发明另一个目的是提供一种制备多糖的方法。
本发明提供的方法,包括如下步骤:发酵上述重组菌,得到多糖。
抑制或沉默所述蛋白hah_1662编码基因表达的物质在降低目的菌中多糖产量中的应用也是本发明保护的范围。
本发明的实验证明了,基因hah_1662确实是负责har.hispanicatcc33960的一种酸性多糖合成的关键基因,敲出该基因,可以提高酸性多糖的产量,该基因为提高生物合成酸性多糖的产量研究奠定基础。
附图说明
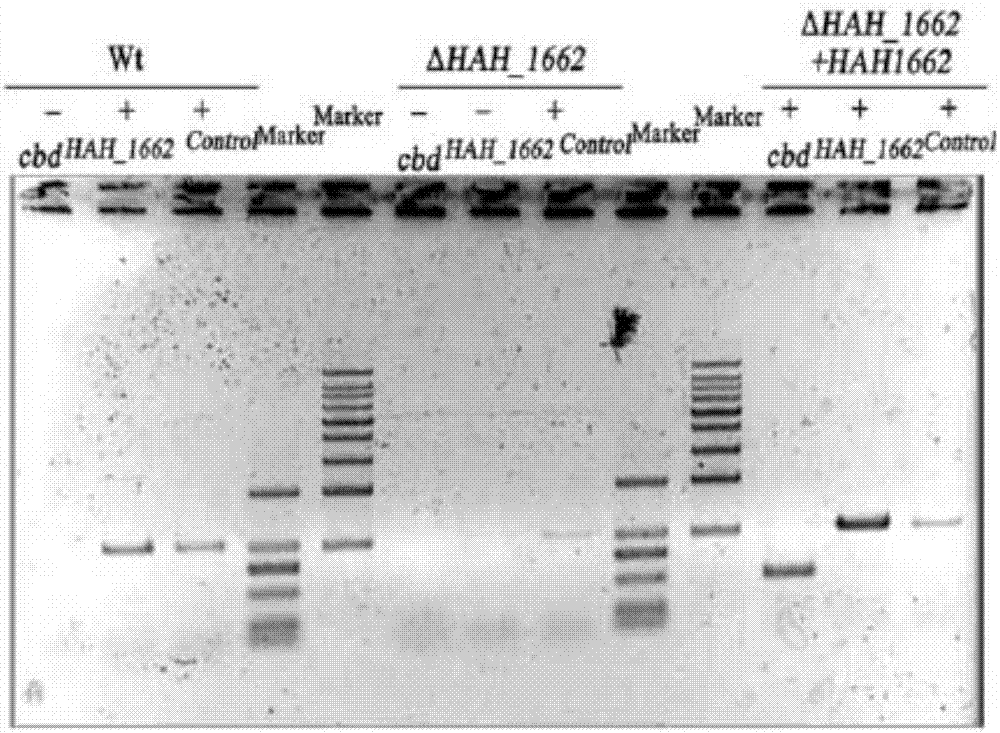
图1为嗜盐古菌har.hispanicatcc33960的基因敲除突变株的pcr鉴定及southern鉴定。
图2为野生株、基因敲除突变株与表达回复菌株的rt-pcr鉴定分析。
图3为酸性多糖的7.5%page电泳检测。
图4为嗜盐古菌har.hispanicatcc33960酸性多糖的分离纯化与分子量测定,a,发酵液经过deae-sepharosefastflow柱纯化。蛋白含量测定,紫外检测器检测od280nm值;多糖含量测定,苯酚硫酸法测定od490nm值;nacl%,nacl浓度。b,洗脱组分的酸性多糖电泳。40-47管。c,多糖的均一性分析及分子量测定。
图5为多糖的单糖组成分析,gc-ms检测多糖的完全酸水解产物。
图6为多糖的红外光谱ftir检测。
图7为多糖的nmr检测。
具体实施方式
下述实施例中所使用的实验方法如无特殊说明,均为常规方法。
下述实施例中所用的材料、试剂等,如无特殊说明,均可从商业途径得到。
实施例1、基因hah_1662的获得
提取嗜盐古菌haloarculahispanicatcc33960(以下称为野生株)的基因组dna,具体方法参见《分子克隆实验指南》,所用n端引物5’ggaattccatatggatatcctccacacgccg3’和c端引物5’ccgctcgagaactaagtcttcatgtac3’,以基因组dna为模板进行pcr扩增,扩增方法为:
pcr反应体系:10×extaqbuffer5μl,n端引物和c端引物各1μl(20μmol/l),dna模板1μl(1μg/μl),dntps(各2.5mm)4μl,extaqenzyme(takara,5u/μl)1μl,最后补水至50μl。
反应条件:98℃热变性5min;95℃变性1min,52℃退火45s,72℃延伸1min30s,共30个循环;72℃最后延伸10min。
得到pcr扩增产物,将该产物连接到pgem-teasy载体上,构建重组质粒pgem-hah_1662,并转化大肠杆菌dh5α,对重组质粒pgem-hah_1662进行测序,测序结果表明,该pcr产物具有序列表中序列1所示的核苷酸,该核苷酸的基因命名为hah_1662,该基因编码的蛋白命名为hah_1662,该蛋白的氨基酸序列为序列2。
实施例2、基因hah_1662功能验证
一、基因敲除突变株嗜盐古菌atcc33960突变株(△hah_1662)的获得
采用同源重组(pop-in和pop-out)的方法进行基因敲除,具体如下:
1、同源重组片段的获得
1)、上游同源臂的扩增
首先以嗜盐古菌haloarculahispanicatcc33960基因组dna为模板,用引物p1(5’cccaagctttatggccgagaacatcctcg3’含hindⅲ位点)和p2(5’ccgtcgattgaaacggtttgggaattagtaaattag3’)扩增,得到619bp片段,为上游同源臂,该片段的核苷酸序列为序列3第1位至第619位。
上述pcr反应体系:10×pyrobestbuffer5μl,引物p1和引物p2各1μl(20μmol/l),dna模板1μl(1μg/μl),dntps(各2.5mm)4μl,pyrobestenzyme(takara,5u/μl)1μl,最后补水至50μl。
反应条件:98℃热变性5min;95℃变性1min,50℃退火30s,72℃延伸45s,共30个循环;72℃最后延伸10min。pcr产物(619-bp片段)用北京天根公司dna凝胶回收试剂盒回收,方法参考其说明书。
2)、下游同源臂的扩增
以嗜盐古菌基因组dna为模板,用引物p3(5’ctaatttactaattcccaaaccgtttcaatcgacgg3’)和p4(5’cggggtacccgcatacctcttggtatag3’含kpni位点)扩增,得到607bp片段,为下游同源臂,该片段的核苷酸序列为序列3第620位至第1226位。
上述pcr反应体系:10×pyrobestbuffer5μl,引物p3和引物p4各1μl(20μmol/l),dna模板1μl(1μg/μl),dntps(各2.5mm)4μl,pyrobestenzyme(takara,5u/μl)1μl,最后补水至50μl。
上述反应条件:98℃热变性5min;95℃变性1min,50℃退火30s,72℃延伸45s,共30个循环;72℃最后延伸10min。pcr产物(607-bp片段)用北京天根公司dna凝胶回收试剂盒回收,方法参考其说明书。
3)、同源重组片段的扩增
以上述1)得到的619bp片段和上述2)得到的607bp片段为模板,p1和p4为引物,进行overlappcr,得到1.2kb片段。
pcr反应体系:10×extaqbuffer5μl,引物p1和引物p4各1μl(20μmol/l),片段模板各1μl(1μg/μl),dntps(各2.5mm)4μl,extaqenzyme(takara,5u/μl)1μl,最后补水至50μl。反应条件:98℃热变性5min;95℃变性1min,52℃退火45s,72℃延伸1min30s,共18个循环;72℃最后延伸10min。将pcr产物用天根公司的pcr产物回收试剂盒回收,方法参考其说明书。
回收上述1.2kb片段,该片段5’端含有hindⅲ位点,3’端含有kpni位点,该片段的核苷酸序列为序列3,该片段即为同源重组片段。
2、重组载体的构建
将上述1得到的同源重组片段用hindⅲ和kpni酶(neb公司生产)双酶切后,将双酶切片段用天根公司dna凝胶回收试剂盒回收,方法参考其说明书。
将敲除载体质粒pubp(该质粒记载在如下文献中:appl.environ.microbiol.,2007,vol73,no19,page6058-6065)同样经过hindⅲ和kpni酶双酶切后,将双酶切片段用天根公司dna凝胶回收试剂盒回收,方法参考其说明书。将上述两个酶切片段用t4ligase(promega公司生产)连接,构建成敲除质粒pubpδhah_1662。
pubpδhah_1662为将序列表中序列3所示的片段替换质粒pubp的hindⅲ和kpni酶切位点间得到的载体。
3、导入目的菌实现敲除
1)感受态的制备:从平板上用牙签挑取少量har.hispanicatcc33960菌体,接种于as-168培养基中(bactocasaminoacids5g;bactoyeastextract5g;sodiumglutamate1g;trisodiumcitrate3g;mgso4·7h2o20g;kcl2g;nacl200g;feso4·7h2o微量;mncl2·7h2o痕量;加ddh2o至1l,用naoh调ph至7.0-7.2,固体培养基加1.2%琼脂,8p灭菌30分钟),37℃,200rpm培养到对数期(菌体呈淡红色),然后以1:10转接于新鲜培养基中,约生长20-24h至菌体呈微红色,再以同样比例转接,生长20-24h,即可用于转化。
2)转化(所有操作均在室温下进行):取1ml活化好的菌液于灭菌的离心管中,6000rpm离心3min;弃上清,用移液枪吸尽残余的上清,然后加入200μlbss-ls缓冲液(nacl5.85g;kcl0.201g;sucrose15g;先溶解于95ml蒸馏水中,8p×30min灭菌后再加入5ml灭菌的1m,ph8.2tris-hcl),用移液枪轻轻吹匀,6000rpm离心3min;弃上清,用移液枪吸尽残余的上清,然后加入100μlbss-ls/加甘油缓冲液(nacl5.85g;kcl0.201g;sucrose15g;glycerol15ml;先溶解于95ml蒸馏水中,8p×30min灭菌后再加入5ml灭菌的1m,ph8.2tris-hcl),用移液枪轻轻吹匀;加入10μl0.5mph8.0的edta缓冲液,用手轻轻拍打离心管壁,混匀后室温下放置10min(形成原生质体);预先将待转化的质粒pubpδhah_16625μl与5μlbss-ls/加甘油缓冲液混匀,然后加入到原生质体溶液中,放置5min(阴性对照在原生质体溶液中加入10μlbss-ls/加甘油缓冲液);加入120μl(与上面离心管中溶液等体积)60%的peg600溶液,peg600溶液使用时用ubss/ls缓冲液(nacl5.85g;kcl0.201g;sucrose15g;ddh2o加至100ml,用tris碱或naoh调至ph至7.0-7.5,8p×30min灭菌)配置,迅速上下颠倒离心管多次,直到溶液变得透亮均一,然后室温放置20-30min。加入1ml复苏培养基(30%seawater76.7ml;peptone0.5g;bactoyeastextract0.1g;sucrose15g;ddh2o加至100ml;用tris碱或naoh调至ph至7.0-7.5,8p×30min灭菌),上下颠倒离心管混匀溶液,10000rpm离心2min;弃上清,再加入500μl-1ml的复苏培养基悬浮菌体,于37℃,200rpm摇床复苏过夜。
3)涂板:将复苏过夜的菌体10000rpm离心2min,剩余500-600μl复苏培养基用来重悬菌体,在含mevinolin(5μg/ml)的as-168固体培养基上,让液体在平板上流动直到均匀地吸附于平板。
4)生长:将涂好的平板放于37℃温箱,用塑料袋装好,以防板子干涸。7天左右可以看到淡红色的转化子,10天左右,可以将转化子在含mevinolin的as-168固体培养基上划线培养,生长3天左右即可用于dna抽提pcr检测。
pcr检测的引物为p1t:5’tatggccgagaacatcctcg3’;p4t:5’cgcatacctcttggtatag3’;得到1.2kb和2.4kb的片段,为目的菌株,为正确的转化子。
5)将正确的转化子在不含mevinolin的as-168的液体培养基中传代培养至少三次,在传代期间,个别菌体发生二次基因重组,选取可以在as-168/mev-平板上生长,而不能在as-168/mev+平板上生长的单菌落,经过pcr验证筛选基因敲除突变株。
选择p1和p4作为引物,单菌落基因组为模板,发生一次重组pop-in菌株可以扩增出1.2kb和2.4kb两条带,而发生两次重组pop-out菌株,只能扩增出1.2kb条带。pcr验证结果见图1a。因此,判断两次重组pop-out菌株为嗜盐古菌atcc33960突变株(△hah_1662),即har.hispanicatcc33960菌体基因组敲除hah_1662基因得到的重组菌。
4、southern杂交验证突变株。
提取野生株嗜盐古菌atcc33960与嗜盐古菌atcc33960突变株(△hah_1662)基因组dna,选择ecorv(neb公司生产)进行酶切,得到的酶切产物选取hah_1662下游1550-bp片段作为探针,进行southern杂交(分子克隆实验指南)。
1550-bp片段用引物p55’aaccgtttcaatcgacggtatatcctgattattc3’和p65’atctcacaacatctgttgattctggcattcacaag3’进行扩增,以野生型菌株嗜盐古菌atcc33960基因组dna为模板进行pcr扩增。
pcr反应体系:10×extaqbuffer5μl,引物p5和引物p6各1μl(20μmol/l),dna模板1μl(1μg/μl),dntps(各2.5mm)4μl,extaqenzyme(takara,5u/μl)1μl,最后补水至50μl。反应条件:98℃热变性5min;95℃变性1min,50℃退火30s,72℃延伸1min30s,共30个循环;72℃最后延伸10min。pcr产物(1550-bp片段)用北京天根公司dna凝胶回收试剂盒回收,方法参考其说明书。
southern验证结果见图1b,野生菌可以杂交出3.3kb的条带,而嗜盐古菌atcc33960突变株(△hah_1662)可以杂出4.4kb的条带,表明,嗜盐古菌atcc33960突变株(△hah_1662)的确敲除hah_1662基因。
二、表达回复菌株嗜盐古菌atcc33960δhah_1662+hah_1662的获得
1、表达载体的构建
1)质粒骨架pwl-cbd的获得
表达质粒pwl-cbd-secy记载在如下文献中:irihimovitch,v.,etal.,2003,isolationoffusionproteinscontainingsecyandsece,componentsoftheproteintranslocationcomplexfromthehalophilicarchaeonhaloferaxvolcanii,extremophiles.7,71-77,该质粒含有组成型启动子prr16和来自于clostridiumthermocellum菌的cbd(纤维素结合区)序列。
将表达质粒pwl-cbd-secy用ndei和kpni(neb公司生产)双酶切去除secy基因,回收10kb的片段,即为质粒骨架pwl-cbd。
2)hah_1662基因的获得
以野生型嗜盐古菌基因组dna为模板,p7和p8为引物,扩增hah_1662基因pcr产物(序列1)。
p75’ggaattccatatggatatcctccacacgcc3’含ndei位点
p85’ggggtaccctaaactaagtcttcatgtacc3’含kpni位点
pcr反应体系:10×pyrobestbuffer5μl,引物p7和引物p8各1μl(20μmol/l),dna模板1μl(1μg/μl),dntps(各2.5mm)4μl,pyrobestenzyme(takara,5u/μl)1μl,最后补水至50μl。反应条件:98℃热变性5min;95℃变性1min,52℃退火30s,72℃延伸1min30s,共30个循环;72℃最后延伸10min。pcr产物用北京天根公司pcr产物回收试剂盒回收,方法参考其说明书。
3)连接
将2)得到的hah_1662基因pcr产物用ndei和kpni(neb公司生产)双酶切,然后用天根公司dna凝胶回收试剂盒回收hah_1662片段,与质粒pwl-cbd片段一起,用t4ligase(promega公司生产)连接,构建表达载体质粒pwl-cbd-hah_1662。
pwl-cbd-hah_1662为将序列1所示的hah_1662片段替换表达质粒pwl-cbd-secy中ndei和kpni位点间的secy基因得到的载体。
2、表达载体的转化
将表达载体pwl-cbd-hah_1662转化进入δhah_1662敲除突变株,转化步骤见上述感受态制备与转化,得到δhah_1662+hah_1662表达回复菌株。
3、野生株、δhah_1662突变株和δhah_1662+hah_1662表达回复菌株的鉴定
1)提取rna反转录得到cdna
野生株、δhah_1662突变株和δhah_1662+hah_1662表达回复菌株在as-168液体培养基中37℃,200rpm培养至od600nm达到0.6-0.8,用高压灭菌两次的ep管收集1.5ml菌体,12000rpm室温离心1min,弃上清,离心甩一次,用移液枪吸尽上清。
每份菌体加入1mltrizol(invitrogen公司),用移液枪上下吹吸菌体,使其充分裂解,室温静置5min。加入200μl氯仿,上下颠倒离心管混匀管中液体,然后于涡轮振荡器上振荡15s,然后室温静置3min。12000rpm,4℃离心10min,转移上面的水相至一洁净ep管中,注意不要吸到中间的蛋白层或者下面的有机相,然后加入200μl中酚/氯仿,混匀后于12000rpm,4℃离心10min。转移水相于一洁净ep管中(约500μl左右),加入500μl异丙醇,室温沉淀10min。12000rpm,4℃离心10min,立即置于冰上,弃上清,用500μl70%乙醇(用depc水配置),洗涤沉淀,轻轻弃掉乙醇。吹干,rna最后溶于100μlddh2o水中。用rnase-freednase(neb公司)去除污染的dna,参见dnase说明书。cdna的合成,按照revertaidfirststrandcdnasynthesiskit(thermoscientific)试剂盒说明书,以randomhexamers作为引物,扩增得到cdna。
2)扩增
以各菌株cdna为模板,用p9(5’atggatatcctccacacgcc3’)和p10(5’catgtacctcgttatgatcg3’)引物扩增hah_1662;
上述pcr反应体系:10×extaqbuffer5μl,引物p9和引物p10各1μl(20μmol/l),cdna模板3μl(100ng/μl),dntps(各2.5mm)4μl,extaqenzyme(takara,5u/μl)1μl,最后补水至50μl。反应条件:98℃热变性5min;95℃变性1min,50℃退火30s,72℃延伸1min,共30个循环;72℃最后延伸10min。
以cdna为模板,用p11(5’gtgagtaatgttctgtatcc3’)和p12(5’gccctgtatgcttccagtgc3’)引物扩增hah_1667做对照(control);
上述pcr反应体系:10×extaqbuffer5μl,引物p11和引物p12各1μl(20μmol/l),cdna模板3μl(100ng/μl),dntps(各2.5mm)4μl,extaqenzyme(takara,5u/μl)1μl,最后补水至50μl。反应条件:98℃热变性5min;95℃变性1min,50℃退火30s,72℃延伸1min,共30个循环;72℃最后延伸10min。
以cdna为模板,用p13(5’atggcaaatacaccggtatcag3’)和p14(5’tactacactgccaccgggttc3’)引物扩增质粒pwl-cbd-hah_1662上的cellulosebindingdomain(cbd);
上述pcr反应体系:10×extaqbuffer5μl,引物p13和引物p14各1μl(20μmol/l),cdna模板3μl(100ng/μl),dntps(各2.5mm)4μl,extaqenzyme(takara,5u/μl)1μl,最后补水至50μl。反应条件:98℃热变性5min;95℃变性1min,50℃退火30s,72℃延伸30s,共30个循环;72℃最后延伸10min。
上述rt-pcr产物在1%的琼脂糖凝胶中电泳后,eb染色,结果如图2所示,说明野生株,基因敲除株,表达回复菌株正确。
三、hah_1662基因在制备胞外酸性多糖中的应用
嗜盐古菌har.hispanicatcc33960野生株、基因敲除突变株δhah_1662与表达回复菌株δhah_1662+hah_1662在40ml的as-168培养基中,37℃200rpm,培养至稳定期,13,000×g离心30分钟离心去除菌体,保留上清。将40ml发酵上清用4倍体积的无水乙醇在4℃沉淀过夜,13,000×g离心30分钟收集沉淀;将沉淀用40ml蒸馏水复溶后,在截留量为8000-12000分子量的透析袋内用蒸馏水透析除盐,然后在透析袋内加入核酸酶2μl(购自sigma,≥250units/μl,mw30kda),37℃放置12小时;再加入20μl5mg/ml蛋白酶k(购自sigma,≥30units/mg,mw29kda),37℃放置12小时;期间换水继续透析。将透析液再经过13,000×g离心30分钟,收集上清,将上清溶液经过100kda截留分子量的超滤浓缩管(millipore公司生产,50ml,操作见产品说明书),浓缩到5ml,冷冻干燥成粉末,得到多糖。将冻干粉末溶于2mlddh2o中,即为粗多糖溶液。
配制7.5%的page胶,参见《分子克隆实验指南》,取20μl粗多糖溶液加入5μl的5×loadingbuffer(终浓度为312.5mmol/l的tris-hcl,甘油终浓度为50%,溴酚蓝终浓度为0.05%,ph6.8的水溶液)120v电泳,待溴酚蓝跑出,收胶。用0.5%的亚甲基蓝溶液(用3%的醋酸溶液配制)染色30min分钟后,3%的醋酸溶液脱色。
结果见图3,可以看出,敲除突变株δhah_1662中无多糖存在,而野生株atcc33960与表达回复株δhah_1662+hah_1662中可以提取到多糖。因此,表明hah_1662基因为与多糖合成相关的基因。
四、多糖性质检测
1)、发酵制备多糖
嗜盐古菌har.hispanic表达回复株δhah_1662+hah_1662在1l的as-168培养基中,37℃200rpm,培养至稳定期,13,000×g离心30分钟离心去除菌体,保留上清。
将发酵上清用4倍体积的无水乙醇在4℃沉淀过夜,13,000×g离心30分钟收集沉淀;将沉淀用500ml蒸馏水复溶后,在截留量为8000-12000分子量的透析袋内用蒸馏水透析除盐,然后在透析袋内加入核酸酶10μl(购自sigma,≥250units/μl,mw30kda),37℃放置12小时;再加入3mg蛋白酶k(购自sigma,≥30units/mg,mw29kda),37℃放置12小时;期间换水继续透析。将透析液再经过13,000×g离心30分钟,收集上清,将上清溶液经过100kda截留量的超滤浓缩装置,浓缩到250ml,冷冻干燥成粉末,得到粗多糖,将冻干粉末溶于缓冲液a(20mmnaac溶液)中,得到粗多糖溶液,粗多糖浓度为10mg/ml。
2)纯化
(1)离子交换柱纯化
上述粗多糖溶液经deae-sepharosefastflow(购自sigma)离子交换柱吸附后,用缓冲液b(含2.5mnacl的20mmnaac溶液)梯度洗脱5个柱体积,流速为0.5ml/min。将洗脱下来的组分收集,用紫外检测器(280nm)、苯酚硫酸法和酸性多糖电泳法鉴定每管洗脱组分。当nacl浓度在1.25m-1.55m时,洗脱下来的组分即为纯化的酸性多糖。结果见图4中a和b,其中41-47管(nacl浓度在1.25m-1.55m)即为洗脱下来的酸性多糖。将酸性多糖各管组分合并(41-47管),装进透析袋(截留量14000da)用蒸馏水透析除盐后,冻成干粉。
(2)sephacryls-400/hr柱纯化
将上述(1)的干粉用ddh2o溶解成多糖含量为2mg/ml的溶液,经过sephacryls-400/hr柱(购自gehealthcare),用ddh2o洗脱,流速为0.5ml/min。每管用苯酚硫酸法检测多糖含量,并收集主峰,冻成干粉,称重,1las-168培养基可以获得纯多糖30mg。
3)多糖的均一性分析及分子量的测定
将上述2)得到的纯多糖干粉溶于ddh2o中,配制成3mg/ml的溶液,取40μl溶液经过tskg4000分子筛柱分析样品的均一性,流动相为0.1mnano3,流速为0.5ml/min,柱温为30℃,利用示差折光检测器来检测。利用不同分子量的dextran(50kda,80kda,150kda,270kda,410kda,670kda,1100kda)来做标准曲线,确定该酸性多糖的分子量。经测定,该酸性多糖分子量为1100kda,见图4c。
4)、多糖的单糖组成测定
将200μg上述2)得到纯多糖,利用2m三氟乙酸(tfa)在121℃下水解2个小时,真空旋转干燥,利用硼氢化钠(nabd4)还原单糖,利用乙酸酐来乙酰化单糖。选择20μg的肌醇(inositol)作为内参。乙酰化的糖醇利用gc-ms分析确定其种类(agilent7890agcinterfacedtoa5975cmsd,electronimpactionizationmode)。分离柱为30msupelcosp-2331bondedphasefusedsilicacapillarycolumn。
gc-ms结果见图5,该多糖中的单糖由甘露糖,半乳糖和葡萄糖组成,其组成的摩尔比为甘露糖:半乳糖:葡萄糖=55.9:43.2:0.9,碳水化合物(所有单糖)占该多糖总量的51%(质量百分含量)。
该多糖的组成不同于其他在嗜盐古菌中发现的多糖,见表1。
表1为已知嗜盐古菌多糖的单糖组成比较
5)、多糖的硫酸根含量测定
将上述2)得到纯多糖干粉与kbr粉末一起研磨后,取少量进行红外光谱检测(thermonicoletis5),所选波长为500-4000cm-1,结果见图6。多糖在3520cm-1处有一大的吸收峰值,这是-oh基团的吸收特征;2937cm-1处的吸收峰是由于c-h键的伸缩振动;1645cm-1处的吸收峰来自于c=o键的伸缩振动;900-1150cm-1处的吸收峰来自c-o-c键的伸缩振动;而1258cm-1和855cm-1处的吸收峰则是来自s=o键的伸缩振动。ftir的结果提示,该多糖是硫酸化的。利用离子色谱对该多糖的硫酸根含量进行了测定,取2mg纯多糖,用2mtfa,在121℃下密闭管中水解2小时后,真空旋转干燥,将水解后样品溶于ddh2o中,利用高效液相离子色谱仪(ics-2100,thermoscientific)检测so42-含量,选择ionpacas11-hc分析柱,柱温维持在30℃,流动相为30mmnaoh溶液,流速为1ml/min。利用na2so4做标准曲线,测定该多糖so42-含量为26%(w/w)。
7)、多糖的一维氢谱,碳谱测定
将40mg上述2)得到多糖溶于0.5ml重水中(99.96%纯度的d2o),冷冻干燥交换3次,进行一维质谱检测(brukeravanceⅲ500mhzspectrometer)。1h谱时用d2o(4.70ppm)作为内参,13c谱时用dmso(39.39ppm)作为内参。一维氢谱、碳谱结果见图7a,13cnmr结果(图7b)显示了四个异头碳原子,分别为δ104.12,103.85,102.52和96.07ppm,60-85ppm为糖环上的碳原子信号,意味着多糖的重复单位由4种类型的单糖(甘露糖,半乳糖,葡萄糖及一种硫酸化修饰的上述单糖)构成。
序列表
<110>中国科学院微生物研究所
<120>基因hah_1662在制备多糖中的应用
<160>3
<170>patentinversion3.5
<210>1
<211>1194
<212>dna
<213>嗜盐古菌haloarculahispanic
<400>1
atggatatcctccacacgccggtccgattctatccttatatcggcggtgtagagacgtac60
gtacacgacctttcgaagaaattggttaagttcaatcacaacgtaacagtggtctgtgcc120
aaagtcgacgaagagacagagcgttgtgaaactatcgacggtatcgatgtacggcgattg180
accagcgtaggtcagatggcgaacactaatataactcctgcgcttcctgcagtgctaatt240
gaggaagcgcaatccgcagacgtaattcacacacatctacctacaccttggttcgcggat300
ctcagtgtccttgctggggtggtaacgggaacaccggtcgttatcacctatcacaatgat360
atcgtgggtgatggaatagctaatcacattgcctatttctataaccagacttggctccga420
ctgacacttcgatattcagatcgaatcatcgtcacacagccagattacgtggagaactcc480
aagtatctcagtccggaaatggataaaattgagattatctcaaacggtgttgacgtcaac540
tattttgaaccgaagacagtctcagccgaggatttggctcgtcttgggttcgacgaatcg600
cgtcccacactattctttttgagtgttctcgacggacaccacgattacaaaggattgaca660
gacctgctagaagcgttggccctgctagtcaaagaagaagatacgactccacaacttctc720
gtcggtggagggggagagtccaagtcaacttatgaacatcgagctgcaaaactcggtgtc780
gatcagttcgttgatttcctcggtcgagttccagaagacgatctggtcaattattattcg840
gcagccgatctttttgtgctaccctcaacaagtagcgaccaagaggggttcggcttagtg900
ttactggaggcgctggcaagtgggactcccgtagtaactacgaatgtcgttggtatcgct960
gaagaggtcaaacaaaatcctgtcggaacgatcgctccaaaggaaaatcccgaggcactg1020
gcgtcttcgattcgaactacgttatcgaatgacgaatttgatttagaggtcgcacgcaac1080
ctctgtgtacagaactattcgtggcgagctagtgctgaagatctggaagccatctatgag1140
agagtttgcgaaacgtcaatcgatcataacgaggtacatgaagacttagtttag1194
<210>2
<211>403
<212>prt
<213>嗜盐古菌haloarculahispanic
<400>2
metgluthraspileleuhisthrprovalargphetyrprotyrile
151015
glyglyvalgluthrtyrvalhisaspleuserlyslysleuvallys
202530
pheasnhisasnvalthrvalvalcysalalysvalaspglugluthr
354045
gluargcysgluthrileaspglyileaspvalargargleuthrser
505560
valglyglnmetgluthralaasnthrasnilethrproalaleupro
65707580
alavalleuilegluglualaglnseralaaspvalilehisthrhis
859095
leuprothrprotrpphealaaspleuservalleualaglyvalval
100105110
thrglythrprovalvalilethrtyrhisasnaspilevalglyasp
115120125
glyilealaasnhisilealatyrphetyrasnglnthrtrpleuarg
130135140
leuthrleuargtyrseraspargileilevalthrglnproasptyr
145150155160
valgluasnserlystyrleuserproglumetgluthrasplysile
165170175
gluileileserasnglyvalaspvalasntyrphegluprolysthr
180185190
valseralagluaspleualaargleuglypheaspgluserargpro
195200205
thrleuphepheleuservalleuaspglyhishisasptyrlysgly
210215220
leuthraspleuleuglualaleualaleuleuvallysglugluasp
225230235240
thrthrproglnleuleuvalglyglyglyglygluserlysserthr
245250255
tyrgluhisargalaalalysleuglyvalaspglnphevalaspphe
260265270
leuglyargvalprogluaspaspleuvalasntyrtyrseralaala
275280285
aspleuphevalleuproserthrserseraspglngluglyphegly
290295300
leuvalleuleuglualaleualaserglythrprovalvalthrthr
305310315320
asnvalvalglyilealaglugluvallysglnasnprovalglythr
325330335
ilealaprolysgluasnproglualaleualaserserileargthr
340345350
thrleuserasnaspglupheaspleugluvalalaargasnleucys
355360365
valglnasntyrsertrpargalaseralagluaspleuglualaile
370375380
tyrgluargvalcysgluthrserileasphisasngluvalhisglu
385390395400
aspleuval
<210>3
<211>1226
<212>人工序列
<220>
<223>
<400>3
tatggccgagaacatcctcgtactcttcgagaaagcctaacatcgaaacgcggtcggcgt60
gttccagtgattcgcgtttggtatccagccggtcacgctccgggccgtcaccgatgatac120
ctagcgtgacgtcatgcctgtcggcgactacatcgaatgcctctagcagaatgtcgacgt180
tcttgtgctcgatcagtcgacctgcgaagacgatgtcgtagccggtgtcggggcgggggg240
ccgtctggacctgctcggtatcgagcccgtttggcacgacctcgatatgctcgcgattcg300
ggccgatgtcagcgaggttgtccgctgtgatgcccgaaaccgcgatcggatgctggggtg360
tcttggccgtgagttgttcgacgagtttgccacccggaacgagcgatctgaagtccatct420
tcaagtgcagaaacagtttgtcatcgccggttctaatcttgagcgacacggcgatcgtag480
cgcacttgggacactcttagacaccagggatttctcctcctcaggtgagtcagttgcaaa540
ggaactcaaaatatttataacacaaccaactgattggagaccgaatctttgataccctta600
tctaatttactaattcccaaaccgtttcaatcgacggtatatcctgattattctttcagt660
gattcatacacttcaacgagtcgatctatatgggtctcaaggctcacatcaacgtcagtc720
agatttgttgcaagccgagttgagtcacctttatgagactcaattacattggcgagaata780
ttcgcttgttctggcttgaaacaataccctgtctcgtcttcttcaatcaattcaggaata840
ccaccaatatctgccccgatgactggtgtttggcgtgcatagctctcataaatgaccatc900
ggggaattatcgtaccagcgagatgggacgacagtgtaatccgcgatagtgtattggcgc960
gctagctcttcttctgatacgaacccgtgaaatttgactctcttgtcgtttctagctcgt1020
ttttcgagcatctcccgatctggtcccttacctaaaatgtgaagttcaagatcaggatca1080
tcaagttgcttcatggcatcaatgagaatatcaattcctttgctgtaggtgagttgaccc1140
gcatataggagacgagtattacactgatcgtagtttttagctttatattgttttaattct1200
gttgtatctataccaagaggtatgcg1226
- 还没有人留言评论。精彩留言会获得点赞!
- 化药/基因共转运功能化碳纳米管的制备方法及应用与流程
- 抗体基因的表达‑分泌系统的制作方法与工艺
- 抗体捕获蛋白及报告基因融合重组蛋白检测抗体的方法与流程
- 治疗性重组抗体、其编码基因及应用的制作方法与工艺
- 一种制备高效合成泛酸基因工程菌的方法及其应用与流程
- MACF1基因及其表达产物在制备诊断和治疗骨质疏松症药物中的应用的制作方法与工艺
- 野生型IDH2基因作为靶标在制备非小细胞肺癌治疗药物中的应用的制作方法与工艺
- FBN1基因在制备检测先天性单纯性晶状体异位制品中的应用的制作方法与工艺
- TMEM104基因在制备治疗椎间盘退行性疾病药物中的应用的制作方法与工艺
- PSMG4基因在制备男性骨质疏松症诊断产品中的用途的制造方法与工艺