储存材料和储存氯气的方法与流程
本发明从基于改性二氧化硅的本身已知的储存材料出发,其在现有技术中已知用于液氯的吸附性储存。
在氯气的工业制造和使用中,存在能够被优化的各种工艺步骤。这些包括氯气液化以便储存和运输液氯和以便提纯和从含氯工艺气体中回收氯气。
对于工业使用,氯气以液体形式储存和运输到各自的消耗点,其中通过管道或在地面上通过公路或铁路进行运输。在这种情况下,氯气在室温下在例如约7bar的高压下通常呈液体形式。替代这一方式,氯气也可以在低压下、但同时在-35℃范围的非常低的温度下储存。在储存时以及在输送氯气时,希望能够在变化的条件下在较低压力或较高温度下工作,以降低能源成本。此外,从操作安全性的观点来看,能够处理较低的容器压力也是非常有利的。例如,如果氯气所处的压力低于室温下的平衡蒸气压(约7bar),则其在发生泄漏时不能快速逸出,并且将获得用于采取相应的保护和维修措施的时间。
氯气的液化也用于其提纯,以分离出在生产过程中形成的杂质。这些杂质包括其它气体,如氧气、氮气或二氧化碳,它们的沸点低于氯气,因此可以通过氯气液化而分离出去。在氯气液化时,用于冷却氯气的高能源支出和与之相关的能源成本是巨大缺点。在此希望的是在具有较低压力或较高温度的条件下(例如在室温下压力p<7bar或在大气压下温度t>-35℃)和因此通过较低的能源支出来实现液化,这将大大降低与之相关的能源成本。
上述用于氯气液化以便储存和运输和提纯的方法方式在现有技术中是常规的。尚未描述用于对于这些应用而在较温和的条件下液化氯气和因此获得能源消耗、能源成本和安全性方面的优势的替代性方法。
在氯气的生产中以及在使用氯气的其它化学生产中,形成含有残余量氯气的各种工艺气体。通常通过例如与氢氧化钠溶液的化学反应而从工艺气体中除去氯气,由此其不再是可用氯的形式。其也可以通过用有机溶剂,例如用四氯化碳的物理吸收来除去,由此氯气同样不再能直接用于化学加工,因为其含有有机杂质。这里希望的是以简单的方式从工艺气体中回收氯气而没有杂质,因此使其可以再次用于化学反应。
为了从工艺气体中回收氯气,描述了通过变压吸附(psapressureswingadsorption)法在多孔性固体上吸附氯气。在ep0741108a2中提出了沸石、非沸石多孔性酸性氧化物、活性炭和分子筛碳作为氯气吸附剂。us5376164a1描述了分子筛,包括沸石筛、活性炭、活性粘土、硅胶和活化氧化铝作为吸附剂。us5376164a1中描述的各种沸石和硅胶上的氯气吸附测量显示了在各自的测量条件(室温,最大0.87bar)下<0.2g氯气/g储存材料的最大氯气吸收能力,这是非常低的并且对于工业应用而言太贵。
在[j.phys.chem.,1942,46(1),第31-35页]中,早已研究了在硅胶上的氯气吸附,其中在测量条件(-26℃,最大0.97bar)下硅胶的氯气吸收能力是0.26g氯气/g储存材料。在w.q.xiao,dissertation,chlorineadsorptionpropertiesofnax,nay,mcm-41,mcm-48andmordenitemolecularsieves,taiyuanuniversityoftechnology,china,2010]中描述了在介孔二氧化硅(mcm-41、mcm-48)上的氯气吸附的测量。在测量条件(0℃、30℃和50℃,最大3.25bar)下,测量了<0.2g氯气/g储存材料的最大氯气吸收能力。在所有这些情况下,氯气吸收能力对于工业使用而言仍然太低,并且对于工业应用而言仍然太贵。
对于工业规模的氯气储存的技术应用而言,短的加工时间也是非常重要的;因此,氯气吸附时间和解吸时间应尽可能短。
在us5376164a1中描述了需要大约2小时直至吸附剂吸收氯气并且不再发生重量增加。没有更详细地描述解吸所需的时间。对于工业应用,这在技术支出和与之相关的成本方面是不利的。因此,希望在分钟范围的吸附和解吸时间。
变压吸附法目前尚未在商业上用于氯气回收。
本发明的目的是提供用于氯气储存方法的基于二氧化硅的储存材料,该储存材料能够通过吸附而吸收大量的氯气,并且可以以简单的方式获得。还可以使用这些储存材料从而以简单的方式从工艺气体中分离和回收氯气。
本发明的特别目的是提供储存材料,其具有比迄今所述的吸附剂基本更高的氯气吸收能力(即至少0.4g氯气/g储存材料的能力),以由此避免商业实施时的成本缺点。该储存材料尤其还必须对腐蚀性氯气具有化学和结构稳定性。优选地,氯气在该储存材料上的吸附应是可逆的,以便使尽可能多的氯气可再用。此外,在该储存材料上氯气的吸附和解吸应能够比已知储存材料尤其更快地进行,以实现商业应用。
令人惊讶地已发现,纳米多孔形式的二氧化硅非常适合于大量吸收氯气,该二氧化硅具有孔径范围为<10nm的开孔结构,优选与孔径为至少20nm的较大孔(其可以例如通过颗粒间隙形成)组合,以及至少0.91的缩合度。由此实现的高达>1g氯气/g储存材料的吸收能力远远优于迄今所述的吸附剂。此外,该储存材料特别满足进一步的标准,例如对氯气的腐蚀稳定性、氯气吸附的可逆性以及分钟范围的快速吸附和解吸。
本发明提供了用于将氯气以液相形式储存的基于二氧化硅颗粒的多孔性储存材料,其中所述颗粒具有孔径<10nm的孔,孔径分布中的最大值为1nm至8nm,优选1.5至2.5nm,并且二氧化硅以通过29硅固态nmr波谱法测定为至少0.91,优选至少0.94的缩合度存在。
令人惊讶地同样已经发现,在该储存材料上的吸附使得氯气能在比相应的纯氯蒸气压曲线的条件更低的压力或更高的温度下在孔内液化氯气,这为了提纯、储存和运输的目的而带来了如上所述在能源消耗、成本和安全性方面的优点。
特别是还令人惊讶地发现,在该储存材料上氯气的吸附完全可逆地进行,这在类似于现有技术中原则上已知的psa法的变换吸附方面和在从含氯工艺气体中回收氯气时是有利的。
此外,令人惊讶地发现,通过所述新型储存材料的氯气的负载以及卸载均尤其表现出更快的动力学,即在分钟范围发生。此外在此还发现,在具有孔径分布最大值为<10nm数量级的孔与孔径≥20nm的较大孔的组合的储存材料的情况下,吸附动力学额外地加速。这种附加的较大孔可以由颗粒间隙产生,其在存在粒径小于1μm的颗粒时形成。
优选的储存材料的特征在于二氧化硅颗粒的粒径为30nm至2μm,优选100nm至1μm。在本发明的另一个优选实施方案中,所述颗粒的平均粒径为200nm至1μm,优选300nm至700nm。
所述储存材料的一个特别优选的实施方式包括二氧化硅颗粒,其在0℃和最高3bar下已经具有至少0.4g氯气/g储存材料,优选至少0.6g氯气/g储存材料,特别优选至少1g氯气/g储存材料的负载能力。
所述储存材料的一个优选实施方式的特征尤其在于,储存材料用于氯气负载的持续时间<40分钟,用于氯气卸载的持续时间<60分钟,基于1g氯气/g材料计且在-26℃和1bar下测量。
对于实际应用,在本发明的一个优选实施方式中,上述储存材料的二氧化硅颗粒三维彼此包装以形成储存体。
上述储存体的优选形式的特征在于,该储存体具有孔径为至少20nm,优选20nm至2μm的附加孔。这些附加的孔用作传输孔,其便于用氯气负载材料,从而减少负载时间。
根据本发明的储存材料和根据本发明的储存体适宜地用于形成用于可逆储存氯气的储存系统。
因此,本发明还提供了用于将氯气以液相形式可逆储存的储存系统,其至少包括用于含氯气体的进料管、用于含氯气体的排出管、任选的用于与氯气分离的残余气体的排出管、用吸附氯气的基于二氧化硅的储存材料填充的隔热压力容器,其特征在于提供本文所述的新型储存材料或本文所述的新型储存体作为储存材料。
借助于所述新型储存材料,将氯气以液相形式可逆储存的新型方法也是可行的。
因此,本发明还提供了将氯气以液相形式可逆储存的方法,该方法包括至少下列方法步骤:
将含氯工艺气体进料到在0.25bar至10bar的压力下保持在最高40℃温度的储存材料中,然后通过将惰性气体导过储存材料而使储存的氯气解吸,或通过任选降低储存材料上的压力或通过提高储存材料的温度而使储存的氯气解吸,其特征在于本文所述的新型储存材料或本文所述的新型储存体用作储存材料。
优选地,所述新型储存方法在上述新型储存系统中进行。
本发明还提供了多孔性二氧化硅材料用于在具有较低压力或高于氯气沸点的温度的条件(例如在室温下p<7bar或在大气压下t>-35℃)下吸收大量氯气(>0.4g/g储存材料)的用途,该材料包括至少一种孔径为<10nm数量级的孔。优选地,使用具有孔径为<10nm数量级的孔与孔径>20nm的较大孔的组合的储存材料。
优选地使用如上所述的新型多孔性储存材料或新型储存体以吸附氯气以便从含氯气的工艺气体中分离氯气。优选地,该用途中的工艺气体除了氯气之外还含有诸如氢气、氧气、氮气之类的气体或诸如氩气和氦气之类的惰性气体。这种气体在储存条件下(在大气压下储存温度t>-35℃)不可冷凝。特别优选是由氯气液化方法的残余气体构成的工艺气体,其含有氯气、氢气和氧气作为主要成分。
所述工艺气体也可以优选是由hcl隔膜电解的阴极电解液室获得并且至少含有氢气和氯气的气体。
在另一个用途的实施方式中,工艺气体是来自用于氯化氢与氧气反应的气相氧化工艺的至少含有氧气和氯气的废气。
本发明此外优选地还提供了如上所述的新型多孔性储存材料或新型储存体用于氯气液化以便提纯、储存或液氯的操作安全运输的用途。
特别是,适用于在具有较低压力或高于氯气沸点的温度的条件(例如在室温下p<7bar或在大气压下t>-35℃)下吸收大量氯气的储存材料是缩合度为至少0.91(通过29硅固态nmr波谱法测定)并且因此对氯气具有高化学和结构耐受性的那些。缩合度最高为0.90(通过29硅固态nmr波谱法测定)的其它二氧化硅储存材料对于根据本发明的用途而言不具有足够的稳定性,因为可以观察到由于与氯气接触所致的结构和/或化学变化。
下面参考实施例和附图更详细地解释本发明,然而它们并不限制本发明。
图1显示了根据本发明的二氧化硅储存材料a在-26℃、0℃和30℃下的氯气储存等温线。储存材料a由平均孔径为1.4nm至3.4nm、粒径为约100nm至800nm的sio2构成。
图2显示了根据本发明的二氧化硅储存材料b在-26℃、0℃和30℃下的氯气储存等温线。储存材料b由平均孔径为1.8nm至3.2nm、粒径为约300nm至1μm的sio2构成。
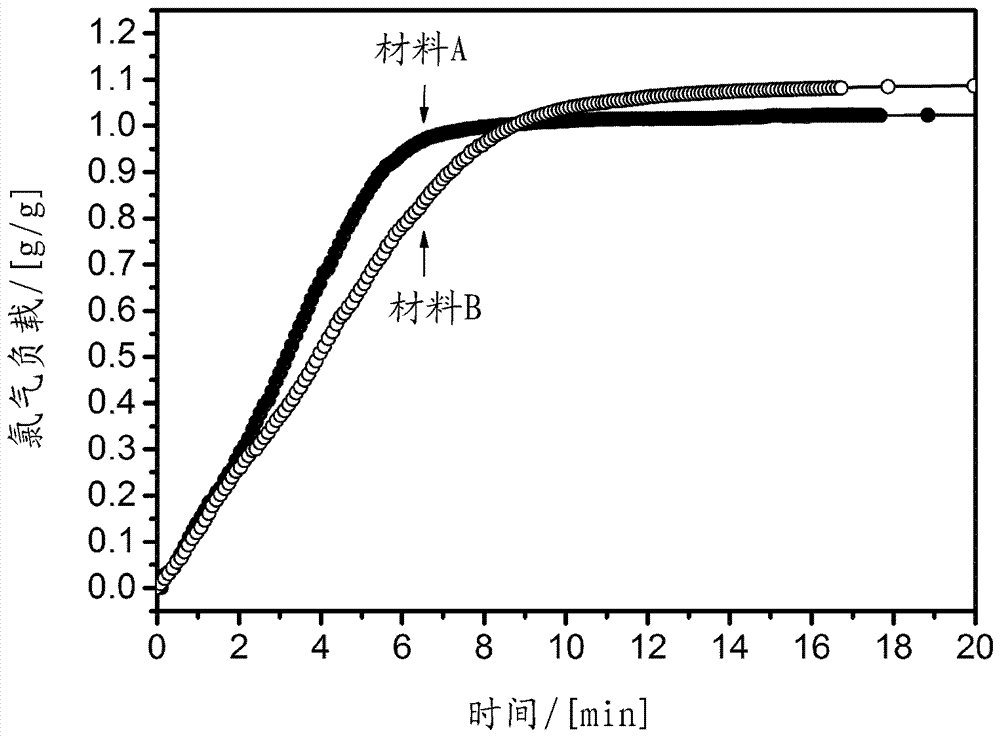
图3显示了在-26℃下根据本发明的二氧化硅储存材料a和b上的时间依赖性氯气吸附。
图4显示了在具有比材料a和b更大颗粒的对比二氧化硅材料c上的时间依赖性氯气吸附。对比材料c由平均孔径为5.5nm至8nm、粒径为约1μm至1.5μm的sio2构成。
图5显示了在-26℃下根据本发明的二氧化硅储存材料a和b的时间依赖性氯气解吸。
实施例
实施例1:
实现比现有技术更高负载的两种储存材料如下制备:
材料a:材料a由平均孔径为1.4nm至3.4nm、粒径为约100nm至800nm的sio2构成。
根据下列配方进行制备:在室温下搅拌下,将87.5ml乙醇和70.3ml去离子水与7.9ml氨水溶液(25重量%)混合。加入2.83g鲸蜡基三甲基溴化铵并通过在室温下搅拌10分钟溶解。在搅拌下,快速加入5.42g原硅酸四乙酯并再搅拌2小时。通过离心(在6000min-1下10分钟)分离出形成的无色固体。将固体再分散于40ml乙醇中并通过离心(在6000min-1下10分钟)分离出。然后将固体在50℃下在空气中储存16小时,然后在500℃下在空气中煅烧15小时。得到的储存材料由粒径为约100nm至800nm的球形颗粒构成。其内表面积为abet=1161±23m2/g,孔体积为vp=0.83cm3/g。孔径为1.4nm至3.4nm,孔径分布的最大值为2.3±0.5nm。另一批材料不同地具有abet=1536±97m2/g的内表面积和vp=0.70cm3/g的孔体积。
材料b:材料b由平均孔径为1.8nm至3.2nm、粒径为约300nm至1μm的sio2构成。
根据下列配方进行制备:在室温下搅拌下,将1.75g鲸蜡基三甲基溴化铵溶于411.6ml去离子水中。向该溶液中加入31.6ml氨水溶液(25重量%),并在室温下搅拌20分钟。在搅拌下,快速加入8.33g原硅酸四乙酯。在室温下搅拌5小时。通过过滤分离出所得无色固体,用50ml水洗涤并在105℃下干燥24小时。然后在500℃下在空气中煅烧15小时。所得储存材料由粒径为约300nm至1μm的颗粒构成。其内表面积为abet=1036±5m2/g,孔体积为vp=0.78cm3/g。孔径为1.8nm至3.2nm,孔径分布的最大值为2.5±0.3nm。
为了研究储存材料的氯气储存能力,记录氯气吸附等温线。在此,为了在磁悬浮天平中测量氯气在材料上的吸附,将约200mg储存材料在2x10-3bar和150℃下充分加热。对于特定的温度和氯气压,测量样品的质量增加,由此获得吸附等温线。
图1显示了在-26℃、0℃和30℃下氯气在材料a上的吸附和解吸等温线。图2显示了在-26℃、0℃和30℃下氯气在材料b上的吸附和解吸等温线。从等温线可以看出,所述材料具有超过1g氯气/1g储存材料的氯气储存能力。因此,它们明显优于现有技术中描述的储存能力最高0.26g氯气/1g材料的材料。储存等温线另外表明,在低压下就已发生相当大的氯气吸附。该材料表现出例如在0℃的温度和3bar的压力下大于0.4g氯气/1g储存材料的负载。在相同条件下,[w.q.xiao,dissertation,chlorineadsorptionpropertiesofnax,nay,mcm-41,mcm-48andmordenitemolecularsieves,taiyuanuniversityoftechnology,china,2010]中在sio2上的氯气负载为低于0.2g氯气/1g材料。
储存材料上氯气的吸附是完全可逆的,如从吸附等温线(图1和图2中的实心符号)与相应的解吸等温线(图1和图2中的空心符号)在最大和最小负载时的几乎一致的曲线可以看出。
实施例2:
储存材料实现在大气压下在高于-35℃的温度下或在室温下在低于6.8bar的压力下在孔中液化氯气,这由相同条件下被吸附的氯气的密度与液态和气态氯气的密度的比较可以得出结论:
在t=-26℃的温度和p氯气=0.90bar下,对于吸附质量mads=1.03g/g、孔体积vp=0.70cm3/g的材料a得出被吸附的氯气的平均密度ρ=1.47g/cm3。在相同条件下,对于吸附质量mads=1.09g/g、孔体积vp=0.78cm3/g的材料b观察到被吸附的氯气的平均密度ρ=1.40g/cm3。由于在这些条件下液氯的密度为1.53g/cm3且气态氯气的密度为0.003g/cm3,因此孔中的氯气大部分为液体形式。
类似地,对于t=30℃和p氯气=6.53bar下,对于吸附质量mads=0.95g/g、孔体积vp=0.83cm3/g的材料a可以观察到被吸附的氯气的平均密度ρ=1.14g/cm3。对于吸附质量mads=0.97g/g、孔体积vp=0.78cm3/g的材料b,在t=30℃和p氯气=6.50bar下得出被吸附的氯气的平均密度ρ=1.24g/cm3。在这些条件下液氯的密度为1.38g/cm3而气态氯气的密度为0.003g/cm3。因此,这里被吸附的氯气大部分也是液体形式。
实施例3:
为了研究储存材料的负载动力学,在0.01bar和150℃下充分加热约150mg储存材料。将该储存材料引入磁悬浮天平中,并在t=95℃和p=1bar下用氮气以150sccm的气流绕流,直至达到恒重。在t=-26℃,p=1bar和150sccm的总气流下,气流的特定体积含量被氯气替换。为了研究吸附动力学,将气流中的氯气体积含量从0体积%增加至88.5体积%,并测量时间依赖性的质量增加。
材料a和b的负载主要遵循受限的线性增长(见图3)。对于用氯气完全负载,得出约10至20分钟的时长。材料的快速负载归因于通过例如由在粒径小于1μm时相应的颗粒间隙形成的附加的较大传输孔(直径>20nm)容易接近储存孔(直径<10nm)。
制备粒径较大的材料c。因此,相对于较小储存孔而言,较大传输孔的数量显著减少。
材料c:c由平均孔径为5.5nm至8nm、粒径为约1μm至1.5μm的sio2构成。
材料c的制备类似于[j.am.chem.soc.,1998,120(24),第6024-6036页]进行。在室温下搅拌下,将4.0g聚(乙二醇)-嵌段-聚(丙二醇)-嵌段-聚(乙二醇)(mn~5800,商品名pluronicp123)溶于30ml水和130mlhcl水溶液(2.0m)的混合物中。向溶液中加入8.5g原硅酸四乙酯,并将其在室温下再搅拌5分钟。然后将该溶液在35℃下加热18小时,然后在80℃下加热24小时。滤出所得无色固体,用50ml水洗涤两次,用50ml乙醇洗涤一次,然后在500℃下在空气中煅烧30小时。材料c由粒径为约1μm至1.5μm、内表面积为abet=656±3m2/g、孔体积为vp=0.77cm3/g的sio2颗粒构成。储存孔的直径为5.5nm至8nm,其中孔径分布的最大值为6.6±1.0nm。
样品c的负载动力学如图4所示。对于最大负载,样品c需要至少20分钟,而在a和b情况下的最大负载在约10分钟的时间内实现。因此,在材料c的情况下,相对于储存孔而言较少数量的传输孔导致材料的负载显著较慢。
解吸动力学的研究类似于吸附动力学的研究进行,其中气流中氯气的体积含量从88.5体积%降低至0体积%并且测量时间依赖性的质量增加。
材料a和b的卸载主要对应于被吸附的氯气的指数型减少(见图5)。材料a和b的完全卸载在20分钟内完成。
实施例4:
为了研究材料对氯气的结构和化学稳定性,使材料与氯气接触,然后再次表征。在此,大于0.91的缩合度被认为是高稳定性的重要参数。在该实施例中sio2材料的缩合度的测定通过29硅固态nmr波谱法(在10khz下的魔角旋转)进行。通过不同qn中心(qn=si(osi)n(oh)4-n)的信号的去卷积和积分,确定材料中相应中心的含量。材料的缩合度作为所有si-or键中的si-osi键含量给出(缩合度=(si-osi键数)/(si-or键总数))。
缩合度为0.95的材料a和缩合度为0.92的材料b在反复完全用氯气负载和卸载后也没有表现出结构变化。可以通过能量色散x射线谱法证明在处理后储存材料a和b中不存在氯气。因此可以排除在处理过程中储存材料与氯气的不可逆反应。
制备了具有较低缩合度并因此不具有足够氯气稳定性的对比材料d。
对比材料d:材料d由缩合度为0.90的气凝胶形式的sio2构成。
对比材料d的制备:在室温下,将4.0ml原硅酸四甲酯溶于3ml甲醇中。在剧烈搅拌下,迅速加入2.0ml的0.1m氨水和3.0ml甲醇的溶液,并在室温下再搅拌1分钟。20分钟后形成的凝胶在室温下保存1天。然后通过用丙酮覆盖来替换凝胶中的溶剂。在高压釜中,通过用液态co2(62bar,室温)覆盖来替换凝胶中的溶剂。通过将温度升高至超过40℃(p>80bar),使co2进入超临界状态。然后将压力以约5bar/h降至常压并移除该材料。
在室温和常压下与氯气气流接触30分钟后,缩合度为0.90的对比材料d就表现出相当大的结构变化。内表面积(abet)从820±3m2/g降至649±1m2/g,而孔体积(vp)从1.95cm3/g增加到3.14cm3/g。通过ir光谱,尤其可以观察到相对于sio振动而言减少的oh振动。由此得出已在该材料中发生化学反应。
- 还没有人留言评论。精彩留言会获得点赞!