具有难熔长石/似长石的大孔氧载体固体,其制备方法及其在化学链氧化还原方法中的用途与流程
本发明涉及氧载体固体,其制备及其在活性物质的化学链氧化还原方法中的用途。特别地,根据本发明的新型氧载体固体可以用于化学链燃烧(clc)方法。
背景
活性物质的化学链氧化还原方法在能量生产、燃气轮机、锅炉和熔炉领域中是已知的,尤其是用于石油、玻璃和水泥工业。
特别地,电、热、氢或蒸汽的生产可以通过这种类型的方法实现,通常是clc方法,其使用活性物质的氧化还原反应,以产生来自燃料的热气体,并分离产生的二氧化碳co2,所述活性物质称为氧化还原物质,通常是金属氧化物,所述燃料例如是天然气、一氧化碳co、氢气h2、煤或石油残渣、烃的混合物。然后可以考虑将捕获的二氧化碳co2储存在地质构造中,或将其用作其他工艺中的试剂,或者将其注入油井中以增加从沉积物中提取的烃的量(提高石油采收率(eor)和提高天然气采收率(egr))。
在活性物质的这种化学链氧化还原方法中,活性物质与作为氧化剂的空气或另一种氧化气体的第一氧化反应由于其氧化放热性质,使得可以获得热气体,然后可以利用该热气体的能量。当氧化气体是水蒸气时,活性物质的氧化也使得可以产生富含h2的气态流出物。
然后,氧化的活性物质借助于还原气体、液体或固体(烃原料)进行的第二还原反应使得可以获得可重复使用的活性物质以及基本包含co2和水的气体混合物,或者甚至是含有co和h2的合成气,这取决于还原步骤中提供的条件。
在clc方法中,能量可以例如以蒸汽或电的形式产生。烃原料的燃烧热与常规燃烧中的燃烧热相似。这对应于化学链中还原和氧化的热量之和。通常通过位于内部、壁中或附接到燃料和/或空气反应器、烟道气管线上或活性物质传输线上的交换器来提取热量。
活性物质的这些化学链氧化还原方法的主要优点是使得可以容易地分离构成还原反应器的流出物的无氧和无氮气体混合物中所含的co2(或合成气)。另一个优点在于,当空气用作氧化气体时,产生几乎不含氧的氮气n2(和氩气)流,并且对应于来自氧化反应器的流出物。
因此,在全球能量需求增加的背景下,clc方法提供了用于捕获co2的有吸引力的解决方案,以便将其隔离或将其重新用于其他方法,从而限制对环境有害的温室气体的排放。
例如,专利us5447024描述了clc方法,其包括使用还原气体还原活性物质的第一反应器和通过与潮湿空气的氧化反应将活性物质恢复至其氧化态的第二氧化反应器。循环流化床技术用于使活性物质从还原反应器连续行进到氧化反应器,反之亦然。
专利申请wo2006/123925描述了使用一个或多个含有活性物质的固定床反应器的clc方法的另一种实施方式,氧化还原循环通过切换气体来进行,以便连续地进行活性物质的氧化和还原反应。
活性物质遵循氧化还原循环,交替地从其氧化形式到其还原形式,反之亦然。
应注意,通常来说,术语氧化和还原分别与活性物质的氧化态或还原态对应使用。氧化反应器是其中活性物质被氧化的反应器,还原反应器是其中活性物质被还原的反应器。
因此,在还原反应器中,根据反应(1),通常是金属氧化物(mxoy)的活性物质首先利用cnhm烃还原到mxoy-2n-m/2态,cnhm烃相应地氧化成co2和h2o,或者任选地氧化为co+h2混合物,具体取决于活性物质的性质和使用的比例。
cnhm+mxoy→nco2+m/2h2o+mxoy-2n-m/2(1)
在氧化反应器中,根据反应(2),活性物质在与空气接触时恢复到其氧化态(mxoy),然后返回第一反应器。
mxoy-2n-m/2+(n+m/4)o2→mxoy(2)
在通过蒸汽进行活性物质的氧化的情况中,在氧化反应器的出口处获得氢气流(反应(3))。
mxoy-2n-m/2+(2n+m/2)h2o→mxoy+(2n+m/2)h2(3)
在上面的方程式中,m代表金属。
活性物质在化学链氧化还原方法中起到氧载体的作用。因此,包含活性物质的固体通常包含能够在化学链氧化还原方法的氧化还原条件下交换氧的金属氧化物,这种固体一般称为氧载体固体。
氧载体固体还可包含粘合剂或负载体与活性物质的组合,特别是为了确保氧化和还原反应的良好可逆性,并改善颗粒的机械强度。具体地,例如选自铜、镍、铁、锰和/或钴氧化还原对的活性物质通常不以纯的形式使用,因为在高温下连续的氧化/还原循环导致由于颗粒烧结造成的氧转移能力明显且快速的下降。
因此,在专利us5447024中,氧载体固体包含nio/ni氧化还原对作为活性物质,并与ysz粘合剂组合,ysz粘合剂是钇稳定的氧化锆,也称为氧化钇氧化锆。
除了氧化钇氧化锆ysz之外,已经在文献中研究了许多类型的粘合剂和负载体,以便在比ysz更低的成本下增加颗粒的机械强度。其中,可以提及氧化铝、金属铝酸盐尖晶石、二氧化钛、二氧化硅、氧化锆、二氧化铈、高岭土、膨润土等。
化学链氧化还原方法的有效性主要取决于氧载体固体的物理化学性质。所涉及的活性物质的反应性和氧载体固体(活性物质+粘合剂/负载体)的氧转移能力对反应器的尺寸有影响,并且在循环流化床技术的情况中对颗粒循环速率也有影响,除此之外,工艺中颗粒的寿命对该工艺的操作成本具有主要影响,特别是在循环流化床工艺的情况中。
具体地说,在循环流化床工艺的情况中,颗粒的磨损率使得必须用新鲜氧载体固体补偿细粒形式的氧载体固体的损失,所述细粒形式的氧载体固体通常是直径小于40μm的氧载体固体颗粒。因此,氧载体固体的置换速率在很大程度上取决于颗粒的机械强度以及其在包括许多连续的氧化/还原循环的工艺条件下的化学稳定性。
通常,文献中报道的氧载体固体的性能在氧转移能力和与所测试的各种烃的反应性方面是令人满意的(adanez,j.,abad,a.,garcia-labiano,f.,gayan,p.&dediego,l.f.,“化学链燃烧和重整技术的进展(progressinchemicalloopingcombustionandreformingtechnologies)”,《能源与燃烧科学进展(progressinenergyandcombustionscience)》,38(2),(2012)215-282)。然而,在大多数出版物中,测试时间太短和/或在测试之后对颗粒缺乏彻底的表征使得无法得出关于clc方法中颗粒寿命的结论,尽管一些作者声称具有显著的寿命。
最近的一些研究强调了与clc方法中颗粒经历的许多氧化还原循环相关的颗粒寿命问题。
例如,最近p.knutsson和c.linderholm强调了钛铁矿颗粒(fetio3矿石)的寿命问题(“在用于固体燃料的100千瓦化学循链燃烧器中用作氧载体的钛铁矿的表征(characterizationofilmeniteusedasoxygencarrierina100kwchemical-loopingcombustorforsolidfuels)”,第三届国际化学链会议(3rdinternationalconferenceonchemicallooping),2014年9月9日至11日,瑞典哥德堡)。在100kwth循环流化床中试装置中进行长期试验后,老化颗粒的sem表征表明,颗粒内部形成了高孔隙率,导致其以细粒形式分解,这些细粒在气/固分离旋风分离器中除去。随着氧化还原循环,钛铁矿矿石颗粒的孔隙率大大增加并导致其碎化,可能会使该矿石对该工艺的适用性产生疑问,尽管最初对使用钛铁矿的研究得出结论认为它非常适合于clc方法。通过测试后颗粒的详细表征观察到的孔隙率的增加伴随着亚铁离子和/或三价铁离子通过在颗粒内扩散而导致的迁移。根据作者的说法,颗粒内铁的分离先于其向表面的迁移,产生的孔隙导致颗粒以细粒的形式分解。孔隙的出现是在该过程中形成细颗粒的主要机制,显著地限制了颗粒的寿命,并因此限制了矿石用于clc应用的潜在价值。具体而言,钛铁矿颗粒的估计寿命仅为约200小时("新兴的co2捕获系统(emergingco2capturesystems)",j.c.abanades,b.arias,a.lyngfelt,t.mattisson,d.e.wiley,h.li,m.t.ho,e.mangano,s.brandani,int.j.greenhousegascontrol40(2015),126)。因此,氧载体固体的磨损现象主要是由于与颗粒经历的连续氧化还原循环相关的形态演变,而不是由于对壁的冲击和颗粒之间的冲击,而后者通常被认为是流化床过程中的主要磨损源。
wei等人(“使用铁基氧载体气化生物质的10kwth化学链集成流化床反应器的连续运行(continuousoperationofa10kwthchemicalloopingintegratedfluidizedbedreactorforgasifyingbiomassusinganiron-basedoxygencarrier)”,能源燃料(energyfuels)29,233,2015)也提到了fe2o3/al2o3(70/30)合成颗粒在循环流化床中仅燃烧60小时后转化为小颗粒(即颗粒碎化为细粒)。
l.s.fan等人(“化学链技术平台(chemical-loopingtechnologyplatform)”,aichej.61,2,2015)指出,缺乏工业规模上clc方法的证明与氧载体固体在反应性、可循环性、氧转移能力、机械强度和耐磨性方面的不适应性有关。根据这些作者的观点,对氧载体固体的初步研究没有意识到颗粒内阳离子和阴离子迁移机制的重要性,这会导致相分离,空穴或微孔的出现,团聚,烧结等。
专利申请wo2012/155059公开了氧载体固体的使用,所述氧载体固体由活性物质(20至70重量%),陶瓷或粘土类型的主要负载材料(5至70重量%)和也是陶瓷或粘土类型的次要负载材料(1至35重量%)组成。对于这些氧载体固体,提出了与控制体积膨胀相关的改进的机械稳定性。据解释,铁离子向颗粒外部的扩散运动导致颗粒的体积膨胀,这导致颗粒脆化。在根据wo2012/155059的固体中,主要负载材料使得可以分散金属活性物质并且可以防止其聚集,保持氧化还原活性,而次要负载材料将有助于降低体积膨胀率,这是通过形成稳定固相而防止铁向表面迁移来实现的。
关于负载体上的金属氧化物(通常基于cu、ni、co、fe和/或mn的氧化物的活性物质)的许多研究得出结论,所测试的大多数配方适用于clc方法。
然而,forero等人(c.r.forero,p.gayán,f.garcía-labiano,l.f.dediego,a.abad,j.adánez,国际温室气体控制杂志(int.j.greenhousegascontrol)5(2011)659-667)报道了显著的氧化铜损失,可能是因为在氧化还原循环期间活性相向颗粒外部迁移。然后表面处的铜因为磨损而以细粒形式除去。另外,cuo/al2o3颗粒的孔隙率随循环次数而增加,并且铝基质逐渐破裂,导致细颗粒的形成。adanez-rubio等人(energyfuels2013(27)3918)因此报道了基于浸渍在各种负载体(tio2,sio2,mgal2o4)上的cuo的颗粒批料的振实(填充)密度明显降低,这可能是因为颗粒的孔隙率显著增加,意味着这些颗粒的寿命是有限的。
如l.s.fan等人报道的,fe2o3/al2o3颗粒也遇到金属随循环次数迁移的问题(“铁氧化中的离子扩散-负载体的作用及其对化学链应用的影响(ionicdiffusionintheoxidationofiron-effectofsupportanditsimplicationstochemicalloopingapplications)”,energyenviron.sci.,4,876,2011)。
lyngfelt等人在功率为10kwth的循环流化床设备中进行1000小时的镍基颗粒(40%nio/60%nial2o4)测试(linderholm,c.,mattisson,t.&lyngfelt,a.,“在使用天然气作为燃料的10千瓦化学链燃烧器中喷雾干燥颗粒的长期完整性测试(long-termintegritytestingofspray-driedparticlesina10-kwchemical-loopingcombustorusingnaturalgasasfuel)”,fuel,88(11),(2009)2083-2096)。作者得出结论,颗粒的寿命约为33000小时,但在测试结束时观察到相当高比例的聚集物,部分固体附着在反应器壁上。由于镍向外部迁移,在颗粒表面上存在镍金属可能是观察到聚集物形成的原因(jerndal,e.,mattisson,t.,thijs,i.,snijkers,f.&lyngfelt,a.,“通过喷雾干燥产生的用于化学链燃烧的nio/nial2o4氧载体的研究(investigationofnio/nial2o4oxygencarriersforchemical-loopingcombustionproducedbyspray-drying)”,internationaljournalofgreenhousegascontrol,4,(2010)23)。这种聚集物代表了clc方法意外关闭的重大风险。此外,老化颗粒的表征不足以真正得出该固体用于clc的优势。由申请人进行的类似载体颗粒的间歇流化床试验显示镍向颗粒周边大迁移,并且在大颗粒的表面上形成基本由镍组成的细颗粒(尺寸为0.1至5μm)。测试的颗粒最初是纯中孔的。
因此,在氧转移能力、与各种能够被处理的烃原料的反应性和机械强度方面寻求高性能氧载体固体仍然是开发化学链氧化还原方法(例如clc)的主要目标。
发明目的和概述
本发明的目的是克服上述现有技术的问题,并且通常旨在提供一种用于化学链氧化还原方法的氧载体固体,其在该方法中使用期间具有长寿命,特别是为了减少这些方法的投资成本和/或运营成本。
因此,为了实现上述目的中的至少一个,例如,本发明根据第一方面提出了一种用于烃原料的化学链氧化还原燃烧方法的颗粒形式的氧载体固体,其包含:
-氧化还原活性物质,占氧载体固体重量的5重量%-75重量%,该氧化还原活性物质包含金属氧化物或金属氧化物的混合物,能够在化学链氧化还原燃烧方法中输送氧;
-陶瓷基质,氧化还原活性物质分散在其中,该陶瓷基质占氧载体固体重量的25重量%至95重量%,该陶瓷基质包含60重量%-100重量%的至少一种熔点高于1500℃的长石或似长石和0%至40%的至少一种氧化物;
-孔隙,使得:
-通过水银孔隙率测定法测得的氧载体固体的总孔体积为0.05-0.9ml/g,
-大孔的孔体积占氧载体固体总孔体积的至少10%;
-通过水银孔隙率测定法测得的氧载体固体内的大孔的尺寸分布在50nm至7μm之间。
优选地,氧载体固体的总孔体积为0.1-0.5ml/g。
大孔的总孔体积占氧载体固体孔体积的至少50%。
优选地,氧载体固体内的大孔的尺寸分布在50nm至4μm之间。
优选地,氧化还原活性物质包含至少一种金属氧化物,其选自fe、cu、ni、mn和/或co的氧化物;具有氧化还原性质的钙钛矿,优选具有式camno3的钙钛矿;具有氧化还原性质的金属铝酸盐尖晶石,优选式cual2o4的金属铝酸盐尖晶石或式cufe2o4的铜铁尖晶石。
根据本发明的一个实施方式,氧化还原活性物质包含至少一种氧化铜。
有利地,所述至少一种长石或似长石的熔点高于1700℃。
有利地,所述陶瓷基质的至少一种长石或似长石是选自下组的长石:钡长石(celsian),锶长石(slawsonite),钙长石,或作为六方钾霞石(kalsilite)的似长石,优选是钡长石。
所述陶瓷基质的至少一种氧化物可选自下组:氧化铝,金属铝酸盐,二氧化硅,硅酸盐,铝硅酸盐,二氧化钛,钙钛矿和氧化锆。
优选地,颗粒的粒度使得超过90%的颗粒具有50μm至600μm的尺寸。
根据第二方面,本发明涉及制备根据本发明的氧载体固体的方法,其包括以下步骤:
(a)制备陶瓷基质的前体,包括:
-a1)制备大孔沸石材料,所述大孔沸石材料包含数均直径小于或等于3μm,优选数均直径为0.4μm至2μm的沸石晶体;和
-a2)所述大孔沸石材料与前体离子溶液进行阳离子交换,选择前体离子以在步骤(d)结束时形成陶瓷基质的熔点>1500℃的长石或似长石,在阳离子交换之后,洗涤所述大孔沸石材料,得到陶瓷基质的前体;
(b)用氧化还原活性物质的前体化合物浸渍步骤(a)中得到的所述陶瓷基质的前体;
(c)在步骤(a1)期间或在步骤(b)结束时形成陶瓷基质的前体的颗粒;
(d)干燥在所有步骤(a)、(b)和(c)结束时获得的颗粒形式的浸渍陶瓷基质的前体;和
(e)煅烧步骤(d)中得到的浸渍且干燥的陶瓷基质的前体,得到颗粒形式的氧载体固体。
根据一个实施方式,步骤a1)包括:
-a'1)用粘土粘合剂使沸石晶体聚集,形成沸石聚集物;
-a'2)使步骤a'1)中获得的沸石聚集物成形以产生颗粒,然后干燥所述颗粒,并任选地随后进行筛选和/或旋风分离(cycloning)步骤;
-a'3)在500℃至600℃的温度下煅烧步骤a'2)中获得的沸石聚集物颗粒,以产生颗粒形式的大孔沸石材料;
-a'4)任选地,通过使步骤a'3)得到的产物与碱金属碱性水溶液接触来使粘土粘合剂沸石化,然后洗涤。
有利地,沸石晶体包含至少一种si/al摩尔比为1.00至1.50的沸石,优选沸石晶体包含至少一种选自a、x、lsx和低硅emt沸石的沸石,所述低硅emt沸石的si/al比为1.0-1.4。
根据一个实施方式,步骤a2)中的阳离子交换用包含碱金属离子,优选k+离子或碱土金属离子的溶液进行,优选用包含碱土金属离子的溶液进行。
优选地,步骤a2)中的阳离子交换用包含选自ba2+、sr2+和ca2+离子的离子的溶液进行,优选用包含ba2+离子的溶液进行。
根据一个实施方式,步骤(a)另外包括步骤a3),即对步骤a2)中获得的大孔沸石材料进行热处理,该热处理包括在100℃-400℃的温度下干燥的步骤。
根据一个实施方式,在步骤(c)中,陶瓷基质的前体形成颗粒,所述颗粒的粒度使得超过90%的颗粒具有50μm至600μm的尺寸。
根据一个实施方式,步骤(b)中的浸渍用含有至少一种铜、镍、钴、铁或锰的可溶性前体化合物的水溶液或有机溶液进行,优选用含有至少一种氧化还原活性物质的前体化合物的水溶液进行,所述氧化还原活性物质的前体化合物选自下式的硝酸盐:cu(no3)2.xh2o、ni(no3)2.xh2o、co(no3)2.xh2o、fe(no3)3.xh2o、mn(no3)2.xh2o。
步骤(b)中的浸渍可以在一个或多个连续步骤中进行,并且当浸渍在几个连续步骤中进行时,优选包括在30℃至200℃之间的温度下干燥和/或在200℃至600℃之间的温度下煅烧的中间步骤。
根据本发明的一个实施方式,步骤(d)中的干燥在空气中或在受控气氛中,在30℃至200℃的温度下进行,并且优选在100℃至150℃的温度下在空气中进行。
根据本发明的一个实施方式,步骤(e)中的煅烧在空气中、在450℃至1400℃之间进行,优选在600℃至1000℃之间,更优选在700℃至900℃之间进行,并且进行1至24小时,优选5至15小时。
根据本发明的一个实施方式,在步骤a1)中,将沸石晶体与选自下组的至少一种氧化物混合:氧化铝,金属铝酸盐,二氧化硅,硅酸盐,铝硅酸盐,二氧化钛,钙钛矿,氧化锆和/或用于增加大孔沸石材料的大孔性的成孔剂。
根据第三方面,本发明涉及使用根据本发明的氧载体固体或根据本发明的制备方法制备的氧载体固体进行烃原料的化学链氧化还原燃烧的方法。
有利地,本发明涉及clc方法,优选其中氧载体固体在至少一个还原区和一个氧化区之间循环,二者均在流化床中操作,还原区和氧化区中的温度在400℃至1400℃之间,优选在600℃至1100℃之间,更优选在800℃至1100℃之间。
通过阅读通过非限制性示例给出的本发明的特定示例性实施方式的以下描述,本发明的其他主题和优点将变得显而易见,该描述是参考下面描述的附图进行的。
附图说明
图1a、1b、1c和1d涉及根据实施例2(不是根据本发明的实施例)的氧载体固体。图1a是给出氧载体固体孔隙率信息的图。图1b是表示使用氧载体固体的clc方法中甲烷转化率与氧化还原循环的函数关系的图。图1c是表示在clc方法中使用氧载体固体之前和之后的氧载体固体的粒度分布的图。图1d是在clc方法中使用氧载体固体之后,氧载体固体样品的抛光部分的扫描电子显微镜(sem)图像。
图2a、2b、2c和2d涉及根据实施例3(不是根据本发明的实施例)的氧载体固体。图2a是给出氧载体固体孔隙率信息的图。图2b是表示使用氧载体固体的clc方法中甲烷转化率与氧化还原循环的函数关系的图。图2c表示在clc方法中使用氧载体固体之前,氧载体固体的(a)sem图像和(b)能量色散x射线光谱(edx)图。图2d是在clc方法中使用氧载体固体之后,氧载体固体样品的抛光部分的sem图像。
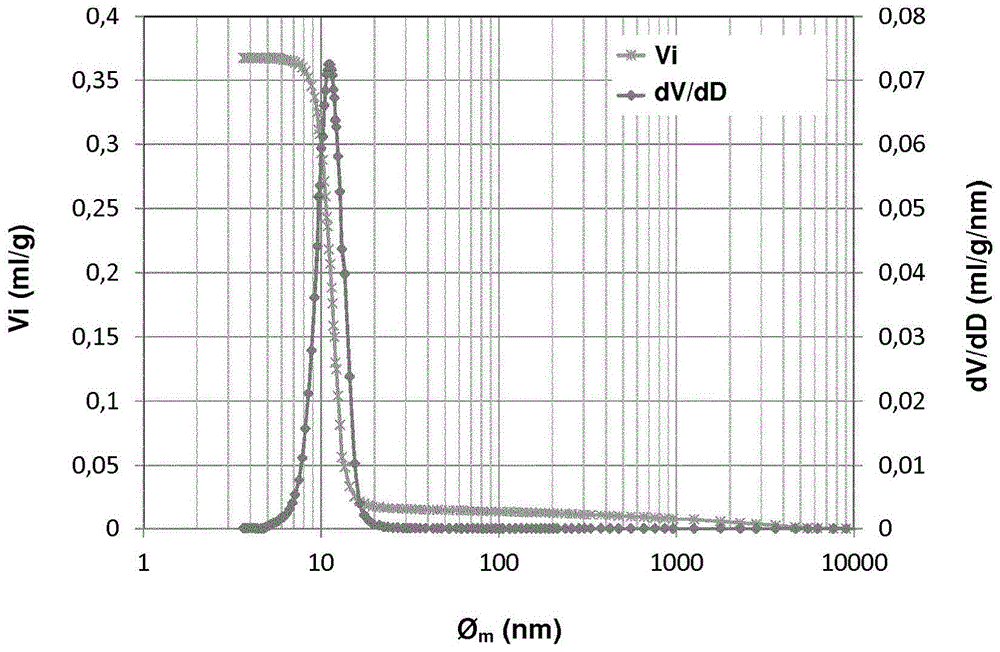
图3a、3b、3c、3d和3e涉及根据实施例4(根据本发明的实施例)的氧载体固体。图3a是通过氧载体固体的x射线衍射(xrd)获得的衍射图。图3b表示在clc方法中使用氧载体固体之前,氧载体固体的抛光部分的(a)sem背散射电子图像和(b)edx图。图3c是给出氧载体固体孔隙率信息的图。图3d表示在clc方法中使用氧载体固体之后,氧载体固体的抛光部分的(a)sem背散射电子图像和(b)edx图。图3e是在clc方法中使用氧载体固体之后,氧载体固体样品的抛光部分的sem图像。
图4a、4b和4c涉及根据实施例5(不是根据本发明的实施例)的氧载体固体。图4a是给出氧载体固体孔隙率信息的图。图4b表示在clc方法中使用氧载体固体之前,氧载体固体的sem图像。图4c表示在clc方法中使用氧载体固体之后,氧载体固体的抛光部分的(a)sem背散射电子图像和(b)edx图。
图5a、5b和5c涉及根据实施例6(不是根据本发明的实施例)的氧载体固体。图5a是给出氧载体固体孔隙率信息的图。图5b表示在clc方法中使用氧载体固体之前,氧载体固体的抛光部分的sem图像。图5c表示在clc方法中使用氧载体固体之后,氧载体固体的抛光部分的sem图像。
图6a、6b涉及根据实施例7(根据本发明的实施例)的氧载体固体。图6a是给出氧载体固体孔隙率信息的图。图6b表示在clc方法中使用氧载体固体之前,氧载体固体的抛光部分的sem图像。
发明详述
本发明的目的是提供用于化学链氧化还原方法的氧载体固体,所述化学链氧化还原方法例如是clc方法,但也可以是活性物质的其他化学链氧化还原方法,例如化学链重整(clr)方法或clou(化学链氧解偶联)方法。
本发明还涉及氧载体固体的制备和在这些方法中的用途。
clc方法通常需要两个单独的反应器,以便首先在还原反应器中利用燃料或更通常的还原气体、液体或固体来进行活性物质的还原。来自还原反应器的流出物主要含有co2和水,可以容易地捕获co2。然后,在氧化反应器中,通过与空气或任何其他氧化气体接触来使活性物质恢复到其氧化态,使得可以相应地产生携带能量的热流出物和贫氮流或无氮流(在使用空气的情况中)。
在本说明书中,尤其提及了氧载体固体在循环流化床clc方法中的用途,但根据本发明的氧载体固体也可用于任何其他类型的在固定床、移动床或沸腾床中或在旋转反应器中进行的化学链(clc,clr,clou)氧化还原方法。
氧载体固体
氧载体包含:
-氧化还原活性物质,占氧载体固体重量的5重量%-75重量%,优选占氧载体固体重量的10重量%-40重量%,该氧化还原活性物质包含金属氧化物或金属氧化物的混合物,能够在所述化学链氧化还原方法的氧化还原条件下交换氧;
-陶瓷基质,氧化还原活性物质分散在其中,该陶瓷基质占氧载体固体重量的25重量%至95重量%,优选占氧载体固体重量的60重量%至90重量%,该陶瓷基质包含60重量%-100重量%、优选80重量%-100重量%的至少一种熔点高于1500℃、优选熔点高于1700℃的架状硅酸盐(tectosilicate)和0重量%至40重量%的至少一种氧化物,优选0重量%至20重量%的至少一种氧化物。
根据一个实施方式,陶瓷基质基本上由至少一种熔点高于1500℃、优选熔点高于1700℃的架状硅酸盐组成。表述“基本上由......组成”应理解为意指包含几乎100%的所述架状硅酸盐,相差在1%以内。
除了包含至少一种熔点高于1500℃、优选熔点高于1700℃的长石或似长石的陶瓷基质外,本发明的氧载体固体具有特别的孔隙率,这出乎意料地使得可以限制活性物质在氧载体颗粒内的迁移现象。该初始结构显著地改善了化学链燃烧方法中颗粒的寿命,其特征在于:
-通过水银孔隙率测定法测得的氧载体固体的总孔体积v总为0.05-0.9ml/g;
-氧载体固体的总孔体积v总包含至少10%的大孔。换句话说,大孔的孔体积构成氧载体固体的总孔体积v总的至少10%;
-通过水银孔隙率测定法测得的氧载体固体内的大孔的尺寸分布在50nm至7μm之间。
回想一下,根据iupac命名法,微孔是指尺寸小于2nm的孔,中孔是指尺寸在2-50nm之间的孔,而大孔是指尺寸大于50nm的孔。
“初始结构(initialtexture)”应理解为在化学链氧化还原方法(例如clc)中任何使用之前的结构。
通过水银孔隙率测定法测量固体的总孔体积,更具体地,测量值涉及当施加的压力从0.22mpa增加至413mpa时注入的水银的体积。
氧载体固体的总孔体积v总优选为0.1-0.5ml/g,更优选为0.1-0.4ml/g。
优选地,颗粒的总孔体积v总的至少50%由大孔构成。换句话说,大孔的孔体积构成氧载体固体的总孔体积v总的至少50%。总孔体积的其余部分可以由微孔或中孔以任何比例构成。
通过水银孔隙率测定法测得的颗粒内的大孔的尺寸分布更优选在50nm至4μm之间,甚至更优选在200nm至1μm之间。
尚不能解释为什么氧载体固体的这种初始大孔结构能够最小化活性物质在颗粒内的迁移的原因。不受特定理论的束缚,本发明人至少部分地将这种现象归因于由于本发明颗粒的特别开放的结构,常常关于现有技术的中孔颗粒报道的扩散限制得到大幅减小。气体可以容易地接近分散在陶瓷基质内的活性物质,由于浓度梯度,特别是在颗粒氧化期间,限制活性物质的迁移。实际上,已经知道,金属阳离子通常迁移通过在还原的金属颗粒氧化方法中形成的主氧化物层(s.mrowec,z.grzesik,“镍的氧化和氧化镍的传输性质(oxidationofnickelandtransportpropertiesofnickeloxide)”,j.phys.chem.solids,64,1651,2004),因为氧化物层中金属阳离子的扩散速率高于氧阴离子(o2-)的扩散速率。此外,氧载体固体的陶瓷基质包含具有高熔点(高于1500℃)的架状硅酸盐(例如,钡长石)的特点使得可以使现有技术中有时观察到的颗粒致密化现象最小化(参见实施例5和6),这将限制氧化还原循环期间颗粒孔隙率的发展。
陶瓷基质
陶瓷基质包含至少一种架状硅酸盐,其优选为长石或似长石,并且陶瓷基质可以仅由这种架状硅酸盐形成。
架状硅酸盐是[sio4]4-四面体的排列构成三维骨架并且其中四面体的每个顶点氧与相邻的四面体共享的硅酸盐。在所有硅酸盐中发现的基本[sio4]4-四面体通过它们的四个顶点连接,并且每个氧结合到两个阳离子上。其他架状硅酸盐的化学式可以衍生自二氧化硅的化学式,概括为nto2,其中t表示四面体阳离子,基本上是硅[sio4]4-或铝[alo4]5-。由于四面体中硅被铝置换所产生的负电荷通过结构空腔中存在mn+阳离子(k+,na+,mg2+,ca2+,sr2+,ba2+等)来补偿。这种特征在长石、似长石和沸石中很常见,但在这三种情况中拓扑结构是不同的。
长石是铝、钙或碱金属(钠或钾)架状硅酸盐。
似长石是高度缺乏二氧化硅的架状硅酸盐。
陶瓷基质包含至少一种选自下组的长石:钡长石,锶长石,钙长石,或一种似长石,六方钾霞石。优选地,陶瓷基质基本上由至少一种选自下组的长石组成:钡长石,锶长石,钙长石。
含有碱土金属阳离子(ca2+,sr2+和ba2+)的长石,例如钡长石、锶长石、钙长石,具有有利的机械、热和电性能。特别地,它们的热膨胀系数非常低,例如对于单斜钡长石为2.29×10-6k-1,这使得可以限制在高温下使用时变形的机械应力,特别是在化学链氧化还原方法(例如clc)中。
此外,它们具有高于1500℃的高熔点(1550℃,1700℃和1760℃,分别对应于钙长石,锶长石和钡长石),这在化学链氧化还原方法(例如clc)的背景下是有利的,其中氧载体颗粒达到的温度高于流化气体的温度,有时高达120℃(guo,xy;sunyl,li,r.,yang,f.“大颗粒和低纵横比的填充床clc反应器中温度变化和不均匀性的实验研究(experimentalinvestigationsontemperaturevariationandinhomogeneityinapackedbedclcreactoroflargeparticlesandlowaspectratio)”,chem.eng.sci.107,266,2014)。长石和似长石的熔点很大程度上取决于mn+阳离子的性质,si/al比和结晶相中四面体的排列。
根据一个优选的实施方式,陶瓷基质包含钡长石。有利地,陶瓷基质基本上由钡长石组成。钡长石是有利地具有高机械强度和非常低的热膨胀系数的长石。钡长石还具有高熔点(1760℃)。
下表1列出了所提及的可以构成陶瓷基质的长石和似石类,以及熔点低于1500℃的其他似长石的实例。
表1
根据本发明的氧载体固体的陶瓷基质也可以由一种或多种架状硅酸盐和通常用作石油精炼过程中的催化剂负载体的其他氧化物的混合物组成。因此,陶瓷基质可包含至少一种选自下组的氧化物:氧化铝,金属铝酸盐,二氧化硅,硅酸盐,硅酸铝,铝硅酸盐,二氧化钛,钙钛矿和氧化锆。
在本说明书中,术语氧化物涵盖混合氧化物,即由氧离子o2-与至少两种阳离子元素组合产生的固体(例如铝酸钙caal2o4或铝酸镁mgal2o4)。氧化物的混合物应理解为表示至少两种不同的固体化合物,并且每种固体化合物都是氧化物。
根据本发明,陶瓷基质由基于沸石的前体获得。
沸石是铝硅酸盐族的结晶微孔固体,其可以在自然界中经常发现。这些材料也可以合成,例如经常用作化学工业中的吸附剂或催化剂。沸石具有通过桥接氧原子结合的[sio4]4-和[alo4]5-四面体的排列形成的三维结构。通过存在一种或多种可交换的补偿阳离子来确保组合的电中性。沸石的通式为mx/malxsi192-xo384·yh2o,其中mm+是具有+m电荷的骨架外阳离子。
已经知道,可以从钡交换的沸石获得钡长石。在钡交换的a、x和lsx沸石的情况中,高温处理(即高于1000℃)根据以下顺序导致形成钡长石:沸石→无定形相→六方钡长石→单斜钡长石。由纯bax形成单斜钡长石(“bax”表示钡交换的x沸石)需要在1550℃进行24小时热处理(s.esposito等人,ba交换的沸石a、x和lsx的热转化的比较研究(acomparativestudyofthethermaltransformationsofba-exchangedzeolitesa,xandlsx),j.eur.ceram.soc.,24,2004,2689)。在1100℃热处理28小时后,仍然主要存在六方钡长石,但观察到单斜钡长石的结晶开始。除了沸石结构的性质之外,各种碱金属阳离子(例如na+、li+、k+)的存在对这些各种相变发生的温度有影响。根据esposito等人在2004年的说法,这些行为差异与在沸石的微孔结构的热处理期间获得的无定形相中混合物的不同程度的组成均匀性有关。
根据本发明的氧载体固体由具有低si/al比的各种沸石制备,所述沸石浸渍有氧化还原活性物质的前体,通常为金属硝酸盐,并且通过煅烧分解,优选在空气中和在450℃至1400℃之间的温度下进行煅烧,以形成分散在由架状硅酸盐或架状硅酸盐混合物组成的陶瓷基质中的氧化还原活性物质(例如金属硝酸盐的氧化物),这取决于沸石笼中阳离子或阳离子混合物的性质和沸石的si/al比。陶瓷基质的熔化温度取决于mm+阳离子的性质,si/al比和结晶相中四面体的排列。在以下说明书中详细描述根据本发明的氧载体固体的制备。
氧化还原活性物质
本发明的氧载体固体包含氧化还原活性物质,该氧化还原活性物质包含至少一种金属氧化物,并优选由至少一种金属氧化物组成,所述至少一种金属氧化物选自fe、cu、ni、mn和co的氧化物;具有氧化还原性质的钙钛矿,优选式camno3的钙钛矿;具有氧化还原性质的金属铝酸盐尖晶石,优选式cual2o4或式cufe2o4的金属铝酸盐尖晶石。式cufe2o4的尖晶石是铜铁尖晶石。
优选地,氧化还原活性物质包含至少一种氧化铜,例如式cuo的氧化铜,并且更优选由至少一种氧化铜组成,例如由式cuo的氧化铜组成。
根据本发明,氧载体固体有利地具有分散在陶瓷基质内的活性物质,通常活性物质的初始分布是相对均匀的,如本说明书后面的一些实例所示,在化学链氧化还原方法的氧化还原循环期间活性物质在氧载体固体颗粒内的迁移最小化。
氧化还原活性物质能够在化学链氧化还原方法的氧化还原条件下交换氧。在与烃原料接触的还原步骤期间,根据上面已经描述的反应(1)还原活性物质,并且在与氧化气体接触的氧化步骤期间根据上面已经描述的反应(2)或(3)氧化活性物质。
取决于材料的类型,氧化还原活性物质的氧存储容量有利地为1重量%至15重量%。有利地,由金属氧化物实际转移的氧的量为1重量至3重量%,这使得可以仅使用一部分氧转移能力。
氧载体固体的形式
根据本发明的氧载体固体优选为颗粒形式,其可在化学链氧化还原方法中流化,特别是可用于循环流化床中。它们可以是属于geldart分类的a、b或c组的可流化颗粒(可流化粉末,通常称为“可流化载体”)(d.geldart.“气体流化类型(typesofgasfluidization)”,powdertechnol.7(5),285-292,1973),优选地,颗粒属于geldart分类的a组或b组,更优选属于geldart分类的b组。
优选地,氧载体固体的颗粒具有的粒度使得超过90%的颗粒具有50μm至600μm的尺寸,更优选具有的粒度使得超过90%的颗粒具有80μm至400μm的尺寸,甚至更优选具有的粒度使得超过90%的颗粒具有100μm至300μm的尺寸,甚至更优选具有的粒度使得超过95%的颗粒具有100μm至300μm的尺寸。
优选地,氧载体固体颗粒的颗粒密度为500kg/m3至5000kg/m3,优选颗粒密度为800kg/m3至4000kg/m3,甚至更优选颗粒密度为1000kg/m3和3000kg/m3。
氧载体固体的颗粒优选基本为球形。
用于固定床、移动床或旋转反应器中的另一种类型的化学链方法(clc、clr、clou)的颗粒的尺寸分布和形态适合于所设想的方法。例如,在使用固定床或旋转反应器技术的方法中使用氧载体固体的情况下,颗粒的优选尺寸大于400μm,以使反应器中的压降最小化,并且颗粒的形态不一定是球形的。形态取决于成形模式,例如以挤出物、珠粒、整料或通过研磨较大颗粒获得的任何几何形状的颗粒的形式。在整体式成形的情况下,通过本领域技术人员已知的涂覆方法将颗粒形式的氧载体固体沉积在陶瓷整料通道的表面上,或者整料本身由根据本发明的颗粒构成。
可以通过激光粒度分析来测量颗粒的尺寸。
颗粒的尺寸分布优选使用激光粒度分析仪测量,例如malvernmastersizer3000,优选通过液体路径,并使用夫琅和费(fraunhofer)理论。
氧载体固体的制备
依据包括以下步骤的方法制备氧载体固体:
步骤(a):制备陶瓷基质的前体
步骤(a)包括:
-a1)制备大孔沸石材料,所述材料包含数均直径小于或等于3μm,优选数均直径为0.4μm至2μm,更优选数均直径为0.5μm至1.7μm的沸石晶体;和
-a2)所述大孔沸石材料与前体离子溶液进行阳离子交换,选择前体离子以在步骤(d)结束时形成陶瓷基质的熔点>1500℃的架状硅酸盐,在所述阳离子交换之后,洗涤所述大孔沸石材料,得到陶瓷基质的所述前体。
步骤a1)
优选地,用于制备大孔沸石材料的步骤a1)包括以下步骤:
-a'1)用粘土粘合剂使沸石晶体聚集,形成沸石聚集物;
-a'2)使步骤a'1)中获得的沸石聚集物成形以产生颗粒,然后干燥所述颗粒,并任选地随后进行筛选和/或旋风分离步骤;
-a'3)在500℃至600℃的温度下煅烧步骤a'2)中获得的沸石聚集物颗粒,以产生颗粒形式的大孔沸石材料。所产生的颗粒具有足够的机械强度以供其后续使用;
-a'4)任选地,通过使步骤a'3)得到的产物与碱金属碱性水溶液接触来使粘土粘合剂沸石化,然后洗涤。
粘土粘合剂是一种聚集粘合剂,旨在确保颗粒形式的晶体的粘聚力。该粘合剂还可有助于将机械强度赋予颗粒,使得它们能够承受在化学链氧化还原单元中使用时所经受的机械应力。
所使用的聚集粘合剂和沸石的比例通常为每95重量份至80重量份沸石5至20重量份的粘合剂。
在步骤a1)中,除了沸石晶体和粘土粘合剂之外,沸石晶体可以与至少一种氧化物混合,所述至少一种氧化物选自下组:氧化铝,金属铝酸盐,二氧化硅,硅酸盐,硅酸铝,铝硅酸盐,二氧化钛,钙钛矿和氧化锆。因此,在该方法结束时,将获得氧载体固体,其在陶瓷基质中包含非零量且小于40%,优选小于20%的除了熔点高于1500℃的架状硅酸盐以外的氧化物。
或者,在沸石聚集物和陶瓷基质前体的处理结束时,可以以所需的量形成这种氧化物,而不在步骤(a)中将所述氧化物加入到沸石晶体中。
在步骤a1)期间,还可以将沸石晶体与用于增加大孔沸石材料的大孔性的成孔剂混合。
在步骤a1)期间,还可以将沸石晶体与至少一种上述氧化物和成孔剂混合。
在步骤a1)期间,还可以使用其他添加剂,旨在促进聚集和/或改善硬化和/或增加所形成的聚集物的大孔性。
有利地,沸石晶体包含至少一种si/al摩尔比为1.00至1.50的沸石,优选至少一种沸石选自a、x、lsx和低硅emt沸石。a沸石为lta结构型,并且si/al比=1。x沸石为fau结构型,并且si/al比为1-1.5,lsx(低硅x)沸石的情况也是如此。低硅emt沸石是emt结构型,并且si/al比为1.0-1.4(mintova等人,化学材料(chem.mater.),24,4758-4765,2012,和科学(science),2012年1月,335,70-73)。本领域技术人员可以参考“沸石骨架类型图集(atlasofzeoliteframeworktypes)”(第6修订版,2007,ch.baerlocher,w.m.meier,d.h.olson)这本书,以获得这些类型沸石的特征。因此,它们可以是仅由所提及的一种沸石或由所述沸石的混合物形成的晶体,优选仅由所提及的一种沸石,特别是x或lsx沸石形成的晶体。
a、x、lsx和低硅emt沸石晶体可以来自合成,并且补偿阳离子主要或甚至仅限于钠阳离子(例如nax(或13x),naa(或4a)晶体),但使用的晶体在钠形式的合成和用于步骤a1)之间经历一次或多次阳离子交换并不脱离本发明的范围。
步骤a1)中使用的x沸石晶体和聚集物中含有的x沸石晶体的数均直径的估计优选通过用扫描电子显微镜(sem)观察或通过透射电子显微镜(tem)观察来进行。为了估计样品上沸石晶体的尺寸,在至少5000的放大率下产生一组图像。然后使用专用软件测量至少200个晶体的直径,例如来自的罗格拉米出版社(logramipublisher)的smileview软件。精确度约为3%。
使粘土粘合剂沸石化的任选步骤a'4)使得可以将全部或部分粘合剂转化为沸石,优选转化为si/al摩尔比为1.00至1.50的沸石,优选转化为a,x、lsx或低硅emt沸石,以获得基本上由沸石组成的大孔沸石材料,非沸石相的量通常小于5%,并且对应于非沸石化的残余粘合剂或沸石化后的任何其它无定形相,同时保持或者甚至提高大孔沸石材料的机械强度,如专利fr2903978和fr2925366所教导的。
步骤a'1)中使用的粘土聚集粘合剂包含粘土或粘土混合物,并且优选由粘土或粘土混合物组成,可以向其中加入二氧化硅源。这些粘土优选自高岭土、高岭石、珍珠陶土、地开石、埃洛石、绿坡缕石、海泡石、蒙脱石、膨润土、伊利石和偏高岭土,以及它们中任何比例的两种或多种的混合物。在任选的沸石化步骤a'4)的情况下,步骤a'1)中使用的粘土聚集粘合剂含有至少80重量%、优选至少90重量%、更优选至少95重量%、更特别至少96重量%的可沸石化粘土,并且还可含有其他矿物,例如膨润土、绿坡缕石等。可沸石化粘土应理解为是指能够转化为沸石材料的粘土或粘土混合物,最常见的是通过碱金属碱性溶液的作用转化为沸石材料。可沸石化的粘土通常属于高岭土、高岭石、珍珠陶土、地开石、埃洛石和/或偏高岭土的类别。高岭土是优选的并且最常用。
在步骤a'2)中干燥后,步骤a'3)中的煅烧在通常500℃至600℃之间的温度下进行,例如在550℃进行,并且可以在任选的沸石化步骤(步骤a'4)中,使可沸石化粘土(通常是高岭土)转化为偏高岭土,该偏高岭土随后可转化为沸石。其原理公开于“沸石分子筛(zeolitemolecularsieves)”(d.w.breck,johnwiley和sons,newyork,(1973),第314-315页)。聚集粘合剂的沸石化根据目前本领域技术人员公知的任何方法进行,可以例如通过将步骤a'3)的产物浸入一般为水性的碱金属碱性溶液,例如氢氧化钠和/或氢氧化钾的水溶液中来进行。
在步骤a1)结束时,大孔沸石材料含有碱金属或碱土金属阳离子,更通常是钠和/或钾阳离子。
替代上述一系列步骤a'1)-a'4),也可以通过形成沸石颗粒的任何替代方法,特别是通过专利us4818508所述的方法,从可沸石化粘土的聚集物开始,通过碱金属碱性溶液的作用进行沸石化,而得到步骤a1)结束时的大孔沸石材料。
步骤a2)
阳离子交换(步骤a2)可以用包含碱金属离子(优选k+离子)或碱土金属离子的溶液进行,优选用包含碱土金属离子的溶液进行。
更优选地,阳离子交换用包含选自ba2+、sr2+和ca2+离子的离子的溶液进行,甚至更优选用包含ba2+离子的溶液进行。
优选地,所用的溶液是水溶液,其中溶解了盐,优选钡盐如氯化钡bacl2,锶盐如氯化锶srcl2或钙盐如氯化钙cacl2,更优选钡盐bacl2。
通过使步骤a1)得到的大孔沸石材料,特别是步骤a'3)或a'4)得到的颗粒形式的大孔沸石材料与水溶液中的碱金属或碱土金属盐(例如bacl2)接触来进行步骤a2)的沸石阳离子交换,所述接触优选在室温至100℃的温度下,更优选在80℃至100℃的温度下进行。为了快速获得阳离子,例如钡,以及实现高的交换率,即大于90%,优选相对于希望交换的沸石的阳离子,以大量过量的交换阳离子进行操作。
步骤a2)得到的陶瓷基质的前体或步骤a1)中使用的沸石晶体的化学分析根据常规技术进行,特别是通过标准nfeniso12677:2011中所述的x射线荧光在波长色散光谱仪(wdxrf)(例如来自布鲁克公司(bruker)的tigers8)上进行,或者根据标准uop961-12利用电感耦合等离子体-光发射光谱法(icp-oes)进行。
可以在不破坏沸石结构的情况下进行沸石的阳离子交换。然而,众所周知,如果试图使交换的沸石脱水,可以获得沸石结构的完全破坏,例如在沸石a与钡交换的情况下(howards.sherry,haroldf.walton,“沸石的离子交换性质(theion-exchangepropertiesofzeolites)”.ii.ionexchange,syntheticzeolitelinde4-a.j.phys.chem.,第71卷,第5期,第1457页,1967)。因此,在任选的热处理步骤a3)结束时获得的陶瓷基质的前体可以是完全或部分无定形的,特别是在步骤a1)中使用a沸石的情况下,或者当步骤a3)的热处理温度太高而不能保留沸石结构时。
步骤a3)
在步骤(a)中制备陶瓷基质的前体可以进一步包括对步骤a2)中获得的大孔沸石材料进行热处理的额外步骤a3)。该热处理包括在100℃至400℃之间的温度下干燥的步骤。
步骤(b):陶瓷基质的前体的浸渍
用氧化还原活性物质的前体化合物浸渍步骤(a)中得到的陶瓷基质的前体。
浸渍可以用含有至少一种铜、镍、钴、铁或锰的可溶性前体化合物的水溶液或有机溶液进行。
优选地,浸渍用含有至少一种氧化还原活性物质的前体化合物的水溶液进行,所述氧化还原活性物质的前体化合物选自下式的硝酸盐:cu(no3)2.xh2o、ni(no3)2.xh2o、co(no3)2.xh2o、fe(no3)3.xh2o、mn(no3)2.xh2o。
有利地,选择硝酸铜cu(no3)2.xh2o进行该浸渍,以获得氧化铜作为氧化还原活性物质,例如式cuo的氧化铜,以形成氧载体固体。
选择用于浸渍阶段的氧化还原活性物质的前体的量,使得氧化还原活性物质占氧载体固体重量的5重量%至75重量%。
可以在一个或多个连续步骤中进行浸渍。
如果浸渍在几个连续步骤中进行,则优选进行在30℃至200℃的温度下干燥和/或在200℃至600℃的温度下煅烧的中间步骤。
步骤(c):陶瓷基质的前体的成形
在步骤(a1)期间或在步骤(b)结束时,陶瓷基质的前体成形为颗粒。
上文已经描述了步骤a1)中的成形。这是在步骤a'1)中获得的沸石聚集物在步骤a'2)中的成形。在该步骤a'2)期间,在成形之后进行颗粒的干燥,任选地随后进行筛选和/或旋风分离步骤。
在该步骤(c)期间,将陶瓷基质的前体成形,以便获得具有粒度的颗粒,所述粒度使得超过90%的颗粒具有100μm至500μm的尺寸。
如果设想循环流化床操作用于使用氧载体固体的化学链氧化还原方法,则优选进行成形以获得沸石聚集物颗粒或来自步骤(b)的陶瓷基质的前体颗粒的尺寸分布,使得所述颗粒属于geldart分类的a类或b类。
优选地,进行成形以产生具有以下粒度的颗粒:超过90%的颗粒具有100μm至500μm的尺寸,并且颗粒密度为500kg/m3至5000kg/m3。优选地,进行成形以产生具有以下粒度的颗粒:超过90%的颗粒具有100μm至300μm的尺寸,并且颗粒密度为800kg/m3至4,000kg/m3。甚至更优选地,进行成形以产生具有以下粒度的颗粒:超过95%的颗粒具有100μm至300μm的尺寸,并且颗粒密度为1,000kg/m3至3,000kg/m3。
成形操作可以紧跟在聚集步骤a'1)之后,可以通过本领域技术人员已知的任何技术进行,例如挤出,压实,在造粒板上聚集,使用造粒鼓,湿法或干法造粒等,优选通过造粒或任何其他可以获得球形颗粒的技术进行。
成形可任选地包括筛选和/或旋风分离步骤,以获得所需粒度的聚集物。
步骤(d):陶瓷基质的前体的干燥
在所有步骤(a)、(b)和(c)结束时获得的颗粒形式的浸渍陶瓷基质的前体进行干燥。
该干燥优选在空气中或在受控气氛中(受控的相对湿度,在氮气下),在30℃至200℃的温度下进行。受控气氛应理解为是指例如具有受控的相对湿度或在氮气下。
更优选地,干燥在空气中在100℃至150℃的温度下进行。
步骤(e):陶瓷基质的前体的煅烧
步骤(d)中得到的浸渍且干燥的陶瓷基质的前体进行煅烧,得到颗粒形式的氧载体固体。
该煅烧优选在空气中在450℃至1400℃之间的温度下,更优选在600℃至1000℃之间的温度下,甚至更优选在700℃至900℃之间的温度下进行。
该煅烧可以进行1至24小时,优选进行5至15小时。
有利地,施加1℃/分钟至50℃/分钟之间、优选5℃/分钟至20℃/分钟之间的温度上升速率,以实现给定的煅烧温度。实施该温度上升的时间不包括在上述煅烧时间范围内。
煅烧使得能够以颗粒形式形成氧载体固体的陶瓷基质的架状硅酸盐,氧化还原活性物质分散在该基质中。
煅烧步骤(e)也似乎对颗粒的初始大孔结构具有有限的影响,当煅烧在700℃和900℃之间的温度下进行时甚至更有限。可以观察到大孔直径的小幅增加和总孔体积的小幅下降。
根据优选的实施方式,根据本发明的式cuo/baal2si2o8的氧载体的制备根据以下步骤进行:
首先,进行制备颗粒形式的钡长石陶瓷基质前体的步骤(a)。
陶瓷基质baal2si2o8的前体是大孔沸石聚集物,其基本上由具有低si/al原子比的沸石组成,即si/al比小于1.5(且大于1)。沸石晶体可包含选自单独或作为混合物的a、x、lsx和低硅emt沸石的沸石。聚集物的沸石与钡交换。陶瓷基质baal2si2o8的前体按照以下步骤制备:
a1)制备大孔沸石材料,其包含si/al原子比为1.00-1.50的沸石晶体的聚集物,所述沸石晶体例如是单独或作为混合物的a、x、lsx或低硅emt沸石,具有的数均直径小于或等于3μm,优选0.4μm至2μm,优选0.5μm至1.7μm,使用基于粘土或粘土混合物的粘合剂(stepa'1),进行成形以形成颗粒,然后干燥颗粒(步骤a'2),然后进行煅烧(步骤a'3)。可以通过碱金属碱性溶液的作用进行粘土粘合剂的沸石化(步骤a'4)。或者,随后,在浸渍步骤(b)之后,进行成形为颗粒形式的操作;
a2)步骤a1)得到的大孔沸石材料颗粒的阳离子交换是通过与钡离子溶液接触,然后洗涤如此处理的产物。通过使步骤a1)得到的大孔沸石材料,特别是步骤a'3)或a'4)得到的颗粒形式的大孔沸石材料与水溶液中的钡盐(例如bacl2)接触来进行沸石阳离子的钡交换,所述接触在室温至100℃的温度下,优选在80℃至100℃的温度下进行。为了快速获得高度钡交换,即大于90%,优选相对于希望交换的沸石的阳离子,以大量过量的钡进行操作,通常通过连续交换使得bao/al2o3比为约10到12。钡离子的交换程度由氧化钡bao的摩尔数与碱金属和碱土金属离子的所有氧化物的摩尔数(通常为bao+k2o+na2o的摩尔数)之间的比值决定。在不破坏沸石结构的情况下实现x、lsx或a或低硅emt沸石的钡交换。
a3)由步骤a2)得到的交换的大孔沸石材料的任选热处理包括在100℃-400℃的温度下干燥的步骤。在该步骤a3)结束时获得的陶瓷基质的前体可以是完全或部分无定形的,尤其是在步骤a1)中使用a沸石的情况下。
关于步骤(a)的子步骤中使用的产品和材料的情况和细节在此不再重复,相当于上文一般描述的那些。
接下来,进行浸渍钡长石陶瓷基质前体的步骤(b):可以用上文详细描述的含有至少一种铜、镍、钴、铁和/或锰的可溶性前体的水溶液或有机溶液浸渍陶瓷基质的前体,优选浸渍根据已经描述的步骤(c)成形的陶瓷基质的前体。
然后进行对经过浸渍的颗粒形式的钡长石陶瓷基质前体进行干燥的步骤(d)。该干燥步骤与上面一般性描述的一致。
最后,进行如上所述的来自步骤(d)的颗粒的煅烧步骤(e),以形成包含钡长石baal2si2o8基质并且在该基质中分散有cuo氧化还原活性物质的氧载体,并且该氧载体具有上述特定的孔结构。用一种或多种氧化还原活性物质的金属前体(例如cu、ni、co、fe和/或mg的前体)浸渍经过成形且钡交换的沸石似乎不会改变如esposito等人在2004年提到的沸石结构的转变顺序,但是相变温度降低了。事实上,用cu(no3)2浸渍的bax沸石前体在800℃煅烧12小时后得到六方和单斜钡长石与黑铜矿(cuo)的混合物,而在1100℃煅烧6小时是从未浸渍有硝酸铜的bax沸石前体获得六方钡长石所必需的,而在1550℃煅烧24小时可以获得单斜钡长石。
氧载体固体的用途
氧载体固体旨在用于化学链氧化还原方法。
因此,本发明涉及使用所述氧载体固体或根据所述制备方法制备的氧载体固体的化学链氧化还原方法。
有利地,所述的氧载体固体用于烃原料的clc方法中,其中氧载体固体为颗粒形式并在至少一个还原区和一个氧化区之间循环,所述至少一个还原区和一个氧化区均在流化床中操作。
还原区和氧化区中的温度在400℃至1400℃之间,优选在600℃至1100℃之间,甚至更优选在800℃至1100℃之间。
处理的烃原料可以是固体、液体或气体烃原料:气体燃料(例如:天然气,合成气,沼气),液体燃料(例如:燃料油,沥青,柴油,汽油等)或固体燃料(例如:煤,焦炭,石油焦,生物质,油砂等)。
使用所述氧载体固体的clc方法的操作原理如下:在称为空气反应器(或氧化反应器)的反应区中使还原的氧载体固体与空气流或任何其它氧化气体接触。这导致耗尽的空气流和氧载体固体的再氧化颗粒流。将氧化的氧载体颗粒流转移到称为燃料反应器(或还原反应器)的还原区。使颗粒流与燃料接触,所述燃料通常是烃原料。这导致燃烧流出物和还原的氧载体颗粒流。clc设备可包括各种设备件,用于空气和燃料反应器周围的材料的可能的再循环,热交换,加压或分离。
在还原区中,使烃原料与包含氧化还原活性物质的颗粒形式的氧载体固体接触,例如顺流接触,以通过还原氧化还原活性物质来进行所述原料的燃烧。根据已经描述的反应(1),氧化还原物质mxoy(m表示金属)利用烃原料cnhm还原到mxoy-2n-m/2态,而烃原料cnhm相应地氧化以产生co2和h2o,或者任选地产生为co+h2混合物,具体取决于使用的比例和金属m的性质。与活性物质接触的原料的燃烧在通常在400℃和1400℃之间、优选在600℃至1100℃之间、甚至更优选在800℃至1100℃之间的温度下进行。接触时间根据所用可燃原料的类型而变化。对于固体或液体原料,接触时间通常在1秒至10分钟之间变化,例如优选在1至5分钟之间变化,并且,例如,对于气体原料,接触时间优选为1秒至20秒。
包含来自燃烧的气体和氧载体固体颗粒的混合物通常在还原区的顶部排出。气/固分离装置,例如旋风分离器,可以使燃烧气体与氧载体的固体颗粒在其最大还原态分离。后者被送至氧化区进行再氧化,温度通常在400℃至1400℃之间,优选在600℃至1100℃之间,甚至更优选在800℃至1100℃之间。
在氧化反应器中,根据已经描述的反应(2)(或者如果氧化气体是h2o,根据反应(3)),活性物质在与空气接触时恢复到其氧化态mxoy,然后在与已经耗氧的空气分离之后,返回还原区,而已经耗氧的空气在氧化区100的顶部排出。
活性物质遵循氧化还原循环,交替地从其氧化形式到其还原形式,反之亦然。
所公开的氧载体固体还可以用于另一种化学链氧化还原方法,例如clr方法或clou方法。
化学链氧化还原方法中使用的技术优选是循环流化床的技术,但不限于该技术,并且可以扩展到其他技术,例如固定床、移动床或沸腾床技术,或旋转反应器技术。
实施例
通过下面的实施例1至7公开了根据本发明的氧载体固体在化学链方法(特别是clc)中的优点,尤其是在氧化还原循环期间活性物质在颗粒内迁移的最小化。
实施例2、3、5和6涉及不根据本发明的氧载体固体。实施例4和7涉及根据本发明的氧载体固体。
实施例1:间歇流化床中氧载体固体的老化测试
在间歇流化床中氧载体固体的老化是在由石英反应器、用于向反应器供应气体的自动系统和用于分析离开反应器的气体的系统组成的单元中进行的。
该老化测试近似于化学链氧化还原方法,特别是化学链燃烧氧化还原方法中氧载体固体的使用条件。
通过质量流量计分配气体(ch4,co2,n2,空气)。出于安全原因,在每个还原期和氧化期之后进行氮气吹扫。
石英反应器的高度为30厘米,其下部直径为4厘米(距离顶部约24厘米),上部直径为7厘米。将石英玻璃料放置在反应器的底部以确保气体的分布和颗粒的良好流化。将另一些玻璃料放置在反应器的上部以防止在测试期间细粒的损失。使用电炉对反应器进行加热。离开反应器的部分气体被泵送到气体分析仪,冷却以使还原过程中形成的大部分水冷凝,然后用氯化钙进行干燥。使用用于co、co2和ch4的非色散红外分析仪,用于氧气的顺磁分析仪和用于氢气的tcd检测器来测量气体浓度。
标准测试条件:将100克颗粒引入石英反应器中,然后在空气流(60nl/h)中加热至900℃。当床的温度在空气中稳定在900℃时,按照以下步骤进行250次循环:
1-氮气吹扫(60nl/h)
2-注入ch4/co2混合物(30nl/h/30nl/h)(颗粒的还原)
3-氮气吹扫(60nl/h)
4-注入空气(60nl/h)(颗粒的氧化)
根据气体转化数据计算氧载体固体的转化率(由氧载体固体提供的用于进行甲烷转化的氧的量,以氧化的氧载体的重量%表示),并且在第一次循环后调节还原时间(循环的步骤2),使得在每个还原循环中氧载体固体释放约2重量%的氧(相对于引入的氧载体固体的氧化质量)。氧化时间(循环的步骤4)足以使颗粒完全再氧化(15分钟)。
使用夫琅和费(fraunhofer)理论,用马尔文(malvern)粒度分析仪测量粒度分布。粒度分析仪是malvernmastersizer3000粒度分析仪,测量通过液体路径进行。
水银孔隙率测量在麦克公司(micromeritics)销售的autoporeiv装置上进行,考虑到汞表面张力为485达因/厘米,接触角为140°。可通过水银孔隙率测定法测量的最小孔径为3.65nm。
氮吸附等温线的测量在由麦克公司(micromeritics)销售的asap2420装置上进行。
实施例2:cuo/氧化铝氧载体固体
根据该实施例2,由氧化铝作为氧化还原活性物质氧化铜的负载基质形成氧载体固体。
用于该实施例的氧化铝是由萨索尔公司(sasol)销售的puraloxscca150-200。含铝负载体的粒度分布表明dv10=104μm,dv50=161μm和dv90=247μm。
通过水银孔隙率测定法测量的颗粒的孔体积为0.450ml/g,孔径分布为5-15nm,以9nm为中心。通过水银孔隙率测定法测量的负载体的大孔体积为0.007ml/g(总孔体积的1.5%)。
由puralox的氮吸附等温线可以测得比表面积为199m2/g,微孔体积(孔<2nm)为零,中孔体积(2nm<孔<50nm)为0.496ml/g。
根据干浸渍法用溶解在必需体积的软化水中的96.5g三水合硝酸铜浸渍233gpuralox氧化铝。在120℃干燥并在850℃煅烧12小时后,得到含有12重量%cuo的固体;通过xrd检测的结晶相是γ-al2o3和cuo。颗粒内铜的分布是均匀的。
通过水银孔隙率测定法测得的所得固体颗粒的孔体积为0.367ml/g,其中0.015ml/g(即通过水银孔隙度测定法测量的总孔体积的4%)是由于大孔性。对于本实施例的氧载体固体,图1a中的图表示注入孔隙中的汞的体积vi(ml/g)以及dv/dd比值[(引入的hg体积/孔径)的导数,提供孔径分布的信息]随孔径(nm)的变化,如该图所示,孔径分布在5到20nm之间,并且以11.25nm为中心。因此颗粒基本上是中孔的。
依据该实施例的氧载体固体的氮吸附等温线,可以测得比表面积为135m2/g,微孔体积(孔<2nm)为零,中孔体积(2nm<孔<50nm)为0.404ml/g。
根据该实施例的氧载体固体在实施例1中描述的条件下老化。
图1b是表示使用依据实施例2的氧载体固体的clc方法中归一化的甲烷转化率xc随氧化还原循环次数n的变化的图。
在测试开始时甲烷的转化率约为98%,其增加直至达到100%,然后在100次循环后观察到逐渐失活。然后转化率稳定在95%左右。
应注意,所用活性物质(cuo)的性质导致在氮气吹扫步骤期间出现氧气。因此,颗粒可以在clc或clou方法中使用。
图1c表示依据本实施例的氧载体固体在其用于clc方法之前(曲线10)和之后(曲线11)(即在根据实施例1的老化测试之前和之后)的粒度分布(μm),如从该图中清楚可见,在测试之后,样品经历了非常显著的磨损,几乎所有颗粒的尺寸小于100μm。
在根据实施例1的老化测试之后的颗粒的抛光部分的sem图像,例如图1d的图像,显示颗粒的含铝基质成分不能承受250次连续的氧化还原循环。大多数颗粒实际上是小碎片(几十μm)的形式。此外,额外的sem-edx分析表明,观察到的最细小颗粒(几微米大小)几乎完全由铜和氧组成。
该实施例表明,当活性物质沉积在纯中孔氧化铝上时,氧化还原循环的累积导致所述含铝基质裂化,并导致铜在含铝基质内迁移,从而形成基本上由铜组成的簇。然后,裂化的陶瓷基质的机械强度不足,颗粒的寿命大大缩短。
实施例3:cuo/5%sio2含硅氧化铝氧载体固体
根据该实施例3,由5%sio2含硅氧化铝作为氧化还原活性物质氧化铜(cuo和cual2o4)的负载基质形成氧载体固体。
所用的含硅氧化铝是由萨索尔(sasol)销售的siralox5,其含有5%重量的二氧化硅(sio2)。粒度分布表示dv10=60μm,dv50=89μm且dv90=131μm。通过水银孔隙率测定法测量的氧化铝-二氧化硅负载体的孔体积为0.549ml/g,孔径分布为5-30nm,以13nm为中心。大孔体积为0.033ml/g,即通过水银孔隙率测定法测量的总孔体积的6%。
由siralox5的氮吸附等温线可以测得比表面积为173m2/g,微孔体积(孔<2nm)为零,中孔体积(2nm<孔<50nm)为0.601ml/g。
根据干浸渍法用水溶液中的109g三水合硝酸铜浸渍240g含硅氧化铝。在120℃干燥并在1,000℃煅烧12小时后,得到含有13重量%cuo等同物(equivalent)的固体。通过xrd检测到的结晶相是δ-al2o3,θ-al2o3,cual2o4和cuo。图2c的抛光部分上的sem背散射电子图像(a)和edx图(b)显示铜相对良好地分散在颗粒内,但是与实施例2相比不那么均匀。
通过水银孔隙率测定法测量的颗粒的孔体积为0.340ml/g,其中0.029ml/g(8.5%)是大孔性的。对于本实施例的氧载体固体,图2a中的图表示注入孔隙中的汞的体积vi(ml/g)以及dv/dd比值随孔径(nm)的变化,如该图所示,孔径分布在7到50nm之间,并且以15nm为中心。浸渍/煅烧后的颗粒基本上是中孔的。
通过氮吸附测量的比表面积是77m2/g。
根据实施例3的氧载体固体在实施例1中描述的条件下老化。
在整个测试中甲烷转化率是稳定的,约为60%(图2b)。
应注意,所用活性物质(氧化铜)的性质导致在氮气吹扫步骤期间出现氧气。因此,颗粒可以在clc或clou方法中使用。
相比于实施例2的甲烷部分转化在工业规模的clc或clou方法中不是问题,可以通过改变颗粒的停留时间、气体速率和/或还原反应器中的存量来实现燃料的完全转化。
老化测试后颗粒的尺寸分布与测试前的材料的尺寸分布相似,这表明与纯氧化铝的颗粒相比,氧化铝-二氧化硅基质具有更好的机械强度。
然而,如图2d的sem图像所示,观察到几乎所有最初分散在颗粒内的铜迁移到所述颗粒的周边,形成基本上含有铜和少量铝的多孔区。虽然是多孔的,但是这些区域的机械强度足以使得在实施例1中描述的条件下,形成的层和簇在大多数情况下仍然与初始氧化铝-二氧化硅载体成为一体。但是,这种类型的颗粒不可能用于工业规模的循环流化床中,其中较高的气体速率和不可避免的磨擦带来的磨损将导致在周边积聚的所有铜快速消除。
根据所进行的edx绘图测量,与初始二氧化硅-氧化铝相比形态相对未改变的颗粒区域主要由氧化铝组成,并且仅含有痕量的铜,并且还含有几乎所有的硅。因此,陶瓷基质中硅的存在使得可以稳定所述陶瓷基质。然而,在连续的氧化还原循环期间,最初良好地分散在中孔基质中的所有铜迁移到颗粒的周边。
实施例4:cuo/钡长石氧载体固体
根据该实施例4,形成氧载体固体,其包含钡长石陶瓷基质,并且氧化还原活性物质氧化铜分散在该基质中。
根据该实施例的氧载体固体是使用以下步骤从bax大孔沸石前体(bax代表钡交换的x沸石)获得的:
-用高岭石和二氧化硅使si/al原子比=1.25且数均直径等于1.5μm的nax沸石晶体聚集,通过造粒成形,然后干燥,然后在550℃在氮气流中煅烧2小时,筛选得到的聚集物,从而回收粒度在200-500μm之间并且体积中值粒径为约350μm的颗粒。
-通过将所得的颗粒放置在玻璃反应器中与100g/l浓度的氢氧化钠水溶液在100℃的温度下接触并搅拌3小时来使粘合剂沸石化。然后用水在3次连续洗涤操作中洗涤颗粒,然后排空反应器。通过测量洗涤水的最终ph值在10至10.5之间来确保洗涤的有效性。
-使用0.5m氯化钡溶液在95℃分四步进行钡交换。在每个步骤中,溶液体积与固体质量的比值为20ml/g,每次交换持续4小时。在每次交换之间,将固体洗涤数次以除去过量的盐。
该沸石前体的钡交换度为95%。
通过水银孔隙率测定法测量的成形陶瓷基质的前体的孔体积为0.206ml/g,其为颗粒形式的大孔bax沸石材料。大孔体积(孔径>50nm)为0.191ml/g,中孔体积(3.65nm<孔<50nm)为0.015ml/g。大孔的尺寸分布在100nm至1000nm之间,以330nm为中心。该分布在图3c中可见,其中viz是指陶瓷基质的前体(成形的大孔bax沸石材料)的孔隙率。
由该陶瓷基质的前体的氮吸附等温线可以测得比表面积为676m2/g,微孔体积(孔<2nm)为0.24ml/g,且中孔体积(2nm<孔<50nm)为0.04ml/g。
用水溶液中的57g三水合硝酸铜对120g该陶瓷基质前体进行干浸渍。在120℃干燥并在800℃煅烧12小时后,得到依据本发明的含有13.5重量%cuo的氧载体固体。通过激光粒度分析仪在液相中测得的粒度分布表明dv10=199μm,dv50=341μm且dv90=534μm。
在800℃煅烧后,初始沸石结构被完全破坏。如图3a的x射线衍射图所示,通过xrd检测到黑铜矿cuo)和两种钡长石多晶型物(六方和单斜)。在该图中,x轴上的a对应于角度2θ(以度为单位),y轴上的cps表示测量期间的计数数值。六方形式的钡长石(h)的衍射峰强度高于单斜形式(m)测得的衍射峰强度。
通过水银孔隙率测定法测得的依据本发明的氧载体固体的孔体积为0.153ml/g。大孔体积(孔径>50nm)为0.145ml/g(94.8%),中孔体积为0.008ml/g。大孔的尺寸分布在100nm至4000nm之间,以400nm为中心。颗粒密度为2086kg/m3。该分布在图3c中可见,其中vis是指初始氧载体固体(在老化测试之前)的孔隙率。
根据bet方法通过氮吸附测量的本发明氧载体的比表面积是5m2/g。
在抛光部分上的sem分析(图3b,sem背散射电子图像(a)和(b)中的edx图)显示颗粒内的铜的分布是相对均匀的,其形式为以尺寸为0.1μm至5μm之间的结节分散在大孔隙中。
根据与实施例1中相同的方案,在间歇流化床中进行颗粒的老化。
在整个测试中甲烷转化为h2o和co2的转化率是稳定的,约为61%。
应注意,所用活性物质(cuo)的性质导致在氮气吹扫步骤期间出现氧气。因此,颗粒可以在clc或clou方法中使用。
相比于实施例2的甲烷部分转化在工业规模的clc或clou方法中不是问题,可以通过改变颗粒的停留时间、气体速率和/或还原反应器中的存量来实现燃料的完全转化。
如在实施例3中,老化测试后的粒度分布类似于测试前的材料的粒度分布。
与实施例3的观察结果不同,在间歇流化床中250次循环后,在本发明氧载体颗粒内的铜分布通常保持均匀,铜向颗粒周边迁移的趋势明显减小,如图3d的sem图像(a)和edx图(b)中可见。仍然观察到在孔隙中存在尺寸为0.1μm至5μm的亚铜结节。在关于老化后氧载体固体颗粒细节的图3e的sem背散射电子图像中可以清楚地看到该结构。
在老化后通过xrd检测到的主晶相是黑铜矿(cuo)和单斜钡长石。还存在表征六方钡长石和铝酸铜(cual2o4)的一些非常低强度的峰。
通过水银孔隙率测定法测量的颗粒的孔体积在老化期间降低20%(0.115ml/g),而孔径增加(孔径分布以600nm为中心)。因此发生了钡长石基质的轻微烧结。然而,鉴于这些结果,并且与其他实施例相比,根据该实施例4的氧载体固体具有良好的耐烧结性。
然而,250次氧化还原循环后的氧载体固体保留了孔径分布和孔体积,其足以限制铜在颗粒内的迁移。
因此,根据本发明的氧载体固体的形态演变(铜的分布和孔隙率)使得可以设想在工业循环流化床工艺中长时间使用这些颗粒。
实施例5:cuo/霞石氧载体固体
根据该实施例5,形成氧载体固体,其包含霞石(似长石)陶瓷基质,并且氧化还原活性物质氧化铜分散在该基质中。
根据该实施例的氧载体固体是使用以下步骤从nax大孔沸石前体获得的:
-用高岭石和二氧化硅使si/al原子比=1.25且数均直径等于1.5μm的nax沸石晶体聚集,通过造粒成形,然后干燥,然后在550℃在氮气流中煅烧2小时,筛选得到的聚集物,从而回收粒度在200μm至500μm之间并且体积中值粒径为约350μm的颗粒。
没有进行粘合剂沸石化和与钡交换的步骤。
通过水银孔隙率测定法测量的成形陶瓷基质的前体(大孔nax沸石材料)的孔体积为0.336ml/g。大孔体积(孔径>50nm)为0.296ml/g,中孔体积为0.040ml/g。大孔的尺寸分布在100nm至1000nm之间,以330nm为中心。该分布在图4a中可见,其中viz是指陶瓷基质的前体的孔隙率。
由该陶瓷基质的前体的氮吸附等温线可以测得比表面积为749m2/g,微孔体积(孔<2nm)为0.260ml/g,且中孔体积(2nm<孔<50nm)为0.112ml/g。
用水溶液中的43.9g三水合硝酸铜对105g该陶瓷基质前体进行干浸渍。在120℃干燥并在800℃煅烧12小时后,得到在二氧化硅-氧化铝上含有12重量%cuo等同物的固体。通过激光粒度分析仪在液相中测得的粒度分布表明dv10=156μm,dv50=286μm且dv90=458μm。
在800℃煅烧后,黑铜矿(cuo)和式na3.6al3.6si4.4o16的霞石是通过xrd检测到的仅有的两相。抛光部分的sem图像(例如图4b的图像)显示,与实施例4的颗粒相比,霞石基质明显裂化,并且铜在颗粒周边积聚。还观察到在基质的大孔隙中形成微米铜结节。
通过水银孔隙率测定法测量的实施例5的颗粒的孔体积为0.103ml/g,具有以750nm为中心的宽孔径分布(130nm至4.7μm)。孔体积由100%大孔组成。该分布在图4a中可见,其中vi是指初始氧载体固体(在老化测试之前)的孔隙率。
根据与实施例1中相同的方案,在间歇流化床中进行颗粒的老化。
在整个测试中甲烷转化为水和二氧化碳的转化率是稳定的,但是仅约为30%。
相比于实施例2的甲烷部分转化在工业规模的clc或clou方法中不是问题,可以通过改变颗粒的停留时间、气体速率和/或还原反应器中的存量来实现燃料的完全转化,但是根据实施例5的固体比实施例4的固体效率低,并且需要更高的存量。
尽管流化,但在测试过程中固体略微结块(在卸载反应器期间观察到易碎的聚集物)。在反应器中(简单)研磨聚集物之后,粒度分布的测量表明,产生了高比例的细颗粒(9重量%的尺寸<100μm的颗粒),这可能是由于从800℃的煅烧步骤开始观察到的严重的裂化。在成形后不存在粘合剂的沸石化可能是颗粒机械强度较低的原因。
仍然主要存在黑铜矿和霞石,并且还观察到石英、方石英和铝酸铜cualo4的主要x射线衍射线特征。这些线的相对强度非常低表明这三个相是少量的。
老化后颗粒的抛光部分上的sem图像显示出两种不同的颗粒形态(图4c,sem背散射电子图像(a)和(b)):
-在某些颗粒上观察到霞石基质的显著致密化,这导致铜明显迁移到颗粒的周边(图4c的sem图像(b))。在这些颗粒周围观察到的外壳可能是250次循环后观察到结块的原因。存在于这些颗粒中的一些铜在测试期间于气/固界面处形成的非常大的孔内聚结。
-第二种形态由仍具有大孔性的颗粒组成,在该大孔内铜形成微米结节(图4c的sem图像(a))。
相对于钡长石(1760℃),霞石的相对低熔点(1230℃)可能是观察到的更高致密化的原因。可能的是,捕集在基质致密的颗粒中的一些铜不能被气体接近,因此甲烷的转化率低于实施例4。除了与实施例4相比降低的反应性之外,在高比例颗粒周边处形成金属氧化物外壳还使得在工业规模的循环流化床中使用这种类型的颗粒是不可思议的(聚集和由于磨损导致铜损失的风险太高)。
通过水银孔隙率测定法测量的颗粒的孔体积(0.088ml/g)与之前具有相同的数量级,孔径分布(110nm-4.7μm)也是如此。
实施例6:cuo/钠长石氧载体固体
根据该实施例6,形成氧载体固体,其包含钠长石(似长石)陶瓷基质,并且氧化还原活性物质氧化铜分散在该基质中。
根据该实施例的氧载体固体是使用以下步骤从nay大孔沸石前体获得的:
-用高岭石和二氧化硅使nay沸石晶体聚集,该nay沸石晶体具有与x和lsx沸石相同的fau结构,但是si/al原子比=3,即高于x沸石或lsx沸石,并且数均直径等于0.7μm,通过造粒成形,然后干燥,然后在550℃在氮气流中煅烧2小时,筛选得到的聚集物,从而回收粒度在200μm至500μm之间并且体积中值粒径为约350μm的颗粒。
-通过将所得的颗粒放置在玻璃反应器中与100g/l浓度的氢氧化钠水溶液在100℃的温度下接触并搅拌3小时来使粘合剂沸石化。然后用水在3次连续洗涤操作中洗涤颗粒,然后排空反应器。通过测量洗涤水的最终ph值在10至10.5之间来确保洗涤的有效性。
通过水银孔隙率测定法测量的成形陶瓷基质的前体(大孔nax沸石材料)的孔体积为0.376ml/g。大孔体积(孔径>50nm)为0.319ml/g,中孔体积(3.65nm<孔<50nm)为0.057ml/g。大孔的尺寸分布在100nm至1000nm之间,以330nm为中心。该分布在图5a中可见,其中viz是指陶瓷基质的前体的孔隙率。
由该陶瓷基质的前体的氮吸附等温线可以测得比表面积为676m2/g,微孔体积(孔<2nm)为0.24ml/g,且中孔体积(2nm<孔<50nm)为0.04ml/g。
用水溶液中的44g三水合硝酸铜对108g该陶瓷基质前体进行干浸渍。在120℃干燥并在800℃煅烧12小时后,得到含有11.8重量%cuo等同物的固体。
在800℃煅烧后,通过xrd检测到黑铜矿(cuo),一种无定形相和石英。一些极低强度的衍射线无法明确归类,这表明出现新的结晶相。
粒度分布表明dv10=104μm,dv50=212μm且dv90=356μm。
氧载体固体颗粒的孔隙率仅为9%,孔径分布非常宽(从30nm到5000nm,见图5a曲线vis),反映了存在通过sem观察到并在煅烧过程中产生的非常大的空腔,并且存在无定形二氧化硅-氧化铝基质的致密化(图5b的sem图像)。总孔体积为0.043ml/g。大孔体积(孔径>50nm)为0.038ml/g(88.4%),中孔体积为0.005ml/g。抛光部分的sem-edx图表明,大部分铜以嵌入基质中的微米结节的形式聚结。颗粒内部发生严重裂化。
根据与实施例1中相同的方案,在间歇流化床中进行颗粒的老化。
观察到颗粒的活化,甲烷转化率从第二次循环中的6%逐渐增加至第250次循环中的14%。在测试期间,固体略微结块。在(简单)研磨反应器中的聚集物之后,老化测试后的粒度分布类似于测试前的材料的粒度分布。
颗粒的孔隙率仅为4%,基本上由颗粒内仍存在的大空腔组成(尺寸以约3700nm为中心)。
低甲烷转化率可直接与基质的孔隙率缺乏相关,基质包封大部分铜并使其不能被各种气体接近。转化率的逐渐增加可能归因于在氧化还原循环过程中铜迁移到颗粒的周边。事实上,老化后的sem分析表明在测试期间铜壳已经积聚在颗粒表面上(图5c的sem图像)。铜在表面上的积聚是造成颗粒聚集的原因。在测试结束时,很大比例的铜仍然被困在基质内。
xrd分析表明,最初的无定形基质形成结晶相钠长石(naalsi3o8),其熔点(1120℃)低于钡长石的熔点。还观察到黑铜矿(cuo)、石英,赤铜矿(cu2o)和痕量霞石的存在。
在颗粒周边处形成铜壳以及钠长石基质的孔隙率过低使得在工业规模的循环流化床中使用这种类型的颗粒是不可想象的。
实施例7:cuo/锶长石氧载体固体
根据该实施例7,形成氧载体固体,其包含锶长石(长石)陶瓷基质,并且氧化还原活性物质氧化铜分散在该基质中。
根据该实施例的氧载体固体是使用以下步骤从srlsx大孔沸石前体(srlsx代表锶交换的lsx沸石)获得的:
-用高岭石和二氧化硅使si/al原子比=1且数均直径等于1.5μm的lsx沸石晶体聚集,通过造粒成形,然后干燥,然后在550℃在氮气流中煅烧2小时,筛选得到的聚集物,从而回收粒度在200μm至500μm之间并且体积中值粒径为约350μm的颗粒。
-通过将所得的颗粒放置在玻璃反应器中与100g/l浓度的氢氧化钠水溶液在100℃的温度下接触并搅拌3小时来使粘合剂沸石化。然后用水在3次连续洗涤操作中洗涤颗粒,然后排空反应器。通过测量洗涤水的最终ph值在10至10.5之间来确保洗涤的有效性。
-使用0.5m氯化锶溶液在95℃分四步进行锶交换。在每个步骤中,溶液体积与固体质量的比值为20ml/g,每次交换持续4小时。在每次交换之间,将固体洗涤数次以除去过量的盐。
该沸石前体的锶交换度为94%。
通过水银孔隙率测定法测量的成形陶瓷基质的前体(大孔srlsx沸石材料)的孔体积为0.195ml/g。大孔体积(孔径>50nm)为0.183ml/g,中孔体积为0.012ml/g。大孔的尺寸分布在50nm至950nm之间,以300nm为中心。该分布在图6a中可见,其中viz是指陶瓷基质的前体的孔隙率。
用水溶液中的51g硝酸铜对122g该沸石进行干浸渍。在120℃干燥并在800℃煅烧12小时后,得到含有12重量%cuo的本发明氧载体固体。通过激光粒度分析仪在液相中测得的粒度分布表明dv10=195μm,dv50=320μm且dv90=495μm。
在800℃煅烧后,初始沸石结构被完全破坏。通过xrd检测到黑铜矿(cuo)和两种锶长石多晶型物(六方sral2si2o8和单斜sr0.8al1.7si2.3o8)。两种多晶型物的衍射峰的强度相似。
通过水银孔隙率测定法测得的本发明氧载体固体的孔体积为0.093ml/g。大孔体积(孔径>50nm)为0.091ml/g,中孔体积为0.002ml/g。大孔的尺寸分布在50nm至3500nm之间,以350nm为中心。该分布在图6a中可见,其中vis是指初始氧载体固体(在老化测试之前)的孔隙率。
根据bet方法通过氮吸附测量的本发明氧载体的比表面积是3m2/g。
抛光部分的sem-edx分析表明,颗粒内的铜的分布是相对均匀的,其形式为以尺寸为0.1μm至5μm之间的结节分散在大孔隙中。
根据与实施例1中相同的方案,在间歇流化床中进行颗粒的老化。
在整个测试中甲烷转化为水和二氧化碳的转化率是稳定的,约为59%。
应注意,所用活性物质(cuo)的性质导致在氮气吹扫步骤期间出现氧气。因此,颗粒可以在clc或clou方法中使用。
相比于实施例2的甲烷部分转化在工业规模的clc或clou方法中不是问题,可以通过改变颗粒的停留时间、气体速率和/或还原反应器中的存量来实现燃料的完全转化。
如在实施例3中,老化测试后的粒度分布类似于测试前的材料的粒度分布。
与实施例3的观察结果不同,在间歇流化床中250次循环后,在根据本发明的氧载体颗粒内的铜的分布通常保持均匀,铜向颗粒周边迁移的趋势明显减小。仍然观察到在孔隙中存在尺寸为0.1μm至5μm的亚铜结节。图6b是老化后氧载体固体颗粒的一部分的sem图像,显示出这种结构。
在老化后通过xrd检测到的主晶相是黑铜矿(cuo)和单斜锶长石。还存在表征六方锶长石和铝酸铜(cual2o4)的一些非常低强度的峰。
通过水银孔隙率测定法测量的颗粒的孔体积在老化期间降低23%(0.072ml/g),而孔径增加(孔径分布以550nm为中心)。因此发生了锶长石基质的轻微烧结。然而,250次氧化还原循环后的氧载体固体保留了孔径分布和孔体积,其足以限制铜在颗粒内的迁移。
- 还没有人留言评论。精彩留言会获得点赞!