生物流体分离装置的制作方法
本公开总体上涉及适用于生物流体的装置。更具体地,本公开涉及适于分离生物流体组分的装置。
背景技术:
血液取样是一种常见的医疗保健程序,涉及从患者体内抽取至少一滴血。通常通过手指刺扎、脚跟刺扎或静脉穿刺,从住院的、家庭护理的和急诊室的患者身上,采集血液样本。血液样本也可以通过静脉或动脉管路从患者身上采集。一旦收集,血液样本可被分析以获得医学上有用的信息,例如包括化学组成、血液学或凝血。
血液测试确定患者的生理生化状态,如疾病、矿物质含量、药物疗效和器官功能。血液测试可在临床实验室或患者附近的护理点进行。护理点血液测试的一个例子是患者血糖水平的常规测试,涉及经由手指刺扎抽取血液和将血液以机械方式收集到诊断盒中。此后,诊断盒分析血液样本,并向临床医生提供患者血糖水平的读数。其他装置也可用于分析血气电解质水平、锂水平和离子钙水平。其他一些护理点装置可识别急性冠状动脉综合征(acs)和深静脉血栓/肺栓塞(dvt/pe)的标志物。
血液样本包含细胞部分(血细胞)和血浆部分(即血浆)。核心实验室测试包括大量血液测试,在试管被呈现给大型诊断仪器之前,使用离心分离法将血浆从血细胞中分离出来,供实验室分析。离心分离是许多实验室测试中通常使用的普遍接受的血浆分离过程。离心分离通常需要15到20分钟,涉及繁重的劳动或复杂的工作流程。
在护理点环境中,血液样本在患者床边或附近呈现给仪器。大多数护理点测试使用的是通过移液管或注射器从血液采集管中转移的全血样本,因为患者床边没法提供血浆样本。
技术实现要素:
本公开提供了一种生物流体分离装置和一种分离过程,其允许从血液样本中高效地分离血浆。本公开的生物流体分离装置适于接纳具有细胞部分(或细胞)和血浆部分(或血浆)的血液样本。本公开的生物流体分离装置使用径迹蚀刻膜和错流过滤,从细胞中分离血浆。
在一个实施例中,本公开的生物流体分离装置提供了集成在抽空血液收集管内的血浆分离装置。有利地,本公开的生物流体分离装置提供了在临床抽血期间血浆的立即分离,以及将分离的血浆样本以受控方式分配到护理点盒或其他诊断仪器端口或测试装置的能力。本公开的生物流体分离装置提供了一种血液收集工作流程,该工作流程与使用真空管(例如bd
本公开的生物流体分离装置允许在抽血期间立即进行血浆分离,因此消除了对单独的离心分离过程的需要,并且还允许使用本公开的嵌入式精确滴液分配器将血浆样本受控地转移到诊断端口。本公开的生物流体分离装置消除了对常规血液收集管进行离心分离的需要,常规血液收集管通常需要被送到实验室进行离心分离。
根据本发明的一个实施例,生物流体分离装置适于接纳具有第一部分和第二部分的血液样本。生物流体分离装置包括具有入口和出口以及通气塞的壳体,以及具有血液腔室入口和血液腔室出口的血液腔室,其中血液腔室适于接纳血液样本。生物流体分离装置还包括具有腔室出口的分离腔室和设置在血液腔室与分离腔室之间的分离器,分离器适于将第一部分截留在血液腔室中,并允许第二部分通过分离器进入分离腔室。生物流体分离装置还包括可移除地连接到壳体的外壳体,其中外壳体包含第一真空,壳体包含第二真空,并且其中壳体连接到外壳体,壳体设置在外壳体内。第一真空和第二真空经由通气塞而连通。
在一种配置中,第一部分是细胞部分,第二部分是血浆部分。第一真空和第二真空可以抽吸壳体内的血液样本,并将血浆部分通过分离器抽吸到分离腔室中。
在某些配置中,分离器可以包括具有孔隙的膜表面。可选地,分离器是径迹蚀刻膜。
生物流体分离装置还可以包括覆盖入口的闭合件,并且在壳体连接到外壳体的情况下,闭合件可以密封壳体的开口端。壳体的入口可以设置在第一端,壳体的出口可以设置在相对的第二端。
在另一些配置中,生物流体分离装置还可以包括腔室出口与壳体出口之间的血浆收集通道。可选地,血浆收集通道可以具有蜿蜒形状。
在另一些配置中,生物流体分离装置还可以包括分配器组件,该分配器组件包括覆盖出口并包括通气塞的帽,该通气塞允许空气从中通过并防止血液样本的第二部分从中通过。分配器组件还可包括可变形部分,该可变形部分能够在初始位置与变形位置之间转变,在初始位置,第二部分包含在分离腔室内,在变形位置,第二部分的一部分从分离腔排出。随着帽从出口移除,并且可变形部分转变到变形位置,第二部分的一部分可以从生物流体分离装置排出。
在其他一些配置中,生物流体分离装置可以包括诊断组件,该诊断组件包括与分离腔室的腔室出口连通的诊断接口,以及用于测试第二部分的传感器。
根据本发明的另一实施例,适于接纳具有细胞部分和血浆部分的血液样本的生物流体分离装置可以包括具有入口和出口的内壳体。生物流体分离装置还可以包括血液腔室和血浆腔室,血液腔室具有血液腔室入口和血液腔室出口,其中血液腔室接纳血液样本,血浆腔室具有血浆腔室出口。生物流体分离装置还可以包括设置在血液腔室与血浆腔室之间的分离器以及可移除地连接到内壳体的外壳体,该分离器适于将细胞部分捕获在血液腔室中,并允许血浆部分通过分离器进入血浆腔室。在内壳体连接到外壳体的情况下,内壳体可以设置在外壳体内,并且其中真空由内壳体和外壳体中的至少一者限定,以通过分离器抽吸血液样本的血浆部分。
生物流体分离装置还可以包括生物流体分离装置连接器,该连接器能够可移除地连接到血液收集管的连接器。可选地,生物流体分离装置的外壳体可以包括抽空管。
根据本发明的又一实施例,生物流体分离装置可以适于接纳具有细胞部分和血浆部分的血液样本。生物流体分离装置可以包括外壳体,该外壳体具有开口端、闭合端和侧壁,侧壁在开口端与闭合端之间延伸并限定内部。生物流体分离装置还可以包括能够可移除地连接到外壳体的分配器单元,以及在外壳体内的内壳体。内壳体可以包括血液腔室,血液腔室具有血液腔室入口和血液腔室出口,血液腔室被配置为接纳血液样本,血液腔室出口与外壳体内部的一部分流体连通。生物流体分离装置还包括具有血浆腔室出口的血浆腔室,以及设置在血液腔室与血浆腔室之间的分离器。分离器可适于将细胞部分截留在血液腔室中,并允许血浆部分通过分离器进入血浆腔室。生物流体分离装置还包括从血浆腔室出口延伸到分配器单元的血浆收集通道。
可选地,生物流体分离装置还可以包括塞子,塞子的尺寸相对于外壳体的内部而设定,以提供与外壳体侧壁的密封接合。塞子可以将外壳体的内部划分成第一密封部分和第二部分。在某些配置中,分配器单元与外壳体脱离连接,血浆部分包含在分配器单元内。
附图说明
通过参考以下结合附图对本公开实施例的描述,本公开的上述和其他特征和优点以及实现它们的方式将变得更加显明,并且本公开本身将被更好地理解,附图中:
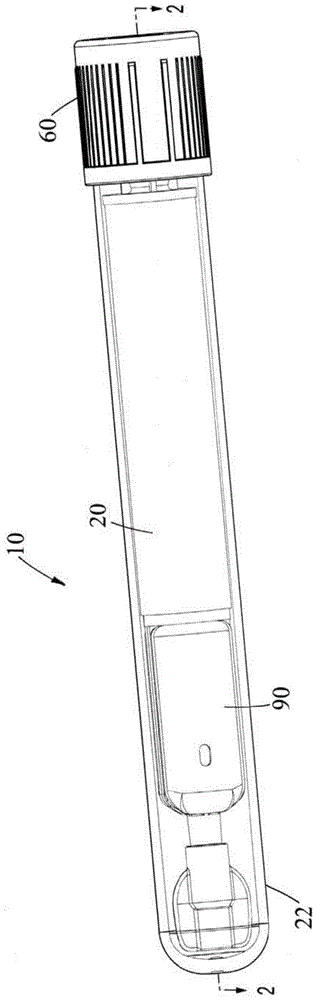
图1是根据本发明的一个实施例的生物流体分离装置的立体图。
图2是根据本发明的一个实施例的沿着图1的线2-2截取的截面图。
图3a是根据本发明的一个实施例的生物流体分离装置的立体图。
图3b是根据本发明的一个实施例的生物流体分离装置的分解立体图。
图3c是根据本发明的一个实施例的生物流体分离装置的分解立体图。
图3d是根据本发明的一个实施例的生物流体分离装置的分配器组件的分解立体图。
图3e是根据本发明的一个实施例的生物流体分离装置的分离器芯片的分解立体图。
图3f是根据本发明的一个实施例的生物流体分离装置的分离器的放大局部截面图。
图3g是根据本发明的一个实施例的生物流体分离装置的分离器的放大局部截面图。
图4a是根据本发明的一个实施例使用本公开的生物流体分离装置的第一步骤的立体图。
图4b是根据本发明的一个实施例使用本公开的生物流体分离装置的第二步骤的立体图。
图4c是根据本发明的一个实施例使用本公开的生物流体分离装置的第三步骤的立体图。
图4d是根据本发明的一个实施例使用本公开的生物流体分离装置的分配步骤的立体图。
图4e是根据本发明的一个实施例使用本公开的生物流体分离装置的分配步骤的立体图。
图4f是根据本发明的一个实施例的生物流体分离装置的内壳体的立体图。
图5是根据本发明另一实施例的生物流体分离装置的立体图。
图6是根据本发明的另一个实施例沿着图5的线6-6截取的截面图。
图7a是根据本发明另一实施例使用本公开的生物流体分离装置的第一步骤的立体图。
图7b是根据本发明另一实施例使用本公开的生物流体分离装置的第二步骤的立体图。
图7c是根据本发明另一实施例使用本公开的生物流体分离装置的分配步骤的立体图。
图7d是根据本发明另一实施例使用本公开的生物流体分离装置的分配步骤的立体图。
图8是根据本发明另一实施例的生物流体分离装置的立体图。
图9是根据本发明的另一个实施例沿着图8的线9-9截取的截面图。
图10a是根据本发明另一实施例使用本公开的生物流体分离装置的第一步骤的立体图。
图10b是根据本发明另一实施例使用本公开的生物流体分离装置的第二步骤的立体图。
图10c是根据本发明另一实施例的图10b的不同传感器配置的放大视图。
图10d是根据本发明另一实施例的使用本公开的生物流体分离装置的第三步骤的立体图。
图11a是根据本发明另一实施例的在直接抽吸过程中使用本公开的生物流体分离装置的第一步骤的立体图。
图11b是根据本发明另一实施例的在直接抽吸过程中使用本公开的生物流体分离装置的第二步骤的立体图。
图12a是根据本发明另一实施例在间接抽吸过程中使用本公开的生物流体分离装置的第一步骤的立体图。
图12b是根据本发明另一实施例在间接抽吸过程中使用本公开的生物流体分离装置的第二步骤的立体图。
图12c是根据本发明另一实施例在间接抽吸过程中使用本公开的生物流体分离装置的第三步骤的立体图。
图13是根据本发明另一实施例的生物流体分离装置的立体图。
图14是根据本发明另一实施例的图13的截面图。
图15是根据本发明另一实施例的图13的截面图。
图16a是根据本发明另一实施例使用本公开的生物流体分离装置的第一步骤的立体图。
图16b是根据本发明另一实施例使用本公开的生物流体分离装置的第二步骤的立体图。
图16c是根据本发明另一实施例使用本公开的生物流体分离装置的第三步骤的立体图。
图17a是根据本发明另一实施例使用本公开的生物流体分离装置的第一步骤的立体图。
图17b是根据本发明另一实施例使用本公开的生物流体分离装置的第二步骤的立体图。
图17c是根据本发明另一实施例使用本公开的生物流体分离装置的第三步骤的立体图。
在几个视图中,相应的附图标记表示相应的部件。这里阐述的范例说明了本公开的例示性实施例,并且这些范例不应被解释为以任何方式限制本公开的范围。
具体实施方式
提供以下描述是为了使本领域技术人员能够制造和使用预期用于实施本发明的所述实施例。然而,对于本领域的技术人员来说,各种修改、等同物、变化和替换仍然是显而易见的。任何和所有这样的修改、变化、等同物和替代物都旨在落入本发明的精神和范围内。
出于下文描述的目的,术语“上”、“下”、“右”、“左”、“竖直”、“水平”、“顶部”、“底部”、“侧向”、“纵向”及其派生词应与如图中所定向的本发明相关。然而,应该理解的是,本发明可以采取替代的变化和步骤顺序,除非有相反的明确说明。还应当理解,附图中示出的以及以下说明书中描述的特定装置和过程仅仅是本发明的例示性实施例。因此,与本文公开的实施例相关的特定尺寸和其他物理特征不应被视为是限制性的。
图1-4e示出了本公开的生物流体分离装置的一个例示性实施例。参考图1-4e,本公开的生物流体分离装置10适于接纳血液样本12,血液样本12具有第一部分例如细胞部分14和第二部分例如血浆部分16。本公开提供了的生物流体分离装置和分离过程允许从血液样本中高效地分离血浆。
在一个实施例中,本公开的生物流体分离装置提供集成在抽空血液收集管内的血浆分离装置。有利的是,本公开的生物流体分离装置在临床抽血期间提供了血浆的立即分离,并且提供了将分离的血浆样本以受控方式分配到护理点盒或其他诊断仪器端口或测试装置的能力。本公开的生物流体分离装置提供了一种血液收集工作流程,该工作流程与使用真空管(例如bd
本公开的生物流体分离装置允许在抽血期间立即进行血浆分离,因此不仅消除了对单独的离心分离过程的需要,并且还允许使用本公开的嵌入式精确滴液分配器将受控的血浆样本转移到诊断端口。本公开的生物流体分离装置消除了对常规血液收集管进行离心分离的需要,常规血液收集管通常需要被送到实验室进行离心分离。
参考图1-4e,在一个例示性实施例中,生物流体分离装置10通常包括内壳体或内管20、外壳体或外管22以及分离器24。
参考图1-4e,内壳体20包括入口30、出口32、接纳血液样本12的血液腔室34、分离腔室(例如血浆腔室36)和分离器24。在一个实施例中,内壳体20的入口30在第一端,内壳体20的出口32在相对的第二端。在另一些实施例中,入口30和出口32的配置可以针对不同的应用而变化。
参照图1-4e,血液腔室34接纳血液样本12,并且包括血液腔室入口40、血液腔室出口42和在血液腔室入口40与血液腔室出口42之间延伸的血液腔室通道44。在一个实施例中,血液腔室入口40与生物流体分离装置10的入口30流体连通。在一个实施例中,血液腔室34还包括与血液腔室出口42流体连通的血液废弃腔室45。以这种方式,血液样本12的细胞部分14可以在流经血液腔室通道44并经过分离器24之后移动并储存在血液废弃腔室45内。血浆腔室36包括血浆腔室出口46。
参考图1-4e,分离器24设置在血液腔室34与血浆腔室36之间。在一个实施例中,分离器24适于将血液样本12的细胞部分14截留在血液腔室34中,并允许血液样本12的血浆部分16通过分离器24进入血浆腔室36。
在一个实施例中,分离器24包括具有孔隙或过滤孔52的膜表面50。膜表面50具有第一或血液侧54和第二或血浆侧56。参考图3e,血液腔室通道44平行于膜表面50,如下面更详细讨论的。
在一个实施例中,分离器24包括径迹蚀刻膜。本公开的生物流体分离装置10使用径迹蚀刻膜和错流过滤将血浆16与细胞14分离。生物流体分离装置10的径迹蚀刻膜是过滤器,其具有足够小的孔隙,以防止红血细胞或细胞流过,但允许血浆流过。穿过膜的血浆流动由膜两侧的压力(即跨膜压力)驱动,但是这种流动也将细胞带到膜表面,并有膜堵塞的风险。这是通过平行于膜表面的连续血液流动(即错流过滤)来防止的,其将细胞冲走并允许连续地进行血浆过滤。
在一个实施例中,本公开的生物流体分离装置10控制径迹蚀刻膜一侧(即第一或血液侧54)的血液流率,同时径迹蚀刻膜两侧的压差将血浆16抽取到径迹蚀刻膜的另一侧,即第二或血浆侧56,如图3e和3f所示。落入血液腔室34的血液样本12在血液腔室通道44内平行于分离器24的膜表面50而流动。以这种方式,这种平行流动防止血液样本12的细胞14堵塞分离器24的孔隙52,分离器24的亚微米孔隙52允许血浆16流向另一侧,即血浆侧56,并进一步流出而进入血浆腔室36。
在一个实施例中,分离器24包括的径迹蚀刻膜具有亚微米孔52,以从平行于膜表面50连续流动的血液样本12中过滤血浆16。以这种方式,防止了过滤孔52的堵塞,如图3f所示。有利的是,本公开的分离过程不是连续地将细胞截留在过滤结构内,最终将产率降低到零。
本公开的生物流体分离装置10被设计成有效地从血浆中分离血细胞,而不使细胞受到损伤,所述损伤例如是被称为溶血的细胞破裂。本公开的生物流体分离装置10以在给定时间内最大化血浆产率的方式平衡基本血液流动特征,同时保持细胞完整性。在一些实施例中,这样设计本公开的生物流体分离装置10:例如使用等效电路方法,使用对过滤系统的每个部分的数学建模来确定临界流量和几何参数,这些参数将使产率最大化、使分离时间最小化并且使溶血最小化。
在一个实施例中,分离器24包括厚度小于100微米的径迹蚀刻膜。在一个实施例中,分离器24包括5-25微米厚的径迹蚀刻膜。在另一个实施例中,分离器24包括6-14微米厚的径迹蚀刻膜。
在一个实施例中,径迹蚀刻膜的亚微米孔52的直径大约为0.1-1.0微米。在另一个实施例中,径迹蚀刻膜的亚微米孔52的直径大约为0.2-0.8微米。
在一个实施例中,径迹蚀刻膜的有效过滤表面积小于40mm2。有利的是,这允许本发明的分离器24装配在常规的血液收集管内,并且还产生具有最小分析物偏差的高品质血浆,特别是心脏标志物(如肌钙蛋白和bnp)的低偏差。
参考图3e,在一个实施例中,分离器24、血液腔室34和血浆腔室36形成分离器芯片58。在一个实施例中,分离器芯片58的尺寸被设定为包含在内壳体20内。
在一个实施例中,分离器芯片58具有大约9-125毫米的芯片长度。在一个实施例中,分离器芯片58具有大约8-16毫米的芯片宽度。在一个实施例中,分离器芯片58具有大约0.5-2毫米的芯片厚度。
在一个实施例中,血液腔室34的高度大约为30-200微米。在一个实施例中,血液腔室34的长度大约为5-121微米。在一个实施例中,血浆腔室36的高度大约为60-1000微米。
在一个实施例中,本公开的生物流体分离装置10包括外壳体22,外壳体22能够可移除地连接到内壳体20。参照图1-3a,在内壳体20连接到外壳体22的情况下,内壳体20设置在外壳体22内。外壳体22包括开口端70、闭合端72和侧壁74,侧壁74在开口端70与闭合端72之间延伸并限定内部76。在一个实施例中,外壳体22包含第一真空78。
参考图1-3c,在一个实施例中,生物流体分离装置10包括覆盖入口30的闭合件60。参照图1-3c,闭合件60与入口30接合,以密封生物流体分离装置10。闭合件60保护性地覆盖入口30。闭合件60允许将血液样本12引入内壳体20的血液腔室34中,并且可以包括可刺穿的自密封塞子62,该塞子62具有外屏蔽件64,例如可从becton,dickinsonandcompany购得的hemogardtm帽。在一个实施例中,闭合件60包括塞子适配器66。
参考图1-3c,在一个实施例中,外壳体22可经由闭合件60可移除地连接到内壳体20。例如,闭合件60固定到外壳体22上。以这种方式,内壳体20连接到外壳体22,闭合件60密封外壳体22的开口端70。
在一个实施例中,外壳体22是抽空管。在一个实施例中,外壳体22可以是包含真空的血液收集管,例如可从becton,dickinsonandcompany购得的
参考图1-3c,在一个实施例中,内壳体20包括帽80,帽80能够可移除地附连到出口32,并且保护性地覆盖出口32。在一个实施例中,帽80包括通气塞82,通气塞82允许空气从中通过,并防止样本12的血浆16通过。
帽80和通气塞82的构造允许空气通过帽80,同时防止血液样本12的血浆16通过帽80,并且可以包括疏水过滤器。通气塞82具有选定的空气通过阻力,该阻力可用于精细地控制内壳体20的血液腔室34和/或血浆腔室36的填充速率。通过改变通气塞82的孔隙率,可以控制空气流出帽80的速率,从而可以控制血液样本流入内壳体20的速率。
参考图1-3c,在一个实施例中,外壳体22包含第一真空78,内壳体20包含第二真空38。在一个实施例中,第一真空78和第二真空38经由通气塞82而连通。在另一些实施例中,内壳体20还可以包括第二通气塞和/或通气塞阀84,其允许第一真空78和第二真空38通过它而连通到一起。
第一真空78和第二真空38在内壳体20内抽吸血液样本12,并通过分离器24将血浆部分16抽吸到血浆腔室36中,如下面更详细描述。
在一个实施例中,一旦血浆16浸湿通气塞82,帽80的通气塞82(该通气塞82允许空气从中通过并防止样本12的血浆16通过)就密封血浆腔室36,并结束分离。
参考图1-4f,在一个实施例中,生物流体分离装置10的内壳体20包括分配器组件或分配器单元90,其允许包含在血浆收集通道48内的血浆16以精确、受控和高效的方式排出。
参考图1-4f,在一个实施例中,内壳体20包括在血浆腔室出口46与内壳体20的出口32之间的血浆收集通道48。这样,在分离之后,血浆16通过血浆腔室出口46流到血浆收集通道48。血浆收集通道48允许血浆16被收集并存储在内壳体20内,直到希望将血浆16转移出内壳体20。
在一个实施例中,血浆收集通道48具有蜿蜒形状。血浆收集通道48的蜿蜒形状的直径的大小被确定为防止在血浆16内形成气泡,并以毛细管形式保持血浆16流过通道48。血浆收集通道48的蜿蜒形状还允许血浆16流入的通道的长度增大,同时保持毛细管形式。
参考图1-4f,在一个实施例中,内壳体20还包括分配器组件或分配器单元90,其允许包含在血浆收集通道48内的血浆16以精确、受控和高效的方式排出。例如,一旦足量的血浆16被收集在血浆收集通道48内,内壳体20就可以从外壳体22移除,如图4c所示。接下来,从出口32移除帽80,分配器组件90用于从内壳体20的血浆收集通道48分配血浆16,如图4d和4e所示。
内壳体20的分配器组件90可以包括允许血浆16以精确、受控和高效的方式从内壳体20的血浆收集通道48排出的任何分配器结构。
参考图3c和3d,将描述分配器组件90的一个例示性实施例。在一个实施例中,分配器组件90包括血浆收集通道48、帽80、通气塞82、可变形部分92、通气口96和单向阀98。在一个实施例中,可变形部分92包括第一分配器球囊93和第二分配器球囊94。
在一个实施例中,帽80覆盖出口32,并包括通气塞82,通气塞82允许空气从中通过并防止血液样本12的血浆部分16通过。
在一个实施例中,可变形部分92能够在初始位置与变形位置之间转变,在初始位置,血浆部分16包含在血浆收集通道48内,在变形位置,血浆部分16的一部分从血浆收集通道48排出。参考图4d和4e,随着帽80从出口32移除,并且可变形部分92转变到变形位置,血浆部分16的一部分从生物流体分离装置10,即内壳体20的血浆收集通道48排出。在一个实施例中,可变形部分92包括第一分配器球囊93和第二分配器球囊94。
在使用中,当挤压可变形部分92时,空气在内壳体20中被推动,以将血浆16从血浆收集通道48排出。在一个实施例中,当挤压可变形部分92时,可变形部分92上的通气口96被使用者的手指覆盖,以迫使空气通过单向阀98,从而将血浆16从血浆收集通道48排出。
当可变形部分92被释放时,通气口96不再被覆盖,并且空气将可变形部分9充胀回来。重要的是,当可变形部分92被释放时,单向阀98防止血浆16在分配后被拉回到血浆收集通道48内。以这种方式,本公开的分配组件90确保包含在血浆收集通道48内的血浆16只能沿一个方向流动,即流出血浆收集通道48。
参考图5-7d,在另一例示性实施例中,内壳体20的血浆腔室出口46与外壳体22的内部76的一部分流体连通。在这样的实施例中,参考图1-4f讨论的实施例的内壳体20的分配组件90被移除,并且血浆16被允许直接流出血浆腔室出口46进入外壳体22的内部76的一部分内。
参考图7a,在该实施例中,当血液样本12被吸入内壳体20内时,血浆16被分离并离开血浆腔室出口46并收集在外壳体22中。参考图7b,血液样本12的废弃细胞部分14保留在内壳体20内,并且可以在血浆16分离后被处理掉。参考图7c和7d,包含在外壳体22内的血浆16然后可以手动转移或直接呈现给临床分析仪。
在操作中,当内壳体20被填充时,图1-4f所示实施例(该实施例具有允许在内壳体20内收集血浆16的血浆收集单元或分配组件90)中的血浆产生停止。
由于需要或多或少的血液来填充血浆收集单元,因此不同患者的血液抽吸和血浆体积不同。移除图5-7d所示实施例中的血浆收集单元允许产生超出收集单元容量的额外血浆。这提供了增加血浆体积的益处(根据患者血细胞比容,自3毫升全血的300-700μl,相比而言,血浆收集单元可能会限制为例如150-250升)。图5-7d所示实施例的另一个益处是,血浆16样本可以直接呈现给临床分析仪,或者根据工作流程需要手动分配。
在图5-7d所示的实施例中,对于所有患者,抽血体积可以增加到稳定的3毫升,而不是在患者之间变化。因此,血浆分离时间可以随着抽血体积的增加而成比例地增加。为了减轻运行时间增加的影响,如图12a-12c所示,图5-7d所示的实施例可以与患者外分离方法结合,如下文更详细描述的。
参考图8-10d,在另一例示性实施例中,内壳体20的血浆腔室出口46与诊断组件200流体连通。在这样的实施例中,参考图1-4f讨论的实施例的内壳体20的分配组件90被移除,并且允许血浆16直接流出血浆腔室出口46进入诊断组件200。在这样的实施例中,血浆16填充诊断组件200,用于在分离后立即测试血浆16的分析物,而不需要从生物流体分离装置10分配任何血浆16。
在一个实施例中,诊断组件200包括与血浆腔室出口46连通的诊断接口202、用于测试血液样本12的血浆部分16的传感器204、以及允许空气从中通过并防止血液样本12的血浆部分16通过的通气塞206。
参考图10c,在一个实施例中,诊断组件200包括单个传感器204。参考图10c,在一个实施例中,诊断组件200包括三个传感器204。参考图10c,在一个实施例中,诊断组件200包括许多传感器204。诊断组件200可以包括期望的测试应用所需的任意数量的传感器204。
在一个实施例中,诊断组件200的通气塞206允许真空将血浆16拉入诊断接口202并填充诊断组件200。例如,通气塞206允许外壳体22的真空78与诊断组件200连通,以将血浆16拉入诊断组件200。通气塞206允许空气从中通过,同时防止血液样本12的血浆16通过。例如,一旦血浆16充满诊断组件200,通气塞206就被血液饱和并浸湿。一旦发生这种情况,诊断组件200充满血浆16,并且不再有血浆16被拉入诊断组件200。随着诊断组件200完全充满血浆16并且通气塞206浸湿,诊断组件200也被密封。
参考图8-10d,诊断组件200提供板载诊断单元,用于在分离后立即测试血浆16中的分析物。诊断组件200将利用但不限于光学测试和其他方法。可能的应用包括分析物存在的定性“是或否”测试,例如类似于普通妊娠测试,以及分析物如胆固醇或钠的定量结果。参考图10b,在一个实施例中,板载诊断组件200可以单独工作。参考图10d,在一个实施例中,板载诊断组件200可以与测试读取器交接,测试读取器为例如诊断适配器208,例如蜂窝电话适配器,其将装置10连接到护理点诊断仪器210,例如蜂窝电话相机,用于样本结果的成像和分析。
装置10的诊断组件200通过消除将血浆16转移到单独测试盒的需要,提供了高效的护理点工作流程和临床医生安全性。装置10的诊断组件200还将减少需要的血浆16的所需体积,例如在一些实施例中,从200-400微升的血浆范围减少到10-50微升,这也将缩短装置的运行时间,例如在一些实施例中,从50-140秒缩短到15-30秒,并且能够减小所需的血液体积,例如在一些实施例中,从1-3毫升减小到0.2-0.5毫升。
参考图4a-4f,现在将描述本公开的生物流体分离装置10的使用。有利地,本公开的生物流体分离装置10允许多种不同的方式来收集和分离血液样本的血浆部分。例如,在一个实施例中,本公开的生物流体分离装置10可以与具有套管或非患者针100的常规管保持器102一起在直接抽吸过程中使用,如下面更详细描述的那样。在另一个实施例中,本公开的生物流体分离装置10可以在间接抽吸过程中与单独的血液收集管130一起使用,如下面更详细描述。
参考图4a、图4b和图11a,现在将讨论本公开的生物流体分离装置10在直接抽吸过程中与具有套管或非患者针100的常规管保持器102一起使用。本公开的生物流体分离装置10与常规的血液收集套件例如管保持器102或其他常规的血液收集装置兼容。
在使用中,针套管或非患者针100(图2和4a)通过闭合件60的可刺穿自密封塞子62直接插入生物流体分离装置10的内壳体20的血液腔室34中。如图4a和4b所示,包括组合的内壳体20和外壳体22的生物流体分离装置10可以插入具有套管或非患者针100的常规管保持器102中,生物流体例如血液样本12穿过套管或非患者针100。
接下来,在本公开的生物流体分离装置10与管保持器102直接连接的情况下,通过抽吸外壳体22中包含的第一真空78和内壳体20中包含的第二真空38,将血液样本12从常规管保持器102拉入生物流体分离装置10的内壳体20的血液腔室34中。例如,当管保持器102的非患者针100刺穿闭合件60的塞子62时,外壳体22中包含的第一真空78和内壳体20中包含的第二真空38经由管保持器102的非患者针100抽吸内壳体20的血液腔室34内的血液样本12。
通气塞82和/或通气塞阀84允许空气从中通过,同时防止血液样本12和/或血浆部分16通过。一旦血液样本12充满分离器芯片58,第一真空78和第二真空38不再连通,并开始单独作用。第二真空38继续将血液样本12的细胞部分14从血液腔室出口42丢弃到血液废弃腔室45。此外,第一真空78继续通过分离器24将血浆部分16吸入血浆腔室36。一旦血浆部分16充满血浆腔室45并到达通气塞82,通气塞将被血液饱和并浸湿,结束分离。如果期望的操作需要,第一真空78和第二真空38可以通过通气塞阀84连接,该阀允许空气在第一真空78和第二真空38之间通过,但是防止血液样本12到达外壳体22。
因此,在一个实施例中,第一真空78和第二真空38最初作为单个真空一起作用,同时第一真空78和第二真空38连通在一起。接下来,在分离器芯片58充满血液样本12之后,第一真空78和第二真空38不再连通在一起,而是单独作用。在另一个实施例中,第一真空78和第二真空38在操作期间通过通气塞阀84保持连通。
一旦血液样本12被收集并且期望量的血浆16被分离,生物流体分离装置10就从管保持器102中移除。接下来,分离的血浆16准备好被分配和/或分析,如下面进一步详细描述的。
参考图12a-12c,现在将讨论本公开的生物流体分离装置10与单独的血液收集管130在间接抽吸过程中一起使用。
间接抽吸过程允许血浆在患者外分离。参考图12a,在该实施例中,在常规血液收集程序中,血液样本12被收集在常规血液收集管130中。使用常规血液收集管130的血液收集允许更快地从患者体内收集血液样本12。以这种方式,减少了患者需要经历血液收集程序的时间。
接下来,参照图12b,然后将包含血液样本12的血液收集管130连接到生物流体分离装置10,用于分离血液样本12的血浆16。以这种方式,当没有血液收集装置连接到患者时,使用生物流体分离装置10进行血浆16的分离。
参考图12b,在一个实施例中,生物流体分离装置10包括生物流体分离装置连接器140,其能够可移除地连接到血液收集管130的连接器132。在使用生物流体分离装置10分离血浆16的过程中,这种连接在生物流体分离装置10与血液收集管130之间提供了密封、可靠的连接。
在一个实施例中,血液收集管130包括通气口134。通气口134允许空气被释放,以允许生物流体分离装置10内的真空将血液样本12拉入生物流体分离装置10,并将血浆部分16通过分离器24拉入血浆腔室36。
一旦分离出所需量的血浆16,就将生物流体分离装置10从血液收集管130中移除。接下来,分离的血浆16准备好被分配和/或分析,如下面进一步详细描述。
随着分离的血浆16被收集在生物流体分离装置10中,分离的血浆16准备好被分配和/或分析。在一个实施例中,可以使用生物流体分离装置10的分配器组件90。例如,参考图1-4f,在一个实施例中,生物流体分离装置10的内壳体20包括分配器组件或分配器单元90,其允许包含在血浆收集通道48内的血浆16以精确、受控和高效的方式排出。
参考图4c,在这样的实施例中,一旦血浆分离和收集完成,内壳体20就与外壳体22分离(图4c)。在一个实施例中,通过从外壳体22移除仍然附连到内壳体20的闭合件60,而使内壳体20与外壳体22分离。闭合件60的移除可以通过使用者抓住闭合件60的外屏蔽件64和外壳体22并沿相反方向拉动或扭转它们来实现。
一旦内壳体20与外壳体22分离,帽80就可从内壳体20上移除,暴露内壳体20的出口32。移除可以通过使用者抓住帽80的外部部分并将帽80从内壳体20中拉出来实现。在一个实施例中,在移除帽80之后,血浆16通过毛细作用保持在内壳体20的血浆收集通道48内。
参考图4d、4e、11b和12c,然后可以通过启动分配组件90从内壳体20的血浆收集通道48分配血浆16。如上所述,在一个实施例中,内壳体20还包括分配器组件90,其允许包含在血浆收集通道48内的血浆16以精确、受控和高效的方式排出。例如,参考图4c,一旦足量的血浆16被收集在血浆收集通道48内,内壳体20就可以从外壳体22移除。接下来,从出口32移除帽80,并且分配器组件90用于从内壳体20的血浆收集通道48分配血浆16。
参考图4d,在一个实施例中,血浆16可以被转移到样本容器110中,同时最小化医务人员对血液样本12的血浆16的暴露。
参考图4e,在一个实施例中,血浆16可以被转移到用于分析血浆16的装置,例如护理点测试装置120、盒测试器或近患者测试装置,同时最小化医务人员对血液样本12的血浆16的暴露。
在血浆16分离之后,分离的血浆16准备好被分配和/或分析。在一个实施例中,可以使用图5-7d所示的生物流体分离装置10的实施例。例如,参考图5-7d,在另一个实施例中,内壳体20的血浆腔室出口46与外壳体22的内部76的一部分流体连通。在这样的实施例中,参考图1-4f讨论的实施例的内壳体20的分配组件90被移除,并且血浆16被允许直接流出血浆腔室出口46进入外壳体22的内部76的一部分。
参考图7b,在这样的实施例中,一旦血浆分离和收集完成,内壳体20就与外壳体22分离。参考图7b,血液样本12的废弃细胞部分14保留在内壳体20内,并且可以在血浆16分离后被处理掉。参考图7c和7d,包含在外壳体22内的血浆16然后可以手动转移或直接呈现给临床分析仪。
在一个实施例中,分离的血浆16填充诊断组件200,用于在分离后立即测试血浆16的分析物,而不需要从生物流体分离装置10分配任何血浆16。例如,参考图8-10d,诊断组件200提供板载诊断单元,用于在分离后立即测试血浆16中的分析物。诊断组件200将利用但不限于光学测试和其他方法。可能的应用包括分析物存在的定性“是或否”测试,例如类似于普通妊娠测试,以及分析物如胆固醇或钠的定量结果。参考图10b,在一个实施例中,板载诊断组件200可以单独工作。参考图10d,在一个实施例中,板载诊断组件200可以与测试读取器交接,测试读取器为例如诊断适配器208,例如蜂窝电话适配器,其将装置10连接到护理点诊断仪器210,例如蜂窝电话相机,用于样本结果的成像和分析。
参考图13-17c,在另一些实施例中,血液腔室出口42(图3e)与外壳体22的内部76的一部分流体连通。
参考图17a-17c,在一个实施例中,在血浆分离期间,装置10将废弃的血液或细胞14导向至外壳体22内部76的底部。血浆16被收集到分配器单元或分配器组件310中,分配器单元或分配器组件310可移除地连接到外壳体22的一部分。参考图17b,在一个实施例中,分配器单元310与闭合件60一起被移除。分离芯片58和废弃的血液或细胞14保留在外壳体22中并被丢弃。参考图17c,在一个实施例中,然后可以使用分配器单元310分配血浆16用于测试。
参考图13-16c,在一个实施例中,装置10包括从血浆腔室出口46延伸到分配器单元310的一部分的血浆收集通道320。参考图15-17c,在一个实施例中,该装置10包括塞子322,塞子322的尺寸相对于外壳体22的内部76设定,以提供与外壳体22的侧壁74的密封接合。在一个实施例中,塞子322将外壳体22的内部76分成第一密封部分324和第二部分326。在一个实施例中,血液腔室出口42与外壳体22的内部76的第一密封部分324流体连通。
虽然本公开被描述为具有例示性设计,但是本公开可以在本公开的精神和范围内进一步修改。因此,本申请旨在利用其一般原理涵盖本公开的任何变化、使用或调适。此外,本申请旨在涵盖与本公开相关的领域中的已知或习惯实践中偏离本公开的内容,并且这些偏离落入所附权利要求的范围内。
- 还没有人留言评论。精彩留言会获得点赞!