离心微流控芯片的制作方法
本发明涉及微流控技术领域,特别是涉及一种离心微流控芯片。
背景技术:
微流控(microfluidics)指的是使用微管道(尺寸在数十到数百微米)处理或操纵微小流体的系统所涉及的科学和技术。因为具有微型化、集成化等特征,微流控装置通常被称为微流控芯片,可将生物及化学领域所涉及的基本操作单元,甚至于把整个化验室的功能(包括采样、稀释、反应、分离、检测等)集成在一个小型芯片上,故又称芯片实验室(lab-on-a-chip)。而离心微控流装置作为微控流技术中使用较为普遍的一类结构,可通过转动离心微流控芯片来使离心力在亚毫米尺度上操控液体。
目前,离心微控流装置在即时诊断(point-of-caretesting,简称poct)设备中应用较多。而传统的即时诊断设备通常都是基于核酸检测的,对于核酸检测之前的样本预处理则是需要利用人工提取纯化的方式实现,故而传统的微流控即时诊断设备只能实现核酸的检测工作,并不能实现对样本的预处理,故传统的即时诊断设备中离心微流控芯片并不能实现样本预处理的自动化。
技术实现要素:
基于此,有必要针对传统的即时诊断设备不能实现样本预处理自动化的问题,提供一种可实现样本预处理自动化的离心微流控装置。
一种离心微流控芯片,包括:
芯片主体,包括基板及第一密封板,所述基板具有相对的第一表面及第二表面,所述第一表面朝向所述第二表面凹陷以形成容置腔,所述容置腔的内壁开设有进液口及出液口,所述第一密封板密封安装于所述第一表面,以密封所述容置腔;及
核酸提取柱,包括用于过滤及吸附样本液中核酸的核酸吸附性载体,所述核酸吸附性载体密封安装于所述容置腔内,并将所述容置腔沿纵长方向分隔为第一腔室及第二腔室,所述进液口及所述出液口分别位于所述第一腔室的内壁及所述第二腔室的内壁。
在其中一个实施例中,所述芯片主体还具有分别与所述进液口及所述出液口连通的第一流道及第二流道,且所述第一流道及所述第二流道分别位于所述容置腔的相对两侧。
在其中一个实施例中,所述第二表面朝向所述第一表面凹陷以形成第一凹槽及第二凹槽;所述芯片主体还包括第二密封板,所述第二密封板密封安装于所述第二表面,并分别与所述第一凹槽及所述第二凹槽的内壁之间形成所述第一流道及所述第二流道。
在其中一个实施例中,所述第一腔室及所述第二腔室的连线方向与所述第一表面垂直设置。
在其中一个实施例中,所述容置腔的内壁靠近所述第二密封板的位置开设有第一通槽,所述第一通槽的两端开口分别与所述进液口及所述第一流道连通;所述容置腔的内壁与所述第一密封板接触的位置开设有第二通槽,所述第二通槽的两端开口分别与所述出液口及所述第二流道连通。
在其中一个实施例中,所述第一腔室及所述第二腔室的连线方向与所述第一表面平行设置。
在其中一个实施例中,所述核酸提取柱还包括呈中空筒状结构的辅助安装套,所述辅助安装套收容并卡持于所述容置腔内,并沿所述第一腔室及所述第二腔室的连线方向延伸,所述核酸吸附性载体收容并卡持于所述辅助安装套内,所述出液口及所述进液口分别与所述辅助安装套两端的开口连通,所述核酸吸附性载体密封安装于所述辅助安装套内。
在其中一个实施例中,所述辅助安装套朝向所述第一密封板的一侧表面与所述第一表面平齐。
在其中一个实施例中,所述核酸提取柱还包括呈中空筒状结构的限位卡环,所述限位卡环密封安装于所述容置腔内,并沿所述第一腔室及所述第二腔室的连线方向延伸,所述限位卡环与所述核酸吸附性载体抵持,并用于在所述样本液的流动方向上对所述核酸吸附性载体的位置进行限定。
在其中一个实施例中,所述限位卡环的内径沿背离所述核酸吸附性载体的方向逐渐增大。
上述离心微流控芯片,主要应用于即时诊断设备。在离心微流控芯片的加工过程中,将核酸提取柱置于容置腔内,并利用第一密封板实现对容置腔的密封,从而可将核酸提取柱封装于芯片主体内,以实现核酸提取柱在离心微流控芯片上的集成。在即时诊断设备中,即时诊断设备中的离心驱动装置驱动离心微流控芯片旋转,以产生离心力,使用时,在上述离心力的作用下,样本液经进液口依次流经第一腔室、核酸吸附性载体及第二腔室,之后再经出液口流出,而样本液在流经核酸吸附性载体时可使核酸被吸附在核酸吸附性载体的表面,清洗样本杂质的清洗液和核酸洗脱液同样流经该结构,以实现样本液中核酸提取及纯化工作的自动化。因此,上述离心微流控芯片的设置,使得即时诊断设备可实现对样本液预处理的自动化。
附图说明
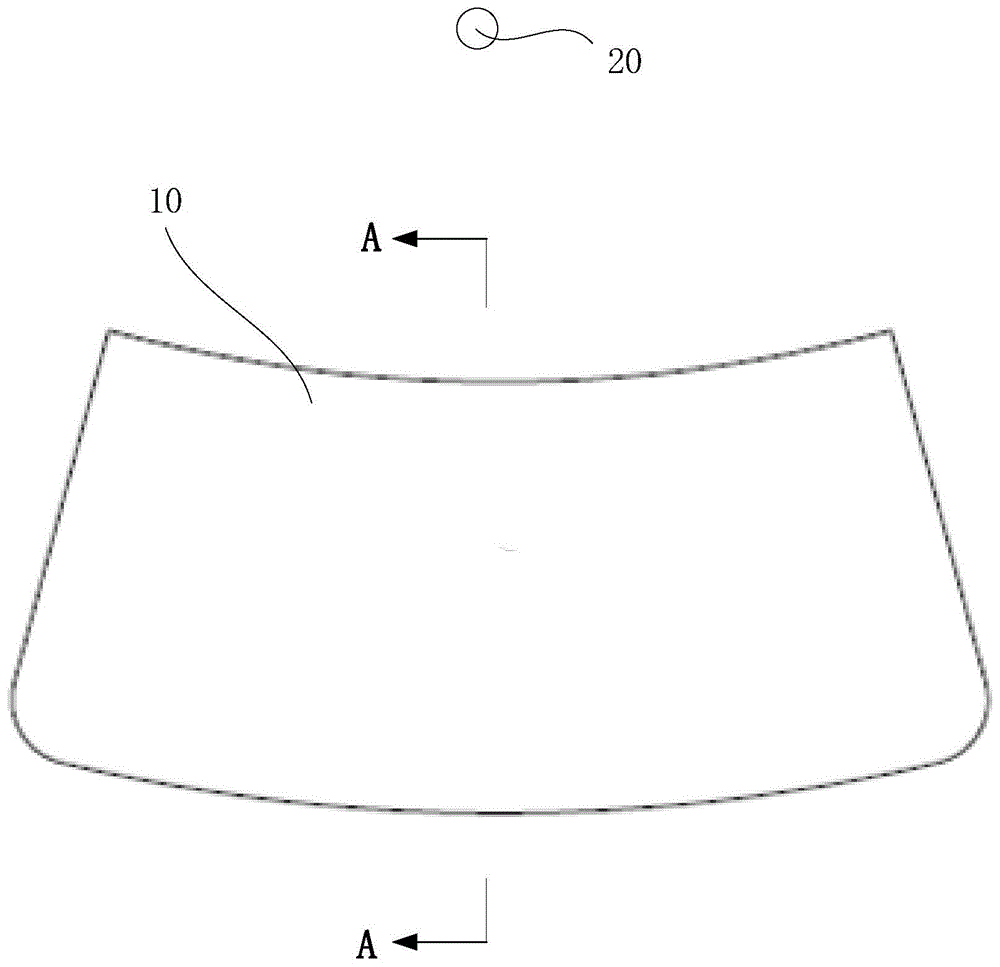
图1为本发明较佳实施例中离心微流控芯片的示意图;
图2为本发明一个实施例中微流控芯片的a-a局部剖视图;
图3为图2所示离心微流控芯片中基板的俯视图;
图4为图3所示基板的b-b剖视图;
图5为图3所示基板的仰视图;
图6为本发明另一个实施例中微流控芯片的a-a局部剖视图;
图7为图6所示离心微流控芯片中基板的俯视图;
图8为图7所示基板的c-c剖视图;
图9为图7所示基板的仰视图;
图10为图6所示离心微流控芯片中辅助安装套的剖视图。
具体实施方式
为了便于理解本发明,下面将参照相关附图对本发明进行更全面的描述。附图中给出了本发明的较佳的实施例。但是,本发明可以以许多不同的形式来实现,并不限于本文所描述的实施例。相反地,提供这些实施例的目的是使对本发明的公开内容的理解更加透彻全面。
除非另有定义,本文所使用的所有的技术和科学术语与属于本发明的技术领域的技术人员通常理解的含义相同。本文中在本发明的说明书中所使用的术语只是为了描述具体的实施例的目的,不是旨在于限制本发明。本文所使用的术语“及/或”包括一个或多个相关的所列项目的任意的和所有的组合。
在描述位置关系时,除非另有规定,否则当一元件被指为在另一元件“上”时,其能直接在其他元件上或亦可存在中间元件。亦可以理解的是,当元件被指为在两个元件“之间”时,其可为两个元件之间的唯一一个,或亦可存在一或多个中间元件。
在使用本文中描述的“包括”、“具有”、和“包含”的情况下,除非使用了明确的限定用语,例如“仅”、“由……组成”等,否则还可以添加另一部件。除非相反地提及,否则单数形式的术语可以包括复数形式,并不能理解为其数量为一个。
此外,附图并不是1:1的比例绘制,并且各元件的相对尺寸在附图中仅以示例地绘制,而不一定按照真实比例绘制。
请参阅图1,本发明提供了一种离心微流控芯片10及即时诊断设备(图未示)。其中,即时诊断设备包括离心微流控芯片10及离心驱动装置(图未示)。
离心微流控芯片10主要用于在实验室中对样本液进行预处理及检测。离心驱动装置的输出轴与离心微流控芯片传动连接,以驱动离心主体10绕旋转轴20可旋转。其中,旋转轴20可以为微流控芯片10的中心轴线,也可以为离心驱动装置的输出轴,更可以为即时诊断设备中其他零部件上的轴类结构。具体的,离心驱动装置可以为驱动电机、伺服马达等。离心驱动装置驱动离心微流控芯片10绕旋转轴20旋转,可在离心微流控芯片10上形成一个离心场,并在离心场中离心力的作用下,可实现离心微流控芯片10中的样本液的自动流动,从而使得离心微流控芯片10实现样本预处理的自动化。
需要说明的是,上述离心微流控芯片10还可以用于其他需要进行样本预处理及样本检测的样品分析检测设备中。
请一并参阅图2,本发明较佳实施例中的离心微流控芯片10包括芯片主体100及核酸提取柱200。
请一并参阅图3至图5,芯片主体100包括基板110及第一密封板120。基板110具有相对的第一表面111及第二表面115。第一表面111朝向第二表面115凹陷以形成容置腔112。容置腔112的内壁开设有进液口1121及出液口1122。第一密封板120密封安装于第一表面111,以密封容置腔112。其中,第一密封板120为由透明塑料等透光性较好的材料制成的薄板或膜状结构。第一密封板120可以通过粘接、压合等方式与基板110的第一表面111密封连接。
在即时诊断设备中,离心驱动装置的输出轴与芯片主体100传动连接,并用于驱动芯片主体110绕旋转轴20旋转。
核酸提取柱200包括用于过滤及吸附样本液中核酸的核酸吸附性载体210。核酸吸附性载体210密封安装于容置腔112内,并将容置腔112沿纵长方向分隔为第一腔室1123及第二腔室1124。进液口1121及出液口1122分别与第一腔室1123及第二腔室1124连通。由此,进液口1121及出液口1122分别位于核酸吸附性载体210的相对两侧。核酸吸附性载体210可以为板状、片状、薄膜等结构,通常由二氧化硅、二氧化硅聚合物、硅酸镁等吸附性能较强的材料制成。
具体的,根据需要吸附的核酸的种类和质量,核酸吸附性载体210可以为一个,也可以为多个。当核酸吸附性载体210为多个时,多个核酸吸附性载体20层叠设置。因此,容置腔111主要用于核酸吸附性载体210的安装及样本液中核酸的提取纯化。
在一些实施例中,核酸吸附性载体210为具有核酸吸附性质的多孔膜。多孔膜是指具有许多细孔的膜,可以过滤及吸附样本液中的核酸,且对核酸的吸附及过滤效果较好。具体的,由于多孔膜通常都质地较软,故在样本液流动方向上,核酸吸附性载体210的直径大于容置腔111的直径,以保证核酸吸附性载体210的密封效果。
为了便于技术方案的理解,有必要简要说明下利用即时诊断设备对样本液进行预处理的过程,具体为:
(1)在离心驱动装置的驱动下,芯片主体100旋转并产生离心场,在该离心场中离心力的作用下,包含有核酸及杂质的待提纯样本液经进液口1121依次自动流经第一腔室1123、核酸吸附性载体210及第二腔室1124,而在样本液流经核酸吸附性载体210时,可将样本液中的核酸吸附在核酸吸附性载体210的表面,而第二腔室1124内的过滤后的样本液经出液口1122流出至废液收集装置中;
(2)将清洗液引入至进液口1121,并在芯片主体100旋转产生的离心力作用下,位于进液口1121的清洗液依次流经第一腔室1123、核酸吸附性载体210及第二腔室1124,而第一腔室1123内的清洗液流经核酸吸附性载体210时,可对核酸吸附性载体210的表面进行清洗,以纯化吸附在核酸吸附性载体210表面的核酸,清洗后得到的废液流至第二腔室1124内,并经出液口1122流出至废液收集装置中;
(3)将洗脱液引入进液口1121,在芯片主体100旋转而产生的离心力作用下,经进液口1121流入第一腔室1123内,而第一腔室1123内的洗脱液在流经核酸吸附性载体210时,可将吸附在核酸吸附性载体210表面的核酸溶解至洗脱液中,并使溶解的核酸随洗脱液一起流至第二腔室1124内,而第二腔室1124内溶解有核酸的洗脱液经出液口1122流出至核酸收集装置中,以完成核酸的提取及纯化工作。
在离心微流控芯片10加工过程中,先将核酸提取柱200经容置腔112位于第一表面111的开口置于容置腔112内,并使核酸吸附性载体210密封安装于容置腔112内,之后再将第一密封板120密封安装于第一表面111上,以将核酸提取柱200封装于容置腔112内,实现核酸提取柱200在芯片主体110内的集成,使得核酸提取柱200在芯片主体110内的集成工作较为容易、简单。因此,上述离心微流控芯片10的设置,使得即时诊断设备可实现对样本液预处理的自动化。
进一步的,将核酸提取柱200集成于芯片主体100上,可使即时诊断设备的结构更为紧凑,体积更小。
请再次参阅2,在一些实施例中,芯片主体100还具有分别与进液口1121及出液口1122连通的第一流道113及第二流道114。第一流道113及第二流道114分别位于容置腔111的相对两侧。具体的,在即时诊断设备中,第一流道113位于容置腔111靠近旋转轴20的一侧,第二流道114位于容置腔111背离旋转轴20的一侧。当核酸吸附性载体210将容置腔111分成第一腔室1123及第二腔室1124时,第一腔室1123及第二腔室1124分别与第一流道113及第二流道114连通。第一流道113及第二流道114分别用于样本液和试剂的输入及输出,第一流道113、第一腔室1123、第二腔室1124及第二流道114依次连通,可形成样本液的流通通路。具体的,第一流道113及第二流道114分别用于连通容置腔112与样本液预处理的上一工序的溶池连通及容置腔112与样本液预处理的下一工序的溶池连通。
在即时诊断设备的工作过程中,芯片主体110在离心驱动装置的驱动下绕旋转轴20旋转,并在芯片主体110旋转所产生的离心场中离心力作用下,样本液依次流经第一流道113、第一腔室1123、核酸吸附性载体210、第二腔室1124及第二流道114。具体的,在与样本液的流动方向垂直的方向上,容置腔112的直径分别大于第一流道113的直径及第二流道114的直径。在流体力学领域中,通道的内径越小,则液体在通道内流动时受到的压力就越大,从而使得液体的流动速度也就会越快。因此,样本液在第一流道113及第二流道114内的流速较快,有效地保证了样本液在流通通路中的流动速度,保证了离心微流控芯片10的核酸提取效率;而且容置腔112的直径较大,从而使得核酸吸附性载体210与样本液的接触面积也较大,而且样本液在容置腔112内的流速较慢,有利于延长样本液与核酸吸附性载体210的接触时间,故而使得样本液与核酸吸附性载体210可以充分接触,有效地保证了核酸吸附性载体210对核酸的提取及纯化效果。
请再次参阅图3至图5,进一步的,在一些实施例中,第二表面115朝向第一表面111凹陷以形成第一凹槽1151及第二凹槽1152。芯片主体100还包括第二密封板130。第二密封板130密封安装于第二表面115,并分别与第一凹槽1151及第二凹槽1152的内壁之间形成第一流道113及第二流道114。第二密封板130通过粘合、压合等方式与基板110的第二表面115密封固定。其中,第二密封板130的材质与第一密封板120的材质相同。当然,其他实施例中,第一密封板120及第二密封板130也可以采用不同的材质。
将第二密封板130密封固定于第二表面115,并使第二密封板130的表面分别与第一凹槽1151及第二凹槽1152的内壁之间形成第一流道113及第二流道114,所以第二密封板130的设置,使得在芯片主体100上形成第一流道113及第二流道114的工序更为简单,进而使得离心微流控芯片10的加工更为简单。
需要说明的是,在另一实施例中,第一流道113及第二流道114可以为形成于基板110内部的通孔。
再一实施例中,第一表面111朝向第二表面115凹陷以形成第一凹槽1151及第二凹槽1152,第一密封板120的表面分别与第一凹槽1151及第二凹槽1152的内壁之间可形成第一流道113及第二流道114。
具体的,第一密封板120与第一表面111之间及第二密封板130与第二表面115之间均形成有一层粘性层(图未示)。在实际加工过程中,在第一表面111及第二表面115通过涂刷、敷设等方式形成一层液体胶,然后将第一密封板120及第二密封板130分别置于第一表面111及第二表面115,待液体胶固化后以形成粘性层,从而可将第一密封板120及第二密封板130分别粘合于第一表面111及第二表面115,以增加容置腔112、第一流道113及第二流道114的密封性。
请再次参阅图2至图5,在一个实施例中,第一腔室1123及第二腔室1124的连线方向与第一表面111垂直设置。当离心微流控芯片10位于水平面时,第一表面111为基板110的上表面,第二表面115为基板110的下表面,所以第一密封板120及第二密封板130分别位于基板110的上表面及下表面,由此第一腔室1123及第二腔室1124沿竖直方向间隔设置,此时核酸吸附性载体210横向设置于容置腔112内,故而核酸吸附性载体210的外周缘与容置腔112的内壁可密封接触,使得核酸吸附性载体210可不借助其他辅助结构就可以实现在容置腔112内的密封安装,从而使得离心微流控芯片10在实现核酸提取纯化功能的同时结构较为简单、紧凑。
请再次参阅图2至图4,进一步的,在本实施例中,容置腔112的内壁靠近第二密封板130的位置开设有第一通槽116。第一通槽116的两端开口分别与进液口1121及第一流道113连通。容置腔112的内壁与第一密封板130接触的位置开口有第二通槽117。第二通槽117的两端开口分别与出液口1122及第二流道114连通。
当离心微流控芯片10位于水平面时,进液口1121位于容置腔111的底部,第一通槽116也位于容置腔111的下方;出液口1122位于容置腔111内壁的上部分,第二通槽116位于容置腔111的一侧,并沿第一密封板120及第二密封板130的连线方向延伸。
由于进液口1121位于第一腔室1123内,出液口1122位于第二腔室1124内,所以第一腔室1123及第二腔室1124呈上下设置,且第一腔室1123位于第二腔室1124的下方,第一流道113及第二流道114都是水平设置,故液体的流动路径较为曲折,从而使得样本液在容置腔112内形成湍流,而且样本液在容置腔112内的流动是自下往上流动,样本液在容置腔112内的流动需要克服自身的重力,有效地减缓了样本液在容置腔112内的流动速度,可使样本液与核酸吸附性载体210的接触更为彻底,提高了样本液中核酸在核酸吸附性载体210上的过滤吸附效果,进而可提高对样本液中核酸的提取效果。
请一并参阅图6至图9,在另一实施例中,第一腔室1123及第二腔室1124的连线方向与第一表面111平行设置。当离心微流控芯片10位于水平面时,第一表面111为基板110的上表面,故第一表面111为水平面,所以第一腔室1123及第二腔室1124在水平方向上间隔设置。具体的,第一流道113及第二流道114均为水平设置,且第一腔室1123及第二腔室1124的连线方向分别与第一流道113及第二流道114的延伸方向一致,所以由第一流道113、第一腔室1123、第二腔室1124及第二流道114构成的流通通路的延伸方向也为水平方向,故样本液在容置腔111内流动时不需要克服自身的重力,从而使得样本液在液体流通路径中具有较高的流动速度,进而使得离心微流控芯片10对核酸的提取效率较高。
进一步的,在本实施例中,容置腔112的内壁开设有第四通槽118及第四通槽119。第四通槽118的两端开口分别与进液口1121及第一流道113连通。第四通槽119的两端开口分别与出液口1122及第二流道113连通。第一流道113、第三通槽118、第一腔室1123、核酸吸附性载体210、第二腔室1124、第四通槽119及第二流道114依次连通,以构成样本液的流动通路。当第一腔室1123指向第二腔室1124的方向为与第一表面111平行的水平面时,进液口1121及出液口1122的开口方向一致,均沿水平方向开设,而第三通槽118的设置,可实现第一流道113与第一腔室1123的连通;第四通槽119的设置,可实现第二流道114与第二腔室1124的连通。
进一步的,在本实施例中,核酸提取柱200还包括呈中空筒状结构的辅助安装套220。辅助安装套220收容并卡持于容置腔112内,并沿第一腔室1123及第二腔室1124的连线方向延伸。核酸吸附性载体210收容并卡持于辅助安装套220内。进液口1121及出液口1122分别与辅助安装套220两端的开口连通。
当离心微流控芯片10位于水平面时,辅助安装套220沿水平方向延伸。而且,由于进液口1121及出液口1122分别与辅助安装套220两端的开口连通,故辅助安装套220的延伸方向与样本液的流动方向一致。
由于辅助安装套220横向设置于容置腔111内,故核酸吸附性载体210的外周缘可与辅助安装套220的内壁密封连接。因此,辅助安装套220主要用于将核酸吸附性载体210密封安装于容置腔111内,以提高核酸吸附性载体210在容置腔111内的安装效果。
具体的,辅助安装套220的外表面形状与容置腔112的内壁形状相匹配,以保证辅助安装套220卡持于容置腔111内时与容置腔112的内壁之间具有较大的接触面积,从而使得辅助安装套220在容置腔112内更为稳定,进一步提高了离心微流控芯片10的结构稳定性。
请再次参阅图6,进一步的,在一个实施例中,辅助安装套220朝向第一密封板120的一侧表面与第一表面111平齐。由此,密封安装于第一表面111上的第一密封板120可与辅助安装套220相贴合,从而使得第一密封板120可防止辅助安装套220沿垂直于第一表面111的方向上下滑动,故将辅助安装套220朝向第一密封板120的一侧表面与第一表面111平齐设置,可提高辅助安装套220在容置腔112内的安装稳定性,进而提高了核酸提取柱200在芯片主体100内的稳定性,不但保证了核酸的提取效果,而且还提高了离心微流控芯片10的结构稳固性。
请一并参阅图10,进一步的,在一个实施例中,辅助安装套220相对两端的内壁边缘均沿自身的周向形成有倒角221。因为辅助安装套220两端的开口分别与进液口1121及出液口1122连通,在辅助安装套220两端的内壁边缘形成倒角221,以保证样本液向辅助安装套220内流入或者从辅助安装套220内流出的过程更为顺畅,从而可减少样本液在辅助安装套220内的残留。
请再次参阅图2及图6,在一些实施例中,核酸提取柱200还包括呈中空筒状结构的限位卡环230。限位卡环230密封安装于容置腔112内,并沿第一腔室1123及第二腔室1124的连线方向延伸。由此,限位卡环230两端的开口分别与进液口1121及出液口1122连通。限位卡环230与核酸吸附性载体210抵持,并与用于在样本液的流动方向上对核酸吸附性载体210的位置进行限定。
限位卡环230可以为一个,也可以为多个。当限位卡环230为一个时,限位卡环230与核酸吸附性载体210的一侧抵持;当第一限位卡环230为多个时,多个限位卡环230可以与核酸吸附性载体210的一侧抵持,也可以分成两组,且两组限位卡环230分别与核酸吸附性载体210的两侧抵持。
由此,限位卡环230主要起限位作用,可降低核酸吸附性载体210沿样本液的流动方向上发生滑动、甚至松脱等情况的概率,以提高离心微流控芯片10的结构稳固性,从而可保证离心微流控芯片10对核酸的提取效果。
具体的,限位卡环230可以为由橡胶、硅胶等弹性较好的材料制成。故限位卡环230为弹性卡环,不但可使限位卡环230与核酸吸附性载体210抵持时减少对核酸吸附性载体210的磨损,而且还可以增加限位卡环230与容置腔112的内壁之间的密封效果。
当第一腔室1123及第二腔室1124的连线方向与第一密封板120及第二密封板130的连线方向一致时,限位卡环230与核酸吸附性载体210朝向第一密封板120的一侧抵持,核酸吸附性载体210与容置腔112的内壁靠近第二密封板130的位置抵持,并覆盖进液口1121。由此,核酸吸附性载体210被夹持于限位卡环230及容置腔112的内壁之间,所以只需要一个限位卡环230,就可以对核酸吸附性载体210沿样本液的流动方向的位置进行限定,故而使得离心微流控芯片10在保证结构稳固性的同时,还使得结构更为简单。
可以理解,在其他实施例中,限位卡环230可以为两个,两个限位卡环230分别与核酸吸附性载体210的相对两侧抵持。具体的,位于核酸吸附性载体210朝向第二密封板130一侧的限位卡环230与容置腔112的内壁抵持。
当第一腔室1123及第二腔室1124的连线方向与第一表面111平行时,限位卡环230为两个,两个限位卡环230均受容并卡持于辅助安装套230内,并沿辅助安装套230的轴向间隔设置,核酸吸附性载体210夹持于两个限位卡环230之间。
由此,放离心微流控芯片10位于水平面上时,两个限位卡环230从左右两侧对核酸吸附性载体210进行夹持,进一步降低了核酸吸附性载体210沿辅助安装套220的轴向发生滑动等情况的概率,进一步提高了核酸吸附性载体210在辅助安装套220内的稳定性,不但使得离心微流控芯片10的结构稳固性更好,而且还有效地保证了核酸提取效果的稳定性。
进一步的,在一些实施例中,限位卡环230的内径沿背离核酸吸附性载体210的方向逐渐增大。由此,限位卡环230的内壁也呈锥形,也就是说限位卡环230的壁厚沿指向核酸吸附性载体210的方向逐渐增厚,以增大核酸吸附性载体210与限位卡环230的接触面积,不但使得限位卡环230对核酸吸附性载体210的固定效果更好,而且还有效地保证了核酸吸附性载体210与限位卡环230之间的密封性。
进一步的,在离心微流控芯片10使用过程中,限位卡环230远离核酸吸附性载体210一端的内径大于限位卡环230靠近核酸吸附性载体210一端的内径,且限位卡环230的内壁沿轴向设置有一定的斜度,可使样本液尽可能地流入限位卡环230内,或者使流过核酸吸附性载体210的样本液尽可能地流出限位卡环230,从而可有效地减少样本液在限位卡环230内的残留。
上述离心微流控芯片10,主要应用于即时诊断设备中。在离心微流控芯片10的加工过程中,将核酸提取柱200置于容置腔112内,并利用第一密封板120实现对容置腔112的密封,从而可将核酸提取柱200封装于芯片主体100内,以实现核酸提取柱200在离心微流控芯片10上的集成。在即时诊断设备中,即时诊断设备中的离心驱动装置驱动离心微流控芯片10旋转,以产生离心力,使用时,在上述离心力的作用下,样本液经进液口1121依次流经第一腔室1123、核酸吸附性载体210及第二腔室1124,之后再经出液口1122流出,而样本液在流经核酸吸附性载体210时可使核酸被吸附在核酸吸附性载体210的表面,清洗样本杂质的清洗液和核酸洗脱液同样流经该结构,以实现样本液中核酸提取及纯化工作的自动化。因此,上述离心微流控芯片10的设置,使得即时诊断设备可实现对样本液预处理的自动化。
以上所述实施例的各技术特征可以进行任意的组合,为使描述简洁,未对上述实施例中的各个技术特征所有可能的组合都进行描述,然而,只要这些技术特征的组合不存在矛盾,都应当认为是本说明书记载的范围。
以上所述实施例仅表达了本发明的几种实施方式,其描述较为具体和详细,但并不能因此而理解为对发明专利范围的限制。应当指出的是,对于本领域的普通技术人员来说,在不脱离本发明构思的前提下,还可以做出若干变形和改进,这些都属于本发明的保护范围。因此,本发明专利的保护范围应以所附权利要求为准。
- 还没有人留言评论。精彩留言会获得点赞!