一种搭载分子印迹反蛋白石结构微球的鱼骨微流控芯片及其制备方法与流程
[0001]
本发明涉及一种微流控芯片,具体涉及一种搭载分子印迹反蛋白石结构微球的鱼骨微流控芯片及其制备方法。
背景技术:
[0002]
血液净化技术目前已经广泛地应用于肾病治疗,其原理在于,通过吸附剂或者透析液在体外对患者血液中过量的代谢废物进行清除。但是由于临床治疗过程的漫长性与高风险性,患者会承受较高的生理痛苦与不便。随着科学技术的进步发展,相对于在医院接受集中式血液透析治疗,患者更希望便携、简易的血液净化治疗方式。
[0003]
分子印迹技术利用印迹聚合物模拟抗体-抗原之间的相互作用,形成类似的锁钥结构,能够对印迹分子进行特异识别。分子印迹技术由于具有稳定性、特异识别性、可重复性等优点,已在仿生传感、医疗诊断、分析化学等领域得到广泛应用,也正成为血液净化中制备新型吸附材料的研究方向。
[0004]
微流控芯片具有液体可控、装置体积小、便携等特点,已在可穿戴肾脏透析装置的研究中得到广泛应用。但是,采用微流控血液净化芯片存在液体交叉污染、封装密闭性不好、易破坏血液电解质平衡、特异性吸附差等缺点。目前主要通过开发新型高效吸附剂、设计特殊芯片流道结构的方法解决微流控芯片吸附效率不高、特异性吸附差的问题。已经开发的新型高效的吸附剂主要包括离树脂材料、物化吸附剂等,这些吸附剂具有良好的血液相容性、生物相容性,能够对目标生物分子能够特异性识别吸附。鱼骨微流控芯片是一种具有特殊的内部空间结构和流道设计的微流控芯片,对扰动液体流动状态有很好的促进作用。
[0005]
因此,以分子印迹反蛋白石结构微球为主体,结合鱼骨微流控技术,设计一种搭载分子印迹反蛋白石结构微球的微流控芯片,用于血液中目标分子的高效、特异性清除与浓度传感将具有重要医学价值和临床意义。
技术实现要素:
[0006]
本发明的技术目的是针对现有微流控芯片血液净化效率不高、特异性吸附差、使用透析液存在导致交叉污染风险的技术不足,提供一种搭载分子印迹反蛋白石结构微球的鱼骨微流控芯片及其制备方法,该微流控芯片以搭载分子印迹反蛋白石结构微球作为吸附剂,结合鱼骨型内部结构的芯片,在不使用透析液的情况下实现目标生物分子的安全高效、特异性吸附。
[0007]
为实现上述技术目的,本发明采取的技术方案为:本发明提供了一种搭载分子印迹反蛋白石结构微球的鱼骨微流控芯片,包括上层阻流单元和下层吸附单元,上层阻流单元为鱼骨型微流控芯片,下层吸附单元包括分子印迹反蛋白石结构微球和吸附底板,吸附底板上设有多级吸附微室和流体流道,分子印迹反蛋白
石结构微球作为吸附剂用以吸附目标生物分子,分子印迹反蛋白石结构微球搭载于多级吸附微室内,流体流道包括进液流道和出液流道,分设于多级吸附微室两侧,用于流体的注入与收集,上层阻流单元和下层吸附单元上下键合封装。
[0008]
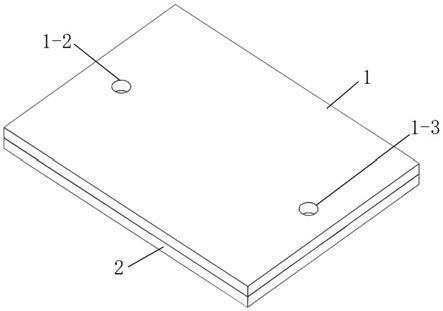
进一步地,所述上层阻流单元为聚二甲基硅氧烷材质的微流控芯片,所述微流控芯片中部设有鱼骨状阻流通道单元,用于改变流体形态,形成湍流,以减缓流体在鱼骨微流控芯片中的流速,所述上层鱼骨状微流控芯片上开设有进液口和出液口,所述进液口和出液口左右对称分布于鱼骨状阻流通道单元两侧。
[0009]
进一步地,所述鱼骨状阻流通道单元由多条平行均布的鱼骨状阻流通道构成,所述鱼骨状阻流通道宽200μm,鱼骨状阻流通道转折处夹角均为60
°
,相邻鱼骨状流道间隔200μm。
[0010]
进一步地,所述分子印迹反蛋白石结构微球包含维生素b
12
分子印迹,用以实现对目标生物分子的特异识别与吸附。
[0011]
进一步地,所述进液流道为一分四分流式进液流道,所述出液流道为四合一合流式出液流道,所述进液口与进液流道的进液口孔位正对,所述出液口与出液流道的出液口孔位正对,分别用于流体的注入与收集。
[0012]
进一步地,所述多级吸附微室由阵列分布的吸附微室级联组成,所述吸附微室由呈120
°
分布的三根相邻微柱围成,所述微柱采用聚二甲基硅氧烷材质,所述分子印迹反蛋白石结构微球搭载在吸附微室内。
[0013]
本发明还提供了上述搭载分子印迹反蛋白石结构微球的鱼骨微流控芯片的制备方法,包括如下步骤:s1、制备上层阻流单元:以聚二甲基硅氧烷为材料,采用刻有鱼骨状阻流通道单元结构的光刻掩模板制备鱼骨型微流控芯片;s2、制备下层吸附单元:以聚二甲基硅氧烷为材料,采用刻有流体流道结构和多级吸附微室结构的光刻掩模板制备吸附底板,将分子印迹反蛋白石结构微球搭载在吸附底板的吸附微室内;s3、上层阻流单元和下层吸附单元上下键合封装:将上层阻流单元和下层吸附单元上下叠放并对齐,然后通过键合方式封装于一体。
[0014]
进一步地,步骤s2中,所述分子印迹反蛋白石结构微球为包含维生素b
12
分子印迹的反蛋白石结构微球,其通过以下步骤制备:s21:采用二氧化硅纳米粒子通过液滴自组装法制备光子晶体球模板;s22:以维生素b
12
作为印迹分子溶解在水凝胶预聚溶液中,然后将溶解维生素b
12
的水凝胶预聚溶液渗透到光子晶体球模板中,通过紫外固化形成光子晶体球-水凝胶杂交体;s23:去除光子晶体球-水凝胶杂交体中的光子晶体球模板和印迹分子,得到分子印迹反蛋白石结构微球。
[0015]
进一步地,所述水凝胶预聚溶液选自聚氨脂、聚乙二醇、聚乙二醇双丙烯酸酯、甲基丙烯酸酯明胶的一种或多种。
[0016]
进一步地,所述溶解维生素b
12
的水凝胶预聚溶液的组成成分为10%v/v的甲基丙烯酸酯明胶、10%v/v的聚乙二醇双丙烯酸酯、10%w/v的维生素b12和1%v/v的光引发剂。
[0017]
进一步地,所述上层阻流单元和下层吸附单元键合方法为:上层阻流单元和下层
吸附单元上下叠放并对齐,将上层阻流单元和下层吸附单元的接触面进行等离子体处理15min后使用固定夹具固定2h。
[0018]
与现有技术相比,本发明的有益效果在于:1)本发明以搭载分子印迹反蛋白石结构微球的下层吸附单元为主体,与鱼骨型微流控芯片上下键合封装,其中分子印迹反蛋白石结构微球作为多孔吸附剂,对维生素b
12
印迹分子的吸附效果极佳,在吸附过程中维生素b
12
浓度显著降低,同时微球对血液中其他蛋白、生物分子的吸附量少,可实现对目标生物分子的高效、特异性吸附功能高,而且其生物相容性、血液相容性良好,对血液无毒害副作用,在血液净化过程中不需要使用透析液,降低了与血液交叉污染的风险,使用安全性高,同时分子印迹反蛋白石结构微球具有特定波长的反射峰,结合不同浓度的目标生物分子后,其特征反射峰的位移与不同的浓度相对应,因此可以实现对目标生物分子维生素b
12
的浓度传感,进而实现对吸附进程的监测,高效省力;2)上层阻流单元上设有鱼骨状阻流通道单元,下层吸附单元上设有多级吸附微室,分子印迹反蛋白石结构微球搭载在吸附微室内,上层阻流单元和下层吸附单元键合封装而成的搭载分子印迹反蛋白石结构微球的鱼骨微流控芯片通过鱼骨状阻流通道单元和多级吸附微室改变流体状态,形成湍流,从而增加流体中目标生物分子与分子印迹反蛋白石结构微球的接触时间和接触面积,进而提高微流控芯片对目标生物分子的吸附率。
附图说明
[0019]
图1为本发明的搭载分子印迹反蛋白石结构微球的鱼骨微流控芯片结构示意图;图2为本发明的上层阻流单元的结构示意图;图3为本发明的下层吸附单元的结构示意图;图4为本发明的分子印迹反蛋白石结构微球的制备工艺流程图;图5为本发明实施例2的分子印迹反蛋白石结构微球对维生素b
12
的浓度传感性验证结果;图6为本发明实施例3的搭载分子印迹反蛋白石结构微球的鱼骨微流控芯片对维生素b
12
吸附性验证结果。
[0020]
其中的附图标记为:上层阻流单元1、鱼骨状阻流通道单元1-1、鱼骨状阻流通道1-11、进液口1-2、出液口1-3、下层吸附单元2、多级吸附微室2-1、进液流道2-2、出液流道2-3。
具体实施方式
[0021]
为了使本领域技术领域人员更好地理解本发明的技术方案,下面结合附图对本发明的实施例作进一步详细描述。
[0022]
下述实施例中所使用的实验方法,如无特殊说明,均为常规方法,所用的试剂、方法和设备,如无特殊说明,均为本技术领域常规试剂、方法和设备。
[0023]
本发明提供了一种搭载分子印迹反蛋白石结构微球的鱼骨微流控芯片,包括上层阻流单元1和下层吸附单元2,上层阻流单元1为聚二甲基硅氧烷(pdms)材质的微流控芯片,微流控芯片中部设有鱼骨状阻流通道单元1-1,上层鱼骨状微流控芯片1上开设有进液口1-2和出液口1-3,进液口1-2和出液口1-3左右对称分布于鱼骨状阻流通道单元1-1两侧,下层吸附单元2包括分子印迹反蛋白石结构微球和吸附底板,吸附底板上设有多级吸附微室2-1
和流体流道,多级吸附微室由阵列分布的吸附微室级联组成,吸附微室由呈120
°
分布的三根相邻微柱围成,微柱采用聚二甲基硅氧烷材质,吸附微室内搭载,分子印迹反蛋白石结构微球搭载于吸附微室内,流体流道包括进液流道2-2和出液流道2-3,进液流道2-2为分流式进液流道,出液流道2-3为合流式出液流道,分流式进液流道和合流式出液流道分设于多级吸附微室2-1两侧,且进液口1-2与进液流道2-2的进液口孔位正对,出液口1-3与出液流道2-3的出液口孔位正对,分别用于流体的注入与收集,上层阻流单元1和下层吸附单元2上下键合封装。
[0024]
实施例1如图1-3所示,上述搭载分子印迹反蛋白石结构微球的鱼骨微流控芯片的一种优选方案,上层阻流单元1的鱼骨状阻流通道单元1-1由多条平行均布的鱼骨状阻流通道1-11构成,鱼骨状阻流通道1-11宽200μm,鱼骨状阻流通道1-11转折处夹角均为60
°
,相邻鱼骨状流道间隔200μm;进液流道为一分四分流式进液流道,出液流道为四合一合流式出液流道,分子印迹反蛋白石结构微球包含维生素b
12
分子印迹。
[0025]
实施例2以实施例1的搭载分子印迹反蛋白石结构微球的鱼骨微流控芯片为例,其制备方法,具体包括以下步骤:步骤s1、制备上层阻流单元1:将聚二甲基硅氧烷(pdms)与固化剂按照10:1的质量比混合均匀后,覆盖在刻有鱼骨状阻流通道单元1-1结构的光刻掩模版上,抽尽溶液中的气泡,于70℃下热固化4h,得到上层阻流单元1(鱼骨型微流控芯片);步骤s2、制备吸附底板:将聚二甲基硅氧烷(pdms)与固化剂按照10:1的质量比混合均匀后,覆盖在刻有流体流道结构和多级吸附微室2-1结构的硅片上,抽尽溶液中的气泡,于70℃下热固化4h,得到吸附底板;步骤s3、制备分子印迹反蛋白石结构微球,具体包括如下步骤:s31、利用粒径280nm的二氧化硅粒子通过液滴自组装法制备光子晶体球模板;s32、维生素b
12
作为印迹分子溶解在水凝胶预聚溶液中,水凝胶预聚溶液选自聚氨脂、聚乙二醇双丙烯酸酯、甲基丙烯酸酯明胶的一种或多种,本实施例优选混合水凝胶预聚溶液组成成分为10%(v/v)甲基丙烯酸酯明胶(gelma),10%(v/v)聚乙二醇双丙烯酸酯(pegda),10%(w/v)维生素b
12
和1%(v/v)光引发剂;s33、将水凝胶预聚溶液渗透到步骤s31制备的光子晶体球模板中,浸泡3h后紫外照射固化形成光子晶体球-水凝胶杂交体,印迹分子(维生素b
12
)在固化的光子晶体球-水凝胶杂交体中形成各自特定的空间结构;s34、利用氢氟酸(hf)去除光子晶体球-水凝胶杂交体中的光子晶体球模板,利用磷酸盐缓冲溶液(pbs)去除光子晶体球-水凝胶杂交体中的生物印迹分子(维生素b
12
),制备得到分子印迹反蛋白石结构微球;如图4所示,本步骤制备的分子印迹反蛋白石结构微球具有周期性多孔结构,且具有特定波长的反射峰和结构色;步骤s4、分子印迹反蛋白石结构微球对维生素b
12
的浓度传感验证配制浓度分别为1mg/ml,800μg/ml,600μg/ml,400μg/ml,200μg/ml,100μg/ml的维生素b
12
水溶液;将步骤s3制备的分子印迹反蛋白石结构微球分别置于上述不同浓度梯度的维生
素b
12
溶液中浸泡5min,然后用磷酸盐缓冲液(pbs)溶液冲洗,记录各组分子印迹反蛋白石结构微球浸泡于维生素b
12
溶液前后的特征反射峰波长,得到分子印迹反蛋白石结构微球在不同浓度的目标生物分子的水溶液中特征反射峰波长的位移,以实现目标分子的浓度传感;如图5所示,分子印迹反蛋白石结构微球在不同浓度维生素b
12
溶液中的反射峰位移与浓度的一一对应,证实了制备的分子印迹反蛋白石结构微球对目标生物分子传感浓度的可行性;步骤s5、上层鱼骨阻流单元和下层吸附单元2上下键合封装:将步骤s3制备的分子印迹反蛋白石结构微球放置于步骤s2制备的吸附底板的吸附微室中,使吸附微室内搭载分子印迹反蛋白石结构微球,共同组成下层吸附单元2,然后将上层阻流单元1和下层吸附单元2按次序上下叠放并对齐,其中进液口1-2与进液流道2-2的进液口孔位正对,出液口1-3与出液流道2-3的出液口孔位正对,分别用于流体的注入与收集,将上层阻流单元1和下层吸附单元2的接触面进行等离子体处理15min,再使用固定夹具固定2h,得到键合封装完毕的搭载分子印迹反蛋白石结构微球的鱼骨微流控芯片。
[0026]
实施例3搭载分子印迹反蛋白石结构微球的鱼骨微流控芯片对目标生物分子的吸附性验证以实施例1制备的搭载分子印迹反蛋白石结构微球的鱼骨微流控芯片(下述简称“鱼骨微流控芯片”)为例,检测其对维生素b
12
的吸附性和浓度传感性,具体如下:配制浓度为400μg/ml的维生素b
12
的水溶液,利用蠕动泵控制维生素b
12
溶液进入鱼骨微流控芯片的流速,装有维生素b
12
溶液的注射器通过pe软管连接鱼骨微流控芯片的进液流道进液口,在出液流道的出液口处收集所有溶液,用紫外分光光度计在维生素b
12
溶液特定波长处检测吸光值,并根据标准曲线计算对应维生素b
12
浓度。
[0027]
结果如图6所示,在吸附清除过程中,维生素b
12
的浓度随吸附时间的增加而降低,验证了搭载分子印迹反蛋白石结构微球的鱼骨微流控芯片可高效吸附目标生物分子。
[0028]
以上仅是本发明的优选实施方式,本发明的保护范围并不仅局限于上述实施例,凡属于本发明思路下的技术方案均属于本发明的保护范围。应当指出,对于本技术领域的普通技术人员来说,在不脱离本发明原理前提下的若干改进和润饰,应视为本发明的保护范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1