一种微流控芯片及其制备与应用
1.本发明涉及微流控技术领域,具体是涉及一种微流控芯片。
背景技术:
2.随着半导体加工工艺与微流控技术的发展,基于微流控技术的化学与生物芯片不断涌现。微流控技术是以微加工技术为基础,将微管道、微反应器等功能单元加工于玻璃、高分子聚合物等基质材料上,实现将生物与化学等领域所涉及的前处理、加样、反应、分离、分析、细胞培养等基本操作单元集成或基本集成到方寸大小的芯片之上,以取代常规化学或生物实验室各种功能的一种技术平台。具体的,微流控芯片通过将通道尺寸降至微米量级,从而显著提高样品的混合效率,但同时,也限制了单位时间内的样品处理量。因此,如何继续优化微通道的结构,提高样品的混合效率,具有重要的意义。
3.现有的如康宁公司设计的心形混合通道,反应物料在该通道内快速流动,可进行有效的非均相混合。但该结构复杂,制作成本高,且主要用于混合气液或液液两相的样品,含有固相的样品可能会停留甚至堵塞在上述心形混合通道的精细结构处,对样品的混合效率与通道的使用寿命均有不利影响。此外,目前的微流控加工常采用软光刻技术,比如使用su
‑
8光刻胶制作微通道阳模,由聚二甲基硅氧烷(pdms)固化成型倒模后与玻璃或有机聚合物基板键合形成芯片,但这种方法仅能制备高度均匀的微结构。
4.进一步具体至细胞生物学领域,微流控芯片也有用于分离外泌体的潜力。外泌体是细胞分泌的一类30
‑
150nm的囊泡结构,可作为肿瘤诊断潜在生物标志物。但由于其密度、尺寸与脂蛋白高度重叠,以及缺少有效分离方法,使用传统的外泌体提取和检测技术获得的血浆外泌体中往往会混入大量脂蛋白,还远远不能满足高灵敏度提取和检测液体活检所需生物样品的要求。现有的如华中科技大学刘笔锋教授团队设计的一种三维纳米结构微流体芯片,其中微柱阵列通过化学沉积用交叉多壁碳纳米管功能化,通过特定识别分子(cd63)和独特拓扑纳米材料可高效捕获外泌体,但是该方法成本高昂,且尚处于实验室研究阶段,难以在短期内进行推广应用。
技术实现要素:
5.本发明针对现有技术中的问题,设计了一种微流控芯片,具有宽窄相间的混合通道,可高效混合目标样品,满足诸如反应、分离、检测等需求,并可选用3d打印技术制备得到,所得的微流控芯片还可以应用于血浆脂蛋白和外泌体分离领域,有利于推动脂蛋白和外泌体在疾病机制研究和诊断中的应用。
6.本发明采用的技术方案为:
7.一种微流控芯片,包括通道层和基底层,所述通道层位于所述基底层上;
8.所述通道层包括顺次连通的进样区域、混合区域和检测区域;
9.所述进样区域包括进样口和进样通道,样品从所述进样口注入,并通过所述进样通道进入所述混合区域;
10.所述混合区域包括若干个混合单元,每个所述混合单元包括至少1个宽通道和至少1个窄通道,所述宽通道的宽度为100~300μm,所述窄通道的宽度为所述宽通道宽度的1/5~1/2,所述样品通过所述混合区域进入所述检测区域;
11.所述检测区域包括至少1个腔室,所述腔室的高度不小于0.5mm。
12.在其他优化的技术方案中,所述混合区域包括不少于100个所述混合单元,每个所述混合单元包括1个宽通道和1个窄通道;所述宽通道的长度为200~500μm,所述窄通道的长度不大于所述宽通道的长度。
13.在其他优化的技术方案中,所述检测区域包括顺次连通第一腔室和第二腔室;所述混合区域与所述第一腔室连通,所述第一腔室与所述第二腔室连通。
14.在其他优化的技术方案中,所述第一腔室的高度为0.5~1.5mm,体积为5~10μl;所述微流控芯片还包括磁铁,所述磁铁设置在所述第一腔室的下方。
15.在其他优化的技术方案中,所述第二腔室的高度为5~10mm,体积为140~300μl。
16.在其他优化的技术方案中,所述通道层的材质为pdms、pmma、pet、pbt中的任一种;和/或,所述基底层为玻璃板。
17.在其他优化的技术方案中,所述玻璃板表面修饰有二硬脂酰基磷脂酰乙醇胺
‑
聚乙二醇。
18.在其他优化的技术方案中,所述微流控芯片的制备方法如下:
19.分别制备得到所述通道层和基底层,再将所述通道层和所述基底层进行装配得到所述微流控芯片;其中,所述通道层的制备方法为:
20.s1:使用3d打印技术,打印所述通道层的微结构;
21.s2:使用倒模的方法,复制所述微结构,得到所述通道层。
22.在其他优化的技术方案中,所述通道层与所述基底层的装配方法为:通过表面等离子体处理将所述通道层键合在所述基底层上。
23.在其他优化的技术方案中,所述微流控芯片用于分离血浆脂蛋白和外泌体,和/或,对所述脂蛋白和所述外泌体分别进行检测,其中,所述微流控芯片通过上述任一种制备方法制备得到。
24.本发明的有益效果是:
25.本发明的微流控芯片采用宽窄相间的混合单元,能够有效提高样品的混合效率,且该芯片上同时集成了包括混合、分离检测在内的功能区域,可有效提高生产或研究的效率。
26.进一步优化,采用3d打印技术制备该微流控芯片,一则可以制备较高的腔室,二则能够制备高低不同的通道,方法简单易行,便于工业化推广应用。相较于传统技术,将本发明设计的微流控芯片用于分离血浆脂蛋白和外泌体时,效率更高。
附图说明
27.为了更清楚地说明本发明的技术方案,下面将对实施例描述中所需要使用的附图作简单的介绍,显而易见地,下面描述中的附图仅仅是本发明中记载的部分实施例,对于本领域普通技术人员来讲,在不付出创造性劳动性的前提下,还可以根据这些附图获得其他的附图。
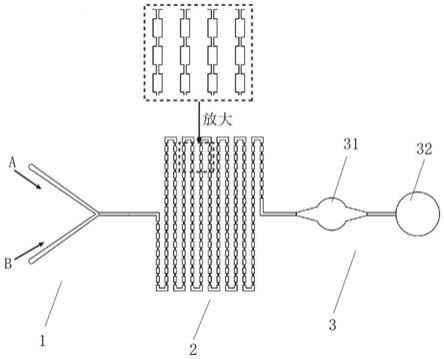
28.图1为实施例1中微流控芯片的通道层示意图;
29.图2为普通矩形微通道(a)与实施例1中宽窄相间的混合通道(b)的混合效果模拟图;
30.图3为实施例1中通过3d打印技术打印所得的通道层微结构模具;
31.图4为实施例1中通过用pdms倒模得到的pdms芯片及其放大图;
32.图5为实施例2中微流控芯片的通道层示意图;
33.图6为实施例2中对脂蛋白检测腔室和外泌体检测腔室中样本分别进行靶向脂蛋白的量子点染料(qdot605
‑
antiapoe)和细胞膜绿色荧光染料(dio dye)的染色结果;
34.图7为存储附图2及附图5~6彩色原图的二维码地址。
具体实施方式
35.下面将结合本发明实施例中的附图,对本发明实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例仅仅是本发明的一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有作出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
36.需要说明的是,在本发明的描述中,除非另有明确的限定,“装配”、“复制”、“键合”等操作,均应作广义理解,能够实现本发明目的的操作均在本发明的保护范围之内。本发明实施例中所有方向性指示(诸如上、下、左、右、前、后
……
)仅用于解释在某一特定状态(如附图所示)下各部件之间的相对位置关系、运动情况等,如果该特定状态发生改变时,则该方向性指示也相应地随之改变。在本发明的描述中,“长度”的测量方向为样品的流动方向,“宽度”的测量方向为垂直于样品的流动方向且平行于基地层的方向,“高度”的测量方向为垂直于基底层的方向。在本发明中,除非另有明确的规定和限定,术语“连接”、“连通”等均应做广义理解。
37.实施例1:
38.本实施例提供一种微流控芯片,包括通道层和基底层,其中通道层通过表面等离子体处理的方式,被键合在上述基底层上。
39.其中,通道层进一步的结构特征如附图1所示,上述通道层包括顺次连通的进样区域1、混合区域2和检测区域3。在本实施例中,该进样区域1包括两个进样口,且进样通道呈“y”形,且该“y”形通道的宽度和高度均为微米级别,具体到本实施例,该“y”形通道的宽度设计为200μm,高度设计为100μm。样本a和样本b分别从两个进样口输入,再通过上述进样通道进入所述混合区域2。
40.在其他实施例中,进样通道也可以设计为诸如“t”形、“s”形等,通道的高度和宽度也可以进行调节,在具体的应用场景中,只要能够满足相应进样需求的通道形状及尺寸,均在本发明保护的范围内。
41.继续参考附图1,上述混合区域2包括若干个混合单元,混合单元的具体数量可根据具体应用中的混合体系确定,本实施例的微流控芯片,包括不少于100个混合单位,每个混合单元包括1个宽通道和1个窄通道。该宽通道的宽度可以在100~300μm之间调节,如设计为200μm,该窄通道的宽度可以设计为宽通道宽度的1/5~1/2,如设计为50μm,且,该宽通道的长度设计为400μm,高度设计为100μm,该窄通道的长度设计为200μm,高度设计为100μ
m。相较于单纯矩形结构的微通道,该宽窄相间的混合单元能够有效提高混合效率,具体可参考附图2的模拟结果。
42.其中,附图2
‑
a为普通的矩形微通道,宽度为200μm,附图2
‑
b为本实施例中具有宽窄相间结构的混合通道,且附图2中将两者混合区域指图中的竖通道,进样区域指图中的横通道,其中,竖通道的长度均设置为5.2mm,横通道的长度设置为4.2mm(长度从两样本相遇时起算),进样的样本a和样本b的进样速度均为5mm/s,样本温度为20℃,黏度为1mpa
·
s,扩散系数为1e
‑9m2/s,模拟软件为comsol multiphysics 5.6,结果如附图2所示:在进样区域中,流体的流动状态为层流流动,样本a和样本b仍处于分层状态,并未得到有效混合。当进入混合区域后,附图2
‑
a中的流体的流动状态仍为层流,且在混合通道的后半段才逐渐开始混合,但此时,仍能看出,两者存在较为明显的浓度梯度,混合效果较差;附图2
‑
b中的流体进入宽窄混合单元后,形成了“类湍流”,且在经过约4个宽窄混合单元之后,即实现了较好的混合,此时,通道中的流体已混合均匀,几乎不存在浓度梯度,可见本实施例中宽窄相间混合结构的混合效率之高。
43.继续参考附图1,样品通过上述混合区域2后进入检测区域3。在本实施例中,该检测区域3包括第一腔室31和第二腔室32,且上述混合区域2与该第一腔室31连通,第一腔室31与第二腔室32连通。
44.该第一腔室的高度可在0.5~1.5mm之间调节,主要是为了便于容纳自混合区域过渡而来的样本,在本实施例中,将第一腔室的高度设计为1mm,体积设计为5~10μl;该第二腔室的高度可在5~10mm之间调节,在本实施例中,将第二腔室的体积设计得较大,可达140~300μl,能够充分容纳相应的样本。但上述对腔室尺寸、容量的设计,具体仍要根据应用需要确定,不限制本发明要保护的技术方案的范围。
45.进一步的,该微流控芯片可通过以下方法制备:
46.首先分别制备得到通道层和基底层,再将通道层和基底层进行装配得到目标的微流控芯片;其中,上述通道层的制备方法为:
47.s1:使用3d打印技术,把微结构打印到一块树脂上,通过控制微结构的高度以及宽度来确定腔室的大小,即可得到该通道层的微结构;如附图3所示,为本实施例中通过3d打印技术打印所得的通道层微结构模具;
48.s2:使用倒模的方法,复制所述微结构。具体的,可以通过聚二甲基硅氧烷(pdms)倒模的形式把微结构复制到pdms上,得到该通道层。如附图4所示,为本实施例中通过用pdms倒模得到的pdms芯片及其放大图;
49.最后将该pdms芯片通过表面等离子体处理键合在玻璃板上面从而完成目标微流控芯片的制作。该制作方法的显著优势为:可以制备比较高的腔室(如高度在1~10mm的腔室),且高低不同的通道或腔室使用3d打印更为高效、便捷,很适宜作为制作本发明要保护的微通道结构模具的方法。
50.实施例2:
51.本实施提供一种微流控芯片,其包括通道层和基底层,其中通道层通过表面等离子体处理的方式,被键合在上述基底层上,具体的制备方法同实施例1。
52.进一步的,本实施例中的通道层的结构与实施例1中的通道层结构相同。进一步的,该实施例中的通道层可使用pdms制作,但除此之外,也可以使用pmma或乙烯基聚合物等
来代替。
53.基底层可以选用玻璃板或者聚乙烯平皿制作,本实施例选用玻璃板作为制作基底层的材料,且在所述玻璃板表面修饰有二硬脂酰基磷脂酰乙醇胺
‑
聚乙二醇(dspe
‑
peg)。
54.进一步的,本实施例的微流控芯片还包括磁铁,如附图5所示,该磁铁设置在第一腔室的下方。
55.接下来,使用本实施例中的微流控芯片分离血浆脂蛋白和外泌体并对脂蛋白和外泌体分别进行检测。
56.如附图5所示,经过预处理的血浆样本和cb(汽巴兰)磁珠样本以同样的流速(1~10μl/min)分别从两个进样口进样,经过进样区域1进入混合区域2,并在混合区域2实现充分混合,以便cb磁珠能够更好地抓取脂蛋白,随后,血浆样本以及被磁珠抓取的脂蛋白随磁珠一起进入第一腔室31,在第一腔室中,磁珠被放置在微流控芯片下方的磁贴所固定,而血浆继续流动,进入到后方的第二腔室32,样本在第二腔室32中积累,其中血浆样本中的外泌体被基底层表面修饰的二硬脂酰基磷脂酰乙醇胺
‑
聚乙二醇(dspe
‑
peg)抓取,使用该微流控芯片对血浆中的脂蛋白和外泌体进行分离检测,一次性可以处理约100μl的血浆量。
57.进一步的,在本实施例中,血浆在进入该微流控芯片前先经超滤(100k)操作去除了大部分的血浆高丰度蛋白,cb磁珠的制备原料包括氨基磁珠(1μm直径,取10mg分散在pbs中),汽巴兰(cibacron blue 3ga,取0.02g分散在去离子水中),氯化钠(取0.20g分散在去离子水中),将上述三种原料混合,于40℃下反应2h即可。
58.最后,取第一腔室31中的样本,记作样本1,取第二腔室32中的样本,记作样本2,使用细胞膜绿色荧光染料(dio dye)以及靶向脂蛋白的量子点染料(qdot605
‑
antiapoe)对上述样本1和样本2中的脂蛋白和外泌体进行染色,并作定量分析,结果如附图6所示。
59.其中,附图6
‑
a为对样本1进行qdot605
‑
antiapoe染色后的表征图像,附图6
‑
b为对样本2进行qdot605
‑
antiapoe染色后的表征图像,附图6
‑
c为样本1与样本2经qdot605
‑
antiapoe染色后的qdot信号强度柱状对比图;附图6
‑
d为对样本1进行dio dye染色后的表征图像,附图6
‑
e为对样本2进行dio dye染色后的表征图像,附图6
‑
f为样本1与样本2经dio dye染色后的dio信号强度柱状对比图。
60.由附图6可以看出,样本1上的qdot605荧光信号很强而样本2上的qdot605荧光信号很弱,证明cb磁珠上抓取了大量脂蛋白,而dspe上几乎没有脂蛋白的信号。dio dye染色结果证实,第一腔室内的磁珠上和第二腔室内的dspe上都发现有膜结构的囊泡,且脂蛋白主要存在于磁珠上,外泌体主要被dspe抓获,实现了高效、便捷分离血浆脂蛋白和外泌体的目的,并能够对外泌体和脂蛋白进行分别检测,可推动二者在疾病机制以及诊断中的应用研究。
61.为了更清楚的说明本发明实施例所展示的技术方案及实现的技术效果,附上附图2及附图5~6的彩色原图的二维码查看地址,如附图7所示。
62.以上所述仅为本发明的优选实施例,并非因此限制本发明的专利范围,凡是在本发明的技术构思下,利用本发明说明书及附图内容所作的各种等效结构变换,或直接/间接运用在其他相关的技术领域,只要不脱离本发明的精神,均应属于本发明权利要求书中所定义的范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1