一种病毒排阻复合型层析介质及其制备方法与流程
1.本发明涉及蛋白质层析分离介质领域,具体涉及一种病毒排阻复合型层析介质及其制备方法。
背景技术:
2.目前在疫苗和细胞治疗等领域,病毒的分离纯化在大规模生产中,主要是通过凝胶过滤层析介质进行病毒排阻模式层析纯化,还有一部分是用离子交换层析介质进行吸附杂质模式层析纯化。其中凝胶过滤层析介质主要是通过微球之间的空隙和微球内部的孔径进行分离,病毒只能通过微球之间的间隙从外水体积先出来,杂质进入微球内部的孔径从内水体积后出来,根据出来的体积先后顺序不同,从而达到病毒与杂质分离的目的。凝胶过滤层析介质的优点是不影响病毒的活性,可以最大限度的保证病毒的稳定性,蛋白去除率和病毒回收率,缺点就是工业化生产效率低下,病毒培养结束后需要经过20-50倍的浓缩处理后上样,且上样量只有凝胶过滤介质装柱体积的10%不到。离子交换层析介质主要是通过键合离子功能基团对病毒样品中的杂质进行吸附,病毒在流穿液中,离子交换层析介质的优点是上样量可以达到离子交换介质装柱体积的十几倍甚至是几十倍体积,缺点是蛋白去除率和病毒回收率低,微球内部孔径较大时病毒进入微球内部孔径出不来,同时微球表面带有功能基团对病毒有少量结合,从而导致病毒损失,回收率不高,还有单独的离子功能基团只能吸附病毒样品中的部分带电荷的杂质,杂质的吸附范围较窄,蛋白去除率较低。
3.因此,如何解决目前病毒纯化工艺中蛋白去除率较低和病毒回收率低的问题,为疫苗生产和细胞治疗企业提供一种高效大规模的病毒分离层析介质具有重要意义。
技术实现要素:
4.针对现有技术所存在的技术问题,本发明提供了一种病毒排阻复合型层析介质及其制备方法。
5.本发明采用如下技术方案来实现上述技术目的:
6.本发明提供一种病毒排阻复合型层析介质,其包括微球和微球表面上的功能配基,所述功能配基为经烯丙基缩水甘油醚活化后偶联的氨基和辛基,所述层析介质的结构组成如下所示:
[0007][0008]
所述微球的排阻极限为10kd~1000kd。
[0009]
上述病毒排阻复合型层析介质的分离原理是:病毒样品通过特定排阻极限的微球时,病毒无法进入微球内部,只能从微球空隙之间的流穿液流出,收集病毒流穿液,同时病毒样品中各种杂质进入微球内部,通过微球内部的氨基和辛基等离子和疏水作用将杂质吸附于微球内部孔径中,可以持续上样到层析介质装柱体积的十几倍甚至几十倍,最后再用
1m naoh和30%异丙醇把吸附的杂质洗脱下来。该病毒排阻复合型层析介质,由于不吸附病毒,病毒的回收率高,同时多种作用吸附杂质,蛋白去除率也比较高,一步纯化就能得到非常高纯度和收率的病毒样品。具体结合原理有三个:一是分子筛作用,根据病毒和杂质的大小,病毒进入微球外部之间的间隙流出,杂质进入微球内部的孔径;二是氨基基团的离子作用,由于氨基基团带有正电荷,通过与病毒样品中杂质表面上的负电荷结合,可以将带负电荷的杂质吸附于微球内部孔径的配基上;三是辛基的疏水作用,通过与病毒样品中杂质的疏水性质结合,将病毒中更大范围的杂质吸附于微球内部孔径的配基上。本发明所提供的病毒排阻复合型层析介质其蛋白去除率能够达到46%以上,病毒回收率可达到87%以上。
[0010]
作为本发明的一种实施方式,所述微球选自琼脂糖微球、葡聚糖微球、纤维素微球、聚苯乙烯微球、聚甲基丙烯酸酯微球中的一种或多种。如购自武汉汇研生物的focurose微球,其微球排阻极限为10-1000kd。
[0011]
本发明还提供了上述病毒排阻复合型层析介质的制备方法,包括以下步骤:
[0012]
s1,将微球在碱性条件下用烯丙基甘油醚进行活化,得甘油醚活化微球;
[0013]
s2,将甘油醚活化微球用溴水进行溴化处理,得到溴化微球;
[0014]
s3,将溴化微球与正辛胺加成反应,即得。
[0015]
本发明通过对特定排阻极限微球的羟基,在碱性条件下,与烯丙基缩水甘油醚的环氧基开环反应得到含有烯丙基的微球,再通过单质溴进行加成反应得到末端为卤代烃的微球,最后与正辛胺加成反应得到含有离子基团氨基和疏水基团辛基的病毒排阻复合型层析介质,其制备原理如下:
[0016]
s1,甘油醚活化微球的化学反应过程:
[0017][0018]
s2,甘油醚微球溴化的化学反应过程:
[0019][0020]
s3,溴化微球与正辛胺的化学反应过程:
[0021][0022]
在本发明的一种实施方式中,步骤s1中微球与烯丙基甘油醚的质量比为:1:0.01—1:0.5,优选为1:0.05—1:0.2。
[0023]
在本发明的一种实施方式中,步骤s1活化的条件为:温度为20~60℃。
[0024]
在本发明的一种实施方式中,步骤s2中甘油醚活化微球与溴水的质量比为:1:0.01—1:0.2,优选为1:0.01—1:0.05。
[0025]
在本发明的一种实施方式中,步骤s2溴化处理的条件为:温度为 20~60℃。
[0026]
在本发明的一种实施方式中,步骤s3中溴化微球与正辛胺的质量比为: 1:0.001—1:0.2,优选为1:0.001—1:0.05。
[0027]
在本发明的一种实施方式中,步骤s3中加成反应的条件为:ph 9~11,温度为20~
60℃。
[0028]
本发明所提供的病毒排阻复合型层析介质具有以下优点:
[0029]
(1)适用性强,可适用于全病毒和病毒样颗粒等的分离纯化,由于病毒无法进入微球内部,对病毒没有吸附和影响,病毒的滴度和活性几乎没有影响,同样对病毒样品中的蛋白和其他杂质具有广谱的吸附效果;
[0030]
(2)产品的分离纯化效率更高,纯化效果更好,集凝胶过滤、离子交换和疏水层析于一身,病毒是通过微球特定的排阻极限,从微球之间的空隙流穿,杂质是通过离子和疏水配基复合作用吸附于层析介质上,同样上样量体积可以达到数十倍,纯化效率相较于传统凝胶过滤层析介质纯化效率提高数百倍,加上配基对于杂质的多种作用,提高了病毒流穿液中蛋白去除率和病毒回收率;
[0031]
(3)产品的工业应用成本更低,由于纯化效率的提高,工业分离纯化生产时间可缩短至8小时以内,生产上的设备和层析介质投入降低数倍,可以节省数百万到数千万的成本投入。
附图说明
[0032]
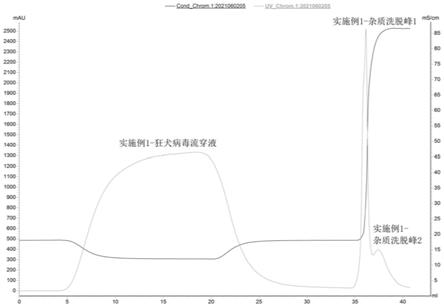
图1为本发明实施例1中制备得到的病毒排阻复合型层析介质排阻纯化狂犬疫苗的图谱;
[0033]
图2为本发明实施例2中制备得到的病毒排阻复合型层析介质排阻纯化狂犬疫苗的图谱;
[0034]
图3为本发明实施例3中制备得到的病毒排阻复合型层析介质排阻纯化狂犬疫苗的图谱;
[0035]
图4为本发明对比例1中制备得到的病毒排阻复合型层析介质排阻纯化狂犬疫苗的图谱。
具体实施方式
[0036]
下面结合具体实施例对本发明作进一步的详细说明,以使本领域的技术人员更加清楚地理解本发明。
[0037]
以下各实施例,仅用于说明本发明,并不用来限制本发明的范围。基于本发明中的具体实施例,本领域普通技术人员在没有做出创造性劳动的情况下,所获得的其他所有实施例,都属于本发明的保护范围。
[0038]
在本发明实施例中,若无特殊说明,所有原料组分均为本领域技术人员熟知的市售产品;在本发明实施例中,若未具体指明,所用的技术手段均为本领域技术人员所熟知的常规手段。
[0039]
本发明提供一种病毒排阻复合型层析介质的制备方法,包括以下步骤:
[0040]
(1)将微球加入到三口烧瓶中,之后加入微球质量约1/5的纯化水进行搅拌,之后再加入烯丙基甘油醚,保证微球与烯丙基甘油醚的质量比为 1:0.01—1:0.5,同时加入氢氧化钠,保证溶液为碱性条件,控制温度在20~60℃之间,搅拌转速在200~500rpm/min之间,反应16~24h,得到甘油醚活化微球;
[0041]
(2)将得到的甘油醚活化微球用10倍体积的纯化水真空抽滤清洗后加入到新的三
口烧瓶中,并加入甘油醚活化微球质量约1/5的纯化水进行搅拌,之后加入溴水保证甘油醚活化微球与溴水的质量比为1:0.01—1:0.2,控制温度在20~60℃,搅拌转速在200~500rpm/min之间,反应10~60min;
[0042]
(3)之后加入甲酸钠,保证甲酸钠与甘油醚活化微球的质量比为 1:0.01—0.2,控制温度在20~60℃,搅拌转速在200~500rpm/min之间,反应10~60min,得到溴化微球;
[0043]
(4)将溴化微球用10倍体积的纯化水真空抽滤清洗后,加入到另一个新的三口烧瓶中,加入溴化微球质量约1/5的纯化水进行搅拌,之后加入正辛胺保证溴化微球与正辛胺的质量比为1:0.001—1:0.2,同时调节ph至9-11,控制温度在20~60℃,搅拌转速在200~500rpm/min之间,反应16~24h,再用10倍体积的纯化水真空抽滤清洗,即得病毒排阻复合型层析介质。
[0044]
实施例1
[0045]
本实施例提供一种病毒排阻复合型层析介质的制备方法,包括以下步骤:
[0046]
(1)称取500g focurose微球加入1000ml三口烧瓶中,之后加入纯水 100g搅拌;
[0047]
(2)称取烯丙基甘油醚25g加入上述三口烧瓶中,同时加入100g氢氧化钠,测得ph>7,控制温度在30℃,搅拌转速为300rpm/min,搅拌24h;
[0048]
(3)用10倍体积的纯化水真空抽滤清洗微球,得到甘油醚活化微球;
[0049]
(4)称取500g甘油醚活化微球加入100ml三口烧瓶中,之后加入纯水100g搅拌;
[0050]
(5)称取20g溴水加入步骤(4)中的三口烧瓶中,水浴锅中控制温度在30℃,搅拌转速为300rpm/min,搅拌30min;
[0051]
(6)称取5g甲酸钠加入到步骤(5)中的三口烧瓶中,水浴锅中控制温度在30℃,搅拌转速为300rpm/min,搅拌30min;
[0052]
(7)用10倍体积的纯化水真空抽滤清洗微球,得到溴化微球;
[0053]
(8)称取500g溴化微球加入1000ml三口烧瓶中,之后加入纯水100g 搅拌;
[0054]
(9)称取2g正辛胺加入步骤(8)中的三口烧瓶中,调节ph至10.0,水浴锅中控制温度在30℃,搅拌转速为300rpm/min,搅拌24h;
[0055]
(10)用10倍体积的纯化水真空抽滤清洗,取样检测氯离子载量和bsa蛋白载量,结果见表1;
[0056]
(11)装柱,纯化狂犬病毒样品,验证蛋白去除率和病毒回收率。
[0057]
本实施例还提供了利用上述病毒排阻复合型层析介质分离纯化狂犬病毒样品的方法,具体步骤如下:
[0058]
a、预装1ml预装柱;
[0059]
b、缓冲液:
[0060]
平衡液:20mm pb,0.15m nacl,ph7.35;
[0061]
洗脱液:30%异丙醇,1m naoh;
[0062]
溶液配制完成经0.45um水相滤膜过滤。
[0063]
c、样品预处理
[0064]
测原始样品ph为7.31(25℃),电导为12.45ms/cm,样品上样前经过 0.45μm滤膜过滤。
[0065]
d、纯化过程:纯化过程中上样流速为0.33ml/min。
[0066][0067]
e、检测蛋白去除率和病毒回收率,病毒蛋白去除率结果见表3,病毒回收率结果见表4所示,狂犬病毒样品纯化图谱见图1所示。
[0068]
实施例2
[0069]
本实施例提供一种病毒排阻复合型层析介质的制备方法,包括以下步骤:
[0070]
(1)称取500g focurose微球加入1000ml三口烧瓶中,之后加入纯水 100g搅拌;
[0071]
(2)称取烯丙基甘油醚100g加入上述三口烧瓶中,同时加入100g氢氧化钠,测得ph>7,控制温度在30℃,搅拌转速为300rpm,搅拌24h;
[0072]
(3)用10倍体积的纯化水真空抽滤清洗微球,得到甘油醚活化微球;
[0073]
(4)称取500g甘油醚活化微球加入100ml三口烧瓶中,之后加入纯水100g搅拌;
[0074]
(5)称取20g溴水加入步骤(4)中的三口烧瓶中,水浴锅中控制温度在30℃,搅拌转速为300rpm/min,搅拌30min;
[0075]
(6)称取5g甲酸钠加入到步骤(5)中的三口烧瓶中,水浴锅中控制温度在30℃,搅拌转速为300rpm/min,搅拌30min;
[0076]
(7)用10倍体积的纯化水真空抽滤清洗微球,得到溴化微球;
[0077]
(8)称取500g溴化微球加入1000ml三口烧瓶中,之后加入纯水100g 搅拌;
[0078]
(9)称取10g正辛胺加入步骤(8)中的三口烧瓶中,调节ph至9-11,水浴锅中控制温度在30℃,搅拌转速为300rpm/min,搅拌24h;
[0079]
(10)用10倍体积的纯化水真空抽滤清洗微球,取样检测氯离子载量和bsa蛋白载量,结果见表1;
[0080]
(11)装柱,纯化狂犬病毒样品,验证蛋白去除率和病毒回收率。
[0081]
本实施例还提供了利用上述病毒排阻复合型层析介质分离纯化狂犬病毒样品的方法,具体步骤如下:
[0082]
a、预装1ml预装柱;
[0083]
b、缓冲液:
[0084]
平衡液:20mm pb,0.15m nacl,ph7.35;
[0085]
洗脱液:30%异丙醇,1m naoh;
[0086]
溶液配制完成经0.45um水相滤膜过滤。
[0087]
c、样品预处理
[0088]
测原始样品ph为7.31(25℃),电导为12.45ms/cm,样品上样前经过 0.45μm滤膜过
滤。
[0089]
d、纯化过程:纯化过程中上样流速为0.33ml/min。
[0090][0091]
e、检测蛋白去除率和病毒回收率,病毒蛋白去除率结果见表3,病毒回收率结果见表4所示,狂犬病毒样品纯化图谱见图2所示。
[0092]
实施例3
[0093]
本实施例提供一种病毒排阻复合型层析介质的制备方法,包括以下步骤:
[0094]
(1)称取500g focurose微球加入1000ml三口烧瓶中,之后加入纯水 100g搅拌;
[0095]
(2)称取烯丙基甘油醚25g加入上述三口烧瓶中,同时加入100g氢氧化钠,测得ph>7,控制温度在30℃,搅拌转速为300rpm,搅拌24h;
[0096]
(3)用10倍体积的纯化水真空抽滤清洗微球,得到甘油醚活化微球;
[0097]
(4)称取500g甘油醚活化微球加入100ml三口烧瓶中,之后加入纯水100g搅拌;
[0098]
(5)称取20g溴水加入步骤(4)中的三口烧瓶中,水浴锅中控制温度在30℃,搅拌转速为300rpm/min,搅拌30min;
[0099]
(6)称取5g甲酸钠加入到步骤(5)中的三口烧瓶中,水浴锅中控制温度在30℃,搅拌转速为300rpm/min,搅拌30min;
[0100]
(7)用10倍体积的纯化水真空抽滤清洗微球,得到溴化微球;
[0101]
(8)称取500g溴化微球加入1000ml三口烧瓶中,之后加入纯水100g 搅拌;
[0102]
(9)称取10g正辛胺加入步骤(8)中的三口烧瓶中,调节ph至9-11,水浴锅中控制温度在30℃,搅拌转速为300rpm/min,搅拌24h;
[0103]
(10)用10倍体积的纯化水真空抽滤清洗微球,取样检测氯离子载量和bsa蛋白载量,结果见表1;
[0104]
(11)装柱,纯化狂犬病毒样品,验证蛋白去除率和病毒回收率。
[0105]
本实施例还提供了利用上述病毒排阻复合型层析介质分离纯化狂犬病毒样品的方法,具体步骤如下:
[0106]
a、预装1ml预装柱;
[0107]
b、缓冲液:
[0108]
平衡液:20mm pb,0.15m nacl,ph7.35;
[0109]
洗脱液:30%异丙醇,1m naoh;
[0110]
溶液配制完成经0.45um水相滤膜过滤。
[0111]
c、样品预处理
[0112]
测原始样品ph为7.31(25℃),电导为12.45ms/cm,样品上样前经过 0.45μm滤膜过滤。
[0113]
d、纯化过程:纯化过程中上样流速为0.33ml/min。
[0114][0115]
e、检测蛋白去除率和病毒回收率,病毒蛋白去除率结果见表3,病毒回收率结果见表4所示,狂犬病毒样品纯化图谱见图3所示。
[0116]
对比例1
[0117]
本对比例提供一种病毒排阻复合型层析介质的制备方法,包括以下步骤:
[0118]
(1)称取500g focurose微球加入1000ml三口烧瓶中,之后加入纯水 100g搅拌;
[0119]
(2)称取烯丙基甘油醚25g加入上述三口烧瓶中,同时加入100g氢氧化钠,测得ph>7,控制温度在30℃,搅拌转速为300rpm,搅拌24h;
[0120]
(3)用10倍体积的纯化水真空抽滤清洗微球,得到甘油醚活化微球;
[0121]
(4)称取500g甘油醚活化微球加入100ml三口烧瓶中,之后加入纯水100g搅拌;
[0122]
(5)称取20g溴水加入步骤(4)中的三口烧瓶中,水浴锅中控制温度在30℃,搅拌转速为300rpm/min,搅拌30min;
[0123]
(6)称取5g甲酸钠加入到步骤(5)中的三口烧瓶中,水浴锅中控制温度在30℃,搅拌转速为300rpm/min,搅拌30min;
[0124]
(7)用10倍体积的纯化水真空抽滤清洗微球,得到溴化微球;
[0125]
(8)称取500g溴化微球加入1000ml三口烧瓶中,之后加入纯水100g 搅拌;
[0126]
(9)称取10g n-苄基-n-甲基乙醇胺加入步骤(8)中的三口烧瓶中,调节ph至9-11,水浴锅中控制温度在3℃,搅拌转速为300rpm/min,搅拌 24h;
[0127]
(10)用10倍体积的纯化水真空抽滤清洗微球,取样检测氯离子载量和bsa蛋白载量,结果见表1;
[0128]
(11)装柱,纯化狂犬病毒样品,验证蛋白去除率和病毒回收率。
[0129]
本对比例还提供了利用上述病毒排阻复合型层析介质分离纯化狂犬病毒样品的方法,具体步骤如下:
[0130]
a、预装1ml预装柱;
[0131]
b、缓冲液:
[0132]
平衡液:20mm pb,0.15m nacl,ph7.35;
[0133]
洗脱液:30%异丙醇,1m naoh;
[0134]
溶液配制完成经0.45um水相滤膜过滤。
[0135]
c、样品预处理
[0136]
测原始样品ph为7.31(25℃),电导为12.45ms/cm,样品上样前经过 0.45μm滤膜过滤。
[0137]
d、纯化过程:纯化过程中上样流速为0.33ml/min。
[0138][0139]
e、检测蛋白去除率和病毒回收率,病毒蛋白去除率结果见表3,病毒回收率结果见表4所示,狂犬病毒样品纯化图谱见图4所示。
[0140]
结果分析:
[0141]
(1)实施例1-3和对比例1中制备得到的病毒排阻复合型层析介质的氯离子载量和bsa蛋白载量的检测结果如下表1所示:
[0142]
表1实施例和对比例中制备得到的层析介质的氯离子载量和bsa蛋白载量
[0143][0144][0145]
(2)bsa蛋白的标准曲线结果如下表2所示,实施例1~3和对比例1 中制备得到的病毒排阻复合型层析介质分离纯化狂犬疫苗病毒的蛋白去除率结果如下表3所示:
[0146]
表2 bsa蛋白标准曲线检测结果
[0147][0148]
得到bsa蛋白的标准曲线为:y=0.0004x+0.5348,r2=0.9934。
[0149]
表3实施例和对比例中制备得到的层析介质分离纯化狂犬疫苗病毒的蛋白去除率
[0150][0151][0152]
备注:蛋白去除率=1-[m(流穿液)/m(原液)]*100%
[0153]
(3)实施例1~3和对比例1中制备得到的病毒排阻复合型层析介质分离纯化狂犬疫苗病毒的病毒回收率结果如下表4所示:
[0154]
表4实施例和对比例中制备得到的层析介质分离纯化狂犬疫苗病毒的病毒回收率
[0155][0156]
备注:因无标准品,病毒回收率=od
450
(流穿)/od
450(
原液)*100%
[0157]
由上述结果可知,本发明通过对特定排阻极限微球的羟基,与烯丙基缩水甘油醚的环氧基开环反应得到含有烯丙基的微球,再通过单质溴进行加成反应得到末端为卤代烃的微球,最后与正辛胺加成反应得到含有离子基团氨基和疏水基团辛基的病毒排阻复合型层析介质,该层析介质分别通过分子筛作用、氨基基团的离子作用以及辛基的疏水作用,其蛋白去除率能够达到46%以上,病毒回收率可达到87%以上。
[0158]
在此有必要指出的是,以上实施例仅限于对本发明的技术方案做进一步的阐述和说明,并不是对本发明的技术方案的进一步的限制,本发明的方法仅为较佳的实施方案,并非用于限定本发明的保护范围。凡在本发明的精神和原则之内,所作的任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1