包括可切割或可切除部分的核酸分子的制作方法
包括可切割或可切除部分的核酸分子
1.相关申请的交叉引用
2.本技术要求于2020年2月10日提交的国际专利申请第pct/us2020/017491号和于2020年11月5日提交的国际专利申请第pct/ib2020/060420号以及于2020年2月2日提交的美国临时专利申请第62/969,100号的优先权权益,所述专利申请的内容全部以全文引用的方式并入本文。
技术领域
3.本发明属于核酸处理领域。
背景技术:
4.随着对患者特异性治疗形式的关注日益增长以及在基因组水平下的研究不断前进,正在高度寻求针对大应用和小应用两者的对整个基因组进行快速、准确且廉价测序的能力。然而,仍然存在必须攻克的技术难题。通常对具有单链dna克隆群体的珠进行测序;然而,由于人基因组中存在大量重复序列,这些单链分子经常交叉杂交,从而导致珠结块、材料掉落以及全基因组覆盖缺失。此外,单链分子自身内在折叠,从而产生可能阻碍测序进展并在碱基识别中产生上下文偏差两者的二级结构。因此,非常期望从双链克隆群体进行测序并且实际上用双链分子执行所有制备和处理步骤的能力。
技术实现要素:
5.本发明提供了包括与固体支持物连接并且包含可切割碱基的双链核酸分子的组合物。提供了分离和/或富集包括双链核酸分子的复合物的方法,所述方法包括切除所述分子内的可切割碱基,作为克隆扩增之前的预富集步骤或克隆扩增之后的后富集步骤。还提供了测序双链核酸分子的方法,所述方法包括切除所述分子内的可切割碱基与本文所描述的富集组合和不组合。
6.根据第一方面,提供了一种分析核酸分子的方法,所述方法包括:
7.a)提供所述核酸分子,其中所述核酸分子包括:(i)第一链,所述第一链包括至少两个可切割或可切除部分;以及(ii)第二链,并且其中所述核酸分子与支持物偶联;
8.b)使与所述支持物偶联的所述核酸分子经受足以切割或切除所述至少两个可切割或可切除部分中的一个或多个的条件,由此产生与所述支持物偶联的经切割的核酸分子,其中所述经切割的核酸分子包括缺口或空位区;
9.c)使所述经切割的核酸分子接触聚合酶和标记的核苷酸,其中所述标记的核苷酸被配置成发出信号;
10.d)使所述经切割的核酸分子经受足以将所述标记的核苷酸并入到所述经切割的核酸分子的所述缺口或空位区中或并入到与所述第二链互补的新合成的链中的条件;以及
11.e)从所述经切割的核酸分子中检测信号或信号变化,其中所述信号或所述信号变化指示所述标记的核苷酸并入到所述经切割的核酸分子的所述缺口或空位区中或并入到
与所述第二链互补的所述新合成的链中;
12.由此分析所述核酸分子。
13.根据一些实施方式,(b)包括使所述核酸分子接触切割剂,所述切割剂被配置成切割或切除所述至少两个可切割或可切除部分中的所述一个或多个。
14.根据一些实施方式,所述切割剂选自由以下组成的组:尿嘧啶dna糖苷酶(udg)、无嘧啶/无嘌呤核酸内切酶(ape)、核酸内切酶(例如,核酸内切酶viii(endoviii)或v(endov))、尿嘧啶特异性切除试剂(user)酶、甲酰胺嘧啶dna糖苷酶(fpg)、8-氧代鸟嘌呤糖苷酶(ogg1)、rna酶(例如,rna酶h,如rna酶hii)、紫外线以及其组合。
15.根据一些实施方式,所述至少两个可切割或可切除部分独立地选自由以下组成的组:核糖核酸(rna)碱基、尿嘧啶碱基、肌苷碱基、2,6-二氨基-4-羟基-5-甲酰胺嘧啶(fapyg)碱基、8-氧代-7,8-二氢鸟嘌呤(8oxog)碱基和光可切割碱基。
16.根据一些实施方式,所述至少两个可切割或可切除部分中的两个或更多个属于不同类型。
17.根据一些实施方式,所述缺口或空位区包括在所述核酸分子的所述第一链中的占两个或更多个碱基的空位区。
18.根据一些实施方式,所述缺口或空位区包括靶核酸序列或其互补序列。
19.根据一些实施方式,所述缺口或空位区与靶核酸序列或其互补核酸序列相邻。
20.根据一些实施方式,所述标记的核苷酸未被封端(terminated)。
21.根据一些实施方式,所述标记的核苷酸包括荧光染料。
22.根据一些实施方式,所述缺口或空位区包括能够通过所述聚合酶引发聚合反应的游离3'末端。
23.根据一些实施方式,(c)包括使所述经切割的核酸分子接触包括包含所述标记的核苷酸的多个核苷酸的溶液,其中所述多个核苷酸中的每个核苷酸属于同一类型。
24.根据一些实施方式,所述多个核苷酸中的每个核苷酸是标记的核苷酸。
25.根据一些实施方式,所述多个核苷酸中的额外的核苷酸并入到所述缺口或空位区中或并入到与所述第二链互补的所述新合成的链中。
26.根据一些实施方式,所述核酸分子包括脱氧核糖核酸(dna)。
27.根据一些实施方式,所述核酸分子包括核糖核酸(rna)。
28.根据一些实施方式,所述支持物是颗粒。
29.根据一些实施方式,所述颗粒固定到表面。
30.根据一些实施方式,在(b)之前,所述核酸分子进一步包括捕获实体或与所述捕获实体偶联。
31.根据一些实施方式,所述捕获实体包括选自由以下组成的组的一个或多个成员:生物素、亲和素、核酸序列、带电颗粒和磁性颗粒。
32.根据一些实施方式,所述捕获实体被配置成与捕获性实体偶联。
33.根据一些实施方式,所述捕获性实体包括选自由以下组成的组的一个或多个成员:生物素、亲和素、核酸序列、电场系统和磁场系统。
34.根据一些实施方式,所述捕获实体与所述捕获性实体偶联。
35.根据一些实施方式,所述捕获性实体与额外的支持物偶联。
36.根据一些实施方式,所述额外的支持物是颗粒。
37.根据一些实施方式,所述捕获实体靠近所述核酸分子的游离末端,并且其中至少一个可切割或可切除部分靠近所述捕获实体,使得所述可切割或可切除部分的切除使所述捕获实体与所述核酸分子解离。
38.根据一些实施方式,(b)中的所述经受使所述核酸分子从所述额外的支持物上解脱偶联,或者其中所述方法进一步包括在步骤(b)之前使与所述支持物偶联的所述核酸分子经受足以切割或切除靠近所述捕获实体的所述至少一个可切割或可切除部分的条件。
39.根据一些实施方式,所述聚合酶是链置换聚合酶。
40.根据一些实施方式,在(c)之前,所述核酸分子位于分区内。
41.根据一些实施方式,在(b)之前,所述核酸分子位于所述分区内并且在所述分区内执行步骤(b)。
42.根据一些实施方式,在所述分区外执行(c)。
43.根据一些实施方式,所述分区是乳液中的液滴。
44.根据一些实施方式,所述分区是孔。
45.根据一些实施方式,所述方法进一步包括用额外的核苷酸重复(c)和(d),其中所述标记的核苷酸和所述额外的核苷酸属于不同类型,任选地其中不同类型是不同的典型核苷碱基。
46.根据一些实施方式,(d)中使所述经切割的核酸分子经受足以并入所述额外的核苷酸的条件包括使所述第一链的一部分与所述第二链的一部分分离。
47.根据一些实施方式,所述额外的核苷酸是标记的核苷酸。
48.根据一些实施方式,所述方法进一步包括重复(e)。
49.根据一些实施方式,所述方法是分析多个核酸分子的方法,并且其中所述多个核酸分子与所述支持物偶联。
50.根据一些实施方式,所述多个核酸分子包括共同的核酸序列。
51.根据一些实施方式,所述共同的核酸序列是靶核酸序列。
52.根据一些实施方式,所述多个核酸分子包括核酸分子的克隆群体。
53.根据一些实施方式,所述方法是双端分析方法,所述第二链包括至少一个额外的可切割或可切除部分,并且在步骤(e)之后,所述方法包括:
54.f)使与所述支持物偶联的所述经切割的核酸分子经受足以切割或切除所述至少一个额外的可切割或可切除部分中的一个或多个的条件,由此产生与所述支持物偶联的两次切割的核酸分子,其中所述两次切割的核酸分子包括所述第二链中的缺口或空位区;
55.g)使所述两次切割的核酸分子接触聚合酶和标记的核苷酸,其中所述标记的核苷酸被配置成发出信号;
56.h)使所述经切割的核酸分子经受足以将所述标记的核苷酸并入到所述两次切割的核酸分子的所述第二链中的所述缺口或空位区中或并入到与所述第一链互补的新合成的链中的条件;以及
57.i)从所述两次切割的核酸分子中检测信号或信号变化,其中所述信号或所述信号变化指示所述标记的核苷酸并入到所述两次切割的核酸分子的所述第二链中的所述缺口或空位区中或并入到与所述第一链互补的所述新合成的链中;
58.由此对所述核酸分子进行双端分析。
59.根据一些实施方式,所述方法包括在步骤(f)之前整合额外的核苷酸,所述额外的核苷酸为不允许3'聚合的封端核苷酸。
60.根据一些实施方式,所述第二链的所述额外的可切割或可切除部分通过与所述第一链的所述至少两个可切割或可切除部分不同的条件进行切割。
61.根据一些实施方式,步骤(g)的所述聚合酶是链置换聚合酶。
62.根据一些实施方式,所述第二链上的所述缺口或空位区包括占两个或更多个碱基的空位区。
63.根据一些实施方式,所述第二链上的所述缺口或空位区与第二靶核酸序列或其互补序列相邻。
64.根据一些实施方式,所述第二链与所述支持物直接偶联,并且所述第一链不与所述支持物直接偶联。
65.根据一些实施方式,所述方法进一步包括用额外的核苷酸重复(g)和(h),其中所述标记的核苷酸和所述额外的核苷酸属于不同类型,任选地其中不同类型是不同的典型核苷碱基。
66.根据一些实施方式,所述额外的核苷酸是标记的核苷酸。
67.根据一些实施方式,所述方法进一步包括重复(e)。
68.根据另一方面,提供了一种分析核酸分子的方法,所述方法包括:
69.a)提供所述核酸分子,其中所述核酸分子包括:(i)第一链,所述第一链包括至少一个第一可切割或可切除部分;以及(ii)第二链,所述第二链包括至少一个第二可切割或可切除部分,并且其中所述核酸分子与支持物偶联;
70.b)使与所述支持物偶联的所述核酸分子经受足以切割或切除所述至少一个第一可切割或可切除部分的条件,由此产生与所述支持物偶联的经切割的核酸分子,其中所述经切割的核酸分子包括所述第一链中的缺口或空位区;
71.c)使所述经切割的核酸分子接触聚合酶和标记的核苷酸,其中所述标记的核苷酸被配置成发出信号;
72.d)使所述经切割的核酸分子经受足以将所述标记的核苷酸并入到所述第一链中的所述缺口或空位区中或并入到与所述第二链互补的新合成的链中的条件;
73.e)从所述经切割的核酸分子中检测信号或信号变化,其中所述信号或所述信号变化指示所述标记的核苷酸并入到所述第一链中的所述缺口或空位区中或并入到与所述第二链互补的所述新合成的链中;
74.f)使与所述支持物偶联的所述核酸分子或所述经切割的核酸分子经受足以切割或切除所述至少一个第二可切割或可切除部分的条件,由此产生与所述支持物偶联的两次切割的核酸分子,其中所述两次切割的核酸分子包括所述第二链中的缺口或空位区;
75.g)使所述两次切割的核酸分子接触聚合酶和标记的核苷酸,其中所述标记的核苷酸被配置成发出信号;
76.h)使所述两次切割的核酸分子经受足以将所述标记的核苷酸并入到所述第二链中的所述缺口或空位区中或并入到与所述第一链互补的新合成的链中的条件;以及
77.i)从所述两次切割的核酸分子中检测信号或信号变化,其中所述信号或所述信号
变化指示所述标记的核苷酸并入到所述第二链中的所述缺口或空位区中或并入到与所述第一链互补的所述新合成的链中;
78.由此分析核酸分子。
79.根据一些实施方式,步骤(b)和步骤(f)同时执行。
80.根据一些实施方式,步骤(c)和步骤(g)同时执行,步骤(d)和步骤(h)同时执行,并且步骤(e)和步骤(i)同时执行。
81.根据一些实施方式,(b)、(f)或两者包括使所述核酸分子接触切割剂,所述切割剂被配置成切割或切除所述至少第一可切割或可切除部分、所述至少第二可切割或可切除部分或两者。
82.根据一些实施方式,所述切割剂选自由以下组成的组:尿嘧啶dna糖苷酶(udg)、无嘧啶/无嘌呤核酸内切酶(ape)、核酸内切酶(例如,核酸内切酶viii(endoviii)或v(endov))、尿嘧啶特异性切除试剂(user)酶、甲酰胺嘧啶dna糖苷酶(fpg)、8-氧代鸟嘌呤糖苷酶(ogg1)、rna酶(例如,rna酶h,如rna酶hii)、紫外线以及其组合。
83.根据一些实施方式,所述至少第一可切割或可切除部分和第二可切割或可切除部分独立地选自由以下组成的组:核糖核酸(rna)碱基、尿嘧啶碱基、肌苷碱基、2,6-二氨基-4-羟基-5-甲酰胺嘧啶(fapyg)碱基、8-氧代-7,8-二氢鸟嘌呤(8oxog)碱基和光可切割碱基。
84.根据一些实施方式,所述至少一个第一可切割或可切除部分和所述至少一个第二可切割或可切除部分属于不同类型。
85.根据一些实施方式,所述至少一个第一可切割或可切除部分和所述至少一个第二可切割或可切除部分属于同一类型。
86.根据一些实施方式,所述第一链、所述第二链或两者中的所述缺口或空位区包括占两个或更多个碱基的空位区。
87.根据一些实施方式,所述第一链、所述第二链或两者中的所述缺口或空位区包括靶核酸序列或其互补序列。
88.根据一些实施方式,所述第一链、所述第二链或两者中的所述缺口或空位区与靶核酸序列或其互补序列相邻。
89.根据一些实施方式,所述标记的核苷酸未被封端。
90.根据一些实施方式,所述标记的核苷酸包括荧光染料。
91.根据一些实施方式,所述第一链、所述第二链或两者中的所述缺口或空位区各自包括能够通过所述聚合酶引发聚合反应的游离3'末端。
92.根据一些实施方式,(c)、(g)或两者包括使所述经切割的核酸分子接触包括包含所述标记的核苷酸的多个核苷酸的溶液,其中所述多个核苷酸中的每个核苷酸属于同一类型。
93.根据一些实施方式,所述多个核苷酸中的每个核苷酸是标记的核苷酸。
94.根据一些实施方式,所述多个核苷酸中的额外的核苷酸并入到所述第一链、所述第二链或两者中的所述缺口或空位区中或并入到与所述第二链互补的所述新合成的链、与所述第一链互补的所述新合成的链或两者中。
95.根据一些实施方式,所述核酸分子包括脱氧核糖核酸(dna)。
96.根据一些实施方式,所述核酸分子包括核糖核酸(rna)。
97.根据一些实施方式,所述支持物是颗粒。
98.根据一些实施方式,所述颗粒固定到表面。
99.根据一些实施方式,在(b)之前,所述核酸分子进一步包括捕获实体或与所述捕获实体偶联。
100.根据一些实施方式,所述捕获实体包括选自由以下组成的组的一个或多个成员:生物素、亲和素、核酸序列、带电颗粒和磁性颗粒。
101.根据一些实施方式,所述捕获实体被配置成与捕获性实体偶联。
102.根据一些实施方式,所述捕获性实体包括选自由以下组成的组的一个或多个成员:生物素、亲和素、核酸序列、电场系统和磁场系统。
103.根据一些实施方式,所述捕获实体与所述捕获性实体偶联。
104.根据一些实施方式,所述捕获性实体与额外的支持物偶联。
105.根据一些实施方式,所述额外的支持物是颗粒。
106.根据一些实施方式,所述捕获实体靠近所述核酸分子的游离末端,并且其中至少一个额外的可切割或可切除部分靠近所述捕获实体,使得所述额外的可切割或可切除部分的切除使所述捕获实体与所述核酸分子解离。
107.根据一些实施方式,(b)中的所述经受使所述核酸分子从所述额外的支持物上解脱偶联,或者其中所述方法进一步包括在步骤(b)之前使与所述支持物偶联的所述核酸分子经受足以切割或切除靠近所述捕获实体的所述至少一个额外的可切割或可切除部分的条件。
108.根据一些实施方式,所述聚合酶是链置换聚合酶。
109.根据一些实施方式,在(c)之前,所述核酸分子位于分区内。
110.根据一些实施方式,在(b)之前,所述核酸分子位于所述分区内并且在所述分区内执行步骤(b)。
111.根据一些实施方式,在所述分区外执行(c)。
112.根据一些实施方式,所述分区是乳液中的液滴。
113.根据一些实施方式,所述分区是孔。
114.根据一些实施方式,所述方法进一步包括用额外的核苷酸重复(c)和(d)、(g)和(h)或两者,其中所述标记的核苷酸和所述额外的核苷酸属于不同类型,任选地其中不同类型是不同的典型核苷碱基。
115.根据一些实施方式,(d)、(h)或两者中使所述经切割的核酸分子经受足以并入所述额外的核苷酸的条件包括使所述第一链的一部分与所述第二链的一部分分离。
116.根据一些实施方式,所述额外的核苷酸是标记的核苷酸。
117.根据一些实施方式,所述方法进一步包括重复(e)、(i)或两者。
118.根据一些实施方式,所述方法是分析多个核酸分子的方法,并且其中所述多个核酸分子与所述支持物偶联。
119.根据一些实施方式,所述多个核酸分子包括共同的核酸序列。
120.根据一些实施方式,所述共同的核酸序列包括第一靶核酸序列和第二靶核酸序列。
121.根据一些实施方式,所述多个核酸分子包括核酸分子的克隆群体。
122.根据一些实施方式,所述第二链与所述支持物直接偶联,并且所述第一链不与所述支持物直接偶联。
123.根据另一方面,提供了一种分析核酸分子的方法,所述方法包括:
124.a)提供所述核酸分子,其中所述核酸分子包括:(i)第一链;以及(ii)第二链,所述第二链包括至少一个可切割或可切除部分,并且其中所述核酸分子通过所述第二链的5'末端与支持物偶联;
125.b)使与所述支持物偶联的所述核酸分子经受足以切割或切除所述至少一个可切割或可切除部分的条件,由此产生与所述支持物偶联的经切割的核酸分子,其中所述经切割的核酸分子包括所述第二链中的缺口或空位区;
126.c)使所述经切割的核酸分子接触聚合酶和标记的核苷酸,其中所述标记的核苷酸被配置成发出信号;
127.d)使所述经切割的核酸分子经受足以将所述标记的核苷酸并入到所述第二链中的所述缺口或空位区中或并入到与所述第一链互补的新合成的链中的条件,其中所述标记的核苷酸并入到直接与所述支持物偶联的核酸聚合物中;
128.e)从所述经切割的核酸分子中检测信号或信号变化,其中所述信号或所述信号变化指示所述标记的核苷酸并入到所述第二链中的所述缺口或空位区中或并入到与所述第一链互补的所述新合成的链中;
129.f)用额外的核苷酸重复(c)、(d)和(e),其中所述标记的核苷酸和所述额外的核苷酸属于不同类型;
130.g)使所述第一链与所述第二链解离,由此产生与所述第二链偶联并且不与所述第一链偶联的所述支持物;
131.h)使与所述第二链偶联并且不与所述第一链偶联的所述支持物接触聚合酶、标记的核苷酸和与所述第二链的3'区互补的寡核苷酸引物,其中所述标记的核苷酸被配置成发出信号;
132.i)使与所述第二链偶联并且不与所述第一链偶联的所述支持物经受足以将所述标记的核苷酸并入到处于所述寡核苷酸引物的3'端并且与所述第二链互补的新合成的第一链中的条件;以及
133.j)从与所述第二链和所述寡核苷酸引物偶联的所述支持物中检测信号或信号变化,其中所述信号或所述信号变化指示所述标记的核苷酸并入到与所述第二链互补的所述新合成的第一链中;
134.由此分析核酸分子。
135.根据一些实施方式,(b)包括使所述核酸分子接触切割剂,所述切割剂被配置成切割或切除所述至少一个可切割或可切除部分。
136.根据一些实施方式,所述切割剂选自由以下组成的组:尿嘧啶dna糖苷酶(udg)、无嘧啶/无嘌呤核酸内切酶(ape)、核酸内切酶(例如,核酸内切酶viii(endoviii)或v(endov))、尿嘧啶特异性切除试剂(user)酶、甲酰胺嘧啶dna糖苷酶(fpg)、8-氧代鸟嘌呤糖苷酶(ogg1)、rna酶(例如,rna酶h,如rna酶hii)、紫外线以及其组合。
137.根据一些实施方式,所述至少一个可切割或可切除部分选自由以下组成的组:核
糖核酸(rna)碱基、尿嘧啶碱基、肌苷碱基、2,6-二氨基-4-羟基-5-甲酰胺嘧啶(fapyg)碱基、8-氧代-7,8-二氢鸟嘌呤(8oxog)碱基和光可切割碱基。
138.根据一些实施方式,所述第二链中的所述缺口或空位区包括占两个或更多个碱基的空位区。
139.根据一些实施方式,所述聚合酶是链置换聚合酶。
140.根据一些实施方式,所述方法进一步包括在步骤(c)之前,使所述经切割的核酸分子接触核酸外切酶并且使所述经切割的核酸分子经受足以使处于所述缺口或空位区的3'端的所述第二链的至少一部分降解的条件。
141.根据一些实施方式,所述缺口或空位区是仅占单个碱基的缺口。
142.根据一些实施方式,所述聚合酶不是链置换聚合酶。
143.根据一些实施方式,所述核酸外切酶是5'至3'核酸外切酶。
144.根据一些实施方式,所述缺口或空位区包括靶核酸序列或其互补序列。
145.根据一些实施方式,所述第一链包括靶核酸序列或其互补序列。
146.根据一些实施方式,所述缺口或空位区与靶核酸序列或其互补序列相邻。
147.根据一些实施方式,所述标记的核苷酸未被封端。
148.根据一些实施方式,所述标记的核苷酸包括荧光染料。
149.根据一些实施方式,所述缺口或空位区包括能够通过所述聚合酶引发聚合反应的游离3'末端。
150.根据一些实施方式,(c)、(h)或两者包括使所述经切割的核酸分子接触包括包含所述标记的核苷酸的多个核苷酸的溶液,其中所述多个核苷酸中的每个核苷酸属于同一类型。
151.根据一些实施方式,所述多个核苷酸中的每个核苷酸是标记的核苷酸。
152.根据一些实施方式,所述多个核苷酸中的额外的核苷酸并入到所述第二链中的所述缺口或空位区中或并入到与所述第二链互补的所述新合成的链、与所述第一链互补的所述新合成的链或两者中。
153.根据一些实施方式,所述核酸分子包括脱氧核糖核酸(dna)。
154.根据一些实施方式,所述核酸分子包括核糖核酸(rna)。
155.根据一些实施方式,所述支持物是颗粒。
156.根据一些实施方式,所述颗粒固定到表面。
157.根据一些实施方式,在(b)之前,所述核酸分子进一步包括捕获实体或与所述捕获实体偶联。
158.根据一些实施方式,所述捕获实体包括选自由以下组成的组的一个或多个成员:生物素、亲和素、核酸序列、带电颗粒和磁性颗粒。
159.根据一些实施方式,所述捕获实体被配置成与捕获性实体偶联。
160.根据一些实施方式,所述捕获性实体包括选自由以下组成的组的一个或多个成员:生物素、亲和素、核酸序列、电场系统和磁场系统。
161.根据一些实施方式,所述捕获实体与所述捕获性实体偶联。
162.根据一些实施方式,所述捕获性实体与额外的支持物偶联。
163.根据一些实施方式,所述额外的支持物是颗粒。
164.根据一些实施方式,所述捕获实体靠近所述核酸分子的游离末端,并且其中至少一个额外的可切割或可切除部分靠近所述捕获实体,使得所述额外的可切割或可切除部分的切除使所述捕获实体与所述核酸分子解离。
165.根据一些实施方式,(b)中的所述经受使所述核酸分子从所述额外的支持物上解脱偶联,或者其中所述方法进一步包括在步骤(b)之前使与所述支持物偶联的所述核酸分子经受足以切割或切除靠近所述捕获实体的所述至少一个额外的可切割或可切除部分的条件。
166.根据一些实施方式,在(c)之前,所述核酸分子位于分区内。
167.根据一些实施方式,在(b)之前,所述核酸分子位于所述分区内并且在所述分区内执行步骤(b)。
168.根据一些实施方式,在所述分区外执行(c)。
169.根据一些实施方式,所述分区是乳液中的液滴。
170.根据一些实施方式,所述分区是孔。
171.根据一些实施方式,所述方法进一步包括用额外的核苷酸重复(h)和(i)或两者,其中所述标记的核苷酸和所述额外的核苷酸属于不同类型,任选地其中不同类型是不同的典型核苷碱基。
172.根据一些实施方式,所述额外的核苷酸是标记的核苷酸。
173.根据一些实施方式,所述方法进一步包括重复(j)。
174.根据一些实施方式,所述方法是分析多个核酸分子的方法,并且其中所述多个核酸分子与所述支持物偶联。
175.根据一些实施方式,所述多个核酸分子包括共同的核酸序列。
176.根据一些实施方式,所述共同的核酸序列包括第一靶核酸序列和第二靶核酸序列。
177.根据一些实施方式,所述多个核酸分子包括核酸分子的克隆群体。
178.根据另一方面,提供了一种组合物,其包含与支持物偶联的核酸分子,其中所述核酸分子包括第一链和第二链,并且其中所述第一链(i)包括至少三个可切割或可切除部分并且(ii)包括捕获实体或与所述捕获实体偶联。
179.根据一些实施方式,所述核酸分子的所述第二链缺乏可切割或可切除部分。
180.根据一些实施方式,所述核酸分子的所述第二链与所述支持物偶联。
181.根据一些实施方式,所述核酸分子的所述第一链与所述支持物偶联。
182.根据一些实施方式,所述至少三个可切割或可切除部分中的可切割或可切除部分选自:核糖核酸(rna)碱基、尿嘧啶碱基、肌苷碱基、2,6-二氨基-4-羟基-5-甲酰胺嘧啶(fapyg)碱基、8-氧代-7,8-二氢鸟嘌呤(8oxog)碱基和光可切割碱基。
183.根据一些实施方式,所述核酸分子包括脱氧核糖核酸(dna),并且所述至少三个可切割或可切除部分是rna碱基,并且其中除了所述至少三个可切割或可切除部分之外,所述核酸分子缺乏rna碱基。
184.根据一些实施方式,所述核酸分子的所述第一链包括侧接有第一衔接子和第二衔接子的靶核酸序列,其中所述第一衔接子安置在所述第一链的第一末端,并且所述第二衔接子安置在所述第一链的第二末端,并且其中所述第一衔接子包括所述至少三个可切割或
可切除部分。
185.根据一些实施方式,所述第二链包括第三衔接子和第四衔接子,所述第三衔接子包括与所述第一衔接子的序列互补的序列,所述第四衔接子包括与所述第二衔接子的序列互补的序列,其中所述第三衔接子安置在所述第二链的第一末端,并且所述第四衔接子安置在所述第二链的第二末端。
186.根据一些实施方式,所述第二链通过所述第四衔接子与所述支持物偶联。
187.根据一些实施方式,所述至少三个可切割或可切除部分中的第一可切割或可切除部分靠近所述核酸分子的所述第一链的末端。
188.根据一些实施方式,所述末端是5'末端。
189.根据一些实施方式,所述末端是3'末端。
190.根据一些实施方式,所述第一可切割或可切除部分位于所述核酸分子的所述第一链的所述末端的3个碱基内。
191.根据一些实施方式,所述至少三个可切割或可切除部分中的所述第一可切割或可切除部分和第二可切割或可切除部分通过至少十个碱基分离。
192.根据一些实施方式,所述至少三个可切割或可切除部分中的所述第一可切割或可切除部分和第二可切割或可切除部分通过少于十个碱基分离。
193.根据一些实施方式,所述第一可切割或可切除部分和第二可切割或可切除部分的切割或切除被配置成诱导一个或多个碱基与所述核酸分子的所述第二链解离。
194.根据一些实施方式,所述第一可切割或可切除部分和第二可切割或可切除部分的切割或切除被配置成不诱导一个或多个碱基与所述核酸分子的所述第二链解离。
195.根据一些实施方式,所述至少三个可切割或可切除部分中的所述第一可切割或可切除部分和第三可切割或可切除部分通过至少十个碱基分离。
196.根据一些实施方式,所述第二可切割或可切除部分和所述第三可切割或可切除部分通过至少十个碱基分离。
197.根据一些实施方式,所述第二可切割或可切除部分和所述第三可切割或可切除部分通过少于十个碱基分离。
198.根据一些实施方式,所述至少三个可切割或可切除部分中的所述第一可切割或可切除部分和第三可切割或可切除部分通过少于十个碱基分离。
199.根据一些实施方式,所述至少三个可切割或可切除部分中的任何一个可切割或可切除部分的切割或切除被配置成不诱导一个或多个碱基与所述核酸分子的所述第二链解离。
200.根据一些实施方式,所述捕获实体包括选自由以下组成的组的一个或多个成员:生物素、亲和素、核酸序列、带电颗粒和磁性颗粒。
201.根据一些实施方式,所述捕获实体包括生物素。
202.根据一些实施方式,所述捕获实体包括核酸序列。
203.根据一些实施方式,所述捕获实体包括磁性颗粒或带电颗粒。
204.根据一些实施方式,所述组合物进一步包含额外的支持物,所述额外的支持物包括捕获性实体,其中所述捕获实体和所述捕获性实体被配置成彼此偶联。
205.根据一些实施方式,所述额外的支持物是颗粒。
206.根据一些实施方式,所述额外的支持物是或包括磁性部分。
207.根据一些实施方式,所述捕获性实体包括选自由以下组成的组的一个或多个成员:生物素、亲和素、核酸序列、电场系统和磁场系统。
208.根据一些实施方式,所述支持物是颗粒。
209.根据一些实施方式,所述支持物是或包括磁性部分。
210.根据一些实施方式,所述核酸分子源自细胞。
211.根据一些实施方式,所述核酸分子包括在分区内。
212.根据一些实施方式,所述分区是乳液中的液滴。
213.根据一些实施方式,所述分区是孔。
214.根据一些实施方式,所述核酸分子包括脱氧核糖核酸(dna)。
215.根据一些实施方式,所述核酸分子包括核糖核酸(rna)。
216.根据另一方面,提供了一种组合物,其包含与支持物偶联的核酸分子,其中所述核酸分子包括第一链和第二链,并且其中所述第一链包括靠近所述第一链的游离5'末端的至少一个第一可切割或可切除部分,并且(ii)所述第二链包括靠近与所述支持物偶联的5'末端的至少一个第二可切割或可切除部分。
217.根据一些实施方式,所述第一可切割或可切除部分、所述第二可切割或可切除部分或两者选自:核糖核酸(rna)碱基、尿嘧啶碱基、肌苷碱基、2,6-二氨基-4-羟基-5-甲酰胺嘧啶(fapyg)碱基、8-氧代-7,8-二氢鸟嘌呤(8oxog)碱基和光可切割碱基。
218.根据一些实施方式,所述第一可切割或可切除部分和所述第二可切割或可切除部分在相同条件下进行切割。
219.根据一些实施方式,所述第一可切割或可切除部分和所述第二可切割或可切除部分在不同条件下进行切割。
220.根据一些实施方式,所述核酸分子包括脱氧核糖核酸(dna),并且所述第一可切割或可切除部分和所述第二可切割或可切除部分中的至少一个可切割或可切除部分是rna碱基,并且其中除了所述第一可切割或可切除部分和所述第二可切割或可切除部分,所述核酸分子缺乏rna碱基。
221.根据一些实施方式,所述核酸分子的所述第一链包括侧接有第一衔接子和第二衔接子的靶核酸序列,其中所述第一衔接子安置在所述第一链的第一末端,并且所述第二衔接子安置在所述第一链的第二末端,并且其中所述第一衔接子包括所述至少一个第一可切割或可切除部分。
222.根据一些实施方式,所述第二链包括第三衔接子和第四衔接子,所述第三衔接子包括与所述第一衔接子的序列互补的序列,所述第四衔接子包括与所述第二衔接子的序列互补的序列,其中所述第三衔接子安置在所述第二链的第一末端,并且所述第四衔接子安置在所述第二链的第二末端,并且其中所述第四衔接子包括所述至少一个第二可切割或可切除部分。
223.根据一些实施方式,所述至少一个第一可切割或可切除部分位于所述核酸分子的所述第一链的所述游离5'末端的30个碱基内,所述至少一个第二可切割或可切除部分位于与所述核酸分子的所述第二链的所述支持物偶联的所述5'末端的30个碱基内。
224.根据一些实施方式,所述至少一个第一可切割或可切除部分和与所述至少一个第
二可切割或可切除部分互补的碱基通过至少100个碱基分离。
225.根据一些实施方式,所述至少一个第一可切割或可切除部分是多个第一可切割或可切除部分,并且所述第一可切割或可切除部分的切割或切除被配置成诱导一个或多个中间碱基与所述核酸分子的所述第二链解离。
226.根据一些实施方式,所述至少一个第一可切割或可切除部分是多个第一可切割或可切除部分,并且所述第一可切割或可切除部分通过少于十个碱基分离。
227.根据一些实施方式,所述至少一个第二可切割或可切除部分是多个第二可切割或可切除部分,并且所述第二可切割或可切除部分的切割或切除被配置成诱导一个或多个中间碱基与所述核酸分子的所述第一链解离。
228.根据一些实施方式,所述至少一个第二可切割或可切除部分是多个第二可切割或可切除部分,并且所述第二可切割或可切除部通过少于十个碱基分离。
229.根据一些实施方式,所述至少一个第一可切割或可切除部分是多个第一可切割或可切除部分,并且所述第一可切割或可切除部分的切割或切除被配置成不诱导一个或多个中间碱基与所述核酸分子的所述第二链解离。
230.根据一些实施方式,所述至少一个第一可切割或可切除部分是多个第一可切割或可切除部分,并且所述第一可切割或可切除部分通过至少十个碱基分离。
231.根据一些实施方式,所述核酸分子进一步包括捕获实体或与所述捕获实体偶联。
232.根据一些实施方式,所述捕获实体包括选自由以下组成的组的一个或多个成员:生物素、亲和素、核酸序列、带电颗粒和磁性颗粒。
233.根据一些实施方式,所述捕获实体被配置成与捕获性实体偶联。
234.根据一些实施方式,所述捕获性实体包括选自由以下组成的组的一个或多个成员:生物素、亲和素、核酸序列、电场系统和磁场系统。
235.根据一些实施方式,所述捕获实体与所述捕获性实体偶联。
236.根据一些实施方式,所述捕获性实体与额外的支持物偶联。
237.根据一些实施方式,所述额外的支持物是颗粒。
238.根据一些实施方式,所述捕获实体靠近所述核酸分子的游离末端,并且其中至少一个额外的可切割或可切除部分靠近所述捕获实体,使得所述额外的可切割或可切除部分的切除使所述捕获实体与所述核酸分子解离。
239.根据一些实施方式,所述额外的可切割或可切除部分以与所述第一可切割或可切除部分相同的条件、以与所述第二可切割或可切除部分相同的条件或两者进行切割或切除。
240.根据一些实施方式,所述第一链包括靠近所述第一链的游离5'末端的所述捕获实体。
241.根据一些实施方式,所述额外的可切割或可切除部分是包括所述捕获实体的碱基或处于包括所述捕获实体的碱基的3'端,并且所述额外的可切割或可切除部分的切割或切除使包括所述捕获实体的所述碱基与所述第二链解离。
242.根据一些实施方式,所述额外的可切割或可切除部分是来自所述第一链的所述游离5'末端的少于10个核苷酸。
243.根据一些实施方式,所述至少一个第一可切割或可切除部分和所述额外的可切割
或可切除部分充分分离,使得所述至少一个第一可切割或可切除部分和所述额外的可切割或可切除部分的切割不使中间碱基与所述第二链解离。
244.根据一些实施方式,所述至少一个第一可切割或可切除部分和所述额外的可切割或可切除部分通过至少10个碱基分离。
245.根据一些实施方式,所述核酸分子源自细胞。
246.根据一些实施方式,所述核酸分子包括在分区内。
247.根据一些实施方式,所述分区是乳液中的液滴。
248.根据一些实施方式,所述分区是孔。
249.根据一些实施方式,所述核酸分子包括脱氧核糖核酸(dna)。
250.根据一些实施方式,所述核酸分子包括核糖核酸(rna)。
251.根据另一方面,提供了一种处理核酸分子的方法,所述方法包括:
252.a)提供包括与支持物偶联的核酸分子的溶液,其中所述核酸分子包括第一链和第二链,其中(i)所述第一链包括靠近所述第一链的末端的可切割或可切除部分,并且(ii)所述第一链在位于或靠近所述末端处包括捕获实体或与所述捕获实体偶联;
253.b)在足以使所述捕获实体与捕获性实体偶联的条件下使所述溶液接触所述捕获性实体;
254.c)使与所述捕获性实体偶联的所述核酸分子与所述溶液的其它组分分离;以及
255.d)在(c)之后,使与所述捕获性实体偶联的所述核酸分子经受足以切割或切除所述可切割或可切除部分的条件,由此使所述核酸分子从所述捕获性实体上解脱偶联;
256.由此处理所述核酸分子。
257.根据一些实施方式,所述方法进一步包括:在(a)之前:
258.(i)提供与单链核酸分子偶联的所述支持物,其中所述单链核酸分子包括所述核酸分子的所述第二链或其部分;
259.(ii)提供包括与处于或靠近远离所述支持物的所述单链核酸分子的末端处的核酸序列互补的核酸序列的引物分子,其中所述引物分子包括所述可切割或可切除部分并且包括所述捕获实体或与所述捕获实体偶联;以及
260.(iii)使所述单链核酸分子和所述引物分子经受足以使所述引物分子与所述单链核酸分子杂交的条件。
261.根据一些实施方式,所述方法进一步包括:在(iii)之后,(iv)使与所述单链核酸分子杂交的所述引物分子经受足以延伸所述引物分子以产生所述核酸分子的所述第一链或其部分的条件。
262.根据一些实施方式,所述方法进一步包括对与所述支持物偶联的多个单链核酸分子重复(i)至(iv)。
263.根据一些实施方式,所述引物分子与颗粒偶联。
264.根据一些实施方式,所述引物分子与所述颗粒可释放地偶联。
265.根据一些实施方式,所述方法进一步包括使与所述颗粒偶联的所述引物分子经受足以从所述颗粒释放所述引物分子的条件。
266.根据一些实施方式,所述方法进一步包括:在(a)之前:
267.(i)提供与包括第一核酸序列的引物分子偶联的所述支持物;
268.(ii)提供包括与所述引物分子的所述第一核酸序列互补的第二核酸序列的模板核酸分子,其中所述模板核酸分子包括与所述核酸分子的所述可切割或可切除部分互补的不可切割或不可切除部分;以及
269.(iii)使所述模板核酸分子和所述引物分子经受足以使所述模板核酸分子与所述引物分子杂交的条件。
270.根据一些实施方式,所述方法进一步包括:在(iii)之后,(iv)使与所述单链核酸分子杂交的所述引物分子经受足以延伸所述引物分子以产生所述核酸分子的所述第二链或其部分的条件。
271.根据一些实施方式,所述方法进一步包括(v)使与所述模板核酸分子杂交的所述核酸分子的所述第二链经受足以使所述模板核酸分子与所述第二链分离的条件。
272.根据一些实施方式,所述模板核酸分子与颗粒偶联。
273.根据一些实施方式,所述模板核酸分子与所述颗粒可释放地偶联。
274.根据一些实施方式,所述方法进一步包括使与所述颗粒偶联的所述模板核酸分子经受足以从所述颗粒释放所述模板核酸分子的条件。
275.根据一些实施方式,所述方法进一步包括对与所述支持物偶联的多个引物分子重复(i)至(v),由此产生与所述支持物偶联的多个第二链。
276.根据一些实施方式,所述方法进一步包括(vi)提供包括以下的额外的引物分子:(a)与所述第二链的第四核酸序列互补的第三核酸序列;以及(b)所述可切割或可切除部分或其不可切割或不可切除类似物,其中所述额外的引物分子包括所述捕获实体或与所述捕获实体偶联;(vii)使所述第二链和所述额外的引物分子经受足以使所述额外的引物分子与所述第二链杂交的条件;以及(viii)使与所述第二链杂交的所述额外的引物分子经受足以延伸所述额外的引物分子以产生所述核酸分子的所述第一链或其部分的条件。
277.根据一些实施方式,所述额外的引物分子与颗粒偶联。
278.根据一些实施方式,所述额外的引物分子与所述颗粒可释放地偶联。
279.根据一些实施方式,所述方法进一步包括使与所述颗粒偶联的所述额外的引物分子经受足以从所述颗粒释放所述额外的引物分子的条件。
280.根据一些实施方式,所述方法进一步包括对多个额外的引物分子重复(vi)至(viii),由此产生多个第一链。
281.根据一些实施方式,所述溶液包括与包括多个捕获实体和多个可切割或可切除部分的多个核酸分子偶联的多个支持物,其中所述多个核酸分子中的每个核酸分子包括第一链和第二链,其中(i)每个所述第一链在靠近每个所述第一链的游离末端处包括所述多个可切割或可切除部分中的一个可切割或可切除部分,并且(ii)每个所述第一链在位于或靠近所述游离末端处包括所述多个捕获实体中的一个捕获实体或与所述捕获实体偶联。
282.根据一些实施方式,所述溶液进一步包括多个额外的支持物,所述多个额外的支持物不与包括多个捕获实体的核酸分子偶联。
283.根据一些实施方式,在(b)之前,所述支持物包括在分区内。
284.根据一些实施方式,所述核酸分子与分区内的所述支持物偶联。
285.根据一些实施方式,所述分区是乳液中的液滴。
286.根据一些实施方式,所述分区是孔。
287.根据一些实施方式,所述可切割或可切除部分选自由以下组成的组:核糖核酸(rna)碱基、尿嘧啶碱基、肌苷碱基、2,6-二氨基-4-羟基-5-甲酰胺嘧啶(fapyg)碱基、8-氧代-7,8-二氢鸟嘌呤(8oxog)碱基和光可切割碱基。
288.根据一些实施方式,所述核酸分子包括脱氧核糖核酸(dna),并且所述可切割或可切除部分是rna碱基,并且其中除了所述可切割或可切除部分之外,所述核酸分子缺乏rna碱基。
289.根据一些实施方式,(d)中的所述条件包括使所述核酸分子接触切割剂,所述切割剂被配置成切割或切除所述可切割或可切除部分。
290.根据一些实施方式,所述切割剂选自由以下组成的组:尿嘧啶dna糖苷酶(udg)、无嘧啶/无嘌呤核酸内切酶(ape)、核酸内切酶(例如,核酸内切酶viii(endoviii)或v(endov))、尿嘧啶特异性切除试剂(user)酶、甲酰胺嘧啶dna糖苷酶(fpg)、8-氧代鸟嘌呤糖苷酶(ogg1)、rna酶(例如,rna酶h,如rna酶hii)、紫外线以及其组合。
291.根据一些实施方式,所述捕获实体包括选自由以下组成的组的一个或多个成员:生物素、亲和素、核酸序列、带电颗粒和磁性颗粒。
292.根据一些实施方式,所述捕获实体包括生物素。
293.根据一些实施方式,所述捕获实体包括核酸序列。
294.根据一些实施方式,所述捕获实体包括磁性颗粒或带电颗粒。
295.根据一些实施方式,所述捕获性实体包括选自由以下组成的组的一个或多个成员:生物素、亲和素、核酸序列、电场系统和磁场系统。
296.根据一些实施方式,所述捕获性实体与另一支持物偶联。
297.根据一些实施方式,所述另一支持物是颗粒。
298.根据一些实施方式,所述支持物是颗粒。
299.根据一些实施方式,所述核酸分子包括脱氧核糖核酸(dna)。
300.根据一些实施方式,所述核酸分子包括核糖核酸(rna)。
301.根据一些实施方式,所述核酸分子包括额外的可切割或可切除部分。
302.根据一些实施方式,所述额外的可切割或可切除部分通过至少十个碱基与所述可切割或可切除部分分离。
303.根据一些实施方式,所述额外的可切割或可切除部分通过少于十个碱基与所述可切割或可切除部分分离。
304.根据一些实施方式,所述核酸分子包括额外的捕获部分或与所述额外的捕获部分偶联。
305.根据一些实施方式,所述方法进一步包括:
306.(e)在足以使所述额外的捕获实体与额外的捕获性实体偶联的条件下,使与所述支持物偶联的所述核酸分子接触所述额外的捕获性实体,由此使所述核酸分子与所述额外的捕获性实体偶联;
307.(f)使与所述额外的捕获性实体偶联的所述核酸分子与包括所述核酸分子的溶液的其它组分分离;以及
308.(g)在(f)之后,使与所述额外的捕获性实体偶联的所述核酸分子经受足以切割或切除所述额外的可切割或可切除部分的条件,由此使所述核酸分子从所述额外的捕获性实
体上解脱偶联。
309.根据一些实施方式,所述额外的捕获性实体与额外的支持物偶联。
310.根据一些实施方式,(g)包括使所述核酸分子接触切割剂。
311.根据一些实施方式,所述切割剂选自由以下组成的组:尿嘧啶dna糖苷酶(udg)、无嘧啶/无嘌呤核酸内切酶(ape)、核酸内切酶(例如,核酸内切酶viii(endoviii)或v(endov))、尿嘧啶特异性切除试剂(user)酶、甲酰胺嘧啶dna糖苷酶(fpg)、8-氧代鸟嘌呤糖苷酶(ogg1)、rna酶(例如,rna酶h,如rna酶hii)、紫外线以及其组合。
312.根据一些实施方式,所述方法进一步包括使所述核酸分子经受足以切割或切除所述额外的可切割或可切除部分的条件,由此产生在所述核酸分子的所述第一链中的缺口或空位区。
313.根据一些实施方式,使所述核酸分子经受足以切割或切除所述额外的可切割或可切除部分的条件包括使所述核酸分子接触切割剂。
314.根据一些实施方式,所述切割剂选自由以下组成的组:尿嘧啶dna糖苷酶(udg)、无嘧啶/无嘌呤核酸内切酶(ape)、核酸内切酶(例如,核酸内切酶viii(endoviii)或v(endov))、尿嘧啶特异性切除试剂(user)酶、甲酰胺嘧啶dna糖苷酶(fpg)、8-氧代鸟嘌呤糖苷酶(ogg1)、rna酶(例如,rna酶h,如rna酶hii)、紫外线以及其组合。
315.根据一些实施方式,所述额外的可切割或可切除部分的切割或切除产生在所述核酸分子的所述第一链中的占两个或更多个碱基的空位区。
316.根据一些实施方式,所述方法进一步包括使包括所述缺口或空位区的所述核酸分子接触聚合酶和标记的核苷酸,其中所述标记的核苷酸被配置成发出信号。
317.根据一些实施方式,所述方法进一步包括使包括所述缺口或空位区的所述核酸分子经受足以将所述标记的核苷酸并入到所述缺口或空位区中的条件。
318.根据一些实施方式,所述方法进一步包括从并入到所述核酸分子的所述缺口或空位区中的所述标记的核苷酸中检测信号或信号变化,其中所述信号或所述信号变化指示所述标记的核苷酸并入到所述核酸分子的所述缺口或空位区中。
319.根据一些实施方式,所述聚合酶是链置换聚合酶。
320.根据一些实施方式,所述标记的核苷酸包括荧光染料。
321.根据另一方面,提供了一种分析双链核酸分子的方法,所述方法包括:
322.a)从与支持物偶联的核酸分子产生所述双链核酸分子,所述双链核酸分子包括包含靶核酸序列和位于所述靶核酸序列的5'端的缺口区的链,其中与所述支持物偶联的所述核酸分子包括:(i)第一链,所述第一链包括至少两个可切割或可切除部分并且包括捕获实体或与所述捕获实体偶联;以及(ii)第二链;
323.b)使所述双链核酸分子与聚合酶和包括多个标记的核苷酸的多个核苷酸接触,所述接触条件足以使所述多个标记的核苷酸中的一个标记的核苷酸并入到与所述缺口区的5'末端相邻的位置;以及
324.c)从所述双链核酸分子中检测信号或信号变化,其中所述信号或所述信号变化指示所述标记的核苷酸并入到所述缺口区中。
325.根据一些实施方式,所述双链核酸分子是核糖核酸分子。
326.根据一些实施方式,所述双链核酸分子是脱氧核糖核酸分子。
327.根据一些实施方式,所述缺口区包括单个碱基空位。
328.根据一些实施方式,所述缺口区包括占两个或更多个碱基的空位区。
329.根据一些实施方式,所述缺口区包括占五个或更少个碱基的空位区。
330.根据一些实施方式,所述聚合酶是链置换聚合酶。
331.根据一些实施方式,所述多个核苷酸中的每个核苷酸包括同一类型的核苷碱基。
332.根据一些实施方式,所述多个核苷酸中的至少20%核苷酸是标记的核苷酸。
333.根据一些实施方式,所述多个核苷酸中的每个核苷酸是标记的核苷酸。
334.根据一些实施方式,所述标记的核苷酸包括荧光染料。
335.根据一些实施方式,所述多个核苷酸是多个未封端核苷酸。
336.根据一些实施方式,所述标记的核苷酸被配置成发出信号。
337.根据一些实施方式,所述方法进一步包括用额外的多个核苷酸重复(b)。
338.根据一些实施方式,所述多个核苷酸和所述额外的多个核苷酸中的每个核苷酸包括同一类型的核苷碱基。
339.根据一些实施方式,所述额外的多个核苷酸中的每个核苷酸是未标记的核苷酸。
340.根据一些实施方式,所述多个核苷酸中的核苷酸和所述额外的多个核苷酸中的核苷酸各自包括不同类型的核苷碱基。
341.根据一些实施方式,所述额外的多个核苷酸包括额外的多个标记的核苷酸。
342.根据一些实施方式,所述额外的多个核苷酸中的至少20%核苷酸是标记的核苷酸。
343.根据一些实施方式,所述额外的多个核苷酸中的每个核苷酸是标记的核苷酸。
344.根据一些实施方式,(b)重复至少三次。
345.根据一些实施方式,所述方法进一步包括重复(c)。
346.根据一些实施方式,所述方法进一步包括:在(b)之后,使所述双链核酸分子接触洗涤溶液以去除所述多个核苷酸中的未并入的核苷酸。
347.根据一些实施方式,所述支持物是颗粒。
348.根据一些实施方式,所述双链核酸分子与额外的支持物偶联。
349.根据一些实施方式,所述额外的支持物是颗粒。
350.根据一些实施方式,所述额外的支持物包括双链核酸分子的克隆群体,其中所述克隆群体中的每个双链核酸分子包括包含所述靶核酸序列和处于所述靶核酸序列的5'端的缺口的链。
351.根据一些实施方式,使用多个双链核酸分子并行执行(b),其中所述多个双链核酸分子包括多个不同靶核酸序列。
352.根据一些实施方式,(a)包括使与所述支持物偶联的所述核酸分子接触切割剂,所述切割剂被配置成切割或切除所述至少两个可切割或可切除部分。
353.根据一些实施方式,与所述支持物偶联的所述核酸分子通过与所述捕获实体偶联的捕获性实体与额外的支持物偶联,其中从与所述支持物偶联的所述核酸分子产生所述双链核酸分子使所述核酸分子从所述支持物上解脱偶联。
354.根据一些实施方式,所述捕获性实体包括选自由以下组成的组的成员:生物素、亲和素、核酸序列、电场系统和磁场系统。
355.根据一些实施方式,所述额外的支持物是颗粒。
356.根据一些实施方式,所述至少两个可切割或可切除部分选自由以下组成的组:核糖核酸(rna)碱基、尿嘧啶碱基、肌苷碱基、2,6-二氨基-4-羟基-5-甲酰胺嘧啶(fapyg)碱基、8-氧代-7,8-二氢鸟嘌呤(8oxog)碱基和光可切割碱基。
357.根据一些实施方式,所述至少两个可切割或可切除部分中的两个或更多个属于同一类型。
358.根据一些实施方式,所述至少两个可切割或可切除部分中的两个或更多个属于不同类型。
359.根据一些实施方式,所述至少两个可切割或可切除部分中的两个或更多个通过三个或更少个碱基分离。
360.根据一些实施方式,所述捕获实体包括选自由以下组成的组的成员:生物素、亲和素、核酸序列、带电颗粒和磁性颗粒。
361.根据以下详细描述,本公开的额外的方面和优势对于本领域技术人员而言将是显而易见的,其中仅示出并描述了本公开的说明性实施方式。如将认识到的,本公开能够具有其它且不同的实施方式,并且其若干细节能够在各种明显的方面进行修改,而所有这些都不脱离本公开。因此,附图和说明书将在本质上被视为是说明性的而非限制性的。
362.本说明书中所提及的所有公开、专利以及专利申请通过引用并入本文,其程度如同每个单独的公开、专利或专利申请被专门地且单独地指示通过引用并入。在通过引用的方式并入的公开和专利或专利申请与本说明书中所包含的公开内容相抵触的情况下,本说明书意欲替代和/或优先于任何这类矛盾材料。
363.附图简要说明
364.本发明的新颖特征在所附权利要求中具体阐述。通过参考对说明性实施方式以及附图(在本文也称为“图(figure)”和“图(fig.)”)进行阐述的以下详细说明,将获得对本发明的特征和优点的更好理解,在所述实施方式中利用了本发明的原理,在附图中:
365.图1a示出了包括在最5'端位置处的可切割碱基的示例性组合物。下图示出了在切除可切割碱基之后的组合物。
366.图1b示出了包括具有靠近最5'端位置的可切割碱基的序列的示例性组合物。实线以下描绘了在切除可切割碱基之后靠近5'的碱基的解离。
367.图2a至2b示出了用于产生本文所提供的组合物的示例性方法。
368.图2c示出了用于产生每个末端处具有不同衔接子的双链体模板分子的示例性方法。
369.图3a至3c示出了本文所提供的示例性预富集方法。
370.图4a至4c示出了本文所提供的示例性后富集方法。
371.图4d至4e示出了图4a的示例性替代方案,其中加入预富集复合物作为输入以进行扩增。
372.图5a至5b示出了本文所提供的组合的后富集和测序方法的实例。
373.图5c至5e示出了本文所提供的组合的后富集和双端测序方法的实例。
374.图6a至6d示出了如本文所提供的具有单个可切割或可切除碱基的双端测序的实例。
375.图6e至6g示出了如本文所提供的具有多个可切割或可切除碱基的双端测序的实例。
376.图7示出了被编程或以其它方式被配置成实施本文所提供的方法的计算机系统的示例性架构。
具体实施方式
377.尽管本文中已经示出并且描述了本发明的各个实施方式,但是对于本领域的技术人员而言将显而易见的是,这些实施方式仅作为实例提供。在不背离本发明的情况下,本领域的技术人员可以想到各种变化、改变和取代。应当理解,可以采用本文所描述的本发明的实施方式的各种替代方案。
378.本发明基于改善模板核酸分子的克隆扩增的方式的惊人发现,所述方式通过规避克隆扩增固有的二重泊松分布问题(double-poisson distribution problem)来避免试剂浪费和样品丢失。在分区中执行的扩增需要将核酸分子模板和扩增支持物(例如,珠)分布到各个分区。标准扩增需要单个珠和单个模板存在于分区中,以促进产生与模板核酸同源或互补的由扩增产物结合的克隆珠。当分区仅包括珠、仅包括核酸或都不包括时,不会发生扩增并且分区中的试剂被浪费。此外,还丢失了没有珠的珍贵的核酸模板。具有多于一个核酸的分区产生了不能适当分析的多克隆珠的分区,这也浪费了试剂和模板。对于分区中极大过量的随机分布的“n”数量的核酸分子和“b”数量的珠的给定情况,在具有任何数量的dna(0个、1个或》1个核酸分子)的分区中发现的相对珠群体取决于n/m的比率。当珠和模板核酸分别分布到分区中时,各自将遵循其自身泊松分布,由此导致二重泊松问题。包括n数量的核酸的珠的分数,即r(n)可以计算为:r(n)=e^-(n/m)x(n/m)^n/n!
379.为了使仅具有一个珠和仅具有一个核酸模板的分区最大化,将选择n/m比率为1。在这种情况下,37%的珠将单独在分区中,26%的珠将在具有多于一个模板的分区中,并且37%的珠将在具有单个模板的分区中。这通常大量损失了模板。然而,由于二重泊松问题,情况甚至更加糟糕。仅具有单个模板分子的这些分区中的一些分区将具有多个珠,因此具有单个珠的分区中的核酸百分比甚至低于37%,并且实际上为大约22%。类似地,仅22%的模板分子将在具有单个珠和单个模板的分区中。本文提供了一种预富集的方法,其中具有捕获实体的模板分子与扩增珠连接。具有模板分子的结合拷贝的珠用捕获剂分离并且然后释放。以此方式,用于扩增的输入总是单个珠和单个模板。不与珠结合(即,进入空分区)的模板可能被重新施用到可能被再次分离的更多珠。这可以按需重复多次,使得不丢失珍贵的样品。因为扩增中的所有珠在分布到分区之前就具有结合的核酸,所以去除了其中一重泊松分布。使用可切割或可切除碱基提供了在预富集之后去除捕获剂的巧妙方式,并且可以与扩增过程组合。
380.本发明还基于使用双链模板的优势的惊人发现。单链模板通常用作输入以进行克隆扩增。然而,当单链模板用于预富集时,单链易于彼此杂交并且自身杂交,从而产生可变的连接和杂交效率。这导致掉落一些靶标以及读段质量和测序效率/准确性以及总基因组覆盖度的整体损失。双链模板降低了珠内结合,消除了内部二级结构形成,允许与捕获性实体脱离的多种方法并且提供了新颖的序列分析方法(如本文以下所描述的)。一个具体有益发现是使用双链分子,后富集步骤(扩增后)可以通过去除可切割/可切除碱基的单个步骤
与测序组合。后富集期间的双链分子尤其有益。由于单链分子的珠内杂交,具有单链分子的经扩增的珠易于结块和聚集。由于富集,珠的紧密贴近使此问题极大地恶化。然而,双链扩增产物不会产生这些珠内连接,并且因此极大降低了结块倾向。
381.在值被描述为范围的情况下,应当理解,此类公开包括此类范围内所有可能的子范围的公开,以及落入此类范围内的特定数值,无论特定数值或特定子范围是否是明确规定的。
382.术语“约”和“大约”通常是指给定值或值范围的可接受误差程度或变化程度,例如,误差程度或变化程度在给定值或值范围的20%以内、15%以内、10%以内或5%以内。
383.如本文所使用的,术语“至少部分”通常是指整体量的任何分数。例如,“至少部分”可以是指整体量的至少约1%、2%、3%、4%、5%、6%、7%、8%、9%、10%、15%、20%、25%、30%、35%、40%、45%、50%、55%、60%、65%、70%、75%、80%、85%、90%、95%、99.9%或更多。
384.如本文所使用的,术语“受试者”通常是指生物样品(例如,正在经受或将经受处理或分析的生物样品)可能源自的个体或实体。受试者可以是动物(例如,哺乳动物或非哺乳动物)或植物。所述受试者可以是人、狗、猫、马、猪、鸟、非人灵长类动物、猿、农场动物、伴侣动物、运动动物或啮齿动物。受试者可以是患者。所述受试者可能患有或疑似患有疾病或病症,如癌症(例如,乳腺癌、结直肠癌、脑癌、白血病、肺癌、皮肤癌、肝癌、胰腺癌、淋巴瘤、食道癌或宫颈癌)或传染病。可替代地或另外地,受试者可能已知之前患有疾病或病症。所述受试者可能患有或疑似患有遗传病症,如软骨发育不全、α-1抗胰蛋白酶缺乏症、抗磷脂综合征、自闭症、常染色体显性多囊性肾病、腓骨肌萎缩症(charcot-marie-tooth)、猫叫综合征(cri du chat)、克罗恩氏病(crohn's disease)、囊胞性纤维症、痛性肥胖症(dercum disease)、唐氏综合征、杜恩综合征(duane syndrome)、杜氏肌营养不良(duchenne muscular dystrophy)、莱登第五因子易栓症(factor v leiden thrombophilia)、家族性高胆固醇血症、家族性地中海热、脆性x染色体综合征、戈谢病(gaucher disease)、血色沉着病、血友病、前脑无裂畸形、亨廷顿氏病(huntington's disease)、克兰费尔特综合征(klinefelter syndrome)、马凡综合征(marfan syndrome)、肌强直性营养不良、神经纤维瘤病、努南综合征(noonan syndrome)、成骨不全症、帕金森氏病(parkinson's disease)、苯丙酮尿症、波兰畸形(poland anomaly)、卟啉症、儿童早衰症、色素性视网膜炎、严重复合免疫缺陷、镰状细胞病、脊髓性肌萎缩、泰萨二氏病(tay-sachs)、地中海贫血、臭鱼症(trimethylaminuria)、特纳综合征(turner syndrome)、颚心面综合症、wagr综合征或威尔森症(wilson disease)。受试者可能正在经受疾病或病症的治疗。受试者可以具有或没有给定疾病或病症的症状。受试者可以是健康的(例如,不疑似患有疾病或病症)。受试者可能具有给定疾病的一个或多个风险因素。受试者可以具有给定体重、身高、体质指数或其它身体特性。受试者可以具有给定的种族或族群遗传、出生地或居住地、国籍、疾病或缓解状态、家庭病史或其它特性。
385.如本文所使用的,术语“生物样品”通常是指从受试者获得的样品。所述生物样品可以直接或间接从受试者获得。样品可以通过任何合适的方法从受试者获得,包括但不限于吐痰、擦拭、抽血、活检、获得排泄物(例如,尿液、粪便、痰、呕吐物或唾液)、切除、刮擦和穿刺。样品可以通过例如静脉内或动脉内进入循环系统,收集所分泌的生物样品(例如,粪
便、尿液、唾液、痰等),呼吸或外科手术提取组织(例如,活检)从受试者获得。所述样品可以通过非侵入方法获得,所述方法包括但不限于:刮擦皮肤或宫颈、擦拭脸颊或收集唾液、尿液、粪便、月经、眼泪或精液。可替代地,所述样品可以通过如活检、针吸或放血等侵入性程序获得。样品可以包括体液,如但不限于血液(例如,全血、红细胞、白细胞或白血球、血小板)、血浆、血清、汗液、泪液、唾液、痰、尿液、精液、粘液、滑液、母乳、初乳、羊水、胆汁、骨髓、间质或细胞外液或脑脊液。例如,可以通过穿刺方法获得包括血液和/或血浆的体液来获得样品。此类样品可以包括细胞和无细胞核酸材料。可替代地,所述样品可以通过任何其它来源获得,包括但不限于血液、汗液、毛囊、颊组织、眼泪、月经、粪便或唾液。所述生物样品可以是组织样品,如肿瘤活检。所述样品可以通过本文所提供的任何组织获得,包括但不限于皮肤、心脏、肺、肾、乳房、胰腺、肝、肠、脑、前列腺、食道、肌肉、平滑肌、膀胱、胆囊、结肠或甲状腺。本文所提供的获得方法包括活检方法,包括细针抽吸、芯针活检、真空辅助活检、大芯活检、切口活检、切除活检、穿孔活检、剃须活检或皮肤活检。所述生物样品可以包括一个或多个细胞。生物样品可以包括一个或多个核酸分子,如一个或多个脱氧核糖核酸(dna)和/或核糖核酸(rna)分子(例如,包括在细胞内或不包括在细胞内)。核酸分子可以包括在细胞内。可替代地或另外地,核酸分子可以不包括在细胞内(例如,无细胞核酸分子)。所述生物样品可以是无细胞样品。
386.如本文所使用的,术语“无细胞样品”通常是指基本上不含细胞的样品(例如,按体积计少于10%的细胞)。无细胞样品可以源自(例如,如本文所描述的)任何来源。例如,无细胞样品可以源自血液、汗液、尿液或唾液。例如,无细胞样品可以源自组织或体液。无细胞样品可以源自多个组织或体液。例如,来自第一组织或体液的样品可以与来自第二组织或体液的样品组合(例如,当获得样品时或在获得样品之后)。在一种实例中,可以从受试者收集第一体液和第二体液(例如,同时或不同时),并且所述第一和第二体液可以组合以提供样品。无细胞样品可以包括一个或多个核酸分子,如一个或多个dna或rna分子。
387.可以处理非无细胞样品的样品(例如,包括一个或多个细胞的样品)以提供无细胞样品。例如,可以从受试者获得包括一个或多个细胞以及不包含在细胞内的一个或多个核酸分子(例如,dna和/或rna分子)的样品(例如,无细胞核酸分子)。所述样品可以经受(例如,如本文所描述的)处理以将细胞和其它材料与不包含在细胞内的核酸分子分离,由此提供无细胞样品(例如,包括不包含在细胞内的核酸分子)。然后,无细胞样品可以经受进一步分析和处理(例如,如本文所提供的)。不包含在细胞内的核酸分子(例如,无细胞核酸分子)可以源自细胞和组织。例如,无细胞核酸分子可以源自(例如,身体组织的)肿瘤组织或降解细胞。无细胞核酸分子可以包括(例如,如本文所描述的)任何类型的核酸分子。无细胞核酸分子可以是双链、单链或其组合。无细胞核酸分子可以通过分泌或细胞死亡过程(例如,细胞坏死、细胞凋亡等)释放到体液中。无细胞核酸分子可以从癌细胞释放到体液中(例如,循环肿瘤dna(ctdna))。无细胞核酸分子还可以是在母体血流中自由循环的胎儿dna(例如,无细胞胎儿核酸分子,如cffdna)。可替代地或另外地,无细胞核酸分子可以从健康细胞释放到体液中。
388.生物样品可以直接从受试者获得并且分析,而无需任何中间处理,例如样品纯化或提取。例如,通过进入受试者循环系统,从受试者中取出血液(例如,通过针)并且将取出的血液转移到接收器中,血液样品可以直接从受试者获得。接收器可以包含试剂(例如,抗
凝剂),使得血液样品可用于进一步分析。此类试剂可以用于在分析之前在接收器或另一接收器中处理样品或源自样品的分析物。在另一个实例中,拭子可以用于获取受试者的口咽表面上的上皮细胞。在从受试者获得生物样品之后,包括生物样品的拭子可以与流体(例如,缓冲液)接触以从拭子收集体液。
389.包括一个或多个核酸分子的任何合适的生物样品可以从受试者获得。根据本文所提供的方法所适用的样品(例如,生物样品或无细胞生物样品)可以是任何材料,所述材料包括待测试个体的组织、细胞、降解细胞、核酸、基因、基因片段、表达产物、基因表达产物和/或基因表达产物片段。生物样品可以是固体物质(例如,生物组织)或者可以是流体(例如,生物流体)。通常,生物流体可以包括任何与生物体相关联的流体。生物样品的非限制性实例包括从受试者的任何解剖位置(例如,组织、循环系统、骨髓)获得的血液(或血液组分——例如,白细胞、红细胞、血小板)、从受试者的任何解剖位置获得的细胞、皮肤、心脏、肺、肾、呼吸、骨髓、粪便、精液、阴道液、源自肿瘤组织的间质液、乳房、胰腺、脑脊髓液、组织、咽拭子、活检、胎盘液、羊水、肝、肌肉、平滑肌、膀胱、胆囊、结肠、肠、脑、腔液、痰、脓、微生物群、胎粪、母乳、前列腺、食道、甲状腺、血清、唾液、尿液、胃液和消化液、眼泪、眼部流体、汗液、粘液、耳垢、油、腺体分泌物、脊髓液、头发、指甲、皮肤细胞、血浆、鼻拭子或鼻咽洗液、脊髓液、脐带血、加重液和/或其它排泄物或身体组织。提供了用于确定样品适用性和/或充分性的方法。样品可以包括但不限于血液、血浆、组织、细胞、降解细胞、无细胞核酸分子和/或来自细胞或源自个体的细胞的生物材料,如无细胞核酸分子。样品可以是细胞、组织或无细胞生物材料的异质群体或同质群体。生物样品可以使用任何可以提供适于本文所描述的分析方法的样品的方法获得。
390.样品(例如,生物样品或无细胞生物样品)在制备中可能经受一个或多个过程以进行分析,包括但不限于过滤、离心、选择性沉淀、渗透、分离、搅拌、加热、纯化和/或其它过程。例如,可以过滤样品以去除污染物或其它材料。在一个实例中,可以处理包括细胞的样品以将细胞与样品中的其它材料分离。此类过程可以用于制备仅包括无细胞核酸分子的样品。此类过程可以由多步离心过程组成。可以获得多个样品,如来自同一受试者的多个样品(例如,以相同或不同方式从相同或不同身体位置获得和/或同时或不同时获得(例如,间隔几秒、几分钟、几小时、几天、几周、几个月或几年))或来自不同受试者的多个样品以如本文所描述的进行分析。在一个实例中,在受试者经受治疗方案或手术之前从受试者获得第一样品,并且在受试者经受治疗方案或手术之后从受试者获得第二样品。可替代地或另外地,可以同时或大约同时从同一受试者获得多个样品。可以以相同或不同方式获得从同一受试者获得的不同样品。例如,第一样品可以通过活检获得,并且第二样品可以通过抽血获得。以不同方式获得的样品可以由不同医学专家使用不同技术在不同时间和/或在不同位置获得。可以从身体的不同区域获得从同一受试者获得的不同样品。例如,可以从身体的第一区域(例如,第一组织)获得第一样品,并且可以从身体的第二区域(例如,第二组织)获得第二样品。
391.如本文所使用的生物样品(例如,包括一个或多个核酸分子的生物样品)当在反应器皿中提供时可以不被纯化。此外,对于包括一个或多个核酸分子的生物样品,当将生物样品提供到反应器皿时,所述一个或多个核酸分子可以不被提取。例如,当将生物样品提供到反应器皿中时,可以不从生物样品中提取生物样品的核糖核酸(rna)和/或脱氧核糖核酸
(dna)分子。此外,当将生物样品提供到反应器皿中时,生物样品中存在的靶核酸(例如,靶rna或靶dna分子)可以不被浓缩。可替代地,可以纯化生物样品和/或可以从生物样品中的其它材料中分离核酸分子。
392.如本文所描述的生物样品可以包括靶核酸。如本文所使用的,术语“模板核酸”、“靶核酸”、“核酸分子”、“核酸序列”、“核酸片段”、“寡核苷酸”、“多核苷酸”和“核酸”通常是指任何长度的核苷酸的聚合形式,如脱氧核苷酸(dntp)或核糖核苷酸(rntp)或其类似物,并且可以可互换地使用。核酸可以具有任何三维结构,并且可以执行任何已知或未知的功能。核酸分子的长度可以为至少约10个核酸碱基(“碱基”)、20个碱基、30个碱基、40个碱基、50个碱基、100个碱基、200个碱基、300个碱基、400个碱基、500个碱基、1千碱基(kb)、2kb、3kb、4kb、5kb、10kb、50kb或更多。寡核苷酸通常由四种核苷酸碱基的特定序列构成:腺嘌呤(a);胞嘧啶(c);鸟嘌呤(g);和胸腺嘧啶(t)(当多核苷酸是rna时,尿嘧啶(u)代替胸腺嘧啶(t))。寡核苷酸可以包括一种或多种非标准核苷酸、核苷酸类似物和/或经修饰的核苷酸。核酸的非限制性实例包括dna、rna、基因组dna(例如,gdna,如剪切gdna)、无细胞dna(例如,cfdna)、合成dna/rna、基因或基因片段的编码或非编码区、由连锁分析定义的基因座(loci/locus)、外显子、内含子、信使rna(mrna)、转移rna、核糖体rna、短干扰rna(sirna)、短发夹rna(shrna)、微小rna(mirna)、核酶、互补dna(cdna)、重组核酸、分支核酸、质粒、载体、任何序列的分离的dna、任何序列的分离的rna、核酸探针和引物。核酸可以包括一个或多个经修饰的核苷酸,如甲基化核苷酸和核苷酸类似物。如果存在,对核苷酸结构的修饰可以在核酸组装之前或之后进行。核酸的核苷酸序列可以间杂有非核苷酸组分。核酸可以在聚合后进一步修饰,如通过与报告剂缀合或结合。
393.如本文所描述的靶核酸或样品靶核酸可以扩增以产生经扩增的产物。靶核酸可以是靶rna或靶dna。当靶核酸是靶rna时,靶rna可以是任何类型的rna,包括本文其它地方所描述的rna类型。靶rna可以是病毒rna和/或肿瘤rna。病毒rna可能对受试者而言是病原性的。病原性病毒rna的非限制性实例包括人免疫缺陷病毒i(hiv i)、人免疫缺陷病毒n(hiv 11)、正粘病毒、埃博拉病毒(ebola virus)、登革热病毒(dengue virus)、流感病毒(例如,h1n1、h3n2、h7n9或h5n1)、疱疹病毒、甲型肝炎病毒、乙型肝炎病毒、丙型肝炎病毒(例如,装甲rna-hcv病毒)、丁型肝炎病毒、戊型肝炎病毒、庚型肝炎病毒、爱泼斯坦-巴尔病毒(epstein-barr virus)、单核细胞增多症病毒、巨细胞病毒、sars病毒、西尼罗河热病毒(west nile fever virus)、脊髓灰质炎病毒和麻疹病毒。
394.生物样品可以包括多个靶核酸分子。例如,生物样品可以包括来自单个受试者的多个靶核酸分子。在另一个实例中,生物样品可以包括来自第一受试者的第一靶核酸分子和来自第二受试者的第二靶核酸分子。
395.如本文所使用的,“双链”分子是包括双链核酸分子区的分子。在一些实施方式中,双链被定义为100%双链的分子。在一些实施方式中,双链被定义为至少50%、55%、60%、65%、70%、75%、80%、85%、90%、92%、95%、97%、99%或100%双链的分子。每种可能性都表示本发明的单独实施方式。在一些实施方式中,双链分子包括长度为至少1个、2个、3个、4个、5个、6个、7个、8个、9个、10个、12个、14个、15个、16个、18个、20个、25个、30个、35个、40个、45个或50个碱基的双链核苷酸区。每种可能性都表示本发明的单独实施方式。在一些实施方式中,双链分子包括单链突出端。在一些实施方式中,突出端的长度为不超过1个、2
个、3个、4个、5个、6个、7个、8个、9个、10个、11个、12个、13个、14个、15个、16个、17个、18个、19个或20个碱基。每种可能性都表示本发明的单独实施方式。在一些实施方式中,突出端的长度为至少5个、6个、7个、8个、9个、10个、11个、12个、13个、14个、15个、16个、17个、18个、19个或20个碱基。每种可能性都表示本发明的单独实施方式。
396.如本文所使用的,术语“核苷酸”通常是指包括碱基(例如,核苷碱基)、糖部分和磷酸基部分的物质。核苷酸可以包括具有附接的磷酸基团的游离碱基。包括具有三个附接的磷酸基团的碱基的物质可以被称为核苷三磷酸。当核苷酸添加到生长的核酸分子链中时,核苷酸的近端磷酸基与生长链之间的磷酸二酯键的形成可能伴随高能量磷酸键的水解,释放两个远端磷酸基作为焦磷酸盐。所述核苷酸可以是天然存在或非天然存在的(例如,经修饰的或工程化的核苷酸)。
397.如本文所使用的,术语“核苷酸类似物”可以包括但不限于核苷酸,所述核苷酸可以是或可以不是天然存在的核苷酸。例如,核苷酸类似物可以源自和/或包括与典型核苷酸,如包括腺嘌呤(a)、胸腺嘧啶(t)、胞嘧啶(c)、尿嘧啶(u)或鸟嘌呤(g)的核苷酸的结构类似处。核苷酸类似物可以包括相对于天然核苷酸的一个或多个差异或修饰。核苷酸类似物的实例包括肌苷、二氨基嘌呤、5-氟尿嘧啶、5-溴尿嘧啶、5-氯尿嘧啶、5-碘尿嘧啶、次黄嘌呤、黄嘌呤、脱氮黄嘌呤、脱氮鸟嘌呤、异胞嘧啶、异鸟嘌呤、4-乙酰基胞嘧啶、5-(羧基羟甲基)尿嘧啶、5-羧甲基氨基甲基-2-硫尿苷、5-羧甲基氨基甲基尿嘧啶、二氢尿嘧啶、β-d-半乳糖基辫苷、n6-异戊烯基腺嘌呤、1-甲基鸟嘌呤、1-甲基肌苷、2,2-二甲基鸟嘌呤、2-甲基腺嘌呤、2-甲基鸟嘌呤、3-甲基胞嘧啶、5-甲基胞嘧啶、n6-腺嘌呤、7-甲基鸟嘌呤、5-甲基氨基甲基尿嘧啶、5-甲氧基氨基甲基-2-硫尿嘧啶、β-d-甘露糖基辫苷、5'-甲氧基羧甲基尿嘧啶、5-甲氧基尿嘧啶、2-甲硫基-d46-异戊烯基腺嘌呤、尿嘧啶-5-氧基乙酸(v)、怀丁氧苷(wybutoxosine)、假尿嘧啶、辫苷、2-巯基胞嘧啶、5-甲基-2-硫尿嘧啶、2-硫尿嘧啶、4-硫尿嘧啶、5-甲基尿嘧啶、尿嘧啶-5-氧基乙酸甲酯、尿嘧啶-5-氧基乙酸(v)、5-甲基-2-硫尿嘧啶、3-(3-氨基-3-n-2-羧丙基)尿嘧啶、(acp3)w、2,6-二氨基嘌呤、乙炔基核苷酸碱基、1-丙炔基核苷酸碱基、叠氮基核苷酸碱基、硒代磷酸酯核酸以及其经修饰的版本(例如,通过氧化、还原和/或加入取代基,如烷基、羟烷基、羟基或卤素部分)。核酸分子(例如,多核苷酸、双链核酸分子、单链核酸分子、引物、衔接子等)可以在碱基部分(例如,在一个或多个通常可用于与互补核苷酸形成氢键的原子处和/或在一个或多个通常不能够与互补核苷酸形成氢键的原子处)、糖部分或磷酸基骨架处进行修饰。在一些情况下,核苷酸可以包括其磷酸基部分中的修饰,所述修饰包括对三磷酸基部分的修饰。修饰的额外的非限制性实例包括更长长度的磷酸链(例如,具有4个、5个、6个、7个、8个、9个、10个或更多个磷酸盐部分的磷酸链)、用硫醇部分进行的修饰(例如,α-硫代三磷酸基和β-硫代三磷酸基)和用硒部分进行的修饰(例如,硒代磷酸核酸)。核苷酸或核苷酸类似物可以包括选自由以下组成的组的糖:核糖、脱氧核糖以及其经修饰的版本(例如,通过氧化、还原和/或加入取代基,如烷基、羟烷基、羟基或卤素部分)。核苷酸类似物还可以包括经修饰的连接子部分(例如,代替磷酸基部分)。核苷酸类似物还可以包括胺修饰的基团,如氨基烯丙基-dutp(aa-dutp)和氨基己基丙烯酰胺-dctp(aha-dctp)以允许胺反应性部分(如n-羟基琥珀酰亚胺酯(nhs))的共价连接。本公开的寡核苷酸中的标准dna碱基对或rna碱基对的替代物可以提供例如以每立方毫米比特为单位的更高密度、更高的安全性(对天然毒素的偶然或有目的合成具有抗性)、更容
易辨别光编程聚合酶和/或更低的二级结构。核苷酸类似物还能够与可检测部分反应或键合以进行核苷酸检测。可切割碱基的类似物可以是碱基的不可切割替代物。例如,胸腺嘧啶是尿嘧啶的不可切割类似物,并且腺嘌呤是肌苷的不可切割类似物。
398.如本文所使用的,术语“均聚物”通常是指包括相同单体单元的聚合物或聚合物的一部分。均聚物可以具有均聚物序列。核酸均聚物可以是指包括相同核苷酸或其任何核苷酸变体的连续重复的多核苷酸或寡核苷酸。例如,均聚物可以是poly(da)、poly(dt)、poly(dg)、poly(dc)、poly(ra)、poly(u)、poly(rg)或poly(rc)。均聚物可以具有任何长度。例如,均聚物的长度可以为至少2个、3个、4个、5个、10个、20个、30个、40个、50个、100个、200个、300个、400个、500个或更多个核酸碱基。每种可能性都表示本发明的单独实施方式。均聚物可以具有10个至500个、或15个至200个或20个至150个核酸碱基。每种可能性都表示本发明的单独实施方式。均聚物的长度可以为至多500个、400个、300个、200个、100个、50个、40个、30个、20个、10个、5个、4个、3个或2个核酸碱基。每种可能性都表示本发明的单独实施方式。分子(如核酸分子)可以包括一个或多个均聚物部分和一个或多个非均聚物部分。分子可以完全由均聚物、多种均聚物或均聚物和非均聚物的组合形成。在核酸测序中,多个核苷酸可以并入到核酸链的均聚区中。此类核苷酸可以是未封端的以允许并入连续核苷酸(例如,在单个核苷酸流动期间)。
399.术语“扩增(amplifying)”、“扩增(amplification)”和“核酸扩增”可互换使用并且如本文所使用通常是指产生核酸分子的拷贝。例如,dna的“扩增”通常是指产生dna分子的一个或多个拷贝。在一些实施方式中,扩增是克隆扩增。扩增子可以是从起始模板核酸分子通过扩增程序产生的单链或双链核酸分子。此类扩增程序可以包括延伸或连接程序的一个或多个循环。扩增子可以包括核酸链,所述核酸链的至少一部分可以与起始模板的至少一部分基本上相同或基本上互补。在起始模板是双链核酸分子的情况下,扩增子可以包括与一条链的至少一部分基本上相同并且与另一条链的至少一部分基本上互补的核酸链。扩增子可以是单链或双链的,无论初始模板是单链的还是双链的。核酸的扩增可以是线性的、指数的或其组合。扩增可以是基于乳液的或者可以是基于非乳液的。核酸扩增方法的非限制性实例包括逆转录、引物延伸、聚合酶链反应(pcr)、连接酶链反应(lcr)、解旋酶依赖性扩增、不对称扩增、滚动循环扩增和多重置换扩增(mda)。扩增反应可以是例如聚合酶链反应(pcr),如乳液聚合酶链反应(empcr,例如在微反应器,如孔或液滴内进行的pcr)。在使用pcr的情况下,可以使用任何形式的pcr,非限制性实例包括实时pcr、等位基因特异性pcr、组装pcr、不对称pcr、数字pcr、乳液pcr、拨出式pcr、解旋酶依赖性pcr、嵌套pcr、热启动pcr、反向pcr、甲基化特异性pcr、微小引物pcr、多重pcr、嵌套pcr、重叠-延伸pcr、热不对称交错pcr和降落式pcr。此外,扩增可以在包括参与或促进扩增的各种组分(例如,引物、模板、核苷酸、聚合酶、缓冲组分、辅助因子等)的反应混合物中进行。在一些情况下,反应混合物包括允许不依赖背景并入核苷酸的缓冲液。非限制性实例包括镁离子、锰离子和异柠檬酸缓冲液。在tabor,s.等人c.c.《美国国家科学院院刊(pnas)》,1989,86,4076-4080和美国专利第5,409,811号和第5,674,716号中描述了此类缓冲液的额外的实例,所述文献中的每个文献以全文引用的方式并入本文。
400.扩增可以是克隆扩增。如本文所使用的,术语“克隆”通常是指核酸群体,其成员的大部分(例如,大于50%、60%、70%、80%、90%、95%或99%)具有基本上相同的序列(例
如,具有彼此至少约50%、60%、70%、80%、90%、95%或99%相同的序列)。核酸分子的克隆群体中的成员彼此可以具有序列同源性。此类成员可以与模板核酸分子具有序列同源性。在一些情况下,此类成员可以与模板核酸分子的互补序列(例如,如果是单链的话)具有序列同源性。克隆群体中的成员可以是双链的或单链的。群体中的成员可以不是100%相同或互补的,因为例如在合成过程期间可能发生“错误”,使得给定群体的少数可能与群体的大多数不具有序列同源性。例如,群体中的成员的至少50%可以彼此基本上相同或与参考核酸分子(即,用作序列比较基础的定义序列的分子)基本上相同。群体中的成员的至少60%、至少70%、至少80%、至少90%、至少95%、至少99%或更多可以与参考核酸分子基本上相同。如果两个分子之间的同一性百分比为至少60%、70%、75%、80%、85%、90%、95%、98%、99%、99.9%或更大,那么两个分子可以被认为基本上相同(或同源)。如果两个分子之间的互补性百分比为至少60%、70%、75%、80%、85%、90%、95%、98%、99%、99.9%或更大,那么两个分子可以被认为基本上互补。可能存在较低或较少水平的非同源核酸混合,并且因此克隆群体可能包括少量不同核酸(例如少于30%,例如少于10%)。
401.用于来自单分子的克隆扩增的有用方法包括滚动循环扩增(rca)(lizardi等人,《自然遗传学(nat.genet.)》19:225-232(1998),所述文献通过引用并入本文)、桥接pcr(adams和kron,用于用与单个固相支持物结合的两个引物执行核酸扩增的方法(method for performing amplification of nucleic acid with two primers bound to a single solid support),马赛克科技公司(mosaic technologies,inc.)(马萨诸塞州冷冬山(winter hill,mass.);马萨诸塞州剑桥怀特黑德生物医学研究所(whitehead institute for biomedical research,cambridge,mass.),(1997);adessi等人,《核酸研究(nucl.acids res.)》28:e87(2000);pemov等人,《核酸研究》33:e11(2005);或美国专利第5,641,658号,所述文献中的每个文献通过引用并入本文)、聚合酶克隆产生(polony generation)(mitra等人,《美国国家科学院院刊》100:5926-5931(2003);mitra等人,《分析生物化学(anal.biochem.)》320:55-65(2003),所述文献中的每个文献通过引用并入本文)以及使用乳液对珠进行克隆扩增(dressman等人,《美国国家科学院院刊》100:8817-8822(2003),所述文献通过引用并入本文)或与基于珠的衔接子文库进行连接(brenner等人,自然生物技术《nat.biotechnol.》18:730-634(2000);brenner等人,《美国国家科学院院刊》97:1665-1670(2000));reinartz等人,《功能基因组蛋白组学简介(brief funct.genomic proteomic)》1:95-104(2002),所述文献中的每个文献通过引用并入本文)。通过克隆扩增所提供的增强的信噪比超过了循环测序要求的缺点。
402.如本文所使用的,术语“催化聚合的酶(polymerizing enzyme)”或“聚合酶(polymerase)”通常是指任何能够催化聚合反应的酶。聚合酶可以用于通过并入核苷酸或核苷酸类似物来延伸与模板链配对的核酸引物。聚合酶可以通过延伸现有核苷酸链的3'末端,通过创建磷酸二酯键来一次添加一个与模板链匹配的新核苷酸来添加dna新链。本文所使用的聚合酶可以具有链置换活性或非链置换活性。聚合酶的实例包括但不限于核酸聚合酶。示例聚合酶是φ29dna聚合酶或其衍生物。聚合酶(polymerase)可以是聚合物酶(polymerization enzyme)。在一些情况下,使用了转录酶或连接酶(即,催化键形成的酶)。聚合酶可以是天然存在的或合成的。聚合酶可以具有相对高持续合成能力,即聚合酶在不释放核酸模板的情况下将核苷酸连续地并入到核酸模板中的能力。聚合酶的实例包括但不
限于dna聚合酶、rna聚合酶、热稳定聚合酶、野生型聚合酶、经修饰的聚合酶、大肠杆菌dna聚合酶i(e.coli dna polymerase i)、t7 dna聚合酶、噬菌体t4 dna聚合酶、φ29(phi29)dna聚合酶、taq聚合酶、tth聚合酶、tli聚合酶、pfu聚合酶、pwo聚合酶、vent聚合酶、deepvent聚合酶、extaq聚合酶、la-taq聚合酶、sso聚合酶、poc聚合酶、pab聚合酶、mth聚合酶、es4聚合酶、tru聚合酶、tac聚合酶、tne聚合酶、tma聚合酶、tea聚合酶、tih聚合酶、tfi聚合酶、铂taq聚合酶、tbr聚合酶、tfl聚合酶、pfu-turbo聚合酶、pyrobest聚合酶、pwo聚合酶、kod聚合酶、bst聚合酶、sac聚合酶、克列诺片段(klenow fragment)、具有3'至5'核酸外切酶活性的聚合酶以及其变体、经修饰的产物和衍生物。聚合酶可以是单个亚基聚合酶。聚合酶可以具有高持续合成能力,即聚合酶在不释放核酸模板的情况下将核苷酸连续地并入到核酸模板中的能力。在一些情况下,聚合酶是被修饰以接受双脱氧核苷酸三磷酸的聚合酶,例如具有667y突变的taq聚合酶(参见例如tabor等人,《美国国家科学院院刊》,1995,92,6339-6343,所述文献出于所有目的以全文引用的方式并入本文)。在一些情况下,聚合酶是具有经修饰的核苷酸结合的聚合酶,所述聚合酶可以用于核酸测序,非限制性实例包括thermosequenas聚合酶(通用电气生命科学公司(ge life sciences))、amplitaq fs(赛默飞世尔公司(thermofisher))聚合酶和测序pol聚合酶(耶拿生物科学公司(jena bioscience))。在一些情况下,聚合酶被基因工程化以具有对双脱氧核苷酸的辨别,例如测序酶dna聚合酶(赛默飞世尔公司)。在一些实施方式中,聚合酶是链置换聚合酶。在一些实施方式中,聚合酶(polymerase)是聚合酶(polymerase enzyme)。
403.聚合酶可以是a族聚合酶或b族dna聚合酶。a族聚合酶包括例如taq、克列诺和bst聚合酶。b族聚合酶包括例如vent聚合酶(exo-)和therminator聚合酶。b族聚合酶已知比a族聚合酶接受更多不同的核苷酸底物。a族聚合酶广泛用于通过合成方法进行测序,可能是因为其高持续合成能力和保真度。
404.如本文所使用的,术语“互补序列”通常是指与另一序列杂交的序列。两个单链核酸分子之间的杂交可以涉及形成在某些条件下稳定的双链结构。如果两个单链多核苷酸通过两个或更多个顺序相邻的碱基配对彼此键合,那么可以认为这两个单链多核苷酸杂交。双链结构的一条链中的很大比例的核苷酸可能经受与另一链上的核苷的沃森-克里克碱基配对(watson-crick base-pairing)。杂交还可以包括核苷类似物的配对,如脱氧肌苷、具有2-氨基嘌呤碱基的核苷等,所述配对可以用于减少探针的简并性,无论此类配对是否涉及氢键的形成。
405.如本文所使用的,术语“变性”通常是指将双链分子(例如,dna)分离成单链分子。变性可以是完全变性或部分变性。在部分变性中,通过使脱氧核糖核酸(dna)中侧接有双链区的两条dna链变性,可以在双链分子中形成单链区。变性可以通过本领域已知的任何方法实现,包括例如通过加热或加入氢氧化钠。
406.如本文所使用的,术语“解链温度”或“解链点”通常是指样品中的核酸分子的链的至少一部分与互补链的至少一部分分离的温度。解链温度可以是双链核酸分子部分变性或完全变性的温度。解链温度可以指代给定核酸分子的多个序列中的序列的温度或所述多个序列的温度。双链核酸分子的不同区可以具有不同解链温度。例如,双链核酸分子可以包括具有第一解链点的第一区和具有比第一解链点更高的第二解链点的第二区。因此,双链核酸分子的不同区可以在不同温度下解链(例如,部分变性)。核酸分子或其区(例如,核酸序
列)的解链点可以通过实验确定(例如,通过解链分析或其它程序)或可以基于核酸分子的序列和长度估计。例如,如melting等软件程序可以用于估计核酸序列的解链温度(dumousseau m,rodriguez n,juty n,le nov
è
re n,“melting,用于预测核酸解链温度的灵活平台(melting,a flexible platform to predict the melting temperatures of nucleic acids)”《bmc生物信息学(bmc bioinformatics)》2012年5月16日;13:101.doi:10.1186/1471-2105-13-101)。因此,如本文所描述的解链点可以是估计的解链点。核酸序列的真实解链点可以基于与所关注的核酸序列相邻的序列或其缺乏以及其它因素而变化。
407.如本文所使用的,术语“测序”通常是指用于产生或鉴定生物分子(如核酸分子或多肽)的序列的方法。此类序列可以是核酸序列,所述核酸序列可以包括核酸碱基(例如,核苷碱基)的序列。测序可以是例如单分子测序、合成测序、杂交测序或连接测序。测序可以使用固定在支持物上(如流动池或一个或多个珠上)的模板核酸分子进行。测序测定可以产生对应于一个或多个模板核酸分子的一个或多个测序读段。
408.如本文所使用的,术语“读段”通常是指核酸序列,如测序读段。测序读段可以是通过核酸测序测定获得的核酸碱基(例如,核苷酸)或碱基对的推断序列。测序读段可以由核酸测序器产生,如大规模并行阵列测序器(例如,加利福尼亚州的因美纳(illumina)或太平洋生物科学公司(pacific biosciences))。测序读段可以对应于受试者的基因组的一部分,或者在一些情况下基因组的全部。测序读段可以是测序读段集合的一部分,所述序列读段可以通过例如比对(例如,与参考基因组比对)来组合以产生受试者的基因组序列。
409.如本文所使用的,术语“检测器”通常是指能够检测或测量信号(如指示存在或不存在并入的核苷酸或核苷酸类似物的信号)的装置。检测器可以包括可以检测和/或测量信号的光学组件和/或电子组件。涉及检测器的检测方法的非限制性实例包括光学检测、光谱检测、静电检测和电化学检测。光学检测方法包括但不限于荧光测定法和紫外-可见光吸光度。光谱检测方法包括但不限于质谱法、核磁共振(nmr)光谱法和红外光谱法。静电检测方法包括但不限于基于凝胶的技术,例如,凝胶电泳。电化学检测方法包括但不限于在高效液相色谱法分离经扩增的产物之后对经扩增的产物进行电化学检测。
410.如本文所使用的,术语“支持物”或“底物”通常是指如核酸分子等试剂可以固定在上面的任何固体或半固体制品。核酸分子可以被合成、附接、连接或以其它方式固定。可以通过任何方法将核酸分子固定在底物上,所述方法包括但不限于物理吸附、通过离子或共价键形成或其组合。底物可以是2维的(例如,平面的2d底物)或3维的。在一些情况下,底物可以是流动池的组分和/或可以包括在测序仪器内或适于被测序仪器接收。底物可以包括聚合物、玻璃或金属材料。底物的实例包括膜、平面底物、微量滴定板、珠(例如,磁珠)、过滤器、测试条、载玻片、盖玻片和试管。底物可以包括有机聚合物,如聚苯乙烯、聚乙烯、聚丙烯、聚氟乙烯、聚乙烯氧基和聚丙烯酰胺(例如,聚丙烯酰胺凝胶)以及其共聚物和移植物。底物可以包括乳胶或葡聚糖。底物可以是无机的,如玻璃、二氧化硅、金、受控孔玻璃(cpg)或反相二氧化硅。支持物的构型可以例如呈珠、球、颗粒、微粒、凝胶、多孔基质或底物的形式。在一些情况下,底物可以是单个固体或半固体制品(例如,单个颗粒),而在其它情况下,底物可以包括多个固体或半固体制品(例如,颗粒集合)。底物可以是平面的、基本上平面的或非平面的。底物可以是多孔的或非多孔的,并且可以具有溶胀或非溶胀特性。底物可以成形以包括一个或多个孔、凹陷或其它容器、器皿、特征或位置。可以在各个位置处将多个底
物配置成阵列。底物可以是可寻址的(例如用于机器人递送试剂)或通过检测方法,如通过激光照明和共焦或偏光聚焦进行扫描。例如,底物可以与检测器进行光学和/或物理通信。可替代地,底物可以与检测器在物理上分隔一定距离。可以将扩增底物(例如,珠)放置在另一底物内或另一底物上(例如,第二支持物的孔内)。在一些实施方式中,支持物是人造支持物。在一些实施方式中,支持物是非有机支持物。在一些实施方式中,支持物是珠。
411.术语“固相支持物”是指任何人造固体结构,包括任何固相支持物或底物。固相支持物的实例包括但不限于珠、树脂、凝胶、水凝胶、胶体、颗粒或纳米颗粒。例如,固相支持物可以是珠。可替代地,所述固相支持物可以是表面。例如,固相支持物可以包括与表面偶联的珠。可替代地,所述固相支持物可以是树脂。所述固相支持物可以是可分离的。所述固相支持物可以是标记的。所述固相支持物可以是磁性的,并且可用磁体分离。可替代地或另外地,所述固相支持物可以通过离心或通过重量、大小或一些其它可测量的量分离的一些其它力来分离。
412.支持物(例如,固相支持物)可以是或包括颗粒。颗粒可以是珠。珠可以包括任何合适的材料,如玻璃或陶瓷、一种或多种聚合物和/或金属。合适的聚合物的实例包括但不限于尼龙、聚四氟乙烯、聚苯乙烯、聚丙烯酰胺、琼脂糖、纤维素、纤维素衍生物或葡聚糖。合适的金属的实例包括顺磁性金属,如铁。珠可以是磁性的或非磁性的。在一些实施方式中,珠是磁性的。例如,珠可以包括一种或多种带有一个或多个磁性标记的聚合物。磁珠可以使用电磁力进行操纵(例如,在位置之间移动或物理约束到给定位置,例如,如流动池室等反应器皿的给定位置)。珠可以具有任何有用的形状,包括例如近似立方体、球形、椭圆形、哑铃形或任何其它形状的形状。例如,珠的形状可以为近似球形的。珠可以具有一个或多个不同的尺寸,包括直径。珠的尺寸(例如,珠的直径)可以小于约1mm、小于约0.1mm、小于约0.01mm、小于约0.005mm、小于约1nm、小于约1μm或更小。珠的尺寸(例如,珠的直径)可以介于约1nm至约100nm之间、介于约1μm至约100μm之间、介于约1mm至约100mm之间。珠集合可以包括一个或多个具有相同或不同特性的珠。例如,珠集合中的第一珠可以具有第一直径,并且珠集合中的第二珠可以具有第二直径。第一直径可以与第二直径相同或大约相同或不同。类似地,第一珠可以具有与第二珠相同或不同的形状和组成。
413.如本文所使用的,术语“标记”通常是指能够与物种偶联的部分,例如核苷酸类似物。标记可以包括亲和力部分。在一些情况下,标记可以是发出可以检测到的信号(或减少已经发出的信号)的可检测标记。在一些情况下,此类信号可以表明并入一种或多种核苷酸或核苷酸类似物。在一些情况下,标记可以与核苷酸或核苷酸类似物偶联,所述核苷酸或核苷酸类似物可以用于引物延伸反应。在一些情况下,在引物延伸反应后,所述标记可以与核苷酸类似物偶联。在一些情况下,所述标记可以与核苷酸或核苷酸类似物进行特异性反应。偶联可以是共价的或非共价的(例如,通过离子相互作用、范德华力(van der waals force)等)。在一些情况下,可以通过连接子进行偶联,所述连接子可以是可切割的,如光可切割的(例如,在紫外光下可切割)、化学可切割的(例如,通过还原剂,如二硫苏糖醇(dtt)、三(2-羧乙基)膦(tcep)、三(羟丙基)膦(thp))或酶可切割的(例如,通过酯酶、脂肪酶、肽酶或蛋白酶)。在一些情况下,所述标记可以是发光的;即荧光的或磷光的。例如,所述标记可以是或包括荧光部分(例如,染料)。染料和标记可以并入到核酸序列中。染料和标记还可以并入到连接子中,如用于将一个或多个珠彼此连接的连接子。例如,如荧光部分等标记可以
通过连接子与核苷酸或核苷酸类似物连接。染料的非限制性实例包括sybr绿、sybr蓝、dapi、碘化丙啶、赫斯特(hoechst)、sybr金、溴化乙锭、吖啶、普罗黄素、吖啶橙、吖啶黄、氟香豆素、玫瑰树碱、道诺霉素、氯喹、偏端菌素d、色霉素、乙菲啶(homidium)、光神霉素、钌多吡啶、氨茴霉素、菲啶和吖啶、碘化丙啶、碘化乙啶、二氢乙锭、乙锭同源二聚体-1和-2、单叠氮乙锭、acma、赫斯特33258、赫斯特33342、赫斯特34580、dapi、吖啶橙、7-aad、放线菌素d、lds751、羟脒芪(hydroxystilbamidine)、sytox蓝、sytox绿、sytox橙、popo-1、popo-3、yoyo-1、yoyo-3、toto-1、toto-3、jojo-1、lolo-1、bobo-1、bobo-3、po-pro-1、po-pro-3、bo-pro-1、bo-pro-3、to-pro-1、to-pro-3、to-pro-5、jo-pro-1、lo-pro-1、yo-pro-1、yo-pro-3、picogreen、oligreen、ribogreen、sybr金、sybr绿i、sybr绿ii、sybr dx、syto标记(例如,syto-40、-41、-42、-43、-44和-45(蓝色);syto-13、-16、-24、-21、-23、-12、-11、-20、-22、-15、-14和-25(绿色);syto-81、-80、-82、-83、-84和-85(橙色);以及syto-64、-17、-59、-61、-62、-60和-63(红色))、荧光素、荧光素异硫氰酸酯(fitc)、四甲基罗丹明异硫氰酸酯(tritc)、罗丹明、四甲基罗丹明、r-藻红蛋白、cy-2、cy-3、cy-3.5、cy-5、cy5.5、cy-7、德克萨斯红、phar-red、别藻蓝蛋白(apc)、sybr绿i、sybr绿ii、sybr金、celltracker绿、7-aad、乙锭同源二聚体i、乙锭同源二聚体ii、乙锭同源二聚体iii、溴化乙锭、伞形酮、曙红、绿色荧光蛋白、赤藓红、香豆素、甲基香豆素、芘、孔雀石绿、二苯乙烯、萤光黄、级联蓝、二氯三锌胺荧光素、丹磺酰氯、荧光镧系元素复合物,如包括铕和铽的荧光镧系元素复合物、羧基四氯荧光素、5和/或6-羧基荧光素(fam)、vic、5-(或6-)碘乙酰胺荧光素、5-{[2(和3)-5-(乙酰巯基)-琥珀酰]氨基}荧光素(samsa-荧光素)、丽丝胺罗丹明b磺酰氯、5和/或6羧基罗丹明(rox)、7-氨基-甲基-香豆素、7-氨基-4-甲基香豆素-3-乙酸(amca)、bodipy荧光团、8-甲氧基芘-1,3,6-三磺酸三钠盐、3,6-二磺酸-4-氨基-萘二甲酰亚胺、藻胆蛋白、alexafluor标记(例如,alexafluor 350、405、430、488、532、546、555、568、594、710、633、735、647、660、680、700、750和790染料)、dylight标记(例如,dylight350、405、488、550、594、633、650、680、755和800染料)、黑洞淬灭剂染料(生物搜索技术(biosearch technologies))(例如,bh1-0、bhq-1、bhq-3和bhq-10)、qsy染料荧光淬灭剂(分子探针公司(molecular probe)/英杰公司(invitrogen))(例如,qsy7、qsy9、qsy21和qsy35)、dabcyl、dabsyl、cy5q、cy7q、深花菁染料(通用医疗公司(ge healthcare))、dy-淬灭剂(dyomics)(例如,dyq-660和dyq-661)、atto荧光淬灭剂(atto-tec gmbh)(例如,atto 540q、atto 580q、atto 612q、atto532[例如,atto 532琥珀酰亚胺酯]和atto633)以及其它荧光团和/或淬灭剂。荧光染料可以通过施加对应于电磁光谱的可见区(例如,介于约430-770纳米(nm)之间)的能量来激发。激发可以使用任何有用的设备来完成,如激光和/或发光二极管。光学元件(包括但不限于反射镜、波片、滤光片、单色仪、光栅、分束器和透镜)可以用于将光引导到荧光染料或从荧光染料引导光。荧光染料可以在电磁光谱的可见区(例如,介于约430-770nm之间)发出光(例如,荧光)。荧光染料可以在单个波长或一系列波长上被激发。荧光染料可以被电磁光谱的可见部分的红色区(约725-740nm)中的光激发(例如,在电磁光谱的可见部分的红色区中具有最大激发)。可替代地或另外地,荧光染料可以被电磁光谱的可见部分的绿色区(约500-565nm)中的光激发(例如,在电磁光谱的可见部分的绿色区中具有最大激发)。荧光染料可以在电磁光谱的可见部分的红色区(约725-740nm)中发出信号(例如,在电磁光谱的可见部分的红色区中具有最大发出)。可替代地或另外地,荧光染料可以在电磁光谱的可见部分的
绿色区(约500-565nm)中发出信号(例如,在电磁光谱的可见部分的绿色区中具有最大发出)。
[0414]
标记可以是淬灭剂分子。如本文所使用的,术语“淬灭剂”是指可以是能量受体的分子。淬灭剂可以是可以减少发出的信号的分子。例如,模板核酸分子可以被设计成发出可检测信号。并入包括淬灭剂的核苷酸或核苷酸类似物可以减少或消除信号,然后检测到所述减少或消除。来自标记(例如,荧光部分,如与核苷酸或核苷酸类似物连接的荧光部分)的发光也可以被淬灭(例如,通过并入可以包括或可以不包括标记的其它核苷酸)。在一些情况下,如本文其它地方所描述的,用淬灭剂进行标记可以在并入核苷酸或核苷酸类似物之后发生。在一些情况下,标记可以是不自淬灭或不表现出接近淬灭的类型。不自淬灭或不表现出接近淬灭的标记类型的非限制性实例包括比曼(bimane)衍生物,如单溴二胺(monobromobimane)。如本文所使用的,术语“接近淬灭”通常是指彼此靠近的一种或多种染料相较于其单独表现的荧光可能表现出较低的荧光的现象。在一些情况下,染料可以经受接近淬灭,其中供体染料和受体染料彼此在1nm至50nm以内。淬灭剂的实例包括但不限于黑洞淬灭剂染料(生物搜索技术公司(biosearch technologies))(例如,bh1-0、bhq-1、bhq-3和bhq-10)、qsy染料荧光淬灭剂(分子探针公司(molecular probes)/英杰公司(invitrogen))(例如,qsy7、qsy9、qsy21和qsy35)、dabcyl、dabsyl、cy5q、cy7q、深花菁染料(通用电气医疗公司(ge healthcare))、dy-淬灭剂(dyomics)(例如,dyq-660和dyq-661)和atto荧光淬灭剂(atto-tec gmbh)(例如,atto 540q、atto 580q和atto 612q)。荧光团供体分子可以与淬灭剂结合使用。可以与淬灭剂结合使用的荧光团供体分子的实例包括但不限于荧光团,如cy3b、cy3或cy5;dy-淬灭剂(dyomics)(例如,dyq-660和dyq-661);以及atto荧光淬灭剂(atto-tec gmbh)(例如,atto 540q、580q和612q)。
[0415]
如本文所使用的,术语“引物”或“引物分子”通常是指与模板核酸分子的一部分互补的多核苷酸。例如,引物可以与模板核酸分子的链的一部分互补。引物可以是核酸的链,所述链用作核酸合成的起始点,如引物延伸反应,所述引物延伸反应可以是核酸反应(例如,核酸扩增反应,如pcr)的组成。引物可以与模板链杂交,并且然后可以将核苷酸(例如,典型核苷酸或核苷酸类似物)添加到引物的末端,有时借助于催化聚合的酶(polymerizing enzyme),如聚合酶(polymerase)。因此,在dna样品的复制期间,催化复制的酶可以在附接到dna样品的引物的3'末端处开始复制并复制相反的链。引物(例如,寡核苷酸)可以具有一个或多个官能团,所述一个或多个官能团可以用于使引物与支持物或载体,如珠或颗粒偶联。在一些实施方式中,引物是寡核苷酸。在一些实施方式中,引物包括至少5个、8个、10个、12个、14个、15个、16个、18个、20个、21个、22个、23个、24个或25个碱基。每种可能性都表示本发明的单独实施方式。在一些实施方式中,引物包括至多15个、20个、25个、30个、35个、40个、45个、50个、60个、70个、75个、80个、90个或100个碱基。每种可能性都表示本发明的单独实施方式。
[0416]
引物可以完全或部分地与模板核酸互补。引物可以表现出与模板核酸的序列同一性或同源性或互补性。引物与模板核酸之间的同源性或序列同一性或互补性可以基于引物的长度。例如,如果引物长度为约20个核酸,则可以包括10个或更多个与模板核酸互补的连续核酸碱基。在一些实施方式中,引物包括非互补区。在一些实施方式中,所述非互补区是5'区。在一些实施方式中,所述非互补区是引物的至多10%、15%、20%、25%、30%、35%、
40%、45%、50%、55%、60%、65%、70%或75%。每种可能性都表示本发明的单独实施方式。在一些实施方式中,所述非互补区的长度为至多1个、2个、3个、5个、7个、10个、12个、15个、17个、18个、20个、25个或30个碱基。每种可能性都表示本发明的单独实施方式。
[0417]
所述引物与模板核酸之间的互补性或同源性或序列同一性可能受到限制。所述引物的长度可以介于8个核苷酸碱基至50个核苷酸碱基之间。所述引物的长度可以是多于2个核苷酸碱基、多于3个核苷酸碱基、4个核苷酸碱基、5个核苷酸碱基、6个核苷酸碱基、7个核苷酸碱基、8个核苷酸碱基、9个核苷酸碱基、10个核苷酸碱基、11个核苷酸碱基、12个核苷酸碱基、13个核苷酸碱基、14个核苷酸碱基、15个核苷酸碱基、16个核苷酸碱基、17个核苷酸碱基、18个核苷酸碱基、19个核苷酸碱基、20个核苷酸碱基、21个核苷酸碱基、22个核苷酸碱基、23个核苷酸碱基、24个核苷酸碱基、25个核苷酸碱基、26个核苷酸碱基、27个核苷酸碱基、28个核苷酸碱基、29个核苷酸碱基、30个核苷酸碱基、31个核苷酸碱基、32个核苷酸碱基、33个核苷酸碱基、34个核苷酸碱基、35个核苷酸碱基、37个核苷酸碱基、40个核苷酸碱基、42个核苷酸碱基、45个核苷酸碱基、47个核苷酸碱基或50个核苷酸碱基。引物的长度可以少于50个核苷酸碱基、47个核苷酸碱基、45个核苷酸碱基、42个核苷酸碱基、40个核苷酸碱基、37个核苷酸碱基、35个核苷酸碱基、34个核苷酸碱基、33个核苷酸碱基、32个核苷酸碱基、31个核苷酸碱基、30个核苷酸碱基、29个核苷酸碱基、28个核苷酸碱基、27个核苷酸碱基、26个核苷酸碱基、25个核苷酸碱基、24个核苷酸碱基、23个核苷酸碱基、22个核苷酸碱基、21个核苷酸碱基、20个核苷酸碱基、19个核苷酸碱基、18个核苷酸碱基、17个核苷酸碱基、16个核苷酸碱基、15个核苷酸碱基、14个核苷酸碱基、13个核苷酸碱基、12个核苷酸碱基、11个核苷酸碱基、10个核苷酸碱基、9个核苷酸碱基、8个核苷酸碱基、7个核苷酸碱基、6个核苷酸碱基、5个核苷酸碱基、4个核苷酸碱基、3个核苷酸碱基或2个核苷酸碱基。
[0418]
术语“序列同一性%”可以在本文中与术语“同一性%”可互换地使用,并且可以指当使用序列比对程序比对时,两个或更多个核苷酸序列之间的核苷酸序列同一性水平。如本文所使用的,80%同一性可以是与由定义的算法所测定的80%序列同一性相同的事物,并且意指给定序列与另一序列的另一长度至少80%相同。同一性%可以选自例如与给定序列至少60%、至少65%、至少70%、至少75%、至少80%、至少85%、至少90%、至少95%或至少99%或更多的序列同一性。同一性%可以在以下范围内,例如约60%至约70%、约70%至约80%、约80%至约85%、约85%至约90%、约90%至约95%或约95%至约99%。
[0419]
术语“序列同源性%”或“序列同源性百分比”或“序列同一性百分比”可以在本文中与术语“同源性%”、“序列同一性%”或“同一性%”可互换地使用,并且可以指当使用序列比对程序比对时,两个或更多个核苷酸序列之间的核苷酸序列同源性水平。例如,如本文所使用的,80%同源性可以是与由定义的算法测定的80%序列同源性相同的事物,并且因此给定序列的同源物在给定序列的长度上具有大于80%的序列同源性。同源性%可以选自例如与给定序列至少60%、至少65%、至少70%、至少75%、至少80%、至少85%、至少90%、至少95%或至少99%或更多的序列同源性。同源性%可以在以下范围内,例如约60%至约70%、约70%至约80%、约80%至约85%、约85%至约90%、约90%至约95%或约95%至约99%。
[0420]
如本文所使用的,术语“引物延伸”通常是指引物与模板核酸的链的结合,随后延长引物。其还可以包括双链核酸的变性以及引物链与一条或两条变性的模板核酸链的结
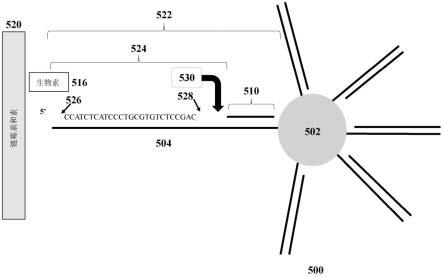
合,随后延长引物。引物延伸反应可以用于通过使用酶(例如,催化聚合的酶(polymerizing enzyme),如聚合酶(polymerase))以模板定向的方式将核苷酸或核苷酸类似物并入到引物。引物延伸反应可以是核酸扩增反应的过程。
[0421]
如本文所使用的,术语“衔接子(adapter)”或“衔接子(adaptor)”通常是指适于允许测序仪器对靶多核苷酸进行测序的分子(例如,多核苷酸),如通过与靶核酸分子相互作用以促进测序(例如,下一代测序(ngs))。所述测序衔接子可以允许通过测序仪器对靶核酸分子进行测序。例如,所述测序衔接子可以包括核苷酸序列,所述核苷酸序列与附接到如珠或流动池等测序系统的固相支持物的捕获多核苷酸杂交或结合。所述测序衔接子可以包括核苷酸序列,所述核苷酸序列与多核苷酸杂交或结合以产生发夹环,所述发夹环允许通过测序系统对靶多核苷酸进行测序。所述测序衔接子可以包括测序器基序,所述测序器基序可以是核苷酸序列,所述核苷酸序列与另一分子(例如,多核苷酸)的流动池序列互补,并且可由测序系统用于对靶多核苷酸进行测序。测序器基序还可以包括用于测序(如通过合成进行测序)的引物序列。测序器基序可以包含用于将库衔接子与测序系统偶联的序列,并对靶多核苷酸(例如,样品核酸)进行测序。
[0422]
如本文所描述的,衔接子可以具有第一子部分和第二子部分。所述第一子部分和第二子部分可以具有序列互补性。如本文所描述的衔接子可以是可用于产生双端序列读段的双端衔接子。衔接子可以包含条形码。
[0423]
如本文所使用的,术语“条形码”或“条形码序列”通常是指可以用于鉴定一种或多种特定核酸的一个或多个核苷酸序列(例如,基于其与特定样品的关联性、源自特定来源(如特定细胞)、包括在特定分区或其它区室中等)。条形码可以包括至少1个、2个、3个、4个、5个、6个、7个、8个、9个、10个、11个、12个、13个、14个、15个、16个、17个、18个、19个、20个或更多个核苷酸(例如,连续核苷酸)。每种可能性都表示本发明的单独实施所述。条形码可以包括至少约10个、约20个、约30个、约40个、约50个、约60个、约70个、约80个、约90个、约100个或更多个连续核苷酸。每种可能性都表示本发明的单独实施所述。用于扩增和/或测序过程(例如,ngs)的所有条形码可以不同。在包括条形码的核酸群体中不同条形码的多样性可以是随机产生的或非随机产生的。
[0424]
条形码可以包括一个或多个片段。例如,条形码可以包括具有第一核酸序列的第一区段和具有第二核酸序列的第二区段。所述第一核酸序列可以与所述第二核酸序列相同或不同。包括多个区段的条形码序列可以根据拆分池方案以组合方式组装,其中多个不同的第一区段分布在多个第一分区中,然后将所述多个第一分区的内容汇集并分布在多个第二分区中。然后将多个不同的第二区段分布在所述多个第二分区中,并与所述多个第二分区内的多个不同的第一区段连接,并且然后将所述多个第二分区的内容汇集。过程可以使用任意数量的不同区段和分区重复任意次数,以提供所需的条形码多样性水平。在一些情况下,条形码序列的第一区段可以与珠偶联。在一些实施方式中,所述条形码包含唯一分子标识符(umi)。在一些实施方式中,所述条形码的一部分是umi。在一些实施方式中,所述衔接子包含umi。
[0425]
如本文所描述的,条形码的使用可以允许使用下一代测序技术对多个样品进行高通量分析。包括多个核酸分子的样品可以分布遍及多个分区(例如,乳液中的液滴),其中每个分区包括包含唯一条形码序列的核酸条形码分子。样品可以被分区,使得所述多个分区
中的全部或大部分分区包括所述多个核酸分子中的至少一个核酸分子。然后,给定分区的核酸分子和核酸条形码分子可以用于产生核酸分子的至少一个序列的一个或多个拷贝和/或互补序列(例如,通过核酸扩增反应),所述拷贝和/或互补序列包括核酸条形码分子的条形码序列或其互补序列。然后可以将各个分区的内含物(例如,扩增产物或其衍生物)汇集并且经受测序。在一些情况下,核酸条形码分子可以与珠偶联。在此类情况下,拷贝和/或互补序列也可以与珠偶联。核酸条形码分子以及拷贝和/或互补序列可以从分区内的珠中释放出来,或者在汇集后释放,以促进使用测序仪器进行核酸测序。因为所述多个核酸分子中的核酸分子的拷贝和/或互补序列各自包括唯一条形码序列或其互补序列,所以使用核酸测序测定获得的测序读段可以与其所对应的多个核酸分子中的核酸分子相关联。此方法可以应用于包括在分裂在多个分区中的细胞内的核酸分子和/或源自多个不同样品的核酸分子。
[0426]
本公开提供了一种组合物,所述组合物包含与支持物(例如,固相支持物,如固体颗粒)连接的核酸分子(例如,双链核酸分子),所述核酸分子包括可切割或可切除碱基。本公开还提供了分离和/或富集核酸分子的方法以及对核酸分子进行测序的方法。
[0427]
富集
[0428]
本公开提供了一种组合物,所述组合物包含包括(例如,如本文所描述的)可切割或可切除部分的核酸分子(例如,双链核酸分子),所述核酸分子可以与支持物(例如,固相支持物)偶联。例如,核酸分子可以是双链核酸分子,所述双链核酸分子可以包括单链中的可切割或可切除部分。核酸分子还可以包括(例如,如本文所描述的)捕获实体或与所述捕获实体偶联。核酸分子可以是脱氧核糖核酸(dna)分子。可替代地,核酸分子可以是核糖核酸(rna)分子。核酸分子可以与支持物(如固相支持物)偶联。例如,核酸分子可以与颗粒(例如,珠)偶联。例如,核酸分子可以和与支持物偶联的颗粒(例如,珠)偶联。
[0429]
所述核酸分子可以是双链核酸分子。可替代地,所述核酸分子可以是单链核酸分子。可替代地,所述核酸分子可以包括核糖核酸(rna)。所述核酸分子可以包括脱氧核糖核酸(dna)。例如,所述核酸分子可以包括基因组dna或互补dna(cdna,如通过逆转录rna分子产生的dna)。所述核酸分子可以包括对应于(例如,如本文所描述的)生物样品的序列或其互补序列和/或衍生物。所述核酸分子可以是连接反应的产物。核所述酸分子可以是扩增反应,如pcr(例如,乳液pcr(epcr))的产物。
[0430]
所述核酸分子(例如,双链核酸分子)可以包括在溶液中。例如,所述核酸分子可以浸入在溶液中。所述溶液可以包括多个核酸分子,如多个双链核酸分子或多个单链核酸分子。溶液中的多个核酸分子可以包含共同的核酸序列。例如,溶液中的多个核酸分子可以包含相同的衔接子序列。可替代地或另外地,溶液中的多个核酸分子可以包含可以源自样品的相同序列(例如,模板序列)。例如,溶液中的多个核酸分子可以是核酸分子的克隆群体。
[0431]
所述溶液可以包括一种或多种试剂,包括一种或多种引物、衔接子、酶(例如,连接酶、聚合酶、转录酶、逆转录酶、糖基化酶、核酸内切酶等)、核苷酸(例如,脱氧核糖核苷酸或核糖核苷酸,如脱氧核糖核苷三磷酸或核糖核苷三磷酸)、离子(例如,钙离子、锶离子、镁离子等)、缓冲液或其它试剂。所述溶液可以包括缓冲液,如pcr缓冲液。所述溶液可以包括多个分区。例如,所述溶液可以包括多个液滴(例如,油中的水性液滴或水溶液中的油滴),如乳液中的多个液滴。可替代地,所述溶液可能缺乏分区。所述溶液可以包含多个支持物,如
多个颗粒。例如,所述溶液可以包括包含多个颗粒的多个液滴。所述多个颗粒可以包括与其偶联的多个核酸分子(例如,多个双链核酸分子或多个单链核酸分子)。
[0432]
所述核酸分子可以与支持物(如固相支持物)偶联。所述支持物可以包含与所述支持物偶联的多个核酸分子。例如,所述支持物可以包含与其偶联的多个核酸分子,其中所述多个核酸分子中的每个核酸分子包括共同的核酸序列。所述共同的核酸序列可以是引物或衔接子的序列。可替代地或另外地,所述共同的核酸序列可以源自样品(例如,模板序列)。例如,所述支持物可以包含与其偶联的核酸分子的克隆群体。
[0433]
所述核酸分子可以最初提供在溶液中,并且然后与支持物(例如,固相支持物)偶联(例如,固定)。例如,支持物可以包含包含与核酸分子至少部分互补的序列的衔接子或引物分子,并且在足以将核酸分子与支持物的衔接子或引物偶联的条件下,支持物可以接触包括核酸分子的溶液。例如,核酸分子可以与支持物的衔接子或引物杂交。核酸分子在与支持物的衔接子或引物偶联之前可以是单链核酸分子。在一个实例中,核酸分子是单链核酸分子,所述单链核酸分子包括与支持物的衔接子或引物至少部分互补的序列。在核酸分子与衔接子或引物杂交之后,衔接子或引物可以经历引物延伸过程以产生与核酸分子的单链区至少部分互补的第二链。
[0434]
可替代地,所述核酸分子是包含单链区的双链核酸分子。在一些实施方式中,所述单链区是单链突出端。在一些实施方式中,所述单链区位于双链分子的末端。在一些实施方式中,所述突出端是5'突出端。在一些实施方式中,所述突出端是3'突出端。在一些实施方式中,所述单链区(例如,突出端)包括与支持物的衔接子或引物至少部分互补的序列。在一些实施方式中,所述衔接子或引物在5'末端与支持物缀合,并且突出端是3'突出端。在双链核酸分子与衔接子或引物杂交后,衔接子或引物可以经历引物延伸过程以产生置换不包括突出端的双链分子的链的新链。在一些实施方式中,所述新链与核酸分子的单链区(例如,突出端)至少部分互补。可替代地,在杂交后,执行缺口填充反应以将衔接子或引物与不包括单链区的链连接。在一些实施方式中,缺口填充是连接。
[0435]
单链核酸分子或单链区的末端可以与支持物(例如,如本文所描述的固相支持物)偶联。所述单链核酸分子可以包括位于核酸分子的另一末端或靠近所述另一末端的(例如,如本文所描述的)捕获实体和/或可切割碱基。(例如,如本文所描述的)双链核酸分子可以包括位于核酸分子的另一末端(与单链区相对的末端)或靠近所述另一末端的捕获实体和/或可切割碱基。在一些实施方式中,所述捕获实体和/或可切割碱基位于双链分子的双链末端。双链核酸分子的单链的末端可以附接(例如,直接附接,如通过共价或非共价相互作用)到支持物。双链核酸分子的第二链可以被认为是通过附接(例如,直接附接)到支持物的第一链固定到支持物上。可替代地,双链分子的两条链的末端可以直接附接到支持物。支持物和捕获实体可以与双链核酸分子的不同链偶联。例如,双链核酸分子的第一链可以附接到支持物(例如,固相支持物),并且双链核酸分子的第二链可以包括捕获实体或与所述捕获实体偶联。可替代地,支持物和捕获实体可以与双链核酸分子的同一链偶联。例如,双链核酸分子的第一链可以附接到支持物(例如,固相支持物),并且第一链还可以包括捕获实体(例如,位于链的另一末端或靠近所述另一末端)或与所述捕获实体偶联。所述支持物和可切割或可切除部分可以与双链核酸分子的不同链偶联。例如,双链核酸分子的第一链可以附接到支持物(例如,固相支持物),并且双链核酸分子的第二链可以包括可切割或可切除
部分。可替代地,支持物和可切割或可切除部分可以与双链核酸分子的同一链偶联。例如,双链核酸分子的第一链可以附接到支持物(例如,固相支持物),并且第一链还可以包括可切割或可切除部分(例如,位于链的另一末端或靠近所述另一末端)。双链核酸分子的给定链可以包括可切割或可切除部分,并且包括捕获实体或与所述捕获实体偶联。给定链还可以直接附接到支持物(例如,固相支持物)。
[0436]
所述核酸分子可以以任何可用的方式与支持物(例如,固相支持物)偶联。核酸分子(例如,双链核酸分子)的末端可以与支持物偶联。例如,核酸分子(例如,双链分子)的3'末端可以附接到固相支持物。可替代地,核酸分子(例如,双链分子)的5'末端可以附接到固相支持物。附接到固相支持物的核酸分子的末端可以不是“游离”末端。未附接到固相支持物的核酸分子的末端可以是“游离”(例如,未附接)末端。例如,核酸分子的链的5'末端可以是游离末端(例如,其中同一链的3'末端或第二链的5'末端附接到支持物)。可替代地,3'末端可以是游离末端(例如,其中同一链的5'末端或第二链的3'末端附接到支持物)。双链核酸分子的链的5'末端可以附接到固相支持物,并且另一5'末端可以是“游离”(例如,未附接)末端。可替代地,双链核酸分子的链的3'末端可以附接到固相支持物,并且另一3'末端可以是游离末端。游离末端可以包括(例如,如本文所描述的)捕获实体或与所述捕获实体连接。游离末端可以不与附接到固相支持物的末端互补。
[0437]
核酸分子(例如,双链核酸分子)可以共价地附接到支持物。例如,核酸分子的链可以共价地附接到支持物。可替代地或另外地,核酸分子(例如,双链核酸分子)可以非共价地附接到支持物。例如,核酸分子的链可以非共价地附接到支持物。引物可以附接到支持物(例如,共价附接),并且可以使用所述引物合成双链核酸分子的链(例如,使用引物延伸过程)。例如,与附接到支持物的引物杂交的单链模板核酸分子可以用于合成双链核酸分子。单链模板可以包括靶序列。引物可以延伸以产生对单链模板的反向互补序列。延伸反应可以产生双链核酸分子。
[0438]
在一些实施方式中,所述支持物包括引物或衔接子。在一些实施方式中,所述引物或衔接子在其5'末端与支持物缀合。所述引物或衔接子可以通过本领域已知的任何方法缀合。常见的缀合方法包括点击反应、无铜点击反应、链霉亲和素与生物素缀合、edc缀合和dsc缀合等。在一些实施方式中,所述支持物包括多个引物或衔接子。在一些实施方式中,所述多个引物或衔接子包括基本上相同的序列。在一些实施方式中,所述支持物包括第一多个引物或衔接子以及第二多个引物或衔接子。在一些实施方式中,所述第一多个引物或衔接子包括基本上相同的序列。在一些实施方式中,所述第二多个引物或衔接子包括基本上相同的序列。在一些实施方式中,所述第一多个引物或衔接子包括与第二多个引物或衔接子不同的序列。在一些实施方式中,所述第一和第二多个用于桥接扩增。
[0439]
在一些实施方式中,所述与支持物缀合的引物或衔接子包括至少一个可切割或可切除碱基。在一些实施方式中,所述与支持物缀合的引物或衔接子包括多个可切割或可切除碱基。在一些实施方式中,切割不包括去除碱基,而仅仅是碱基之间键的切割。例如,rna酶h切割rna碱基或dna-rna碱基之间的磷酸二酯主链,但除非发生多次切割,否则可能无法完全切除rna碱基。在一些实施方式中,碱基之间的切割产生缺口。在一些实施方式中,单个可切割或可切除碱基在被切除时产生缺口。在一些实施方式中,单个可切割或可切除碱基在被切除时产生空位。例如,user酶去除dna尿嘧啶碱基,从而复杂地从分子中切除碱基。在
一些实施方式中,空位是占单个碱基的空位。在一些实施方式中,单个可切割或可切除碱基在被切割时产生缺口。在一些实施方式中,所述多个可切割或可切除碱基被配置成在切除碱基时产生空位区。在一些实施方式中,所述缺口包括游离5'末端。在一些实施方式中,所述空位区包括游离5'末端。在一些实施方式中,所述缺口包括游离3'末端。在一些实施方式中,所述空位区包括游离3'末端。在一些实施方式中,所述游离3'末端充当引物以通过聚合剂将核苷酸添加到空位区中。在一些实施方式中,所述游离3'末端能够通过聚合酶引发聚合反应。
[0440]
核酸分子可以包括捕获实体或与所述捕获实体偶联。捕获实体可以安置在核酸分子的游离末端(例如,未附接到支持物的末端)。捕获实体可以与核酸分子的核酸链的游离末端处的核酸链的核苷酸连接。捕获实体可以靠近核酸分子的链的游离末端。例如,捕获实体可以位于核酸分子的链的末端的0个、1个、2个、3个、4个、5个、6个、7个、8个、9个或10个碱基内。每种可能性都表示本发明的单独实施方式。在一些实施方式中,靠近是0个、1个、2个、3个、4个、5个、6个、7个、8个、9个或10个碱基以内。每种可能性都表示本发明的单独实施方式。在一些实施方式中,靠近是5个碱基以内。在一些实施方式中,靠近是3个碱基以内。在一些实施方式中,靠近是10个碱基以内。例如,捕获实体可以位于核酸分子的链的末端的3个碱基内。例如,捕获实体可以以0个碱基靠近核酸分子的链的末端(例如,捕获实体可以与链的最后一个碱基偶联)。例如,捕获实体可以以1个碱基靠近核酸分子的链的末端(例如,捕获实体可以与与链的最后一个碱基相邻的碱基偶联)。包括捕获实体或与所述捕获实体偶联的所述游离末端可以不与附接到支持物(例如,固相支持物)的核酸链的末端互补。捕获实体可以与不直接附接到支持物(例如,固相支持物)的核酸分子的链偶联。例如,捕获实体可以与不附接到支持物(例如,固相支持物)的双链核酸分子的链的最后一个碱基偶联(例如,捕获实体可以与离固相支持物最远的碱基偶联)。
[0441]
如本文所使用的,术语“捕获实体”是指可以由捕获性实体特异性地结合的任何分子。所述捕获实体可以包括例如生物素、亲和素、核酸序列、磁性部分、带电部分、点击化学或任何其它可用的部分。所述捕获实体和捕获性实体可以形成对,其中每个实体彼此特异性地结合。所述捕获实体可以包括生物素,并且捕获性实体可以包括亲和素,如链霉亲和素(例如,捕获实体和捕获性实体可以包括生物素-亲和素对)。可替代地,所述捕获实体可以包括亲和素(例如,链霉亲和素),并且所述捕获性实体可以包括生物素。所述捕获实体可以包括捕获序列(例如,核酸序列),并且所述捕获性实体可以包括与捕获序列互补的序列。所述捕获实体可以包括磁性颗粒,并且所述捕获性实体可以包括磁场系统。所述捕获实体可以包括带电颗粒,并且所述捕获性实体可以包括电场系统。任何可用的捕获实体/捕获性实体配对可以用于本文所提供的方法和组合物。
[0442]
核酸分子(例如,双链核酸分子)可以包括可切割或可切除部分。例如,核酸分子可以包含可切割碱基。可切割或可切除部分可以作为捕获实体包含在核酸分子的同一链中。例如,可切割或可切除部分(例如,可切割碱基)可以靠近捕获实体。可切割或可切除部分(例如,可切割碱基)可以靠近双链分子的链的游离末端。例如,双链分子的链的5'末端可以附接到支持物(例如,固相支持物),并且可切割或可切除部分(例如,可切割碱基)可以靠近双链核酸分子的第二链的游离5'末端。在一些实施方式中,所述可切割或可切除碱基包括所述捕获实体。在另一实例中,双链分子的链的5'末端可以附接到支持物(例如,固相支持
物),并且可切割或可切除部分(例如,可切割碱基)可以靠近双链核酸分子的同一链的游离3'末端。在另一实例中,双链分子的链的5'末端可以附接到支持物(例如,固相支持物),并且可切割或可切除部分(例如,可切割碱基)可以靠近双链核酸分子的第二链的游离5'末端。在另一实例中,双链分子的链的3'末端可以附接到支持物(例如,固相支持物),并且可切割或可切除部分(例如,可切割碱基)可以靠近双链核酸分子的第二链的游离3'末端。在另一实例中,双链分子的链的3'末端可以附接到支持物(例如,固相支持物),并且可切割或可切除部分(例如,可切割碱基)可以靠近双链核酸分子的同一链的游离5'末端。可切割或可切除部分可以被安置成靠近捕获实体。例如,核酸分子的链可以包括彼此靠近的可切割或可切除部分和捕获实体(例如,彼此在0至5个碱基内,如在至多5个、4个、3个、2个、1个碱基内或无碱基)。可替代地,核酸分子可以包括彼此靠近但与核酸分子的不同链相关联的可切割或可切除部分和捕获实体。在一些实施方式中,所述可切割或可切除部分靠近游离末端。在一些实施方式中,靠近是足够接近,使得可切割或可切除碱基的切除使可切割或可切除碱基与游离末端之间的所有碱基解离。在一些实施方式中,所述捕获实体位于可切割或可切除碱基与游离末端之间。在一些实施方式中,所述可切割或可切除碱基的切除使包括所述捕获实体的碱基解离。在一些实施方式中,所述可切割或可切除碱基的切除从分子中去除所述捕获实体。
[0443]
安置为靠近核酸分子的游离末端的可切割或可切除部分可以用于本文所提供的富集方法中。接近核酸分子的末端并且靠近捕获实体的可切割或可切除部分(例如,可切割碱基)的定位可以允许通过捕获性实体进行捕获(例如,将核酸分子和与捕获性实体偶联的支持物偶联),并且随后通过可切割或可切除部分的切割或切除来释放核酸分子。此类系统可以允许任何数量的富集或纯化过程,所述过程可以在处理核酸分子期间的任何时间执行(例如,使用多个不同的可切割或可切除部分)。在核酸处理的任何阶段,可切割或可切除部分(例如,可切割碱基)和捕获实体可以通过引物与核酸分子偶联。例如,可切割或可切除部分和/或捕获实体与核酸分子的偶联可以使用例如引物分子进行,并且随后进行纯化和/或释放过程,从而允许简单且快速的富集。将可切割或可切除部分(例如,可切割碱基)和捕获实体整合到与支持物(例如,珠)偶联的核酸分子(例如,双链核酸分子)中可以减少或消除由于重复序列引起的珠间杂交问题。这产生最小的珠损失、最小的靠近重复序列的序列丢失和易于执行的纯化方法。
[0444]
如本文所使用的,术语“可切割或可切除部分”通常是指可以从核酸分子中切割和/或切除的任何部分。可切割或可切除部分可以是可切割碱基。如本文所使用的,术语“可切割碱基”通常是指可以被特异性地切割并从核酸分子中去除或切除的任何碱基或碱基的类似物(例如,核苷碱基)。可切割碱基的实例包括但不限于尿嘧啶、8-氧代鸟嘌呤(在本文中也称为8-羟基鸟嘌呤、8-氧代-7,8-二氢鸟嘌呤、7,8-二氢-8-氧代鸟嘌呤和8oxog)、肌苷、rna碱基和2,6-二氨基-4-羟基-5-甲酰胺嘧啶(fapyg)。在一些实施方式中,所述尿嘧啶是dna尿嘧啶碱基。在一些实施方式中,所述rna碱基位于dna主链中。在一些实施方式中,除了所述可切割或可切除碱基外,所述dna缺乏rna碱基。在一些实施方式中,除了所述可切割或可切除碱基外,所述dna主链缺乏rna碱基。可以通过使可切割或可切除部分(例如,可切割碱基)接触切割剂来进行可切割或可切除部分的切割和/或切除。切割剂的实例包括但不限于尿嘧啶dna糖苷酶(udg)、无嘧啶/无嘌呤核酸内切酶(ape)、核酸内切酶(例如,核酸内
切酶viii(endoviii)或v(endov))、尿嘧啶特异性切除试剂(user)酶、甲酰胺嘧啶dna糖苷酶(fpg)、8-氧代鸟嘌呤糖苷酶(ogg1)、rna酶(例如,rna酶h,如rna酶hii)。光可切割或光可切除部分可以使用适当的能量应用来切割或切除,如通过使部分与uv光接触。一种或多种切割剂可以组合使用,以切割或切除可切割或可切除部分。在一个实例中,可切割碱基可以是dna主链中的rna碱基,并且切割剂可以是rna酶(例如,rna酶h或rna酶hii)。在此类情况下,核酸分子可以不是rna分子。在此类情况下,除了可切割或可切除碱基之外,核酸分子可能缺乏rna碱基。在一些实施方式中,所述第一可切割或可切除碱基是唯一的rna碱基,所述第二可切割或可切除碱基是唯一的rna碱基,所述第三可切割或可切除碱基是唯一的rna碱基或其组合。在另一实例中,所述可切割碱基可以是尿嘧啶碱基,并且切割剂可以选自尿嘧啶dna糖苷酶(udg)、无嘧啶/无嘌呤核酸内切酶(ape)、核酸内切酶viii和尿嘧啶特异性切除试剂(user)酶。例如,所述切割剂可以是udg。例如,所述切割剂可以是ape。例如,所述切割剂可以是user。在另一实例中,所述可切割碱基可以是肌苷碱基,并且所述切割剂可以是核酸内切酶v(endo v)。在另一实例中,所述可切割碱基可以是2,6-二氨基-4-羟基-5-甲酰胺嘧啶(fapyg)碱基,并且所述切割剂可以是甲酰胺嘧啶dna糖苷酶(fpg)。在另一实例中,所述可切割碱基可以是8-氧代-7,8-二氢鸟嘌呤(8oxog),并且所述切割剂可以是8-氧代鸟嘌呤糖苷酶(ogg1)。在另一实例中,所述可切割碱基可以是光可切割碱基,并且所述切割剂可以是光,如激光。应用切割剂可以在核酸分子的链中产生“缺口”。可替代地或另外地,可以添加另一种酶以产生缺口或以其它方式使缺口功能化。例如,可以添加t4多核苷酸激酶以去除3'磷酸盐。酶可以用于去除病变,如3'病变。
[0445]
熟练的技术人员将理解,所述切割剂与特异性可切割或可切除碱基一起使用。例如,dna尿嘧啶碱基的切除可以通过使用udg、ape、核酸内切酶viii或user实现。类似地,rna酶可以用于从dna主链中切除rna碱基。因此,不同的可切割或可切除碱基将通过不同的切割剂去除。这允许同时或顺序切割可切割或可切除碱基。如果至少两个可切割或可切除碱基由同一切割剂进行切割,那么至少两个可切割或可切除碱基可以被同时切割。如果第一可切割碱基由第一切割剂切割,并且第二可切割碱基由第二切割剂切割,那么可以通过首先添加一种切割剂并且然后添加另一种切割剂来完成顺序切割。例如,如果核酸分子包括dna尿嘧啶碱基和rna碱基,那么可以首先添加user以去除尿嘧啶,并且随后可以添加rna酶以去除rna碱基。可替代地,可以在user酶之前添加rna酶。这两种切割剂可以在方法的同一步骤或不同步骤中添加。例如,在预富集期间,可以去除第一可切割或可切除碱基,以使靶分子从捕获剂中游离出来。然后,在测序期间,可以去除第二可切割或可切除碱基,以产生用于启动测序的空位区的缺口(如本文所描述的一样)。可替代地,可以去除第一可切割或可切除碱基以产生单链突出端,以允许与固相支持物杂交,并且在预富集期间,可以去除第二可切割或可切除碱基,以使靶分子从捕获剂中游离出来(如本文所描述的一样)。
[0446]
核酸分子可以包括一个或多个可切割或可切除部分(例如,一个或多个可切割碱基)。在核酸分子包括多于一个可切割或可切除部分的情况下,可切割或可切除部分可以彼此相同或不同。例如,核酸分子可以包括第一可切割或可切除部分和第二可切割或可切除部分,其中第一可切割或可切除部分不同于第二可切割或可切除部分。第一可切割或可切除部分和第二可切割或可切除部分可以被配置成由相同的切割剂或切割剂的组合进行切割。在另一实例中,核酸分子可以包括第一可切割或可切除部分和第二可切割或可切除部
分,其中第一可切割或可切除部分和第二可切割或可切除部分属于同一类型。
[0447]
在可切割或可切除部分(例如,可切割碱基)靠近核酸分子的链的末端的情况下,部分的切割或切除可以诱导一个或多个其它碱基从核酸分子解离。例如,可切割或可切除部分可以安置为靠近核酸分子的第一链的游离末端(例如,在第一链的末端的0个、1个、2个、3个、4个或5个碱基内),并且可切割或可切除部分的切割或切除可以诱导核酸分子的第二链的一个或多个碱基从第二链(例如,位于或靠近第二链的末端处的一个或多个碱基)解离。解离可能是由于在经切割或经切除的链中以例如缺口、空位或孔的形式产生的不稳定性引起的。在一些实施方式中,所述空位是空位区。如果与未切的链有足够的碱基配对,那么所有碱基都可能保持附接。然而,当只有少数连续的碱基与另一条链中(如靠近双链核酸分子的链的末端)的碱基偶联时,此不稳定性可能足以使这几个碱基解离。如本文其它地方所描述的,捕获实体可以与位于或靠近核酸分子的末端处(如位于或靠近双链核酸分子的链的末端处)的碱基偶联。因此,核酸分子的第一链中的可切割或可切除部分的切割或切除可以使包括捕获实体或与所述捕获实体偶联的核酸分子的第二链中的碱基解离,使得可切割或可切除部分的切割或切除使捕获实体从核酸分子中释放出来。核酸分子可以与支持物(例如,固相支持物)偶联,并且捕获实体可以通过捕获性实体与另一个支持物(例如,另一个固相支持物)偶联。因此,通过应用切割剂所诱导的包括捕获实体或与所述捕获实体偶联的碱基的解离可以使核酸分子与其它支持物分离。
[0448]
本公开提供了用于富集核酸分子(例如,双链核酸分子),如与支持物(例如,颗粒)偶联的核酸分子的方法。一方面,本公开提供了一种用于处理核酸分子的方法,所述方法可以包括富集例如溶液内的核酸分子(例如,双链核酸分子)。所述方法可以包括提供包括与支持物(例如,颗粒,如珠)偶联的核酸分子(例如,双链核酸分子)的溶液。核酸分子可以包括脱氧核糖核酸。可替代地或另外地,核酸分子可以包括核糖核酸。核酸分子可以是包括第一链和第二链的双链核酸分子。核酸分子的第一链可以包括(例如,如本文所描述的)可切割或可切除部分。核酸分子的第二链可以包括(例如,如本文所描述的)可切割或可切除部分。可切割或可切除部分可以包括例如尿嘧啶、8-氧代鸟嘌呤(在本文中也称为8-羟基鸟嘌呤、8-氧代-7,8-二氢鸟嘌呤、7,8-二氢-8-氧代鸟嘌呤和8oxog)、肌苷、2,6-二氨基-4-羟基-5-甲酰胺嘧啶(fapyg)、rna碱基或光可切割碱基。所述可切割或可切除部分可以处于或接近(near)(例如靠近(proximal to))第一链的末端(例如,处于远离支持物的末端)。例如,所述可切割或可切除部分可以是第一链的最后一个碱基或与所述最后一个碱基偶联。可替代地,所述可切割或可切除部分可以是来自第一链的末端的10个或更少个碱基(如位于10个、9个、8个、7个、6个、5个、4个、3个或更少个碱基内)的碱基或与所述碱基偶联。所述可切割或可切除部分可以被配置成用切割剂进行切割,例如尿嘧啶dna糖苷酶(udg)、无嘧啶/无嘌呤核酸内切酶(ape)、核酸内切酶(例如,核酸内切酶viii(endoviii)或v(endov))、尿嘧啶特异性切除试剂(user)酶、甲酰胺嘧啶dna糖苷酶(fpg)、8-氧代鸟嘌呤糖苷酶(ogg1)、rna酶(例如,rna酶h,如rna酶hii)、紫外线或其组合。
[0449]
所述核酸分子的第一链还可以包括(例如,如本文所描述的)捕获实体或与所述捕获实体偶联。所述捕获实体可以包括例如带电颗粒、磁性颗粒、核酸序列、生物素、亲和素、另一部分或其组合。所述捕获实体可以与可切割或可切除部分(例如,可切割碱基)偶联。可替代地,所述捕获实体可以与第一链的另一碱基偶联。例如,所述可切割或可切除部分可以
是靠近第一链的末端的碱基或与所述碱基偶联,并且捕获实体可以与比可切割或可切除部分更靠近第一链的末端的碱基偶联。所述核酸分子可以包括在溶液(如水溶液)中。溶液可以包括(例如,如本文所描述的)一种或多种试剂,如用于切割或切除可切割或可切除部分、执行引物杂交或延伸过程或执行核酸扩增反应的一种或多种试剂。
[0450]
所述方法可以包括引起包括与支持物偶联的核酸分子的溶液接触捕获性实体。引起包括与支持物偶联的核酸分子的溶液接触捕获性实体可以具有使捕获实体与捕获性实体偶联的效果。在一些实施方式中,所述引起是使捕获实体接触捕获性实体。在一些实施方式中,所述引起或接触是在足以使捕获实体与捕获性实体结合的条件下进行的。所述捕获性实体可以包括例如生物素、亲和素(例如,链霉亲和素)、磁场系统、电场系统、核酸序列或其组合。例如,所述捕获实体可以是磁性颗粒,并且所述捕获性实体可以包括磁场系统。在另一实例中,所述捕获实体可以包括生物素部分,并且所述捕获性实体可以包括亲和素部分(例如,链霉亲和素)。在另一实例中,所述捕获实体可以包括核酸序列,并且所述捕获性实体可以包括包含与捕获实体的序列互补的序列的核酸序列。所述捕获性实体可以与额外的支持物(例如,通过共价或非共价相互作用)偶联。所述额外的支持物可以是颗粒,如珠。所述额外的支持物可以是表面,如流动池、盘或测序仪器的其它组件的表面。在一个实例中,所述支持物是第一颗粒,并且所述额外的支持物是第二颗粒。在捕获性实体与额外的支持物偶联的情况下,使捕获实体与捕获性实体偶联可以有效地将核酸分子与额外的支持物偶联。因此,本公开提供了一种用于制备与第一支持物和第二支持物偶联的核酸分子的方法,其中第一支持物和第二支持物可以属于同一类型或不同类型。
[0451]
所述方法可以包括将与捕获性实体偶联的核酸分子(例如,通过捕获实体)与溶液中的其它组分分离。例如,与捕获性实体偶联的核酸分子可以与溶液中与捕获性实体偶联的其它核酸分子分离。例如,此类其它核酸分子可以包括不包括所关注的靶核酸序列的引物分子或核酸分子。在另一实例中,与所述捕获性实体偶联的所述核酸分子可以与未与捕获性实体偶联的支持物分离。在一些实施方式中,未与捕获性实体偶联的所述支持物是缺乏靶核酸分子的支持物。将与捕获性实体偶联的核酸分子与溶液中的其它组分分离可以具有富集溶液内的核酸分子的效果。在核酸分子包括靶核酸序列(如与样品相关联的靶核酸序列)的情况下,此类分离可以具有富集溶液内的靶核酸序列的效果。在一些实施方式中,包括靶核酸序列的珠在溶液内富集。在溶液包括与一个或多个捕获性实体偶联的多个此类核酸分子(例如,包括靶核酸序列的多个核酸分子,如与同一支持物偶联的多个核酸分子)的情况下,此类分离可以具有富集溶液内的靶核酸序列的效果,并且可以提供具有最少污染物的所关注的核酸分子的克隆群体,这可以允许包括核酸测序的精简且误差减少的下游处理。在溶液包括多个支持物,一些支持物与靶核酸结合并且一些支持物不与靶核酸结合的情况下,仅分离具有靶分子的支持物可以精简下游扩增。因此,预富集将仅允许带有模板的珠进入扩增反应,从而减少反应浪费,增加覆盖率,减少稀有序列的丢失并改善包括核酸测序的整体下游处理。将与捕获性实体偶联的核酸分子与溶液中的其它组分分离可以包括将与捕获性实体偶联的核酸分子与其它材料分离。用双链分子分离经扩增的珠具有减少珠之间结块/聚集的额外的益处。
[0452]
与捕获性实体偶联的核酸分子可以通过例如洗去其它组分与溶液中的其它组分分离。例如,核酸分子可以和与额外的支持物(如固体表面)偶联的捕获性实体偶联,并且可
以使用例如洗涤溶液(如缓冲水溶液)洗去额外的材料。在一个实例中,所述核酸分子包括是磁性颗粒的捕获实体或与所述捕获实体偶联,并且所述捕获性实体是磁场系统。包括磁性颗粒或与所述磁性颗粒偶联的核酸分子可以通过磁性分离与溶液中的其它材料分离。在另一实例中,所述核酸分子包括包含生物素的捕获实体或与所述捕获实体偶联,并且所述捕获性实体包括亲和素(例如,链霉亲和素)。包括生物素部分或与所述生物素部分偶联的核酸分子可以通过生物素-亲和素相互作用与包括捕获性实体的额外的支持物偶联,并且随后通过洗去未与支持物偶联的材料与溶液中的其它材料分离。
[0453]
核酸分子的捕获实体或与核酸分子偶联的捕获实体以及捕获性实体可以是解脱偶联的。例如,捕获实体和捕获性实体可以在核酸分子与其它材料分离(例如,核酸分子的富集或分离)之后解脱偶联。捕获实体和捕获性实体的解脱偶联可以通过逆转其偶联条件来完成。例如,在捕获实体包括磁性颗粒并且捕获性实体包括磁场系统的情况下,可以去除或去激活磁场系统,从而有效地使捕获实体从捕获性实体(例如,与额外的支持物(如磁性支持物)偶联的捕获性实体)上解脱偶联。可替代地或另外地,核酸分子(例如,富集或分离的核酸分子)的捕获实体或与核酸分子偶联的捕获实体可以与核酸分子分离,由此使核酸分子和捕获性实体从可以偶联的捕获性实体上解脱偶联。使捕获实体与核酸分子分离可以包括切割或切除核酸分子的一个或多个碱基。例如,捕获实体可以与核酸分子的可切割或可切除部分(例如,可切割碱基)偶联,使得可切割或可切除部分的切割或切除有效地使核酸分子从捕获实体上解脱偶联。在另一实例中,捕获实体可以与靠近核酸分子的可切割或可切除部分(例如,可切割碱基)的碱基偶联,使得可切割或可切除部分的切割或切除有效地使核酸分子从捕获实体上解脱偶联(例如,在解离捕获实体所偶联的碱基时)。核酸分子的可切割或可切除部分的切割或切除可以在核酸分子的链中引入缺口或空位区(例如,不存在一个或多个碱基)。例如,可切割或可切除部分的切割或切除可以产生缺口。例如,可切割或可切除部分的切割或切除可以在包括一个或多个碱基(如至少1个、2个、3个、4个、5个或更多个碱基)的核酸分子的链中产生空位区。核酸分子的一个或多个可切割或可切除部分可以被切割或切除(例如,使用相同或不同的切割机制或试剂)。例如,在核酸分子的同一链中的两个可切割或可切除部分可以被切割或切除,所述可切割或可切除部分中的一个可切割或可切除部分与捕获实体偶联或靠近所述捕获实体。这些部分的切割或切除可以诱导在两个部分之间产生空位区,所述空位区可以跨越至少2个、3个、4个、5个、6个、7个、8个、9个、10个或更多个碱基。可替代地或另外地,核酸分子可以通过第一链与支持物缀合,并且捕获实体可以位于第二链上,并且两条链的解离使靶核酸分子的支持物和单链从捕获性实体上解脱偶联。
[0454]
(例如,如本文所描述的)核酸分子的富集可以包括核酸分子的分离。核酸分子的富集或分离可以是完全的或不完全的(例如,一种或多种额外的材料(如一个或多个额外的核酸分子)可以不被去除)。例如,富集可以包括核酸分子或核酸分子群体(例如,克隆群体)至少70%、75%、80%、85%、90%、92%、95%、97%、99%或100%的富集。富集可以在溶液内执行(例如,通过磁性或基于电荷的分离方法)。可替代地,富集可以包括转移到新的缓冲液或溶液中,如在使用洗涤溶液去除初始溶液中的其它材料时。富集可以包括有利于双链核酸分子的单链核酸分子的耗尽。富集可以包括耗尽缺乏可切割或可切除部分(例如,可切割碱基)或与(例如,如本文所描述的)捕获实体偶联的可切割或可切除部分的核酸分子。
[0455]
现在参考图1a和1b。图1a示出了一个系统,其中双链核酸分子104的5'末端与支持物102(例如,如本文所描述的“固相支持物”)偶联。支持物102可以是颗粒(例如,珠)。核酸分子104包括链106和链108。在一些实施方式中,链106是第一链,并且链108是第二链。在一些实施方式中,链106是第二链,并且链108是第一链。在一些实施方式中,链106与支持物102偶联。在一些实施方式中,链106的5'末端与固相支持物102偶联。在一些实施方式中,链108不与固相支持物102偶联。在一些实施方式中,链108的3'末端靠近支持物102,但不与支持物102偶联。核酸分子104可以包括图中示出为尿嘧啶碱基的可切割碱基110。在一些实施方式中,链108包括可切割碱基110。可切割碱基110示出为“零靠近”链108的5'末端的位置处(例如,其是末端碱基)。示为生物素的捕获实体112与可切割碱基110偶联。熟练的技术人员将理解,如本文所描述的任何捕获实体可以用作捕获实体112。当核酸分子104接触切割剂(例如,udg、ape等)时,可切割碱基110被去除,并且捕获实体(生物素)112被释放。在一些实施方式中,所述切割剂被配置成切割可切割碱基110。将基于要切割的可切割碱基110选择合适的切割剂。可切割碱基110示为链108的末端碱基并且包括捕获实体112;然而,熟练的技术人员将理解,可切割碱基110只需要足够接近链108的5'末端,使得可切割碱基110的切除导致释放包括捕获实体112的更5'端的碱基。在一些实施方式中,释放是包括来自链106的捕获实体112的碱基的解离。例如,如果来自链108的5'末端的第二碱基是可切割碱基110,并且链108的5'末端碱基包括捕获实体112,那么在切除可切割碱基110时,包括捕获实体112的末端碱基将解离。图1b中描绘了此类实施方式。如果捕获实体(生物素)112已被包括捕获性药剂,如亲和素(例如,链霉亲和素)的第二支持物(例如,如本文所描述的颗粒)所捕获,那么可切割碱基110的切割或切除将释放出与来自第二支持物的支持物102偶联的双链核酸分子。在去除可切割碱基110之后,核酸分子104可以包括缺口114。如果可切割碱基110被安置在链108的末端的一个或多个碱基中,那么缺口114可以包括在链108内而不是在链108的末端处。图1b示出了此类实例。
[0456]
图1b示出了与图1a的系统类似的系统,所述系统包括与(例如,如本文所描述的)支持物122偶联的双链核酸分子124的5'末端。支持物122可以是颗粒(例如,珠)。核酸分子124包括链126和链128。在一些实施方式中,链126是第一链,并且链128是第二链。在一些实施方式中,链126是第二链,并且链128是第一链。在一些实施方式中,链126与支持物122(例如,固相支持物)偶联。在一些实施方式中,链126的5'末端与固相支持物122偶联。在一些实施方式中,链128不与固相支持物122偶联。在一些实施方式中,链128的3'末端靠近支持物122,但不与支持物122偶联。核酸分子124可以包括图中示出为尿嘧啶碱基的可切割碱基130。在一些实施方式中,链128包含可切割碱基130。可切割碱基130示出为以2碱基靠近链128的5'末端的位置(例如,可切割碱基距离链的末端2个碱基/是链的末端碱基)。示为生物素的捕获实体132与可切割碱基130偶联。熟练的技术人员将理解,如本文所描述的任何捕获实体可以用作捕获实体132。在切除(例如,如本文所描述的)可切割碱基130时,核酸分子124可以包括缺口134。在去除可切割碱基130之后,在与链126杂交的链128的末端处包括仅两个碱基的区。此相互作用可能是不稳定的,使得这些碱基可以与核酸分子124解离并进入溶液中(参见下面的灰线)。第一碱基的解离(示出为t)可以在第二碱基的解离(示出为g)之后发生或与第二碱基的解离同时发生,所述第二碱基在这里与捕获实体132偶联。因此,通过去除可切割碱基130所诱导的这些碱基的解离使核酸分子124和捕获实体(生物素)132分
离。如上所述,在存在与捕获性药剂偶联的第二支持物(例如,颗粒)的情况下,可切割碱基130的去除将使核酸分子124从第二支持物上解脱偶联,捕获实体132被配置成与所述捕获性药剂(例如,亲和素)偶联。
[0457]
所述方法可以进一步包括提供与单链核酸分子偶联的支持物。单链核酸分子可以包括核酸分子的第二链的全部或一部分。单链核酸分子可以包括不与支持物结合的末端(例如,“游离”末端)。此末端可以是3'端。可替代地,此末端可以是5'端。单链核酸分子可能缺乏可切割或可切除部分。可以提供引物分子。引物分子可以包括核酸序列,所述核酸序列与处于或靠近远离支持物的单链核酸分子的末端(例如,“游离”末端)处的核酸序列互补。引物分子可以包括核酸分子的可切割或可切除部分,并且可以包括捕获实体或与所述捕获实体偶联。例如,捕获实体可以与可切割或可切除部分(例如,可切割碱基)偶联,或者可切割或可切除部分可以靠近和5'于包括捕获实体的碱基。引物分子可以与支持物(如颗粒)偶联。引物分子可以与支持物可释放地偶联,并且在施加刺激(如化学刺激)时可从支持物中释放出来。单链核酸分子和引物分子可以经受足以使引物分子与单链核酸分子杂交的条件。如果引物分子与支持物偶联,那么引物分子可以经受足以从支持物中释放引物分子的条件,以促进引物分子与单链核酸分子之间的相互作用。与单链核酸分子杂交的引物分子可以经受足以延伸引物分子以产生核酸分子的第一链或其部分的条件。可以对与支持物偶联的多个单链核酸分子重复此过程。
[0458]
所述方法可以进一步包括提供与引物分子偶联的支持物。引物分子可以与支持物可释放地偶联,并且在施加刺激(如化学刺激)时可从支持物中释放出来。在一些实施方式中,所述方法进一步包括提供引物分子。在一些实施方式中,所述方法进一步包括提供能够捕获捕获部分的支持物。在一些实施方式中,所述方法进一步包括提供包括捕获性实体的支持物。引物分子可以包括第一核酸序列。引物可以包括至少一个可切割或可切除部分。引物可以包括多个可切割或可切除部分。第一核酸序列可以包括至少一个可切割或可切除碱基。在一些实施方式中,至少一个是多个。在一些实施方式中,至少1个是至少2个。在一些实施方式中,至少1个是至少3个。在一些实施方式中,多个是至少3个。可以提供包括第二核酸序列的模板核酸分子,其中模板核酸分子的第二核酸序列可以与引物分子的第一核酸序列互补。所述模板核酸分子可以与支持物(如颗粒)偶联。所述模板核酸分子可以与支持物可释放地偶联,并且在施加刺激(如化学刺激)时可从支持物中释放出来。所述模板核酸分子可以包括不可切割或不可切除部分,所述不可切割或不可切除部分与核酸分子的可切割或可切除部分互补。所述模板核酸分子和所述引物分子可以经受足以使模板核酸分子与引物分子杂交的条件。所述方法可以进一步包括使与模板核酸分子杂交的引物分子经受足以延伸引物分子以产生核酸分子的第二链或其部分的条件。与模板核酸分子杂交的核酸分子的第二链可以经受足以使模板核酸分子与第二链分离的条件。可以对与支持物偶联的多个引物分子以及任选地多个模板核酸分子重复此过程,由此产生多个与支持物偶联的第二链。
[0459]
所述方法可以进一步包括提供额外的引物分子。在一些实施方式中,额外的引物分子包括:(a)与第二链的第四核酸序列互补的第三核酸序列;以及(b)可切割或可切除部分或其不可切割或不可切除类似物,其中所述额外的引物分子包括捕获实体或与所述捕获实体偶联。在一些实施方式中,额外的引物分子包括:(a)与第一链的第四核酸序列互补的第三核酸序列;以及(b)可切割或可切除部分或其不可切割或不可切除类似物,其中所述额
外的引物分子包括捕获实体或与所述捕获实体偶联。第二链或第一链以及额外的引物分子可以经受足以使额外的引物分子与第二链或第一链杂交的条件。与第二链杂交的额外的引物分子可以经受足以延伸额外的引物分子以产生核酸分子的第一链或其部分的条件。与第一链杂交的额外的引物分子可以经受足以延伸额外的引物分子以产生核酸分子的第二链或其部分的条件。在一些实施方式中,第二链是第二链的克隆拷贝。在一些实施方式中,第一链是第一链的克隆拷贝。所述额外的引物分子可以与颗粒偶联。例如,所述额外的引物分子可以与颗粒可释放地偶联,并且可以在施加刺激(如化学刺激)时释放出来。所述方法可以进一步包括使与颗粒偶联的额外的引物分子经受足以从颗粒释放额外的引物分子的条件。可以对多个额外的引物分子重复此过程,由此产生多个第一链。
[0460]
包括与支持物偶联的核酸分子的溶液可以包括多个此类支持物。所述多个支持物可以与多个核酸分子偶联,所述多个核酸分子包括多个捕获实体和多个可切割和可切除部分。所述多个核酸分子中的每个核酸分子可以包括第一链和第二链。每条第一链可以包括靠近第一链的末端的多个可切割或可切除部分中的可切割或可切除部分。每条第二链可以包括靠近第二链的末端的多个可切割或可切除部分中的可切割或可切除部分。每条第一链还可以包括位于或靠近所述末端处的多个捕获实体中的捕获实体或与所述捕获实体偶联。溶液可以进一步包括多个额外的支持物,所述多个额外的支持物可以不与包括多个捕获实体的核酸分子偶联。
[0461]
所述支持物最初可以包括在分区内,如乳液的孔或液滴。核酸分子可以与分区内的支持物偶联。
[0462]
所述核酸分子可以包括(例如,如本文所描述的)额外的可切割或可切除部分。所述可切割或可切除部分可以通过至少十个碱基与所述额外的可切割或可切除部分分离。可替代地,所述可切割或可切除部分可以通过少于十个碱基与所述额外的可切割或可切除部分分离。
[0463]
所述核酸分子可以包括额外的捕获实体或与所述额外的捕获实体偶联。例如,所述额外的捕获实体可以与所述额外的可切割或可切除部分偶联。所述方法可以进一步包括在足以使额外的捕获实体与(例如,如本文所描述的)额外的捕获性实体偶联的条件下,使与支持物偶联的核酸分子接触额外的捕获性实体,由此使核酸分子与额外的捕获性实体偶联。额外的捕获性实体可以与额外的支持物(例如,颗粒)偶联。与额外的捕获性实体偶联的核酸分子可以与包括(例如,如本文所描述的)核酸分子的溶液的其它组分分离。与额外的捕获性实体偶联的核酸分子可以经受足以切割或切除额外的可切割或可切除部分的条件,由此使核酸分子从额外的捕获性实体上解脱偶联。这可以包括使核酸分子接触切割剂。切割剂可以选自由以下组成的组:尿嘧啶dna糖苷酶(udg)、无嘧啶/无嘌呤核酸内切酶(ape)、核酸内切酶(例如,核酸内切酶viii(endoviii)或v(endov))、尿嘧啶特异性切除试剂(user)酶、甲酰胺嘧啶dna糖苷酶(fpg)、8-氧代鸟嘌呤糖苷酶(ogg1)、rna酶(例如,rna酶h,如rna酶hii)、紫外线以及其组合。
[0464]
所述核酸分子可以经受足以切割或切除额外的可切割或可切除部分的条件,由此产生在核酸分子的第一链中的缺口或空位区。在一些实施方式中,经受足以切割或切除额外的可切割或可切除部分的条件产生在核酸分子的第二链中的缺口或空位区。核酸分子可以经受足以切割或切除额外的可切割或可切除部分的条件包括使核酸分子接触切割剂。切
割剂可以选自由以下组成的组:尿嘧啶dna糖苷酶(udg)、无嘧啶/无嘌呤核酸内切酶(ape)、核酸内切酶(例如,核酸内切酶viii(endoviii)或v(endov))、尿嘧啶特异性切除试剂(user)酶、甲酰胺嘧啶dna糖苷酶(fpg)、8-氧代鸟嘌呤糖苷酶(ogg1)、rna酶(例如,rna酶h,如rna酶hii)、紫外线以及其组合。切割或切除额外的可切割或可切除部分可以产生在核酸分子的第一链或核酸分子的第二链中的占两个或更多个碱基的空位区。包括缺口或空位区的核酸分子可以接触聚合酶和标记的核苷酸。标记的核苷酸可以被配置成发出信号(例如,荧光信号,如在适当的波长或波长范围下激发时)。标记的核苷酸可以包括(例如,如本文所描述的)荧光染料。聚合酶可以是链置换聚合酶。包括缺口或空位区的核酸分子可以经受足以将标记的核苷酸并入到缺口或空位区中的条件。包括缺口或空位区的核酸分子可以经受足以将标记的核苷酸并入到附接到空位区或缺口的游离3'末端的新合成的链中的条件。可以从并入到核酸分子的缺口或空位区或新合成的链中的标记的核苷酸中检测到信号或信号变化。信号或信号变化可以指示标记的核苷酸并入到核酸分子的缺口或空位区中。
[0465]
在一些实施方式中,产生包括与支持物偶联的核酸分子的溶液包括:
[0466]
a)提供包括多个第一支持物(例如,颗粒)的溶液,其中每个支持物包括至少一个第一引物分子;
[0467]
b)使溶液与至少一个模板核酸分子接触,所述模板核酸分子包括与第一引物分子反向互补的3'区和类似于靠近核酸分子的5'端的可切割碱基的不可切割碱基;
[0468]
c)使所述至少一个模板核酸分子和所述至少一个第一引物分子经受足以将所述至少一个第一引物分子与所述至少一个模板核酸分子杂交的条件;
[0469]
d)使与所述至少一个模板核酸分子杂交的所述至少一个第一引物分子经受足以延伸所述至少一个第一引物分子以产生核酸分子的条件,所述核酸分子包括与至少一个模板核酸分子的序列反向互补的核酸序列;以及
[0470]
e)使核酸分子经受足以使所述至少一个模板核酸分子与反向互补的核酸序列解离的条件,以产生包括与至少一个第一单链核酸分子偶联的第一支持物的溶液。
[0471]
在一些实施方式中,产生包括与支持物偶联的核酸分子的溶液包括:
[0472]
a)提供包括多个第一支持物(例如,颗粒)的溶液,其中每个支持物包括至少一个第一引物分子;
[0473]
b)使溶液与至少一个双链模板核酸分子接触,其中双链模板核酸分子包括:i)第一链,所述第一链包括与第一引物分子反向互补的3'单链区以及靠近第一链的5'端的可切割碱基;以及ii)第二链;
[0474]
c)使所述至少一个双链模板核酸分子和所述至少一个第一引物分子经受足以使所述至少一个第一引物分子与双链模板核酸分子的单链区杂交的条件;以及
[0475]
d)使所述至少一个第一引物分子和第二链至少一个双链模板核酸分子经受足以密封所述至少一个第一引物分子与所述至少一个双链模板核酸分子的第二链之间的缺口的条件,以产生包括与至少一个第一双链核酸分子偶联的第一支持物的溶液。
[0476]
在一些实施方式中,通过提供双链模板分子并将l形衔接子附接到所述至少一个双链模板核酸分子的两侧来产生所述至少一个双链模板核酸分子。如本文所使用的,“l形衔接子”是指包括以下的衔接子:双链退火区,所述双链退火区包括第一链与第二链之间的互补性,并且其中第二链基本上由互补性区组成;以及位于多核苷酸衔接子的第一链上的
突出端部分。在一些实施方式中,l形衔接子是国际专利申请pct/ib2020/060420中提供的衔接子。
[0477]
在一些实施方式中,关于l形衔接子,至少一条链是3'阻断的。如本文所使用的,术语“3'阻断”是指不能通过聚合酶在其3'端延伸的核苷酸。在一些实施方式中,3'阻断的链包括3'修饰或经修饰的碱基。在一些实施方式中,所述修饰是阻断修饰。在一些实施方式中,所述经修饰的碱基是经阻断的碱基。在一些实施方式中,经阻断的碱基是聚合酶不能与其连接新碱基的碱基。在一些实施方式中,连接是在新碱基上的聚合。在一些实施方式中,经阻断的碱基选自单磷酸核苷酸、双脱氧核苷酸和3'己二醇修饰的碱基。在一些实施方式中,经阻断的碱基是单磷酸核苷酸。在一些实施方式中,经阻断的碱基是双脱氧核苷酸。在一些实施方式中,经阻断的碱基是3'己二醇修饰的碱基。在一些实施方式中,所述突出端部分是5'端突出端。在一些实施方式中,第二链的5'端处的第一核苷酸是单磷酸核苷酸。在一些实施方式中,所述第二链的3'端处的第一核苷酸是单磷酸核苷酸。在一些实施方式中,所述突出端部分是5'端突出端,并且所述第二链的5'端处的第一核苷酸是单磷酸核苷酸。在一些实施方式中,所述突出端部分是5'端突出端,并且所述第二链的3'端处的第一核苷酸是单磷酸核苷酸。在一些实施方式中,所述突出端部分是3'端突出端。在一些实施方式中,所述来自第二链的3'端的第一核苷酸是双脱氧核苷酸。在一些实施方式中,所述来自第二链的5'端的第一核苷酸是双脱氧核苷酸。在一些实施方式中,所述突出端部分是3'端突出端,并且所述来自第二链的5'端的第一核苷酸是双脱氧核苷酸。在一些实施方式中,所述突出端部分是3'端突出端,并且所述来自第二链的3'端的第一核苷酸是双脱氧核苷酸。在一些实施方式中,所述突出端部分是5'端突出端,并且所述来自第二链的3'端的第一核苷酸是双脱氧核苷酸。在一些实施方式中,所述突出端部分是5'端突出端,并且所述来自第二链的5'端的第一核苷酸是双脱氧核苷酸。在一些实施方式中,所述来自第二链的3'端的第一核苷酸是3'己二醇修饰的碱基。在一些实施方式中,所述来自第二链的5'端的第一核苷酸是3'己二醇修饰的碱基。在一些实施方式中,所述突出端部分是3'末端突出端,并且所述来自第二链的5'端的第一核苷酸是3'己二醇修饰的碱基。在一些实施方式中,所述突出端部分是3'端突出端,并且所述来自第二链的3'端的第一核苷酸是3'己二醇修饰的碱基。在一些实施方式中,所述突出端部分是5'端突出端,并且所述来自第二链的3'端的第一核苷酸是3'己二醇修饰的碱基。在一些实施方式中,所述突出端部分是5'端突出端,并且所述来自第二链的5'端的第一核苷酸是3'己二醇修饰的碱基。
[0478]
在一些实施方式中,关于l形衔接子,所述第二链是不可延伸的。术语“不可延伸的(un-extendable)”、“不可延伸的(non-extendable)”或“阻断的”是可互换的,并且是指多核苷酸不能通过形成磷酸二酯键进一步聚合。在一些实施方式中,聚合是模板依赖性的或非依赖性的。在一些实施方式中,聚合是酶依赖性的或非依赖性的。可以根据本发明的方法使用的不可延伸的多核苷酸可以根据分子生物学领域已知的任何方法产生或包括经化学修饰的核苷酸。在一些实施方式中,3'己二醇修饰的碱基使多核苷酸成为“不可延伸的”。在一些实施方式中,双脱氧核苷酸使多核苷酸成为“不可延伸的”。在一些实施方式中,不可延伸的多核苷酸包括双脱氧核苷酸。在一些实施方式中,不可延伸的多核苷酸包括3'己二醇修饰的碱基。在一些实施方式中,所述经化学修饰的核苷酸(例如,双脱氧核苷酸或3'己二醇修饰的碱基)位于不可延伸的多核苷酸的3'端。在一些实施方式中,所述第一链包括5'突
出端,并且所述第二链是3'阻断的。
[0479]
退火区的精确核苷酸序列通常对本发明不重要,并且可以由用户选择。在一些实施方式中,所述退火区的一条链至少包括“引物结合”序列,当模板在固相扩增反应中使用时,所述序列使得能够对扩增引物进行特异性退火。在一些实施方式中,所述第一链的退火区包括引物结合序列。在一些实施方式中,所述第二链的退火区包括引物结合序列。因此,引物结合序列由最终用于固相扩增的引物的序列测定。这些引物的序列进而被有利地选择,以避免或最小化在扩增反应条件下引物与库内的模板的靶部分的结合,但在其它方面没有特别限制。例如,如果模板的靶部分源自人基因组dna,那么理想情况下应选择用于固相扩增的引物序列,以最小化与任何人基因组序列的非特异性结合。在一些实施方式中,所述引物不与在自然界中发现的序列结合。在一些实施方式中,所述引物不与在靶细胞中发现的序列结合。在一些实施方式中,所述细胞是哺乳动物细胞。在一些实施方式中,所述哺乳动物是人。
[0480]
衔接子的精确核苷酸序列通常对本发明不重要,并且可以由用户选择,使得所需的序列元素最终包括在源自衔接子的模板库的常见序列中,例如以为通用扩增引物和/或测序引物的特定集提供结合位点。可以包括额外的序列元件,例如以为测序引物提供结合位点,所述结合位点最终将用于文库中的模板分子的测序,或者提供由模板库的扩增产生的产物,例如在固相支持物上。衔接子可以进一步包括“标记”序列,所述序列可以用于标记或标明源自特定来源的模板分子。在一些实施方式中,所述标记是条形码。
[0481]
在一些实施方式中,所述第一链、第二链或两者的退火区包括条形码。在一些实施方式中,所述条形码是核苷酸条形码。在一些实施方式中,所述第一链、第二链或两者的退火区包括条形码核苷酸序列。在一些实施方式中,所述第一链、第二链或两者的退火区包括条形码核苷酸序列的一部分。在一些实施方式中,所述第一链、第二链或两者的退火区包括与条形码核苷酸序列互补的序列。在一些实施方式中,所述第一链、第二链或两者的退火区包括与条形码核苷酸序列互补的序列的一部分。在一些实施方式中,所述第一链包括条形码核苷酸序列,并且所述条形码核苷酸序列从退火部分延伸到突出端部分。在一些实施方式中,所述第二链包括条形码核苷酸序列。在一些实施方式中,所述第二链包括条形码核苷酸序列的反向互补序列。条形码序列在本领域中是众所周知的,并且可以使用任何此类条形码。在一些实施方式中,所述条形码是未在靶细胞中表达的序列。在一些实施方式中,所述条形码是未在模板核酸分子中表达的序列。在一些实施方式中,所述条形码是未在自然界中表达的序列。
[0482]
在一些实施方式中,一部分是至少25%、30%、40%、50%、60%、70%、75%、80%、90%、95%、97%、99%或100%。每种可能性都表示本发明的单独实施方式。在一些实施方式中,一部分是至少50%。在一些实施方式中,一部分是至少70%。在一些实施方式中,一部分是至少90%。在一些实施方式中,一部分是少于100%。
[0483]
在一个实施方式中,所述条形码是一个或多个核酸分子。在一些实施方式中,所述条形码是唯一分子标识符(umi)。在一些实施方式中,所述第一链包括umi。在一些实施方式中,所述第二链包括umi。在一些实施方式中,所述第二链包括umi的反向互补序列。在一些实施方式中,所述退火区包括umi。在一些实施方式中,所述突出端区包括umi。在一些实施方式中,所述突出端区包括条形码。在一些实施方式中,所述umi从退火区延伸到突出端区。
在一些实施方式中,所述条形码从退火区延伸到突出端区。核酸分子(如dna链)提供无限数量的条形码选择。如贯穿本发明所使用的,“条形码”和“dna条形码”是彼此可互换的,并且具有相同的含义。充当dna条形码的核酸分子是脱氧核酸或核糖核酸或两者的聚合物,并且可以是单链的或双链的,任选地包括合成的、非天然的或改变的核苷酸碱基。在一些实施方式中,所述核酸分子例如用生物素、放射性标记或荧光标记而标记。条形码在本领域中是众所周知的,并且任何此类条形码都可以用于本发明的表现。
[0484]
如本领域技术人员将理解的,将独特的dna条形码并入到与一个或多个核酸池(如包括来自不同来源的核酸分子)连接的本发明的多核苷酸(例如,衔接子)中允许鉴定单个或特定核酸来源,而不必从池中单独分选每种核酸来源,同时使用包括但不限于微阵列系统、pcr、核酸杂交(包括“印迹”)或高通量测序的测定。
[0485]
在一些实施方式中,所述条形码包括未在自然界中发现的序列或由所述序列组成。在另一个实施方式中,所述条形码包括与细胞的基因组材料基本上不相同或不互补的序列或由所述序列组成(如防止细胞基因组材料内的内源性核酸分子非特异性扩增,例如避免假阳性扩增结果)。在一些实施方式中,所述细胞是哺乳动物细胞。在一些实施方式中,所述哺乳动物是人。在一些实施方式中,所述条形码不是完全基因组。在一些实施方式中,所述条形码不是染色体。在一些实施方式中,所述条形码不具有与天然存在的序列等于或大于60%、65%、70%、75%、80%、85%、90%、95%、97%、99%或100%的互补性或介于其间的任何值和范围。每种可能性都表示本发明的单独实施方式。在一些实施方式中,所述条形码包括与天然存在的序列少于60%、55%、50%、45%、40%、35%、30%、25%、20%、15%、10%、5%、3%或1%的互补性或介于其间的任何值和范围。每种可能性都表示本发明的单独实施方式。
[0486]
在一些实施方式中,独特的条形码适于鉴定不同核酸分子的异源池内的核酸分子的特异性或特定亚群,从而实现本发明所公开的方法。用于检测核酸分子或序列的存在和鉴定核酸分子或序列的方法是熟练的技术人员已知的,并且包括能够增强多个条形码的存在的测序和阵列(例如,微阵列)系统。
[0487]
在一些实施方式中,所述突出端区包括与核酸引物的3'区互补的序列。在一些实施方式中,所述第一链退火区包括与核酸引物的3'区互补的序列。在一些实施方式中,所述第二链退火区包括与核酸引物的3'区互补的序列。
[0488]
在一些实施方式中,所述突出端区包括至少一个可切割或可切除部分。在一些实施方式中,所述突出端区包括多个可切割或可切除部分。在一些实施方式中,所述方法包括使与两个衔接子偶联的双链模板的第一链和第二链解离。在一些实施方式中,所述单链与第二引物接触。在一些实施方式中,所述第二引物包括可切割或可切除部分。在一些实施方式中,所述引物的可切割或可切除部分是与衔接子的可切割或可切除部分不同的可切割或可切除部分。在一些实施方式中,所述第二引物包括捕获实体。在一些实施方式中,所述方法进一步包括使第二引物和单链经受足以将引物退火到单链的3'末端的条件。在一些实施方式中,所述方法进一步包括延伸第二引物以产生与单链互补的新链,由此产生完全双链模板分子。在一些实施方式中,所述完全双链模板分子包括一个末端处的第一完全双链衔接子和另一末端处的第二完全双链衔接子。在一些实施方式中,第一完全双链衔接子和第二完全双链衔接子不同。在一些实施方式中,所述第二引物是与用于扩增的引物相同的引
物。
[0489]
在一些实施方式中,所述方法进一步包括使完全双链模板分子接触足以切割或切除l形衔接子中的可切割或可切除部分的条件。在一些实施方式中,从l形衔接子中切除可切割或可切除部分产生3'单链(例如,突出端)区。在一些实施方式中,所述方法产生如本文所描述的双链模板分子。
[0490]
所述至少一个模板核酸分子可以包括一个或多个衔接子。在一些实施方式中,所述衔接子是单链衔接子。在一些实施方式中,所述衔接子是双链衔接子。在一些实施方式中,所述衔接子是完全双链衔接子。在一些实施方式中,所述衔接子是l形衔接子。例如,所述至少一个模板核酸分子可以包括已经连接或以其它方式附接到模板核酸分子的第一衔接子。所述第一衔接子可以包括核酸序列,所述核酸序列是与所述多个支持物中的支持物偶联的至少一个引物中的引物的反向互补序列。所述第一衔接子可以包括单链区。所述第一衔接子可以包括双链区,所述双链区包括包含单链区的序列的第一链和包含与单链区的序列互补的序列的第二链。在一些实施方式中,与单链区的序列互补的序列包括至少一个可切割或可切除碱基。在一些实施方式中,从衔接子的第二链中切除所述至少一个可切割或可切除碱基产生单链区。在一些实施方式中,从第二链中切除所述至少一个可切割或可切除碱基使与单链区的序列互补的序列与衔接子的第一链解离,由此产生单链区。溶液可以包括缺乏模板核酸分子的多个第二支持物。这些支持物将留空,其中只有引物与其偶联而没有模板与其偶联,并且因此在后续处理期间将保持为空。预富集方法将去除这些空的第二支持物。
[0491]
所述模板核酸分子可以包括已连接或以其它方式附接到模板核酸分子的第二衔接子。所述第二衔接子可以安置在不与引物分子互补的模板核酸分子的末端。所述第二衔接子可以包括类似于可切割碱基的碱基。所述第二衔接子可以包括可切割或可切除碱基。可替代地或另外地,所述模板核酸分子可以包括类似于可切割碱基的不可切割碱基。不可切割类似物可以靠近模板核酸分子或其第二衔接子的末端(例如,“游离”末端)。所述末端可以是5'端。所述不可切割类似物可以位于用于可切割碱基的近侧位置,所述可切割碱基可以之后并入到所述位置中。所述可切割或可切除碱基可以靠近模板核酸分子或其第二衔接子的末端(例如,“游离”末端)。所述末端可以是模板核酸分子或其第二衔接子的第一链的5'端。在一些实施方式中,所述第一衔接子的第一链和所述第二衔接子的第一链是单链。在一些实施方式中,所述第一衔接子的第二链和所述第二衔接子的第二链是单链。
[0492]
提供溶液可以包括提供包括与至少一个第一单链分子的末端(例如,“游离”末端)反向互补的区的第二核酸分子。所述第二核酸分子可以是引物分子。所述第二核酸分子可以是单链的。所述第二核酸分子可以是双链的。所述第二核酸分子可以是衔接子。所述反向互补区可以是单链的。第二区可以是双链的。所述第二核酸分子可以包括第一可切割或可切除部分(例如,可切割碱基)。所述可切割或可切除部分可以靠近第二核酸分子的末端。所述可切割或可切除部分可以靠近末端,所述末端可以与第一单链分子的游离末端反向互补。所述第二核酸分子可以包括(例如,如本文所描述的)捕获实体。所述捕获实体可以位于末端(例如,“游离”末端),如5'端或与末端连接。所述可切割碱基可以靠近捕获实体。
[0493]
提供溶液可以进一步包括使第二核酸分子经受足以使至少一个第一单链核酸分子与第二核酸分子杂交的条件,以产生至少一个附接到第一支持物的双链核酸分子。此类
条件可以包括特定退火温度,例如,可以基于第二核酸分子的核苷酸含量和长度以及具体地其gc含量来辨别所述温度。
[0494]
所述方法可以进一步包括使第二核酸分子经受足以从第二核酸分子延伸与第一核酸分子反向互补的序列的条件。此延伸可以产生可以与第一支持物偶联的完全双链核酸分子。延伸可以包括添加游离核苷酸,包括(例如,如本文所描述的)标记的核苷酸。延伸可以包括使用(例如,如本文所描述的)聚合酶。在一些情况下,只可以执行一轮延伸。在一些情况下,只可以执行一次延伸反应。在一些情况下,可以执行多轮延伸。在一些实施方式中,可以执行几轮延伸。在一些实施方式中,几轮是少于2轮、3轮、4轮、5轮、6轮、7轮、8轮、9轮、10轮、11轮、12轮、13轮、14轮或15轮延伸。每种可能性都表示本发明的单独实施方式。在一些实施方式中,几轮小于10。在一些实施方式中,几轮小于15。在一些实施方式中,与第二核酸分子接触是克隆地扩增模板核酸分子。
[0495]
现在参考图2a,其示出了产生与支持物偶联的核酸分子的方法。支持物(例如,珠)202可以与引物分子204偶联。引物分子204可以包括至少一个可切割或可切除部分。可以提供靶核酸分子206,所述靶核酸分子包括具有与引物分子204的核酸序列互补的核酸序列的3'衔接子208以及5'衔接子210。靶核酸分子206可以使用库制备方法产生。靶核酸分子206可以使用连接和/或扩增技术产生。靶核酸分子206的衔接子序列208可以经受足以使衔接子序列208与引物分子204偶联(例如,杂交)的条件,由此使靶核酸分子206与支持物202偶联。引物分子204可以经受足以执行引物延伸过程的条件,以延伸引物分子204以产生与靶核酸分子互补的链212,由此提供与支持物202偶联的双链核酸分子。双链核酸分子可以包括具有与衔接子210的序列互补的序列的一部分214。此双链核酸分子可以不包括可切割或可切除部分。然而,双链核酸分子可以包括可切割或可切除部分的不可切割类似物,如在第二(未与支持物偶联的)链中。未与支持物202(例如,靶核酸分子206)偶联的链可以从支持物202上解脱偶联。引物分子216可以被引入。引物分子216可以包括与捕获实体220(此处示出为生物素)偶联的可切割或可切除部分218(此处示出为尿嘧啶碱基)。引物分子216可以包括与序列214互补的序列。引物分子216可以经受足以与序列214杂交的条件,并且随后经受足以延伸引物分子216以产生链222的条件。与支持物202偶联的链222可以与支持物202连接或者可以不与支持物202连接;最终产物是支持物结合的双链体靶分子262。包括可切割或可切除部分218和捕获实体220的链222可以经历富集和/或分离过程,如本文所描述的。链222还可以经历核酸测序,例如在经历富集和/或分离过程之后。包括可切割或可切除部分218和捕获实体220的支持物结合的双链体靶分子262可以经历富集和/或分离过程,如本文所描述的。支持物结合的双链体靶分子262还可以经历核酸测序,例如在经历富集和/或分离过程之后。
[0496]
现在参考图2b和2c,其示出了用于产生与支持物偶联的核酸分子的替代性方法。双链靶核酸分子236可以根据本领域已知的方法产生。可以使用双链体模板分子,如源自生物样品的双链体模板分子,所述双链模板分子可以用例如双链衔接子或可替代地用如pct/ib2020/060420中所描述的方法进行退火,所述文献以全文引用的方式并入本文。图3c示出了产生双链(例如,双链体)靶核酸分子236的示例性方法。来自生物样品的双链输入模板分子231与两端上的l形衔接子233连接。这些l形衔接子包括双链区235和5'突出端237。5'突出端237包括至少一个可切割或可切除碱基239,并且在图2b和2c中所描绘的实施方式中,
包括两个可切割或可切除碱基239。在此实施方式中,可切割或可切除碱基239是dna主链内的rna碱基。此rna碱基可以是rna尿嘧啶、腺嘌呤、鸟嘌呤和胞嘧啶中的任何一种。在衔接子238连接在两端上之后,所得双链体分子被解离成两个单独的单链241。这些单链241具有相同的5'和3'端,并且一条链中间的模板区是另一条链中间的模板区的反向互补序列。为简单起见,仅示出了一条单链241。引入引物246,所述引物包括:(i)3'区,所述3'区与单链241的3'端互补;以及(ii)5'区,所述5'区不与任一单链中的任何区互补,并且所述5'区包括另一可切割或可切除部分249,其中第二可切割或可切除部分249与至少一个可切割或可切除碱基239不同。在此背景下,不同通过不同的条件进行切割。如此实施方式所示出的,第二可切割或可切除部分249是dna尿嘧啶。dna尿嘧啶将不被rna特异性核酸酶切割,但可以从dna主链中独立去除。引物还包括5'捕获实体250(此处示出为生物素)。在此实例中,第二可切割部分249和捕获实体250包括在5'末端碱基中;然而,应当理解的是,还设想了替代方案,所述替代方案被配置使得可切割或可切除部分249靠近5'端,位于捕获实体250的3'端。在一些实施方式中,引物246与引物分子216等效或相同。引物246与单链241杂交,并且然后延伸以产生双链体靶核酸分子236(例如,双链体模板)。在延伸期间,单链241的3'端也被延伸以产生与引物246的5'端互补的区。在一些实施方式中,衔接子233的第二链的3'端被阻断并且不能延伸。在此类实施方式中,延伸引物以产生单链241的互补序列,但单链241不能延伸以包括与引物246的5'端互补的区。
[0497]
如图2b所示,提供了双链体靶核酸分子236。双链体靶核酸分子236可以通过如图2c所示的方法产生或通过本领域已知的另一种方法产生。双链体靶核酸分子236可以使用库制备方法产生。双链体靶核酸分子236可以使用连接和/或扩增技术产生。双链体靶核酸分子236在一末端处包括衔接子238并且在另一末端处包括衔接子240。双链体靶核酸分子236的衔接子238包括包含至少一个可切割或可切除碱基239的第一链。在此实施方式中,示出了两个可切割或可切除碱基239,并且所述碱基是dna主链内的rna碱基。衔接子240包括包含另一可切割或可切除部分249和捕获实体250(此处示出为生物素)的第一链。可切割或可切除碱基239被配置成使得碱基的切除导致在双链体靶核酸分子236的3'端处形成单链区。可切割或可切除部分249被配置成使得切割使捕获实体250与双链体靶核酸分子236解离。在此实施方式中,可切割或可切除部分249是dna尿嘧啶碱基。可切割或可切除碱基239和可切割或可切除部分249是不同的,使得其在不同的条件下被切割/切除。由于可切割或可切除部分249是dna碱基,因此在存在rna特异性核酸酶的情况下其将不被切割。双链体靶核酸分子236现在被置于导致切除可切割或可切除碱基239而非可切割或可切除部分249的条件下。例如,所述条件可以是添加rna特异性核酸酶。可切割或可切除碱基239的切割导致在切割的双链体靶分子256内产生3'突出端区248。引入与引物分子234偶联的支持物(例如,珠)232。引物分子234与突出端区248互补。切割的双链体靶分子248的突出端区256可以经受足以使突出端区248与引物分子234偶联(例如,杂交)的条件,由此使靶核酸分子256与支持物232偶联。执行空位填充反应以去除5'核糖核苷酸并闭合引物分子234的3'端与切割的双链体分子256的较短链的5'端之间的空位区,以产生支持物偶联的双链体靶标242。支持物偶联的双链体靶分子242包括不与支持物232直接缀合的链上的可切割或可切除部分288和捕获实体250。支持物偶联的双链体靶分子242等同于支持物偶联的双链体靶分子262。支持物偶联的双链体靶分子242可以经历富集和/或分离过程,如本文所描述的。支持
物偶联的双链体靶分子242还可以经历核酸测序,例如在经历富集和/或分离过程之后。
[0498]
预富集
[0499]
本文所提供的方法可以包括克隆地扩增核酸分子(例如,双链核酸分子)的序列。所产生的克隆群体可以是双链群体。所述方法可以包括克隆地扩增单链核酸分子(例如,第一单链核酸分子)的序列。所产生的克隆群体可以是单链群体。核酸分子(例如,双链核酸分子)可以在经历富集或分离过程(例如,核酸分子的输入群体可以被富集和/或分离,如本文所提供的)之后被克隆地扩增。核酸分子(例如,双链核酸分子)可以在经历富集或分离过程(例如,核酸分子的克隆群体可以被富集和/或分离,如本文所提供的)之前被克隆地扩增。可替代地或另外地,核酸分子(例如,单链核酸分子)可以在经历(例如,如本文所描述的)富集或分离过程之后被克隆地扩增。克隆扩增可以使用多个第一引物分子执行,所述多个第一引物分子可以附接到支持物(例如,颗粒)。多个第一引物分子中的第一引物分子可以是(例如,如本文所描述的)第一衔接子。克隆扩增可以进一步包括使用多个第二引物分子。所述多个第二引物分子中的第二引物分子可以与核酸分子的序列或其前体或衍生物同源。多个第二引物分子中的第二引物分子可以是(例如,如本文所描述的)第二衔接子。第一引物分子和/或第二引物分子可以包括(例如,如本文所描述的)一个或多个可切割或可切除部分,在扩增过程期间,所述一个或多个可切割或可切除部分可以并入到(例如,如本文所描述的)核酸分子中。第一引物分子和/或第二引物分子可以包括(例如,如本文所描述的)捕获实体或与所述捕获实体偶联,在扩增过程期间,所述捕获实体可以并入到(例如,如本文所描述的)核酸分子中或与所述核酸分子偶联。核酸分子的克隆群体中的大多数核酸分子可以包括可切割或可切除部分和/或包括捕获实体或与所述捕获实体偶联。例如,核酸分子的克隆群体中的每个核酸分子可以包括可切割或可切除部分和/或包括捕获实体或与所述捕获实体偶联。第一引物分子和/或第二引物分子可以包括可切割或可切除部分(例如,可切割碱基)的不可切割类似物。使用此类引物分子制备核酸分子的克隆群体可以提供包括可切割或可切除部分的多个核酸分子。
[0500]
核酸分子的扩增(包括克隆扩增)可以在多个分区中的分区内执行。所述分区可以是乳液的液滴(例如,水性液滴)。所述分区可以是孔(例如,微孔板的微孔)。所述分区可以包括支持物(例如,如本文所描述的颗粒),所述支持物可以与(例如,如本文所描述的)核酸分子或引物分子偶联。所述方法可以包括在分区内提供核酸分子(例如,与支持物偶联的核酸分子)。可替代地或另外地,与支持物偶联的核酸分子可以在(例如,如本文所描述的)本体溶液中制备,并且可以经历一个或多个额外的处理步骤,包括例如在分区内富集和/或扩增。可替代地或另外地,与支持物偶联的核酸分子可以在分区外经历扩增过程。例如,与支持物偶联的核酸分子可以在本体溶液中经历扩增过程。可替代地或另外地,与支持物偶联的核酸分子可以在(例如,如本文所描述的)分区内制备,并且可以经历一个或多个额外的处理步骤,包括例如在分区外富集和/或扩增(例如,在从分区中回收之后)。扩增过程(例如,克隆扩增过程)可以包括乳液pcr(empcr或epcr)。
[0501]
克隆扩增可以在执行本文所描述的富集和/或分离过程之后执行。此类富集过程可以被称为“预富集”过程。预富集过程可以是预pcr富集过程。例如,预富集过程可以确保仅包括与所关注的核酸分子偶联的支持物的复合物使用扩增过程进行处理。
[0502]
现在参考图3a至3c,其示出了预富集过程的实例。如图3a所示,提供了包括引物分
子的多个支持物(例如,珠)302和多个核酸分子304。所述多个支持物中的支持物可以包括与其偶联的多个引物分子。所述多个核酸分子304可以包括靶核酸序列或其互补序列。所述多个核酸分子304可以包括衔接子,如第一末端处的第一衔接子和第二末端处的第二衔接子。所述多个核酸分子304可以是多个单链核酸分子。可替代地,所述多个核酸分子304可以是多个双链核酸分子。所述多个核酸分子304可以包括脱氧核糖核酸(dna)和/或核糖核酸(rna)。与引物分子偶联的支持物302可以过量于所述多个核酸分子304,以通过所述多个支持物302中的支持物最大限度地捕获所述多个核酸分子304中的核酸分子。包括包含引物分子的所述多个支持物302和所述多个核酸分子304的溶液可以经受足以使所述多个核酸分子304中的核酸分子和与所述多个支持物302偶联的引物分子杂交并且延伸偶联的引物分子的条件,以产生包括与链308偶联的支持物的复合物306。链308可以与所述多个核酸分子304中的核酸分子的序列至少部分地互补。复合物306最初可以包括双链核酸分子,所述双链核酸分子包括与其偶联的链308和所述多个核酸分子304的链;所述多个核酸分子304的链,所述链可以不与支持物直接偶联,可以解离以提供与链308偶联的复合物306。由于包括引物分子的所述多个支持物302被过量地提供,因此在复合物306产生之后,所述多个支持物中的支持物可以保留在溶液中。可以提供多个引物分子310,如图3b所示。所述多个引物分子中的引物分子310可以包括核酸序列312、可切割或可切除部分(示出为尿嘧啶碱基)314和捕获实体(示出为生物素)316。引物分子310的核酸序列312可以与复合物306的链308的序列互补。包括所述多个复合物306、包含引物分子的支持物302和所述多个引物分子310的溶液可以经受足以使引物分子310与链308杂交的条件以提供复合物318。复合物318可以包括和与引物分子310杂交的链308偶联的支持物。溶液可以经受足以延伸杂交的引物分子310以产生具有与链308互补的序列的链322的条件。复合物362可以各自包括与链308偶联的支持物,所述链与包括可切割或可切除部分314和捕获实体316的链322杂交。复合物362等同于支持物偶联的靶双链体分子262和支持物偶联的靶双链体242。可以引入图3b所示的捕获性实体324,所述捕获性实体作为包括与其偶联的多个亲和素部分(链霉亲和素)的表面。捕获实体316可以与捕获性实体324偶联。包括与引物分子偶联的支持物302的未复合部分可以与捕获的复合物362分离(例如,通过洗去多余的支持物302),由此富集和/或分离复合物362。切割剂(例如,udg、ape等)或切割剂的组合可以用于使复合物326与捕获性实体324分离,如图3c所示。复合物326可以包括和与互补链328杂交的链308偶联的支持物,所述互补链可以不包括可切割或可切除部分314和捕获实体316。复合物326可以在(例如,如本文所描述的)包括其的溶液内富集。捕获性实体324可以被去除。链328可以与复合物326解离。复合物326可以经受包括扩增(例如,克隆扩增,如通过乳液pcr扩增)的额外的处理以提供克隆支持物(例如,克隆珠)330和/或核酸测序。通过从一个珠到另一个珠杂交重复序列,在整个富集/分离过程中使用双链核酸分子降低了珠结块的风险。
[0503]
熟练的技术人员将理解,图2b至2c所示的方法可以用于产生等同于复合物362的支持物偶联的双链体靶分子242。支持物偶联的双链体靶分子242接触捕获性实体324,由此富集和/或分离支持物偶联的双链体靶分子242。切割剂(例如,udg、ape等)或切割剂的组合可以用于使支持物偶联的双链体靶分子242与捕获性实体324分离;然而,支持物偶联的双链体靶分子242将丢失可切割或可切除部分249和捕获实体250。支持物偶联的双链体靶分子242可以被富集在(例如,如本文所描述的)包括其的溶液内。捕获性实体324可以被去除。
支持物偶联的双链体靶分子242可以经受包括扩增(例如,克隆扩增,如通过乳液pcr扩增)的额外的处理以提供克隆支持物(例如,克隆珠)330和/或核酸测序。通过从一个珠到另一个珠杂交重复序列,在整个富集/分离过程中使用双链核酸分子降低了珠结块的风险。
[0504]
后富集
[0505]
所述方法可以进一步包括使用附接到支持物(例如,颗粒)的多个第一引物分子克隆地扩增核酸分子(例如,双链核酸分子)的序列。克隆扩增可以产生附接到第一核酸分子的克隆群体的支持物。克隆扩增可以在本文所描述的富集和/或分离过程之前执行。此类富集过程可以被称为“后富集”过程。后富集过程可以是pcr后富集过程。可以执行预富集过程和后富集过程两者(例如,扩增过程之前和之后的富集)。后富集过程可以用于去除“空”支持物(例如,珠),所述支持物可以是缺乏所关注的核酸分子的克隆群体的支持物。预富集过程和后富集过程两者都可以节省试剂并产生更高比例的所关注的最终产物。
[0506]
如上所述,克隆扩增过程可以用多个引物分子执行,所述引物分子可以是衔接子。还可以使用额外的多个引物分子(例如,额外的多个衔接子)。引物分子和/或额外的引物分子可以包括可切割或可切除部分和/或可切割或可切除部分的不可切割类似物和/或包括(例如,如本文所描述的)捕获实体或与所述捕获实体偶联。当并入到与支持物偶联的核酸分子中时,此类部分可以安置在处于或接近远离支持物的核酸分子的末端处,如并入到不与支持物直接偶联的链的3'或5'端。引物分子和/或额外的引物分子可以包括与所关注的核酸分子的序列互补的序列。在本文其它地方描述了克隆扩增的额外的细节和实例。
[0507]
包括后富集过程的过程可以进一步包括使包括与第一支持物(例如,颗粒,如包括与其偶联的多个核酸分子的颗粒[例如,核酸分子的克隆群体])偶联的核酸分子的溶液接触第二支持物(例如,颗粒)。第二固相支持物可以包括(例如,如本文所描述的)捕获性实体或与所述捕获性实体偶联。使溶液接触第二支持物可以使捕获实体与捕获性实体偶联,由此有效地使包括捕获实体或与所述捕获实体偶联的核酸分子与第二支持物偶联。
[0508]
方法可以进一步包括富集或分离第二支持物(例如,与核酸分子偶联的第二支持物)。富集或分离第二支持物可以包括例如使用电场系统(例如,对于包括带电颗粒的系统)或磁场系统(例如,对于包括磁性颗粒的系统)、过滤(例如,对于包括大颗粒的系统)、离心(例如,对于包括重颗粒的系统)或其组合。富集或分离可以是小于100%的富集或分离(例如,如本文所描述的)。此类过程可以不富集或分离可以不与第二支持物偶联的第一支持物。此类过程可以不富集或分离不与第二支持物结合的核酸分子。
[0509]
方法可以进一步包括使核酸分子的可切割或可切除部分经受足以切割或切除可切割或可切除部分的条件。切割或切除可切割或可切除部分可以使与核酸分子的克隆群体偶联的第一支持物从第一支持物可以偶联的第二支持物释放(例如,通过捕获实体与捕获性实体之间的相互作用,如本文所描述的)。
[0510]
现在参考图4a至4c,其示出了后富集过程的实例。提供了多个分区(例如,乳液的液滴)。这些分区可以被认为是“微反应器”。所述多个分区中的分区可以包括一个或多个不同的组分。例如,分区402可以各自包括包含与引物分子412偶联的支持物410(例如,颗粒)的复合物408。分区404可以各自包括核酸分子414,所述核酸分子可以包括靶核酸序列或其互补核酸序列。核酸分子414可以包括与引物分子412的序列的全部或一部分互补的序列。分区400可以各自包括至少一个复合物408和至少一个核酸分子414。分区406可以不包括复
合物408或核酸分子414(例如,此类分区可以是空的)。包括例如酶(例如,聚合酶)和核苷酸的试剂也可以包括在所述多个分区中的分区中。如图4a的右图所示,所述多个分区中的分区还可以包括多个引物分子416。引物分子416可以包括核酸序列418、可切割或可切除部分420(示出为尿嘧啶碱基)和捕获实体422(示出为生物素部分)。核酸序列418可以与核酸分子414的序列或其互补核酸序列互补。核酸序列418可以与核酸分子414的序列相同或同源。在分区400中,复合物408可以经受足以使引物分子412与核酸分子414杂交并且延伸引物分子412的条件,以产生具有与核酸分子414的序列418互补的序列的链426。然后核酸分子414可以与链426解离。
[0511]
如图4a的右图所示,在分区400中,引物分子416的核酸序列418和与支持物410偶联的链426可以经受足以使核酸序列418与链426的序列杂交的条件。所得复合物424可以包括与链426偶联的支持物410,所述链与包括可切割或可切除部分420和捕获实体422的引物分子416杂交。复合物424不可以在不包括复合物408和核酸分子414的分区402、404或406中产生。
[0512]
如图4b所示,在分区400中,可以执行克隆扩增过程以提供包括与多个双链核酸分子偶联的支持物410的复合物428,其中所述多个双链核酸分子中的双链核酸分子可以包括链426和包含核酸序列418、可切割或可切除部分420以及捕获实体422的链430。所述多个双链核酸分子中的一个或多个双链核酸分子可以不包括可切割或可切除部分或捕获实体(未示出)。复合物428的产生可以包括与链426偶联的引物分子416的延伸以及涉及一个或多个额外的引物分子的后续处理(例如,如本文所描述的)。给定支持物410可以包括此类双链核酸分子的克隆群体,所述克隆群体可以包括例如至少约100个、1,000个、10,000个、100,000个、500,000个、1,000,000个或更多个此类核酸分子。扩增过程可以包括乳液pcr。
[0513]
如图4c所示,内含物可以从所述多个分区中回收(例如,可以破坏乳液)。此类内含物(包括复合物408、核酸分子414、引物分子416和复合物428)可以提供在溶液(如缓冲溶液)中。可以提供捕获性实体432。捕获性实体432可以包括多个与表面偶联的亲和素(例如,链霉亲和素)部分。溶液可以经受足以使复合物428的捕获实体422与捕获性实体432偶联的条件。与捕获性实体432偶联的复合物428可以被(例如,如本文所描述的)溶液中的其它组分分离,如通过洗去包括(例如,如本文所描述的)“空”支持物的其它组分。复合物428可以在溶液中富集和/或分离(例如,如本文所描述的)。然后(例如,如本文所描述的)切割剂可以用于使捕获实体422从捕获性实体432上解脱偶联,由此释放包括与包括链426和436的多个双链核酸分子偶联的支持物410的复合物434。然后此类复合物可以用于包括核酸测序的下游处理(例如,如本文所描述的)。
[0514]
预富集和后富集方法也可以组合。如图4d所示,复合物462被用作到多个分区中的输入。复合物462等同于复合物326,并且是支持物偶联的双链体靶分子。由于输入自动具有支持物(珠)与模板(双链体分子)1:1的比率,因此珠中没有多克隆的风险。这允许输入模板与分区的比率更高,并产生更少的空分区和更少的浪费试剂。所述多个分区中的分区可以包括一个或多个不同的组分。包括例如酶(例如,聚合酶)和核苷酸的试剂也可以包括在所述多个分区中的分区中。多个引物分子416也被添加到分区中。引物分子416可以具有这样的丰度,使得所有分区都接收引物。引物分子416可以包括核酸序列418、可切割或可切除部分420(示出为尿嘧啶碱基)和捕获实体422(示出为生物素部分)。核酸序列418可以与位于
或靠近链476的3'端的序列互补。在包括复合物462的分区450内,不与支持物460偶联的链480与偶联的链476解离。链480可以和与支持物460偶联的其它引物杂交,或链480可以保留在分区内的溶液中。在分区450中,复合物462可以经受足以使引物分子416与链476杂交的条件以产生复合物424。同时,链480可以和与支持物460偶联的其它引物杂交。分区406没有接收复合物462并且仅包括引物分子416。然后如图4b和4c所详述的,继续进行扩增和后富集。可替代地,链480可以在与分区接触之前与链476解离。在此类实施方式中,如图4e所示,包括支持物460和缀合链476的复合物463装载到分区中。再次,珠与模板分子的比率为1:1,从而确保仅发生克隆扩增。在引物分子416延伸以产生链430之后,使链430解离并且然后可以与支持物460上的游离引物杂交。然后如图4b和4c所详述的,继续进行扩增和后富集。
[0515]
测序
[0516]
本公开还提供了分析核酸分子的方法。一种分析核酸分子的方法可以包括核酸测序。分析核酸分子的方法可以包括提供核酸分子(例如,双链核酸分子)。所述核酸分子可以包括脱氧核糖核酸(dna)和/或核糖核酸(rna)。所述核酸分子可以包括包含至少两个可切割或可切除部分的第一链以及第二链。所述至少两个可切割或可切除部分可以独立地选自由以下组成的组:核糖核酸(rna)碱基、尿嘧啶碱基、肌苷碱基、2,6-二氨基-4-羟基-5-甲酰胺嘧啶(fapyg)碱基、8-氧代-7,8-二氢鸟嘌呤(8oxog)碱基和光可切割碱基。所述至少两个可切割或可切除部分中的两个或更多个可以属于不同类型。可替代地或另外地,所述至少两个可切割或可切除部分中的两个或更多个可以属于同一类型。在一些实施方式中,至少两个可切割或可切除部分是至少三个可切割或可切除部分。在一些实施方式中,部分是碱基。
[0517]
所述核酸分子可以与支持物(如颗粒)偶联。所述核酸分子可以包括捕获实体或与所述捕获实体偶联。所述捕获实体可以包括选自由以下组成的组的一个或多个成员:生物素、亲和素、核酸序列、带电颗粒和磁性颗粒。所述捕获实体可以被配置成与捕获性实体偶联。所述捕获性实体可以包括选自由以下组成的组的一个或多个成员:生物素、亲和素、核酸序列、电场系统和磁场系统。所述捕获实体可以与所述捕获性实体偶联。所述捕获性实体可以与额外的支持物(如颗粒)偶联。
[0518]
所述核酸分子可能已经历如本文所描述的富集和/或分离过程(例如,预富集过程)。核酸分子(例如,与支持物偶联的核酸分子)可以经受足以切割或切除所述至少两个可切割或可切除部分中的一个或多个的条件,由此产生与支持物偶联的经切割的核酸分子。使核酸分子经受足以切割或切除所述至少两个可切割或可切除部分中的一个或多个的条件可以包括使核酸分子接触切割剂,所述切割剂被配置成切割或切除所述一个或多个可切割或可切除部分。所述切割剂可以选自由以下组成的组:例如尿嘧啶dna糖苷酶(udg)、无嘧啶/无嘌呤核酸内切酶(ape)、核酸内切酶(例如,核酸内切酶viii(endoviii)或v(endov))、尿嘧啶特异性切除试剂(user)酶、甲酰胺嘧啶dna糖苷酶(fpg)、8-氧代鸟嘌呤糖苷酶(ogg1)、rna酶(例如,rna酶h,如rna酶hii)、紫外线以及其组合。使核酸分子经受足以切割或切除所述至少两个可切割或可切除部分中的一个或多个的条件可以使核酸分子从额外的支持物上解脱偶联,其中核酸分子包括捕获实体或与所述捕获实体偶联,所述捕获实体和与额外的支持物偶联的捕获性实体偶联。
[0519]
所述经切割的核酸分子可以包括缺口或空位区。例如,经切割的核酸分子可以包
括包含单个碱基的缺口。例如,经切割的核酸分子可以包括包含占两个或更多个碱基(如至少2个、3个、4个、5个、6个、7个、8个、9个、10或更多个碱基)的空位区。缺口或空位区可以包括靶核酸序列或其互补序列。可替代地或另外地,所述缺口或空位区可以与靶核酸序列或其互补序列相邻。在一些实施方式中,其互补序列是其互补核酸序列。
[0520]
所述方法可以包括使经切割的核酸分子接触(例如,如本文所描述的)聚合酶和(例如,如本文所描述的)标记的核苷酸。所述标记的核苷酸可以包括荧光染料,如通过连接子与核苷酸偶联的荧光染料。所述标记的核苷酸可以被配置成发出信号(例如,荧光信号)。标记的核苷酸可以未被封端。所述标记的核苷酸可以是多个核苷酸中的核苷酸。所述多个核苷酸可以包括多个标记的核苷酸。例如,所述多个核苷酸中的每个核苷酸可以是标记的核苷酸。所述多个核苷酸中的每个核苷酸可以属于同一类型(例如,包括相同典型碱基,如a、c、g和u/t)。所述经切割的核酸分子可以经受足以将标记的核苷酸并入到经切割的核酸分子的缺口或空位区中的条件。所述经切割的核酸分子可以经受足以将标记的核苷酸并入到包括缺口或空位区的链中的条件。所述经切割的核酸分子可以经受足以将标记的核苷酸并入到新合成的链中的条件。在一些实施方式中,新合成的链(newly synthesized strand)是新合成中的链(newly synthesizing strand)。在一些实施方式中,所述新合成的链与不包括缺口或空位区的链互补。在一些实施方式中,所述不包括缺口或空位区的链是第二链。在一些实施方式中,所述不包括缺口或空位区的链是第一链。额外的核苷酸也可以并入到缺口或空位区或与其相邻的位置中(即,并入到新合成中的链中)。所述额外的核苷酸可以是所述多个核苷酸中的标记的核苷酸。在并入多个核苷酸的情况下,此类核苷酸可以并入到经切割的核酸分子的均聚区中。标记的核苷酸以及任选地额外的核苷酸的并入可以使用(例如,如本文所描述的)聚合酶(如链置换聚合酶)完成。可以从经切割的核酸分子中检测到信号或信号变化。所述信号或信号变化可以指示标记的核苷酸并入到经切割的核酸分子的缺口或空位区中。
[0521]
核酸分子或经切割的核酸分子可以位于分区内。支持物可以位于分区中。例如,可以在分区内执行可切割或可切除部分的切割或切除。可替代地或另外地,可以在分区内执行并入核苷酸(例如,标记的核苷酸)。分区可以是例如乳液的液滴。可替代地,分区可以是孔。
[0522]
上述测序方法的全部或一部分可以重复一次或多次。例如,所述与经切割的核酸分子偶联的支持物可以接触额外的多个核苷酸(例如,包括多个额外的标记的核苷酸的额外的多个核苷酸),并且额外的多个核苷酸中的额外的核苷酸可以并入到经切割的核酸分子中。额外的核苷酸可以属于与先前并入的标记的核苷酸不同的类型。所述多个核苷酸和额外的多个核苷酸中的核苷酸可以各自属于核苷碱基的不同类型。所述额外的核苷酸可以是标记的核苷酸或未标记的核苷酸。所述额外的核苷酸可以是未封端的。在使支持物接触额外的多个核苷酸之前,可以使用例如洗涤流从先前测序过程中洗去试剂和核苷酸。还可以使用一种或多种额外的溶液流,如包括用于从标记的核苷酸中去除标记的试剂的流或包括多个未标记的核苷酸的流。将额外的核苷酸并入到经切割的核酸分子中可以包括使经切割的核酸分子的第一链的一部分与第二链的一部分分离。在使经切割的核酸分子接触额外的核苷酸之后,可以检测到额外的信号或信号变化(例如,使用成像)。
[0523]
上述过程可以应用于多个核酸分子,如与给定支持物偶联的多个核酸分子或与多
个支持物偶联的多个核酸分子。测序过程的全部或一部分可以在(例如,如本文所描述的)分区内发生。分析多个核酸分子(例如,多个脱氧核糖核酸分子或多个核糖核酸分子)的方法可以包括提供支持物(例如,颗粒),所述支持物包括与其偶联的多个核酸分子。支持物可以固定到另一支持物。例如,支持物可以是固定到表面的颗粒。所述多个核酸分子中的每个核酸分子可以包括:(i)第一链,所述第一链包括至少两个可切割或可切除部分;以及(ii)第二链。所述至少两个可切割或可切除部分可以独立地选自由以下组成的组:核糖核酸(rna)碱基、尿嘧啶碱基、肌苷碱基、2,6-二氨基-4-羟基-5-甲酰胺嘧啶(fapyg)碱基、8-氧代-7,8-二氢鸟嘌呤(8oxog)碱基和光可切割碱基。所述至少两个可切割或可切除部分中的两个或更多个可以属于不同类型。可替代地或另外地,所述至少两个可切割或可切除部分中的两个或更多个可以属于同一类型。所述可切割或可切除部分可以跨与支持物偶联的多个核酸分子变化。
[0524]
所述多个核酸分子可以包括多个捕获实体或与所述多个捕获实体偶联。例如,所述多个核酸分子中的每个核酸分子可以包括所述多个捕获实体中的捕获实体或与所述捕获实体偶联。可替代地,所述多个核酸分子中的至少一个核酸分子可以不包括捕获实体或不与所述捕获实体偶联。
[0525]
所述多个核酸分子可以包括共同的核酸序列。共同的核酸序列可以是靶核酸序列。所述多个核酸分子可以包括核酸分子的克隆群体。
[0526]
如本文所描述的,与支持物偶联的核酸分子可能已经历富集和/或分离过程(例如,预富集过程)。如本文所描述的,所述多个核酸分子可能已经历富集和/或分离过程(例如,后富集过程)。与所述多个核酸分子偶联的支持物可以经受足以切割或切除所述多个核酸分子中的核酸分子的所述至少两个可切割或可切除部分中的一个或多个的条件,由此产生与支持物偶联的多个经切割的核酸分子。使支持物经受足以切割或切除所述多个核酸分子中的核酸分子的所述至少两个可切割或可切除部分中的一个或多个的条件可以包括使支持物接触切割剂或多个切割剂,所述切割剂被配置成切割或切除所述一个或多个可切割或可切除部分。使支持物经受足以切割或切除所述至少两个可切割或可切除部分中的一个或多个的条件可以使一个或多个核酸分子从额外的支持物(例如,颗粒)上解脱偶联,其中所述一个或多个核酸分子包括与捕获性实体偶联的捕获实体或与所述捕获实体偶联,所述捕获性实体与额外的支持物偶联。
[0527]
本公开可以提供一种对靶核酸序列进行测序的方法。所述方法可以包括:提供包括双链核酸分子的溶液,其中双链核酸分子可以包括第一链上的靶序列和至少两个可切割或可切除部分(例如,可切割碱基);从双链核酸分子中切割所述至少两个可切割或可切除部分,以产生带缺口的双链核酸分子;使带缺口的双链核酸分子接触聚合酶和标记的核苷酸;以及测量标记的核苷酸到与靶核酸分子互补或同源的新合成的核酸分子中的整合,由此对靶核酸序列进行测序。
[0528]
本公开可以提供一种对双链核酸分子进行测序的方法。所述方法可以包括:分离附接到(例如,如本文所描述的)双链核酸分子的克隆群体的至少一个支持物(例如,颗粒);使双链核酸分子的群体接触聚合酶和标记的核苷酸;以及测量标记的核苷酸到与双链核酸分子群体中的双链核酸分子互补或同源的新合成的核酸分子中的整合,由此对双链核酸分子进行测序。
[0529]
本公开可以提供一种测定靶核酸序列的方法。所述方法可以包括:提供包括包含靶序列和位于靶序列的5'端的缺口的第一链的双链核酸分子;使带缺口的双链核酸分子接触聚合酶和标记的核苷酸;以及测量标记的核苷酸到与靶核酸分子互补或同源的新合成的核酸分子中的整合,由此测定靶核酸序列。
[0530]
所述核酸分子(例如,双链核酸分子)可以是dna分子。双链核酸分子可以与第一支持物(例如,第一固相支持物,如颗粒)偶联。附接到第一支持物的双链核酸分子可以是如本文所描述的组合物,并且可以如本文所描述的进行制备。双链核酸分子可以包括第一链上的至少两个可切割或可切除部分(例如,可切割碱基)。所述至少两个可切割或可切除部分(例如,可切割碱基)可以是多个可切割或可切除部分。
[0531]
所述双链核酸分子可以包括安置在处于或靠近双链核酸分子的末端(例如,远离支持物的末端,如“游离”末端)的(例如,如本文所描述的)捕获实体。末端可以是5'端。双链核酸分子可以通过捕获实体与包括(例如,如本文所描述的)捕获性实体的第二支持物(例如,第二固相支持物)连接。在此类情况下,切割或切除可切割或可切除部分可以释放出第二支持物的带缺口的双链核酸分子。切割可以释放出与来自第二支持物的第一支持物连接的带缺口的双链核酸分子。这可以允许同时对靶分子进行富集并且产生缺口,例如,用于测序。因此,可以使用单个过程进行纯化并且开始测序过程,这可以精简核酸分析并允许一次分离和测序所有双链模板。
[0532]
所述支持物可以包括双链核酸分子的克隆群体。每个双链核酸分子可以包括包含靶序列和位于靶序列的5'端的缺口的第一链。所述缺口可以是空位区,如占至少2个、3个、4个、5个、6个、7个、8个、9个、10个或更多个碱基的空位区。
[0533]
所述至少两个可切割或可切除部分可以足够地位于末端的下游,使得中间碱基可以不与另一链解离。所述至少两个可切割或可切除部分可以与末端保持足够的距离,使得切除不使中间碱基解离。如上文所述,双链核酸分子的缺口可以在带缺口的链上产生不稳定性。如果彼此连接的碱基的数量不足,那么与第二链的碱基配对可能不足以防止碱基解离。所述可切割或可切除部分可以定位成使得双链核酸分子的5'末端可以不丢失。所述可切割或可切除部分可以定位成使得可以在缺口处产生3'末端。
[0534]
切除不使中间碱基解离的足够距离可以是至少3个、4个、5个、6个、7个、8个、9个或10个碱基。切除不使中间碱基解离的足够距离可以大于3个碱基。切除不使中间碱基解离的足够距离可以是至少10个碱基。切除不使中间碱基解离的足够距离可以大于10个碱基。
[0535]
第一可切割或可切除部分可以靠近5'末端,并且第二可切割或可切除部分可以与第一可切割或可切除部分保持足够的距离,使得切除不使中间碱基解离。第三可切割或可切除部分也可以与第一可切割或可切除部分保持足够的距离,使得切除不使中间碱基解离。第二可切割或可切除部分和第三可切割或可切除部分可以足够接近,使得切除确实使中间碱基解离。
[0536]
所述至少两个可切割或可切除部分既可以足够地位于末端的下游,也可以是靠近末端的可切割或可切除部分,使得切除不使中间碱基解离。所述至少两个可切割或可切除部分可以彼此足够接近,使得切除确实使中间碱基解离。所述两个可切割或可切除部分可以彼此靠近。所述可切割或可切除部分的切割可以产生空位区而不是缺口。“空位”可以是至少2个丢失碱基的延伸段。缺口可以包括空位。空位区的长度可以为至少2个核苷酸。空位
区的长度可以不超过5个、6个、7个、8个、9个或10个核苷酸。空位区的长度可以不超过5个核苷酸。使得切除确实使中间碱基解离的足够距离可以少于10个、9个、8个、7个、6个、5个、4个、3个、2个或1个碱基。使得切除确实使中间碱基解离的足够距离可以少于10个碱基。使得切除确实使中间碱基解离的足够距离可以不大于3个碱基。
[0537]
这两个可切割或可切除部分的切割可以在一条链中产生空位区。由于空位区可能不靠近5'末端,因此可以在空位区处产生可用(例如,“游离”)3'末端。此末端可以用作可以在空位区开始延长核酸序列的传入聚合酶的引物,从而合成新的链或其部分。所述聚合酶可以使用位于去除的可切割或可切除部分的上游的末端(例如,3'末端)作为链合成的模板。所述聚合酶可以使用位于缺口上游的末端(例如,3'末端)作为链合成的模板。所述聚合酶可以使用位于空位区上游的末端(例如,3'末端)作为链合成的模板。所述缺口可以通过切割可切割或可切除部分而产生。
[0538]
所述双链分子可以包括至少3个可切割或可切除部分,其中第一可切割或可切除部分可以靠近5'捕获实体。所述至少3个可切割或可切除部分中的至少两个可切割或可切除部分可以与第一可切割或可切除部分保持足够的距离,使得切除可以不诱导中间碱基的解离,并且所述至少3个可切割或可切除部分中的至少两个可切割或可切除部分可以彼此足够接近,使得切除可以诱导中间碱基的解离。在此类系统中,接触切割剂的单个步骤既可以释放分离的复合物,也可以准备好双链核酸分子以进行测序。
[0539]
双链核酸分子可以通过以下产生:提供双链核酸分子,所述双链核酸分子包括包含靶序列和位于靶序列的5'端的至少一个可切割或可切除部分(例如,可切割碱基)的第一链;以及切割所述至少一个可切割碱基。提供包括至少一个可切割或可切除部分(例如,可切割碱基)的双链核酸分子可以包括:提供包括与靶序列反向互补的序列的单链核酸分子;提供与至少一个单链分子的3'末端反向互补并且包括至少一个可切割或可切除部分(例如,可切割碱基)的第二核酸分子;以及使第二核酸分子经受足以使至少一个第一单链核酸分子杂交以产生双链核酸分子的条件。
[0540]
所述第二核酸分子可以是第二引物分子。所述第二核酸分子可以是衔接子。所述衔接子可以是双链衔接子。所述方法可以进一步包括从第二核酸分子延伸与包括靶序列的单链核酸分子反向互补的序列。所述方法可以进一步包括从第二核酸分子延伸与包括靶序列的单链核酸分子反向互补的序列。所述第二核酸分子可以缺乏靶序列。所述第二核酸分子可以是通用引物。所述第二核酸分子可以与至少一个单链分子的3'衔接子区反向互补。所述3'区可以是5'衔接子区的反向互补序列。
[0541]
所述单链核酸分子可以附接到第一支持物。提供单链核酸分子可以包括:提供包括多个第一支持物的溶液,每个支持物包括至少一个第一引物分子;使溶液与至少一个包括靶序列的模板核酸分子和与第一引物分子反向互补的3'区接触;使所述至少一个模板核酸分子经受足以使所述至少一个模板核酸分子与至少一个第一引物分子杂交的条件;使与所述至少一个第一引物分子杂交的所述至少一个模板核酸分子经受足以从所述至少一个第一引物分子延伸与所述至少一个模板核酸分子反向互补的核酸序列的条件;以及使模板核酸分子经受足以使模板核酸分子与反向互补分子解离的条件,以产生包括与至少一个第一单链核酸分子偶联的至少一个第一支持物的溶液。
[0542]
所述3'区可以是3'引物衔接子。所述衔接子可以是通用衔接子,并且可以与支持
物引物反向互补。所述第一引物分子可以是支持物引物分子。所述模板核酸分子可以进一步包括5'衔接子序列。所述至少一个第一单链核酸分子可以包括与5'衔接子序列反向互补的3'区。第二核酸分子可以与5'衔接子同源,并且因此与所述至少一个单链分子的3'末端反向互补。
[0543]
还可以使用多个第二引物分子和/或第三引物分子。第二引物分子和/或第三引物分子包括至少两个可切割或可切除部分(例如,可切割碱基)。所述第二引物分子可以包括至少两个可切割或可切除部分。所述第三引物分子可以包括至少两个可切割或可切除部分。所述第二核酸分子可以包括至少两个可切割或可切除部分。所述至少两个可切割或可切除部分中的至少一个可以与末端的下游保持足够的距离,使得可切割或可切除部分的切除不诱导中间碱基的解离。所述至少两个可切割或可切除部分中的一个可以靠近引物分子的5'捕获实体。至少两个可切割或可切除部分可以以足够的距离处于5'末端的下游,使得可切割或可切除部分的切除可以不诱导中间碱基的解离。所述足够下游的至少两个可切割碱基可以彼此靠近。所述足够下游的至少两个可切割碱基可以靠近引物分子的3'末端。通过将可切割或可切除部分定位在3'末端,所述可切割或可切除部分将靠近靶序列的起始,这可以允许聚合酶立即开始合成靶序列。所述足够下游的至少两个可切割或可切除部分可以彼此足够接近,使得切除可以诱导中间碱基的解离。所述引物分子可以包括至少3个可切割或可切除部分,其中第一可切割或可切除部分可以靠近5'捕获实体,所述可切割或可切除部分中的至少两个可切割或可切除部分可以与第一可切割或可切除部分保持足够下游距离,使得切除可以不诱导中间碱基的解离,并且足够下游的至少两个碱基可以彼此足够接近,使得切除可以诱导中间碱基的解离。所述至少三个可切割或可切除部分中的任何一个可切割或可切除部分的切割或切除可以被配置成不诱导中间碱基的解离。所述解离或缺乏解离可以属于来自核酸分子的第二链的一个或多个碱基(例如,中间碱基)。在本文所提供的富集方法中使用此类引物分子可以导致分离如可以用于本文所提供的测序方法的双链核酸分子。
[0544]
下表1中提供了可能的引物序列的非限制性实例。可切割的尿嘧啶碱基带有下划线。seq id no:1和seq id no:2提供了带有具有靠近的可切割碱基的5'生物素部分的引物,使得分子可以在捕获之后游离。所述引物也可以在没有5'生物素的情况下使用。seq id no:3可以缺乏捕获实体,并且因此也不具有5'靠近的可切割碱基。seq id no:2和seq id no:3只具有单个可切割3'尿嘧啶,并且因此在切除时只可以产生一个缺口。seq id no:1具有两个彼此靠近的可切割碱基,使得切除也可以去除中间碱基(cag)。
[0545]
seq id no序列5'生物素1gtuccatctcatccctgcgtgtctccgacucagu是2gtuccatctcatccctgcgtgtctccgacucag是3ccatctcatccctgcgtgtctccgacucag否
[0546]
切割剂的实例包括但不限于udg、ape、user、endoviii、rna酶、endov、fpg、ogg1和光(例如,紫外光)。所述光可以是激光。切割剂可以基于给定系统中包括的一个或多个可切割或可切除部分选择,使得切割剂可以被配置成切割或切除一个或多个可切割或可切除部分。一种或多种不同的切割剂可以彼此组合使用。方法可以进一步包括使核酸分子与另一种酶促剂接触以产生功能性缺口。功能性缺口可以是聚合酶可以开始链合成的缺口。此类
酶促剂可以是例如t4多核苷酸激酶(t4 pnk)。也可以使用被配置成去除或修复病变(例如,3'病变)的酶。此类修复酶的实例包括但不限于apn1、apn2和tpp1。
[0547]
聚合酶可以是链置换聚合酶。聚合酶可以包括5'至3'核酸外切酶活性。所述聚合酶可以是例如链置换型(strand-displacement)(例如,链置换(strand-displacing))聚合酶和/或具有5'至3'核酸外切酶活性的聚合酶。链置换聚合酶的实例包括但不限于bst dna聚合酶、大片段聚合酶和φ29聚合酶。具有5'至3'核酸外切酶活性的聚合酶的实例包括但不限于taq聚合酶和dna聚合酶i(非克列诺)。
[0548]
可以使用多种聚合酶,所述聚合酶中的许多聚合酶是可商购获得的。例如,可以使用属于a族、b族和c族中的任何一族的聚合酶。a族聚合酶可以是可以包括多种酶促功能(包括聚合酶、3'至5'核酸外切酶活性和5'至3'核酸外切酶活性)的单链蛋白。b族聚合酶可以具有带有聚合酶和3'至5'核酸外切酶活性以及辅助因子的单一催化结构域。c族聚合酶可以是具有聚合和3'至5'核酸外切酶活性的多亚基蛋白。c族聚合酶也可以具有链置换活性。还可以使用额外的聚合酶。例如,在大肠杆菌(e.coli)中,已经发现了三种类型的dna聚合酶,即dna聚合酶i、ii和iii(分别类似于a族、b族和c族)。在真核细胞中,三种不同的b族聚合酶(即dna聚合酶α、δ和∈)与核复制有关,并且a族聚合酶(即聚合酶γ)可以用于线粒体dna复制。其它类型的dna聚合酶包括噬菌体聚合酶。可以在本文所提供的方法中使用任何此类聚合酶。
[0549]
测量核苷酸到核酸分子中的整合可以包括检测并入的标记的核苷酸的存在或不存在,如通过检测信号或信号变化(例如,荧光信号)。所述检测可以是检测延伸的第一链中的存在或不存在。当可以检测到并入的标记的核苷酸的存在时,也可以检测到串联的相同类型的大于一个碱基的延伸段的存在和大小或不存在。也可以检测将多个顺序核苷酸并入到核酸链中(例如,并入到核酸链的均聚区中)的检测。不存在信号可以指示没有并入。在一些实施方式中,所述检测或测量核苷酸的整合是对互补链的测序。
[0550]
所述方法可以进一步包括洗涤以去除未并入的核苷酸。所述方法可以进一步包括用第二单核苷酸溶液、第三单核苷酸溶液和第四单核苷酸溶液(例如,包括包含不同典型碱基(包括a、c、g和t/u)的核苷酸的额外的核苷酸溶液)重复上述过程。可以重复这些步骤,直到没有新的核苷酸并入为止(例如,直到分析所关注的核酸序列为止)。因此,每个碱基可以一次添加一个,并且可以测量并入,直到所有四个碱基都已添加为止。可以重复此操作,直到已经对靶序列的全长进行测序为止。所述方法可以包括在添加每个碱基之后洗涤以及在一些情况下使用额外的溶液,所述额外的溶液包括包含用于从标记的核苷酸切割标记的试剂的溶液和包含未标记的核苷酸的追加液。
[0551]
多个核苷酸可以是多个标记的核苷酸。例如,核苷酸溶液中100%的核苷酸可以被标记。在另一个实例中,溶液中少于100%、90%、80%、70%、60%、50%、40%、30%、20%或10%的核苷酸可以被标记。例如,核苷酸溶液中少于20%的核苷酸可以被标记。在另一个实例中,由聚合酶并入的核苷酸中少于100%、90%、80%、70%、60%、50%、40%、30%、20%和10%的核苷酸可以是并入的核苷酸。在一个实例中,由聚合酶并入的核苷酸中少于20%的核苷酸可以是标记的核苷酸。
[0552]
在测序过程中使用的材料可以被选择以优化测序过程。例如,可以使用聚合酶(例如,dna聚合酶)和标记的核苷酸,所述聚合酶和标记的核苷酸使并入效率最大化并且使并
入可变性最小化。选择此类材料可以减少或避免标记的核苷酸并入效率的差异可能性。各种聚合酶(例如,dna聚合酶)可以有效地沿核酸(例如,dna)模板并入荧光标记的核苷酸(例如,dntp),以产生独立于序列上下文的非常均匀的片段。此类聚合酶可以用于使用毛细管阵列dna测序器的基于桑格/双脱氧的自动测序方法(automated sanger/dideoxy-based sequencing method)。许多天然和工程化dna聚合酶能够并入荧光标记的脱氧核糖核苷酸。可以在例如reeve和fuller《自然(nature)》376,796-97(1995);rosenblum等人,《核酸研究(nucleic acids res.)》25,4500-04(1997);ramanathan等人《分析生物化学(anal biochem)》337,1-11(2005);aksyonov等人《分析生物化学》348,127-138(2006);tabor和richardson,《生物化学杂志(j biol chem)》265,8322-28(1990);zhu等人,《核酸研究(nucleic acids res.)》22,3418-22(1994);zhu和waggoner《细胞计数法(cytometry)》28,206-211(1997);randolph和waggoner《核酸研究》25,2923-29(1997);mitra等人《分析生物化学》320,55-65(2003);anderson等人《生物技术(biotechniques)》38,257-264(2005)中找到实例,所述文献中的每个文献通过引用并入本文。
[0553]
测序过程可以包括通过合成进行测序。在例如国际专利申请wo2010/117804和wo1998/044152中公开了测序方法的额外的实例,所述国际专利申请中的每个国际专利申请以全文引用的方式并入本文。
[0554]
一个或多个核酸分子(例如,双链核酸分子)可以并行执行。所述一个或多个核酸分子可以与相同或不同的支持物偶联。所述一个或多个核酸分子可以各自包括靶序列,所述靶序列可以是相同的或不同的。例如,多个双链核酸分子可以包括多个可以并行分析的靶序列。多个双链核酸分子可以包括(例如,如本文所描述的)核酸分子的克隆群体。
[0555]
从双链核酸模板进行测序可以减少序列测定中的二级结构依赖性错误。在并入标记的核苷酸时,由与支持物偶联的核酸分子所产生的信号或信号变化可以基于并入位点的上下文而扰乱或改变。靶序列中的二级结构可以减缓并入,降低并入速率或甚至排斥并入。当并非所有核苷酸都是标记的核苷酸时(例如,当测序过程中使用的多个核苷酸包括多个未标记的核苷酸时),这些类型的扰动可能更多地增加测序过程中的错误率。使用双链核酸模板可以减少与二级结构相关联的问题,因为所述模板可能不会以单链模板可以的相同方式自身退火。
[0556]
如本文所使用的,术语“上下文依赖性(context dependence)”或“上下文依赖性(context dependency)”通常是指与局部序列、相对核苷酸表示或基因组位点的信号相关性。给定序列的信号可能由于上下文依赖性而变化,所述上下文依赖性可能取决于局部序列、序列的相对核苷酸表示或序列的基因组位点。
[0557]
通过流动边合成边测序(sequecing by synthesis,sbs)可以包括执行重复的核酸(例如,dna)延伸循环,其中核苷酸和/或标记的核苷酸类似物的单个物种在所谓的“流动”中呈递到引物-模板-聚合酶复合物中,如果所述单个物种与模板的下一开放位置互补,则将其并入核苷酸。每个流动的产物可以对模板的每个克隆群体(例如,珠或集落)进行测量。可以通过明确区分对应于零个、一个、二个、三个、四个、五个、六个、七个、八个、九个、十个或大于十个顺序并入(例如,在并入到均聚区的情况下)或与所述顺序并入相关联的信号来检测和定量所得核苷酸并入。对此类多个顺序并入的准确定量可以包括定量并入在每个流动的集落中的0个、1个、2个、
……
、n个顺序核苷酸的每种可能均聚物的特性信号。例如,
包括顺序a核苷酸的均聚物可以表示为a、aa、aaa、
……
、至多n个顺序a核苷酸。由于信号水平中的随机和不可预测的系统性变化,因此对均聚物长度(例如,序列中许多顺序的相同核苷酸)的准确定量可能会面临挑战,这可能导致定量均聚物长度的错误。对均聚物长度(例如,序列中许多顺序的相同核苷酸)的准确定量也可能由于序列上下文依赖性信号而面临挑战,每个序列的序列上下文依赖性信号可能不同。例如,在稀释标记的核苷酸的荧光测量的情况下,序列上下文可能影响标记的类似物的数量(对并入标记的类似物的可变耐受性)以及单独标记的类似物的荧光(例如,受
±
5碱基的局部上下文影响的染料的量子产率,如kretschy等人,cy3和cy5标记的双链dna的序列依赖性荧光(sequence-dependent fluorescence of cy3-and cy5-labeled double-stranded dna),《生物缀合物化学(bioconjugate chem.)》,27(3),第840-848页所描述的,所述文献以全文引用的方式并入本文)。在实践中,在染料-终止子桑格循环测序的情况下,已经确定3-碱基上下文中信号的重大系统性变化(例如,如zakeri等人,“二氯罗丹明和能量转移染料终止子测序中的峰高度模式(peak height pattern in dichloro-rhodamine and energy transfer dye terminator sequencing)”,《生物技术》,25(3),第406-10页所描述的,所述文献以全文引用的方式并入本文)。
[0558]
现在参考图5a至5b,其示出了示例性测序方法。图5a示出了包括支持物502(例如,珠)的复合物500,所述支持物已通过5'端连接的生物素部分518与捕获性树脂520(例如,链霉亲和素)偶联。许多此类复合物可以与树脂偶联,即使为简单起见,仅示出了单个复合物。复合物500包括与其偶联的多个核酸分子。所述多个核酸分子中的一个或多个核酸分子可以包括生物素部分和一个或多个可切割或可切除部分,即使仅示出了一个此类实例。与支持物502偶联的核酸分子包括链504和506。链506包括序列508,所述序列包括可切割或可切除部分512、514和516(此处示出为尿嘧啶碱基)。生物素部分518与链506的末端处的序列508的碱基偶联。链506还包括第一靶序列510。复合物500可以接触(例如,如本文所描述的)如udg或ape等切割剂以切割或切除可切割或可切除部分512、514和516。如图5b所示,在切割或切除可切割或可切除部分512时,链506的5'末端处的额外的碱基可以解离以在经修饰的链522的序列524的5'末端处提供空位区526。在切割或切除可切割或可切除部分514和516时,可以产生与靶序列510相邻(例如,5'相邻)的空位区528。位于空位区528的5'端的剩余序列可以用作引物,聚合酶530可以与所述引物相互作用。聚合酶530可以开始从此序列的可用3'末端朝向靶序列510延伸。序列510可以在延伸过程期间与链504解离(例如,如果聚合酶530是链置换聚合酶)。延伸可以包括并入标记的和/或未标记的核苷酸(例如,如上文所描述的核苷酸)。
[0559]
现在参考图5c至5e,其示出了双端测序方法的示例性实施方式。此方法与预富集步骤组合示出,即使此步骤不是必需的。如图5c所示,复合物550等同于图5a所示的复合物500;不同之处在于复合物550包括第二链554,所述第二链包括序列558,所述序列包括可切割或可切除部分564和566(此处示出为rna碱基,“r”),所述可切割或可切除部分与第二靶序列570相邻(例如,5'相邻)。可切割或可切除部分564和566可以位于与支持物502缀合的最初用于与模板核酸结合的原始引物内。此实例中的可切割或可切除碱基564和566可以与链506中的可切割或可切除碱基512、514和516不同的条件切割。可切割或可切除碱基512、514和516的切除如上文所述和图5b所示执行。应当理解的是,碱基512的切割对于测序不是
必需的,但其确实产生空位区526并去除生物素部分518。测序可以在存在富集支持物520(例如,链霉亲和素)的情况下执行,或者可替代地测序可以在没有预富集步骤的情况下执行。聚合酶530开始从空位区528的可用3'末端延伸以产生新序列580,所述新序列包括与第一靶序列510相同的序列。当延伸包括标记的核苷酸的并入并且标记的核苷酸的并入被测量时,对第一靶序列510进行测序。可以通过将加帽(capped)或阻断的核苷酸引入到新序列580中来阻止延伸。为简单起见,复合物550中仅示出了所描述的链。
[0560]
接下来,复合物550可以接触(例如,如本文所描述的)如rna酶等切割剂以切割或切除可切割或可切除部分564和566。如图5d所示,在切割或切除可切割或可切除部分564和566时,可以产生与第二靶序列570相邻(例如,5'相邻)的空位区578。位于空位区578的5'端的剩余序列可以用作引物,聚合酶531可以与所述引物相互作用。聚合酶531可以开始从此序列的可用3'末端朝向第二靶序列570延伸。聚合酶531可以是与聚合酶530相同的聚合酶,或者其可以是不同的聚合酶。第二靶序列570可以在延伸过程期间与链506解离(例如,如果聚合酶530是链置换聚合酶)。延伸可以包括并入标记的和/或未标记的核苷酸(例如,如上文所描述的核苷酸)。如图5e所示,聚合酶531开始从空位区528的可用3'末端延伸以产生新序列590,所述新序列包括与第二靶序列570相同的序列。当延伸包括标记的核苷酸的并入并且标记的核苷酸的并入被测量时,对第二靶序列570进行测序。在产生与序列580/510互补的序列之前,可以停止延伸,或者可以继续产生此类互补序列。
[0561]
现在参考图6a至6d,其示出了双端测序方法的另一个示例性实施方式,所述双端测序方法只需要在链内与支持物缀合的单个可切割或可切除碱基。此方法可以与预富集方法组合使用,即使这不是必需的。图6a示出了复合物600,所述复合物包括与其偶联的多个核酸分子。所述多个核酸分子中的一个或多个核酸分子可以包括一个或多个可切割或可切除部分,即使仅示出了一个此类实例。与支持物602偶联的核酸分子包括链604和606。链604包括序列608,所述序列包括可切割或可切除部分616(此处示出为尿嘧啶碱基)。链604还包括与序列608相邻(例如,3'相邻)的第一靶序列610。链606包括第二靶序列670,所述第二靶序列与链604中的序列互补,所述序列位于第一序列610的3'端。复合物600可以接触(例如,如本文所描述的)如udg或ape等切割剂以切割或切除可切割或可切除部分616。在包括预富集步骤的方法中,还对靠近捕获实体的额外的可切割或可切除部分进行切割或切除,所述捕获实体靠近链606的5'末端(位于第二靶区670的5'端)。捕获实体包括在碱基上,与所述碱基缀合,所述碱基为额外的可切割或可切除部分或位于额外的可切割或可切除部分的5'端,使得额外的可切割或可切除部分的切除使捕获实体与复合物600解离。此切除是由切割或切除可切割或可切除部分616的相同切割剂或由不同的切割剂进行的。
[0562]
如图6b所示,在切割或切除可切割或可切除碱基616时,可以产生与第一靶序列610相邻(例如,5'相邻)的缺口628。产生了对应于切割后保留的序列608的5'片段的序列609。缺口628包括游离5'末端和游离3'末端。如果使用多个可切割或可切除部分,那么产生了代替缺口的空位区。添加5'至3'核酸外切酶632并其消化掉位于缺口628的3'端的区613。第一靶序列610随着区613的消化而降解。链606将不降解,因为其5'末端受到硫代磷酸化亚磷酰胺碱基的存在的保护。如图6c所示,序列609可以用作引物,聚合酶630可以与所述引物相互作用。聚合酶630可以开始从此序列的可用3'末端延伸以产生与第一靶序列610相同的新序列680。当延伸包括标记的核苷酸的并入并且标记的核苷酸的并入被测量时,对第一靶
序列610进行测序。还产生了新序列671,所述新序列与第二靶序列670互补(参见例如图6b)。位于新序列680的3'端的区的产生可以在没有标记的核苷酸的情况下进行,并且可以用核苷碱基的混合物迅速进行。当产生全新的链604时,可以停止延伸,或者可以添加加帽或阻断的核苷酸以停止延伸。
[0563]
图6d示出了第二靶序列670的测序。链606与复合物600解离(例如,通过氢氧化钠或甲酰胺条)。因此,复合物600现在仅包括与链604缀合的珠(例如,支持物)602,所述链包括与第二靶序列670互补的序列671。添加测序引物678,所述测序引物与链604的3'末端中的序列679互补。序列679位于序列671的3'端。还添加了聚合酶631。聚合酶631可以与聚合酶630相同或不同。引物678可以与聚合酶631相互作用。聚合酶631可以开始从引物678的可用3'末端延伸以产生与第二靶序列670相同的新序列690。当延伸包括标记的核苷酸的并入并且标记的核苷酸的并入被测量时,对第二靶序列670进行测序。
[0564]
现在参考图6e至6g,其示出了双端测序方法的另一个示例性实施方式,所述双端测序方法需要在链内与支持物缀合的多个可切割或可切除碱基。此方法可以与预富集方法组合使用,即使这不是必需的。图6e示出了复合物650,所述复合物包括与其偶联的多个核酸分子。所述多个核酸分子中的一个或多个核酸分子可以包括多个可切割或可切除部分,即使仅示出一个此类实例。与支持物602偶联的核酸分子包括链654和606。链654包括序列618,所述序列包括至少两个可切割或可切除部分614和616(此处示出为尿嘧啶碱基)。链654还包括与序列618相邻(例如,3'相邻)的第一靶序列610。链606包括第二靶序列670,所述第二靶序列与链604中的序列互补,所述序列位于第一靶序列610的3'端。复合物650可以接触(例如,如本文所描述的)如udg或ape等切割剂以切割或切除可切割或可切除部分614和616。在包括预富集步骤的方法中,还对靠近捕获实体的额外的可切割或可切除部分进行切割或切除,所述捕获实体靠近链606的5'末端(位于第二靶区670的5'端)。捕获实体包括在碱基上,与所述碱基缀合,所述碱基为额外的可切割或可切除部分或位于额外的可切割或可切除部分的5'端,使得额外的可切割或可切除部分的切除使捕获实体与复合物650解离。此切除是由切割或切除可切割或可切除部分614和616的相同切割剂或由不同的切割剂进行的。在切割或切除可切割或可切除碱基(例如,部分)614和616时,可以产生与靶序列610相邻(例如,5'相邻)的空位区648。位于空位区648的5'端的剩余序列可以用作引物,聚合酶630可以与所述引物相互作用。聚合酶630可以开始从此序列的可用3'末端朝向靶序列610延伸。序列610可以在延伸过程期间与链606解离(例如,如果聚合酶630是链置换聚合酶)。延伸可以包括并入标记的和/或未标记的核苷酸(例如,如上文所描述的核苷酸)。
[0565]
从图6f中可以看出,聚合酶630可以开始从与支持物602缀合的序列的可用3'末端延伸以产生与第一靶序列610相同的新序列680。当延伸包括标记的核苷酸的并入并且标记的核苷酸的并入被测量时,对第一靶序列610进行测序。还产生了与第二靶序列670互补的新序列671(例如,参见图6g)。位于新序列680的3'端的区的产生可以在没有标记的核苷酸的情况下进行,并且可以用核苷碱基的混合物迅速进行。当产生全新的链654时,可以停止延伸,或者可以添加加帽或阻断的核苷酸以停止延伸。
[0566]
图6g示出了第二靶序列670的测序。链606与复合物650解离(例如,通过氢氧化钠或甲酰胺条)。随着链606的解离,被聚合酶630置换的原始链也从复合物650中去除。因此,复合物650现在仅包括与链654缀合的珠602,所述链与上文描述的链604基本上相同并且包
括与第二靶序列670互补的序列671。添加测序引物678,所述测序引物与链654的3'末端中的序列679互补。序列679位于序列671的3'端。还添加了聚合酶631。聚合酶631可以与聚合酶630相同或不同。引物678可以与聚合酶631相互作用。聚合酶631可以开始从引物678的可用3'末端延伸以产生与第二靶序列670相同的新序列690。当延伸包括标记的核苷酸的并入并且标记的核苷酸的并入被测量时,对第二靶序列670进行测序。
[0567]
计算机系统
[0568]
本公开提供了被编程为实施本公开的方法的计算机系统。图7示出了计算机系统701,所述计算机系统被编程或以其它方式配置成执行核酸测序。计算机系统701可以至少部分地基于检测到的光信号的强度来测定序列读段。计算机系统701可以调节本公开的各个方面,例如,执行核酸测序、序列分析并且调节核苷酸的瞬态结合和非瞬态结合(例如,并入)的条件。计算机系统701可以是用户的电子装置或相对于电子装置远程定位的计算机系统。所述电子装置可以是可移动电子装置。
[0569]
计算机系统701包括中央处理单元(cpu,本文中也称为“处理器”和“计算机处理器”)705,所述中央处理单元可以是单核或多核处理器或用于并行处理的多个处理器。计算机系统701还包括存储器或存储器位置710(例如,随机存取存储器、只读存储器、闪存)、电子存储单元715(例如,硬盘)、用于与一个或多个其它系统通信的通信接口720(例如,网络适配器)以及外围装置725,如高速缓存、其它存储器、数据存储装置和/或电子显示适配器。存储器710、电子存储单元715、通信接口720和外围装置725通过如母板等通信总线(实线)与cpu 705通信。电子存储单元715可以是用于存储数据的数据存储单元(或数据储存库)。计算机系统701可以借助于通信接口720可操作地耦接到计算机网络(“网络”)730。网络730可以是英特网、互联网和/或外联网或与英特网通信的内联网和/或外联网。在一些情况下,网络730是电信网络和/或数据网络。网络730可以包括一个或多个计算机服务器,所述一个或多个计算机服务器可以实现如云计算等分布式计算。在一些情况下,网络730借助于计算机系统701可以实施对等网络,所述对等网络可以实现将装置耦接到计算机系统701以充当客户端或服务器。
[0570]
cpu 705可以执行一系列机器可读指令,所述一系列机器可读指令可以体现在程序或软件中。指令可以存储在如存储器710等存储器位置中。指令可以涉及cpu 705,所述指令可以随后编程或以其它方式配置cpu 705以实施本公开的方法。由cpu 705执行的操作的实例可以包括取得、解码、执行和回写。
[0571]
cpu 705可以是电路(如集成电路)的一部分。系统701的一个或多个其它组件可以包括在电路中。在一些情况下,电路是专用集成电路(asic)。
[0572]
电子存储单元715可以存储文件,如驱动程序、库和保存的程序。电子存储单元715可以存储用户数据,例如用户偏好和用户程序。在一些情况下,计算机系统701可以包括一个或多个额外的数据存储单元,所述一个或多个额外的数据存储单元位于计算机系统701外部,如定位在通过内联网或因特网与计算机系统701通信的远程服务器上。
[0573]
计算机系统701可以通过网络730与一个或多个远程计算机系统通信。例如,计算机系统701可以与用户的远程计算机系统通信。远程计算机系统的实例包括个人计算机(例如,便携式pc)、平板或平板pc(例如,ipad、galaxy tab)、电话、智能电话(例如,iphone、支持安卓的装置、)或个人数字助理。用户可以通过网
络730访问计算机系统701。
[0574]
可以通过存储在计算机系统701的电子存储位置上(例如存储器710或电子存储单元715上)的机器(例如,计算机处理器)可执行代码实施如本文所描述的方法。机器可执行代码或机器可读代码可以以软件的形式提供。在使用期间,代码可以由处理器705执行。在一些情况下,代码可以从电子存储单元715中检索并且存储在存储器710上以供由处理器705随时访问。在一些情形下,可以排除电子存储单元715,并且在存储器710上存储机器可执行指令。
[0575]
代码可以被预先编译且被配置成用于与具有被适配成执行所述代码的处理器的机器一起使用或可以在运行期间进行编译。代码可以以编程语言供应,可以选择所述编程语言以实现以预先编译或类编译(as-compiled)的方式执行代码。
[0576]
本文提供的如计算机系统701等系统和方法的各方面可以体现在编程中。技术的各个方面可以被视为通常呈机器(或处理器)可执行代码和/或相关联的数据形式的“产品”或“制品”,所述机器可执行代码和/或相关联的数据在一种类型的机器可读介质上执行或在所述一种类型的机器可读介质中实施。机器可执行代码可以存储在电子存储单元,如存储器(例如,只读存储器、随机存取存储器、快闪存储器)或硬盘上。“存储”类型介质可以包括计算机、处理器等的任何或全部有形存储器或其相关联的模块,如可以在任何时间为软件编程提供非暂时性存储的各种半导体存储器、磁带驱动、硬盘驱动等。软件的全部或部分有时可以通过互联网或各种其它电信网络通信。此类通信例如可以实现将软件从一个计算机或处理器加载到另一个计算机或处理器中,例如从管理服务器或主机计算机加载到应用服务器的计算机平台中。因此,可以承载软件元素的另一种类型的介质包括如通过有线和光学陆地线网络以及在各个空中链路之上跨本地装置之间的物理接口使用的光波、电波和电磁波。如有线或无线链路、光学链路等的承载此类波的物理元素还可以被视为承载软件的介质。如本文所使用的,除非限制为非暂时性、有形“存储”介质,否则如计算机或机器“可读介质”等术语是指参与向处理器提供指令以供执行的任何介质。
[0577]
因此,机器可读介质(如计算机可执行代码)可以采取许多形式,包括但不限于有形存储介质、载波介质或物理传输介质。非易失性存储介质包括例如光盘或磁盘,如任何计算机中的存储装置中的任何存储装置等,如可以用于实施附图中示出的数据库等的任何存储装置。易失性存储介质包括动态存储器,如此类计算机平台的主存储器。有形传输介质包括同轴电缆;铜线和光纤光学器件,包括在计算机系统内包括总线的导线。载波传输介质可以采用电信号或电磁信号的形式,或声波或光波的形式,如在射频(rf)和红外(ir)数据通信期间生成的那些。因此,计算机可读介质的常见形式包括例如:软盘、软磁盘、硬盘、磁带、任何其它磁性介质、cd-rom、dvd或dvd-rom、任何其它光学介质、穿孔卡、纸带、任何其它带有孔图案的物理存储介质、ram、rom、prom和eprom、快闪-eprom、任何其它存储器芯片或存储器盒、传输数据或指令的载波、传输此类载波的电缆或链路、或计算机可以从其读取程序代码和/或数据的任何其它介质。计算机可读介质的这些形式中的许多形式可以涉及将一个或多个指令的一个或多个序列承载到处理器以供执行。
[0578]
计算机系统701可以包括电子显示器735或与所述电子显示器通信,所述电子显示器包括用于提供例如核酸序列和光信号检测的结果(例如,序列读段、强度图等)的用户接口(ui)740。ui的实例包括但不限于图形用户接口(gui)和基于web的用户接口。
[0579]
本公开的方法和系统可以通过一种或多种算法来实施。算法可以在由中央处理单元(cpu)705执行时通过软件实施。算法可以例如实施本公开的方法和系统,如至少部分基于检测到的光信号的强度来测定序列读段。
[0580]
实施例
[0581]
一般来说,本文所使用的命名和本发明中所利用的实验室程序包括分子技术、生物化学技术、微生物学技术和重组dna技术。可以在以下中找到这些技术的细节:例如《分子克隆:实验室手册(molecular cloning:a laboratory manual)》sambrook等人,(1989);《当代分子生物学实验指南(current protocols in molecular biology)》第i-iii卷ausubel,r.m.编辑(1994);ausubel等人,《当代分子生物学实验指南》,马里兰州巴尔的摩约翰
·
威利父子出版公司(john wiley and sons,baltimore,maryland)(1989);perbal,《分子克隆实用指南(a practical guide to molecular cloning)》,纽约约翰
·
威利父子出版公司(1988);watson等人,《重组dna(recombinant dna)》,纽约科学美国人书籍(scientific american books);birren等人(编辑)《基因组分析:实验室手册系列(genome analysis:a laboratory manual series)》,第1-4卷,纽约冷泉港实验室出版社(cold spring harbor laboratory press,new york)(1998);如以下中所示的方法:美国专利第4,666,828号;第4,683,202号;第4,801,531号;第5,192,659号;以及第5,272,057号;《细胞生物学:实验室手册(cell biology:a laboratory handbook)》,第i-iii卷,cellis,j.e.,编辑(1994);freshney的《动物细胞培养:基础技术手册(culture of animal cells-a manual of basic technique)》,纽约威利-里斯公司(wiley-liss,n.y.),(1994),第三版;《当代免疫学实验手册(current protocols in immunology)》,第i-iii卷,coligan j.e.,编辑(1994);stites等人(编辑),《基础和临床免疫学(basic and clinical immunology)》(第8版),康涅狄格州诺沃克阿普尔顿&兰格公司(appleton&lange,norwalk,ct)(1994);mishell和shiigi(编辑),《蛋白质纯化和表征策略——实验过程指南(strategies for protein purification and characterization-alaboratory course manual)》cshl出版社(cshl press)(1996);全部文献通过引用并入。贯穿本文件提供了其它的一般参考文献。
[0582]
当用单链模板执行时,如上所述的预富集方法导致分子内二级结构形成,所述分子内二级结构形成导致杂交和酶促效率差。此外,在后富集后发现珠聚集,因此使其不能稳定用于测序。然而,当使用双链模板并通过切割掉捕获实体(例如,生物素)来释放时,序列的丢失和后富集珠的聚集减少。具有单链模板的颗粒和具有双链模板的颗粒被预富集和后富集并且随后发送以进行测序。监测结块珠的数量、错误百分比、基因组覆盖率、通过rsq过滤器的读段百分比以及通过u-比对的百分比。发现具有双链模板的颗粒具有较少的聚集、更好的基因组覆盖率和卓越的读段质量。
[0583]
尽管本文中已经示出并描述了本发明的优选实施方式,但是对于本领域的技术人员来说将显而易见的是,此类实施方式仅通过举例方式提供。本发明并不旨在受说明书内提供的具体实例限制。尽管已经参考上述说明书描述了本发明,但本文中的实施方式的描述和说明并不打算以限制意义理解。在不脱离本发明的情况下,本领域的技术人员现在将想到许多变化、改变和替代。此外,应当理解,本发明的所有方面不限于本文所阐述的取决于各种条件和变量的特定描绘、配置或相对比例。应当理解,本文所描述的本发明的实施方式的各个替代方案都可以用于实践本发明。因此,可以设想,本发明还将覆盖任何此类替代
方案、修改、变化或等效物。以下权利要求旨在限定本发明的范围并且由此覆盖在这些权利要求和其等效物的范围内的方法和结构。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1