生物流体分离装置的制作方法
生物流体分离装置
1.相关申请的交叉引用
2.本技术要求2020年6月9日提交的美国临时申请号63/036,822的权益,其通过引用并入本文。
技术领域
3.本公开内容总体上涉及适用于生物流体的装置。更具体地,本公开内容涉及适于分离生物流体的组分的装置。本公开内容还涉及检测或测试物质比如抗原或抗体的存在的装置。
背景技术:
4.血液采样是一种常见的卫生保健程序,包括从患者身上抽取至少一滴血液。通常通过手指针刺、足跟针刺或静脉穿刺从住院患者、家庭护理患者和急诊室患者采集血液样品。也可以通过静脉或动脉管线从患者身上采集血液样品。一旦收集,就可以分析血液样品以获得医学上有用的信息,包括例如化学组成、血液学或凝血。
5.血液测试确定患者的生理和生化状态,比如疾病、矿物质含量、药物有效性和器官功能。血液测试可以在临床实验室或在患者附近的床旁检测(point-of-care)进行。床旁检测血液测试的一个实例是对患者血糖水平的常规测试,该测试涉及通过手指针刺抽取血液并将血液机械收集到诊断盒中。之后,诊断盒会分析血液样品,并为临床医生提供患者血糖水平的读数。还可以使用其他装置来分析血液气体电解质水平、锂水平和离子钙水平。其他一些床旁检测设备可识别急性冠脉综合征(acs)和深静脉血栓形成/肺栓塞(dvt/pe)的标志物。
6.血液样品包含全血部分和血浆部分。从全血中分离血浆传统上是通过离心来实现的,离心通常需要15至20分钟,并且涉及繁重的劳动或复杂的工作流程。最近,已经使用或尝试了分离血浆的其他技术,比如沉降、纤维或非纤维膜过滤、侧流分离、微流交叉流过滤和其他微流流体动力分离技术。然而,这些技术中的许多技术面临各种挑战,包括血浆纯度差、分析物偏倚(analyte bias)或需要特殊涂层以防止分析物偏倚、溶血度高、需要稀释、分离时间长和/或难以回收血浆。例如,大多数基于膜的分离技术都存在分析物偏倚的问题,并且通常需要对目标分析物进行特殊的涂层处理。
技术实现要素:
7.本公开内容提供了一种允许使用单个电源生成高质量血浆的血液分离装置和分离方法。
8.在一个示例性实施方式中,已经用集成式径迹蚀刻膜(track-etch membrane)(tem)血浆分离技术开发了一次性床旁检测(poc)微流体装置,该技术使用单个电源从全血中产生高质量的血浆。血浆分离过程不需要任何硬件或电源。该装置由压力操作,该压力是通过简单地按压和释放装置一端的真空球来手动产生的。分离的血浆的质量表明可溶性分
析物具有极好的(低的)偏倚,这与离心分离生成的管血浆相当。分离的血浆可潜在地用于各种应用中的装置中,比如比色和化学分析、免疫分析以及侧向流动类型测试。使用者简单地将全血样品吸移(pipette)或分配到一次性使用的一次性装置中,并且然后在装置的一端按压并释放真空球。释放球会产生内部真空压力,并将血液样品抽取到装置中,在该装置中血液样品沿切线流过径迹蚀刻膜。tem的另一侧也存在真空压力,从而产生使血浆穿过膜的跨膜压力。在一个实施方式中,该分离的血浆流到测试区域,在该区域中它与测试和阳性对照试剂混合。然后,试剂可能会根据分离的血浆中存在的靶向抗原的量改变颜色。然后,可通过poc读取仪检测一次性装置中每个孔的颜色。读取仪中的分析检测方法可能有所不同,并且可能基于反射率、吸光度、荧光、化学发光或其他方法,以验证测试是否正常工作,即阳性对照,并至少报告阳性或阴性测试结果。作为替代方案,颜色强度可以潜在地用于量化测试结果。
9.在另一个示例性实施方式中,分离的血浆可以流过结合垫,在其中,如果在血浆样品中存在目标抗原,则该抗原与结合垫内的检测抗体配对。离开结合垫后,血浆流到包含捕获抗体的一片或多片硝化纤维素膜或其他类似类型的3-d结构。对于含有目标抗原的样品,抗原和检测抗体与膜中的捕获抗体配对,并出现可视线条或标记。然后可以通过poc读取仪检测每个膜上的线条,并在其中报告测试结果。在一个实施方式中,检测抗体直接附着于装置中的测试区域,或者可以包埋(embed)在位于测试区域中的水凝胶中。然后,该装置类似地起作用,其中从流过结合垫或含有与目标抗原配对的捕获抗体的其他多孔材料的血液中分离出血浆。然后血浆从结合物垫或类似的多孔材料流到测试区域,在该区域,抗原和捕获抗体与检测抗体配对,这又可以通过poc读取仪进行检测,并报告检测结果。
10.在又另一示例性实施方式中,血液分离装置被设计成用在单独的三维结构上的单独的阳性对照和测试标记代替整个侧流试纸条(strip)。已经观察到硝化纤维素膜以及其他类型的膜会引入分析物偏倚,其可能使最终的测试结果产生偏差。因此,在该装置中使用的三维结构被显著减小以最小化那些偏倚效应。带有膜试纸条的血浆分离盒设计用于从血液中分离血浆,并使分离出的血浆流过含有检测抗体的结合垫,进入含有三维结构的两个不同孔,该三维结构比如包埋有捕获抗体的硝化纤维素膜的小试纸条,该试纸条基于样品中存在的抗原的浓度变化颜色。该装置不严格限于使用硝化纤维素膜或典型的结合垫材料。可以替代地使用其他非偏倚的三维结构、膜或垫。
11.根据本发明的实施方式,适于接收具有全血部分和血浆部分的血液样品的血液分离装置包括壳体,该壳体包括适于接收血液样品的入口、具有与入口流体连通的第一腔室流动通道的第一腔室、具有第二腔室流动通道的第二腔室、设置在第一腔室和第二腔室之间的分离构件;和至少部分地设置在壳体内并与入口、第一腔室和第二腔室连通的致动器,该致动器在初始位置和压低位置之间可转换,其中在致动器被致动之后,当致动器返回到初始位置时,致动器施加真空压力以同时通过第一腔室流动通道抽取血液样品和通过分离构件抽取血浆部分到第二腔室流动通道中。
12.在一种配置中,壳体进一步包括与第二腔室流动通道流体连通的第一孔。在另一种配置中,第一孔包括第一试剂。在又另一种配置中,壳体进一步包括与第二腔室流动通道流体连通的第二孔。在一种配置中,第二孔包括第二试剂。在另一种配置中,血浆部分同时流入第一孔和第二孔中。在又另一种配置中,装置进一步包括与第一腔室流动通道连通的
全血储存器,其中在血液样品流过分离构件之后,全血部分流入全血储存器中。在一种配置中,装置进一步包括与第一孔和第二孔连通的血浆储存器,其中,在血浆部分填充第一孔和第二孔之后,多余的血浆流入血浆储存器中。在另一种配置中,壳体包括与第一孔和第二孔对准的观察窗口,其中观察窗口提供第一孔和第二孔从壳体的外部的可视化。在又另一种配置中,装置进一步包括位于壳体内部的第一阀,第一阀在第一阀打开位置和第一阀关闭位置之间可转换;位于壳体内部的第二阀,第二阀在第二阀打开位置和第二阀关闭位置之间可转换;和位于壳体外壁的第三阀,第三阀在第三阀打开位置和第三阀关闭位置之间可转换。在一种配置中,在将致动器致动到压低位置时,第一阀处于第一阀关闭位置,第二阀处于第二阀关闭位置,和第三阀处于第三阀打开位置,并且其中,在致动器从压低位置转换到初始位置时,第一阀处于第一阀打开位置,第二阀处于第二阀打开位置,和第三阀处于第三阀关闭位置。在另一种配置中,分离构件适于将全血部分限制在第一腔室流动通道中,并允许血浆部分从其穿过进入第二腔室流动通道。在又另一种配置中,装置进一步包括邻近入口的第一进出孔。在一种配置中,装置进一步包括邻近第一孔和第二孔的第二进出孔。在另一种配置中,分离构件包括径迹蚀刻膜。在又另一种配置中,致动器是按钮。
13.根据本发明的另一个实施方式,适于接收具有全血部分和血浆部分的血液样品的血液分离装置包括壳体,该壳体包括适于接收血液样品的入口、具有与入口流体连通的第一腔室流动通道的第一腔室、具有第二腔室流动通道的第二腔室、设置在第一腔室和第二腔室之间的分离构件;至少部分地设置在壳体内并与入口、第一腔室和第二腔室连通的致动器,致动器在初始位置和压低位置之间可转换,其中在致动器被致动之后,当致动器返回到初始位置时,致动器施加真空压力以同时通过第一腔室流动通道抽取血液样品和通过分离构件抽取血浆部分到第二腔室流动通道中;和与第二腔室流动通道流体连通的测试区域,该测试区域包括:具有第一测试物质的第一部分;和具有第二测试物质的第二部分。
14.在一种配置中,如果血浆部分含有抗原,则在第二部分中产生阳性状态。在另一种配置中,如果血浆部分不含抗原,则在第二部分中产生阴性状态。在又另一种配置中,血浆部分从第二腔室流动通道流动到测试区域的第一部分,并且如果血浆部分含有抗原,抗原与第一测试物质配对,则血浆部分和第一测试物质流入测试区域的第二部分,并且抗原和第一测试物质与第二测试物质结合以产生阳性状态。在一种配置中,在致动器被第二次致动之后,当致动器返回到初始位置时,致动器施加第二真空压力以通过第二腔室流动通道将血浆部分抽取到测试区域的第一部分和第二部分。在另一种配置中,装置进一步包括在致动器被第二次致动时引入血浆部分和测试区域的缓冲液。在又另一种配置中,测试区域包括第二腔室流动通道和测试区域的第一部分之间的血浆分离室。在一种配置中,测试区域包括侧流试纸条。在另一种配置中,第一部分包括结合垫。在又另一种配置中,第二部分包括三维结构。在一种配置中,第一测试物质包括检测抗体。在另一种配置中,第二测试物质包括捕获抗体。在又另一种配置中,装置进一步包括与第一腔室流动通道连通的全血储存器,其中在血液样品流过分离构件之后,全血部分流入全血储存器中。在一种配置中,装置进一步包括与所述测试区域连通的血浆储存器,其中在血浆部分填充测试区域之后,多余的血浆流入血浆储存器中。在另一种配置中,壳体包括与测试区域对准的观察窗口,其中观察窗口提供测试区域从壳体的外部的可视化。在又另一种配置中,装置进一步包括位于壳体内部的第一阀,第一阀在第一阀打开位置和第一阀关闭位置之间可转换;位于壳体内
部的第二阀,第二阀在第二阀打开位置和第二阀关闭位置之间可转换;和位于壳体外壁的第三阀,第三阀在第三阀打开位置和第三阀关闭位置之间可转换。在一种配置中,在将致动器致动到压低位置时,第一阀处于第一阀关闭位置,第二阀处于第二阀关闭位置,和第三阀处于第三阀打开位置,并且其中,在致动器从压低位置转换到初始位置时,第一阀处于第一阀打开位置,第二阀处于第二阀打开位置,和第三阀处于第三阀关闭位置。在另一种配置中,分离构件适于将全血部分限制在第一腔室流动通道中,并允许血浆部分从其穿过进入第二腔室流动通道。在又另一种配置中,分离构件包括径迹蚀刻膜。在一种配置中,致动器是按钮。在另一种配置中,测试区域包括膜试纸条。在又另一种配置中,第二部分包括容纳第一膜试纸条的第一凹槽。在一种配置中,第二部分进一步包括容纳第二膜试纸条的第二凹槽。在另一种配置中,第一部分包括结合垫。在又另一种配置中,第一测试物质包括检测抗体。在一种配置中,第二测试物质包括捕获抗体。
附图说明
15.通过参考本公开内容的实施方式的以下描述并结合附图,本公开内容的上面提到的和其他的特征和优势和实现它们的方式将变得更显而易见,并将更好地理解本公开内容本身,其中:
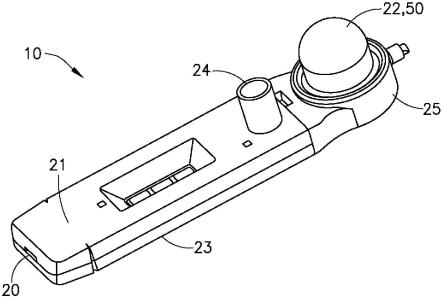
16.图1是根据本发明的实施方式的血液分离装置的透视图。
17.图2是根据本发明的实施方式的血液分离装置的第二透视图。
18.图3是根据本发明的实施方式的血液分离装置的分解图。
19.图4是根据本发明的实施方式的血液分离装置的第二分解图。
20.图5是根据本发明的另一个实施方式的血液分离装置的透视图。
21.图6是根据本发明的另一个实施方式的血液分离装置的第二透视图。
22.图7是根据本发明的另一个实施方式的血液分离装置的分解图。
23.图8是根据本发明的另一个实施方式的血液分离装置的第二分解图。
24.图9是根据本发明的另一个实施方式的血液分离装置的透视图。
25.图10是根据本发明的另一个实施方式的血液分离装置的第二透视图。
26.图11是根据本发明的另一个实施方式的血液分离装置的分解图。
27.图12是根据本发明的另一个实施方式的血液分离装置的第二分解图。
28.图13是使用根据本发明的实施方式的血液分离装置的第一步的顶部透视图。
29.图14是使用根据本发明的实施方式的血液分离装置的第二步的顶部透视图。
30.图15是使用根据本发明的实施方式的血液分离装置的第三步的顶部透视图。
31.图16是根据本发明的实施方式的血液分离装置的分支填充通道的顶部透视图。
32.图17是根据本发明的另一个实施方式的血液分离装置的分支填充通道的顶部透视图。
33.图18a-18c图解了使用根据本发明的实施方式的血液分离装置的示例性甘油三酯测定。
34.图19图解了使用poc读取仪的图18c中的实施方式的测试孔和阳性对照孔的图像。
35.图20a和20b分别显示了使用根据本发明实施方式的血液分离装置的示例性甘油三酯比色测定的图像和曲线图。
36.图21显示了使用ams临床化学分析仪与本发明的血液分离装置的实施方式测量的甘油三酯浓度的比较。
37.图22a-22c图解了使用根据本发明的实施方式的血液分离装置的示例性甲状腺刺激激素(tsh)测定。
38.图23a-23c图解了tsh测定的方面。图23a显示了使用根据本发明的实施方式的血液分离装置的示例性tsh测定;图23b和23c显示了使用图23a中的血液分离装置的示例性tsh测定的图像。
39.图24a和24b分别显示了使用根据本发明的实施方式的血液分离装置的示例性tsh测定的图像和曲线图。
40.图25显示了使用盒和本发明的血液分离装置的实施方式测得的tsh浓度的比较。
41.图26a和26b分别显示了使用根据本发明实施方式的血液分离装置的示例性蛋白质测定的图像和曲线图。
42.相应的附图标记在所有几个视图中指示相应的部分。本文阐述的示例阐释了本公开内容的示例性实施方式,并且这些示例不应被解释为以任何方式限制本公开内容的范围。
具体实施方式
43.提供以下描述以使本领域技术人员能够制造和使用预期用于实现本发明的所描述的实施方式。然而,对于本领域技术人员而言,各种修改、等同方案、变型和替代方案将仍然是显而易见的。任何和所有这样的修改、变型、等同方案和替代方案旨在落入本发明的精神和范围内。
44.为了下文描述的目的,术语“上(upper)”、“下(lower)”、“右(right)”、“左(left)”、“垂直(vertical)”、“水平(horizontal)”、“顶(top)”、“底(bottom)”、“侧向(lateral)”、“纵向(longitudinal)”及其派生词应与本发明在附图中的含义有关。然而,应理解,除非明确相反地指出,否则本发明可以设想替代变型和步骤顺序。还应当理解,附图中图解的以及在以下说明书中描述的特定装置和方法仅仅是本发明的示例性实施方式。因此,与本文公开的实施方式有关的特定尺寸和其他物理特性不应被认为是限制性的。
45.本公开内容提供了一种允许使用单个电源生成高质量血浆的血液分离装置和分离方法。
46.图1-4图解了本公开内容的血液分离装置10的示例性实施方式。参考图1-4,本公开内容的血液分离装置10适于接收如图13-15中所图解的例如具有全血部分14和血浆部分16的血液样品12。本公开内容提供了一种允许使用单个电源生成高质量血浆的血液分离装置和分离方法。
47.在一个示例性实施方式中,一次性床旁检测(poc)微流体血液分离装置10包括集成的径迹蚀刻膜(tem)血浆分离技术,该技术使用单个电源从全血中产生高质量的血浆。血浆分离过程不需要任何硬件或电源。该装置由通过简单地按压和释放在装置的一端的真空球来手动产生的压力操作。分离的血浆的质量表明可溶性分析物具有极好的(低)偏倚,这与离心产生的管血浆相当。分离的血浆可潜在地在装置内用于多种应用中,例如在比色和
化学测定、免疫测定以及侧向流动类型测试中。使用者简单地将全血样品吸移或分配到一次性使用的一次性装置中,并且然后在装置的一端按压并释放真空球。释放球会产生内部真空压力,并将血液样品抽取到装置中,在此其沿切线流过径迹蚀刻膜。tem的相对侧也存在真空压力,这产生使血浆穿过膜的跨膜压力。在一个实施方式中,该分离的血浆流到测试区域,在该区域中它与测试和阳性对照试剂混合。然后,试剂可能会基于分离的血浆中存在的靶向抗原的量来改变颜色。然后,可通过poc读取仪检测一次性装置中每个孔的颜色。读取仪中的检测方法可改变,并且可基于反射率、吸光度、荧光、化学发光或其他方法,以便验证测试是否正常运行(即阳性对照),并还至少报告阳性或阴性测试结果。作为替代方案,颜色强度可以潜在地用于量化测试结果。
48.参考图1-4,血液分离装置10通常包括壳体20和致动器22。在一个实施方式中,壳体20可以包括顶部部件21、底部部件23和第三部件或拇指部件25。在一个示例性实施方式中,壳体20包括适于接收血液样品12的入口24、具有与入口24流体连通的第一腔室流动通道28的第一腔室或血液腔室26、具有第二腔室流动通道32的第二或血浆腔室30和设置在第一腔室26和第二腔室30之间的分离构件34。分离构件34适于将全血部分14限制在第一腔室流动通道28中并允许血浆部分16从其穿过进入第二腔室流动通道32。在一个实施方式中,分离构件34包括径迹蚀刻膜。
49.在一个示例性实施方式中,壳体20还包括与第二腔室流动通道32流体连通的第一孔36和与第二腔室流动通道32流体连通的第二孔40。在一个实施方式中,第一孔36包括第一试剂38和第二孔40包括第二试剂42。
50.在一个示例性实施方式中,壳体20还包括与第一孔36和第二孔40对准的观察窗口44。如此,观察窗口44提供第一孔36和第二孔40从壳体20的外部的可视化。
51.在一个示例性实施方式中,致动器22至少部分地设置在壳体20内并与入口24、第一腔室26和第二腔室30连通。血液分离装置10的致动器22在初始位置(图13和15)和压低位置(图14)之间可转换。在一个实施方式中,致动器22是按钮50。
52.参考图1-4,血液分离装置10还包括全血储存器60、血浆储存器62、第一阀64、第二阀66、第三阀68、第一进出孔70和第二进出孔72。
53.在一个示例性实施方式中,全血储存器60与第一腔室流动通道28连通。血浆储存器62与第一孔36和第二孔40连通。第一阀64位于壳体20内部,并且第一阀64在第一阀打开位置和第一阀关闭位置之间可转换。第二阀66位于壳体20内部,并且第二阀66在第二阀打开位置和第二阀关闭位置之间可转换。第三阀68位于壳体20的外壁46处,并且第三阀68在第三阀打开位置和第三阀关闭位置之间可转换。在一个实施方式中,第一进出孔70邻近入口24,并且第二进出孔72邻近第一孔36和第二孔40。
54.如下面更详细描述的,在一个示例性实施方式中,在致动器22被致动(图14)之后,当致动器22返回到初始位置(图13和15)时,致动器22施加真空压力以同时通过第一腔室流动通道28抽取血液样品12和通过分离构件34抽取血浆部分16到第二腔室流动通道32。在一个实施方式中,血浆部分16同时流到第一孔36和第二孔40中。
55.如下面更详细描述的,在一个示例性实施方式中,当致动器22被致动(图14)到压低位置(图14)时,第一阀64处于第一阀关闭位置,第二阀66处于第二阀关闭位置,和第三阀68处于第三阀打开位置,并且其中,当致动器22从压低位置(图14)转换到初始位置(图13和
15)时,第一阀64处于第一阀打开位置,第二阀66处于第二阀打开位置,和第三阀68处于第三阀关闭位置。
56.如下面更详细描述的,在一个示例性实施方式中,在血液样品12流过分离构件34时,全血部分14流入全血储存器60中,并且在血浆部分16填充第一孔36和第二孔40之后,多余的血浆16流入血浆储存器中62。
57.参考图1-4,本公开内容的血液分离装置10被设计成从血液样品12中分离血浆16并且使分离的血浆16流到装置10内的两个不同的孔,例如第一孔36和第二孔40中,在其中分离的血浆16可以与试剂或抗体例如第一试剂38和第二试剂42混合(如果需要的话)。在一个示例性实施方式中,顶部部件21包含入口24,入口24被设计成容纳例如高达350μl的样品体积,该样品体积是人全血的典型样品类型。在填充入口24之后,通过按压位于装置10的一端的致动器22,例如按钮50,并且然后将其释放,将血液样品12抽取到装置10中。装置10包含一系列的三(3)个单向阀64、66、68,其与致动器22活动一起操作以在装置10内产生和释放真空压力。当致动器22被按压时,两个位于装置10内部的单向阀64、66关闭,而位于装置10端部的单向阀68打开以排放并释放内部盒压力,这防止血液12从入口24喷出。当释放致动器22时,装置10端部的单向排气阀68关闭,而两(2)个内部单向阀64、66打开,以产生内部真空压力,该压力将血液样品12抽取到装置10中。
58.如上所讨论的,分离构件34适于将全血部分14限制在第一腔室流动通道28中并允许血浆部分16从其穿过进入第二腔室流动通道32。在一个实施方式中,分离构件34包括径迹蚀刻膜。在一个示例性实施方式中,小的径迹蚀刻膜(tem)设置在第一腔室或血液腔室26和第二或血浆腔室30之间。在一个实施方式中,如图1-4中所显示的,然后将血液腔室和血浆腔室组合26、30在壳体20的顶部和底部部件21、23之间组装。两个(2)内部单向阀64、66可以水平附连到位于顶部和底部部件21、23的端部的真空端口柱48。在组装之后,然后将两个阀64、66插入包含致动器22的壳体20的拇指部件25中的配合端口。当经由致动器22激活内部装置真空压力时,附连到壳体20的顶部部件21的阀64打开,并将血液样品12抽取到装置10中,在此血液样品在血液腔室或第一腔室26中的第一腔室流动通道28,例如,“u”形通道周围流动,并且切向地穿过第一腔室26下面的分离构件34。附连到壳体的基底或底部组件23的阀66也被同时打开,这产生跨越分离构件34的真空压差(称为跨膜压力)。当血液12切向地流过分离构件34时,跨膜压力拉动血浆16通过分离构件34的膜孔并进入血浆腔室或第二腔室30的通道32中。在流过分离构件34之后,血液12中的用过的全血14经由阀64离开血液腔室26并排入到拇指部件25中的第一或左或全血储存器或隔室60中。然后将分离的血浆16引导通过壳体20的基底部件23中的通道78,到达第一和第二孔36、40。参见图16-17。就在到达孔36、40之前,模制的通道78被分离成两个单独的分支,例如,每个孔一个,以便每个孔同时填充,这防止了孔之间的交叉污染。在填充孔36、40之后,将多余的血浆16通过连接到壳体20的基底部件23的阀66排出,并进入拇指部件25的第二或右隔室或血浆储存器62。
59.如上所讨论的,在一个示例性实施方式中,壳体20还包括与第一孔36和第二孔40对准的观察窗口44。如此,观察窗口44提供第一孔36和第二孔40从壳体20的外部的可视化。
60.例如,在一个示例性实施方式中,观察窗口44可以包括薄的圆形光学透明载玻片80和具有成像窗切口81的相应的吸盘(adhesive disc),该成像窗切口81设置在壳体20的顶部部件21与血液腔室或第一腔室26之间。载玻片80位于测试和阳性对照孔36、40的正上
方,在载玻片80上方的顶部部件21中包括开放窗口44,以在血浆分离后根据需要通过载玻片80清晰地观察两个孔36、40。仅对于使用半透明材料例如vero clear印刷的顶部部件21的3d打印原型版本,才需要载玻片80和顶部部件开放窗口44的设计。当直接通过vero透明材料观察时,测试孔和阳性对照孔的内容物的颜色变得混浊且不太明显。当使用透明塑料比如pmma、聚碳酸酯、pet、coc等注射成型顶部部件21时,成像窗口44将是固体的透明塑料,这排除了对于载玻片80和相应的吸盘的需要。基底部件和拇指部件23、25目前也是使用vero白色印刷材料制造的3d印刷零件;然而,它们也可以由注塑的丙烯腈丁二烯苯乙烯(abs)、聚丙烯、聚乙烯、聚氨酯、聚苯乙烯、pmma聚碳酸酯、pet、coc或其他类型的材料构成。
61.在示例性实施方式中,本公开内容的血液分离装置10包括壳体20的顶部部件21,该顶部部件21包含能够接收高达350μl的样品体积的入口24。输入端口的体积不限于350μl,并且可以根据需要使用其他体积,例如,大于0.5ml或小于100μl。
62.在一个示例性实施方式中,血液分离装置10包括为鸭嘴阀的阀64、66、68。鸭嘴阀可以由vmq(有机硅弹性体)制成。在其他实施方式中,可以使用其他材料或单向阀类型。顶部部件21包含设计为与第一腔室或血液腔室26的通道28配合的40微米高的“u”形脊。在一个实施方式中,血液腔室26由聚酯基板上的78微米厚的双面丙烯酸胶带构成。顶部部件21中的40微米高的“u”形脊被设计成减小血液腔室“u”形通道28的高度,以便使较薄的血液层流过分离构件34,目的是为了提高血浆分离效率。分离构件34可以是孔径为0.4μm,长28.5mm
×
宽17.5mm的径迹蚀刻膜。顶部部件21还可以包含0.23mm深的15.5mm圆形凹槽,以与薄的透明玻璃载片80和双面胶带配合。载玻片80的直径可以为15mm,厚为0.15mm,并且由硼硅酸盐玻璃制成;然而,可以使用其他惰性玻璃材料和载玻片厚度。用于血液腔室26的相同的双面胶带也可以用于载玻片胶带。设计在载玻片胶带中的矩形切口与顶部部件成像窗口中的矩形开口对准。另外,在血液腔室和血浆腔室26、30中设计了两个直径为5.25mm的圆形切口,并且当与矩形窗口切口81、载玻片80和壳体20的顶部部件21中的观察窗口44组合时,允许通过载玻片80清晰地观察位于壳体20的基底部件23中的测试孔和阳性对照孔36、40。如前所述,当顶部部件21从3-d打印转换为透明的塑料注塑零件例如pmma、pc、pet、coc等时,可以将此设计简化为移除透明载玻片和胶带。
63.在一个示例性实施方式中,两个进出孔82包括在顶部部件21以及两个血液腔室和血浆腔室26、30中。位于入口24附近的进出孔82被设计为减轻装置10中的残留真空压力,而在孔36、40附近的进出孔82允许空气即氧气与测试孔的内容物混合。在真空程序(vacuum sequence)中,进出孔82例如用单面胶带覆盖。在血浆分离过程完成之后,首先移除血液输入端口进出孔82上方的胶带,然后再移除测试孔进出孔上方的胶带。当移除测试孔进出孔胶带时,该方法防止气泡在测试孔36中形成。在移除测试孔进出孔胶带之后,空气通过进出孔进入装置10,在该处它与测试孔36中的血浆和试剂混合。在化学反应期间,一些比色测定法需要氧气以使试剂改变颜色。颜色变化的量或深浅(shade)基于样品中存在的抗原的量。然后可以使用这种颜色变化的差异来量化样品中抗原的浓度。在示例性实施方式中,顶部部件21包含两个带有对准孔的凸台(boss)特征,该对准孔与基底部件中的立柱耦合,以确保血液腔室和血浆腔室特征(例如“u”形通道)、测试和对照孔的开口和进出孔开口的一致对准。
64.在一个示例性实施方式中,壳体20的基底部件23包含真空端口柱48,该真空端口
柱以与上述关于阀64相同的方式使阀66与壳体20的顶部部件21接合。在示例性实施方式中,壳体20的基底部件23还可以包括两(2)个“u”形肋条(rib),以及填充和排放通道以及模制到该部件中的测试和阳性对照孔36、40。两(2)个40微米高的“u”形肋条的宽度均为0.35mm,和间距为0.6mm。肋条被设计成与血浆腔室“u”形通道32配合,以防止分离构件34在血浆分离期间下垂,这可以减少或阻止血浆16进一步流入装置10中。在一个实施方式中,在基底部件23中设计有宽0.6mm
×
深0.3mm的填充通道,以将收集在血浆腔室“u”形通道32中的分离的血浆16引导至两(2)个直径5毫米
×
深1毫米的孔中,每个孔的容量为20μl。可以预见的是,本公开内容的装置10中的孔的数量和每个孔的容量不限于两(2)个孔36、40,并且可以根据每个孔的大小、形状和容量而在1个或多个孔的范围内变化,每个孔的容量至少为2μl或更大。
65.参考图16和图17,在一个示例性实施方式中,在分支通道78到达孔36、40之前,将其分成两个分支,例如,第一分支84和第二分支86,其中一个分支引导至每个孔36、40。分支通道84、86就在距离任一孔36、40不远的地方停止,并且没有物理连接到孔36、40。在一个实施方式中,血浆腔室30胶带中的切口跨越基底部件23的面将血浆16向上引导并从分支通道78中出来,在此处它分别流入每个孔36、40中,这防止了孔36、40之间的交叉污染。在一个示例性实施方式中,血浆腔室30由与血液腔室26相同的78微米厚的双面胶带制成。在测试孔和阳性对照孔36、40充满血浆16之后,使用相同的技术将多余的血浆16从每个孔36、40中引出,并进入宽0.3mm
×
深0.2mm的排放通道中,将其进给到拇指部件25的右隔室或血浆储存器62中。如果需要,基底部件23的底面还可以包括用于将组装后的装置10安装到现有的bd poc读取仪中以进行成像和测试结果报告的特征。
66.在一个示例性实施方式中,拇指部件25可以包括真空排出口48,该真空排出口被设计为以与上述关于阀64、66相同的方式与第三阀68配合。拇指部件25还可以包括与附连到壳体20的基底和顶部部件21、23的阀64、66连接的两个端口孔88。在一个示例性实施方式中,拇指部件25包括插入基底和顶部部件21、23中的插槽中的对准和支撑肋条。在将基底和顶部部件21、23组装在一起之后,将粘合剂施加到每个肋条。接下来,将肋条插入基底和顶部部件21、23的插槽中,并且然后将组件放置在uv光源下以固化粘合剂并将组件连接在一起。也可以将相同的粘合剂施加到连接在拇指部件端口中的基底和顶部部件阀64、66以及围绕附连到拇指部件25的端部的阀68周围,以密封每个接口并防止真空泄漏。在一个实施方式中,拇指部件可以包括三(3)个单独的隔室。每个隔室用于特定的目的。左隔室或全血储存器60捕获从血液腔室26排出的用过的血液12、14。右隔室或血浆储存器62捕获从血浆腔室30排出的多余的血浆16,并且第三隔室77可位于邻近阀排出口的位置,这可防止用过的血液和多余的血浆阻塞端口。该特征允许多次按压致动器22,而不会通过排出口喷射用过的血液或多余的血浆。在一个实施方式中,如果需要,可以将吸收性材料添加到拇指隔室中,以确保不会从排出口喷射出血液或血浆。将拇指储存器分成三(3)个隔室的隔板的高度也作为致动器限位块(displacement stop)而加倍。
67.在一个示例性实施方式中,当致动器22被按压并释放时,其产生必要的真空压力以将血液样品12抽取到装置10中并将血浆16与血液样品12的全血14分离。不同的致动器位移距离会影响所产生的真空压力量。例如,位移越大,真空压力越高。为了不论使用者是谁都可以每次产生一致的真空压力;拇指隔室分隔肋条将用于在特定距离处停止致动器位
移。拇指部件25还可包含在凸缘id周围的等间隔的竖直肋条,该竖直肋条用于将致动器22定位在拇指储存器隔室上方并居中。在一个实施方式中,可使用用于密封阀的相同粘合剂将致动器22连接至拇指部件25。在其他实施方式中,可以使用其他等级或品牌的粘合剂或其他连接部件的方法。
68.在示例性实施方式中,可以通过首先从患者抽取血液样品12来使用血液分离装置10。然后将一部分血液样品12,最高350μl,分配或吸移到微流体血浆分离装置10的入口24中。接下来,使用者按压并释放装置10上的致动器22来将血液样品12抽取到装置10中,在此自动进行血浆分离。当血浆16开始从血液样品12分离时,它同时流入两个单独的孔36、40中,在此处与测试孔试剂或抗体,例如第一试剂38和第二试剂42混合。用过的血液12和多余的血浆16排放到拇指部件25的各自的隔室60、62中。在一些实施方式中,如果孔36、40中的内容物包含比色试剂,则移除输入端口上的胶带,并测试孔的进出孔,并且然后按照方案进行规定的时间以允许发生颜色反应。然后可通过poc读取仪分析一次性装置10中的每个孔36、40的内容物,以验证测试是否正常运行并报告测试结果。在其他替代实施方式中,如果方案要求洗涤孔的内容物,则可以将洗涤溶液分配或吸移到装置入口24中,并且然后使用者重复真空程序,即再次按压并释放真空致动器22以将溶液拉到装置10中并洗涤孔的内容物。多余的清洗液排入拇指储存器中。如果方案需要的话,重复洗涤。然后,可以通过poc读取仪检测一次性装置10中的每个孔36、40的内容物,以验证测试是否正常运行并报告测试结果。在测试完成之后,单次使用的一次性装置10然后可以被丢弃。
69.图5-8图解了本公开内容的血液分离装置100的另一示例性实施方式。参考图5-8,本公开内容的血液分离装置100适于接收具有全血部分14和血浆部分16的血液样品12。本公开内容提供了一种允许使用单个电源生成高质量血浆的血液分离装置和分离方法。
70.图5
–
8中图解的实施方式包括与图1
–
4中图解的实施方式相似的部件,并且相似的部件由附图标记后跟字母a表示。为简洁起见,将不对全部这些相似的部件和使用血液分离装置100(图5至图8)的相似步骤结合图5-8中图解的实施方式进行讨论。
71.在一个示例性实施方式中,分离的血浆可以流过结合垫,在此处目标抗原(如果存在于血浆样品中)与结合垫内的检测抗体配对。在离开结合垫后,血浆流到包含捕获抗体的一片或多片硝化纤维素膜或其他类似类型的3-d结构。对于包含目标抗原的样品,抗原和检测抗体与膜中的捕获抗体配对,并出现可视线条或标记。然后可以通过poc读取仪检测每个膜上的线条,在该读取仪中报告测试结果。在一个实施方式中,检测抗体直接附连到装置中的测试区域,或者可以包埋在位于测试区域中的水凝胶中。然后,该装置类似地起作用,从流过结合垫或含有与目标抗原配对的捕获抗体的其他多孔材料的血液中分离出血浆。然后血浆从结合垫或类似物流向测试区域,在此处抗原和捕获抗体与检测抗体配对,这可以再次被poc读取仪检测到,并报告检测结果。
72.参考图5-8,血液分离装置100通常包括壳体120和致动器122。在一个实施方式中,壳体120可以包括顶部部件21a、底部部件23a和第三部件或拇指部件25a。在一个示例性实施方式中,壳体120包括适于接收血液样品12的入口124、具有与入口124流体连通的第一腔室流动通道128的第一腔室或血液腔室126、具有第二腔室流动通道132的第二或血浆腔室130和设置在第一腔室126和第二腔室130之间的分离构件34a。分离构件34a适于将全血部分14限制在第一腔室流动通道128中,并允许血浆部分16从其穿过进入第二腔室流动通道
132。在一个实施方式中,分离构件34a包括径迹蚀刻膜。
73.在一个示例性实施方式中,壳体120还包括与第二腔室流动通道132流体连通的测试区域135。在一个实施方式中,测试区域135包括具有第一测试物质138的第一部分136和具有第二测试物质142的第二部分140。
74.在一个示例性实施方式中,测试区域135包括在第二腔室流动通道132和测试区域135的第一部分136之间的血浆分离室190。在一个实施方式中,测试区域135包括侧流试纸条192。在一个实施方式中,第一部分136包括结合垫。在一个实施方式中,第二部分140包括三维结构。在一个实施方式中,第一测试物质138包括检测抗体和第二测试物质142包括捕获抗体。
75.在一个示例性实施方式中,致动器122至少部分地设置在壳体120内并与入口124、第一腔室126和第二腔室130连通。血液分离装置100的致动器122在初始位置(图13和15)和压低位置(图14)之间可转换。在一个实施方式中,在致动器122被致动(图14)之后,当致动器122返回到初始位置(图13和15)时,致动器122施加真空压力以同时通过第一腔室流动通道128抽取血液样品12和通过分离构件34a抽取血浆部分16进入第二腔室流动通道132。在一个实施方式中,致动器122是按钮50a。
76.参考图5-8,血液分离装置100还包括观察窗口44a、全血储存器60a、血浆储存器62a、第一阀64a、第二阀66a和第三阀68a,如上面关于血液分离装置10(图1-4)详细描述的。
77.如下面更详细描述的,在一个示例性实施方式中,在致动器122被致动(图14)之后,当致动器122返回到初始位置(图13和15)时,致动器122施加真空压力以同时通过第一腔室流动通道128抽取血液样品12和通过分离构件34a抽取血浆部分16进入第二腔室流动通道132。
78.如下面更详细描述的,在一个示例性实施方式中,如果血浆部分16含有抗原,则在第二部分140中产生阳性状态。如果血浆部分16不含抗原,则在第二部分140中产生阴性状态。
79.如下面更详细描述的,在一个示例性实施方式中,血浆部分16从第二腔室流动通道132流到测试区域135的第一部分136,并且如果血浆部分16含有抗原,抗原与第一测试物质138配对,则血浆部分16和第一测试物质138流入测试区域135的第二部分140,并且抗原和第一测试物质138与第二测试物质142结合以产生阳性状态。
80.在一个实施方式中,在致动器122被第二次致动(图14)之后,当致动器返回到初始位置(图13和15)时,致动器122施加第二真空压力以通过第二腔室流动通道132将血浆部分16抽取到测试区域135的第一部分136和第二部分140。在一个实施方式中,血液分离装置100还可以包括在致动器122被第二次致动时引入血浆部分16和测试区域135的缓冲液。
81.参考图5-8,在示例性实施方式中,本公开内容的血液分离装置100包括侧流试纸条192。本公开内容的装置100非常简单并且易于使用,并且被设计为从血液12中分离血浆16,使分离的血浆16流过含有检测抗体的第一部分136,例如结合垫,然后直接流入第二部分140,例如三维结构,比如硝化纤维素膜。当检测抗体和抗原沿着三维结构向下芯吸(wick)时,它们与包埋在三维结构测试区域中的捕获抗体结合,该测试区域会基于样品12中存在的抗原浓度而改变颜色。在样品12中不存在或缺乏足够抗原的情况下,测试区域颜色保持不变。本公开内容的血液分离装置100不严格限于使用硝化纤维素膜或典型的结合
垫材料。例如,可以替代地使用其他非偏置三维结构、膜或垫。
82.用于血液分离装置100的真空操作与以上关于血液分离装置10详细描述的相同
83.使用血液分离装置100的一个重要区别是对于分离的血浆16接下来所发生的。例如,在一个示例性实施方式中,分离的血浆16流入位于与结合垫136相邻的基底部件23a中的隔室190中。真空系统和隔室容积设计为使得大部分分离的血浆16保留在该隔室190内,以最小化流入结合垫136和三维结构140,例如硝化纤维素膜。接下来,将足够量的淋洗(chase)缓冲液加载到入口124中,并且然后使用者再次按压并释放致动器122以激活真空系统,这使分离的血浆和缓冲液流过结合垫136并进入三维结构140中。如果血浆16中存在目标抗原,则当样品沿着三维结构140向下芯吸到其与捕获抗体142结合的测试区域135时,结合垫136中的检测抗体会附连到抗原。在按照方案等待规定的温育时间后,在测试区域135中会出现阳性样品的可视线条或标记,然后可由使用者从视觉上检测到或由报告结果的poc读取仪成像。
84.血液分离装置100的顶部部件21a不需要薄的圆形透明玻璃载玻片和相应的吸盘,以及关于血液分离装置10讨论的进出孔和对准孔。在一些示例性实施方式中,增加侧流试纸条192还要求将顶部部件21a的长度增加几乎22mm。血液腔室126胶带是在三维结构测试区域上的半透明和无缝设计,其允许直接通过观察窗口44a观察测试线条或标记。结果,将载玻片和载玻片粘合剂以及顶部部件中的载玻片凹槽从血液分离装置100移除。同样,在血浆分离后,不需要空气来配对三维结构上的抗原和抗体,也不需要排空真空系统;因此,两个进出孔也被移除。为了容纳侧流试纸条192,同时试图使装置的总长度最小化,并将测试线条保持在成像窗口的中心,去除了与基底部件23a中的立柱相配合的对准孔。通过主动使用每个部件21a、23a的前表面和侧面作为配合表面,仍然可以实现精确的顶部和基底部件对准。
85.在一个示例性实施方式中,壳体120的基底部件23a将装置10的两(2)个直径为5mm的孔去除并用设计为容纳侧流试纸条192的46.7mm
×
9.5mm
×
l.4mm深的凹槽代替。肋条192也在靠近结合垫136的一端和与芯吸垫相邻的相对端被引入凹槽中。肋条被设计成将试纸条192保持在适当的位置并将其在凹槽内对准,同时还在凹槽侧和三维结构140之间形成间隙,以防止样品在其沿着三维结构140向下行进时芯吸出去。在示例性实施方式中,在侧流试纸条凹槽和“u”形肋条之间也添加了第二凹槽(例如6.75mm
×
7.14mm
×
0.84mm深)。该凹槽设计为与激活的真空压力一致工作,以容纳或储存高达40μl的分离血浆,同时防止大多数血浆过早流入结合垫136和三维结构140中。在血浆分离期间,血浆16从“u”形肋条通过(例如0.5mm宽
×
0.7mm深)通道流到该血浆分离室190。在添加淋洗缓冲液并再次激活真空系统之后,分离的血浆16和淋洗缓冲液通过(例如,1.0mm
×
0.5mm
×
0.84mm深)通道从血浆隔室190流到侧流试纸条192中的结合垫136。在侧流试纸条凹槽的相对端处的(例如,0.2mm宽
×
0.3mm深)排放通道将穿过试纸条行进的任何多余的血浆或淋洗缓冲液引导至阀68a,阀68a将其排放到拇指部件25a的右隔室62a中。
86.在一个示例性实施方式中,侧流试纸条192的增加还要求将基底部件23a的长度增加几乎22mm,这与顶部部件21a的增加相同。为了容纳侧流试纸条192,同时试图最小化盒的总长度以及将测试线保持在顶部部件成像窗口的中心,将与顶部部件21a中的孔配合的对准立柱移除。通过将每个部件21a、23a的前表面和侧表面用作配合表面,仍然积极地实现了
顶部和基底部件的精确对准。基底部件23a的底面还包含与装置10相同的特征,如果需要,该特征可用于将组装后的装置安装到现有的bd poc仪器中以进行成像。
87.在示例性实施方式中,可以通过首先从患者抽取血液样品12来使用血液分离装置100。然后将一部分血液样品12,最高350μl,但通常为200μl,分配或吸移到微流体血浆分离装置100的入口124中。接下来,使用者按压并释放装置100上的致动器122,以将血液样品12抽取到自动进行血浆分离的装置100中。将经过分离构件34a的用过的血液排出到拇指部件25a中。当血浆16开始从血液样品12分离时,血浆流入血浆分离隔室190中并主要包含在其中。少量的分离的血浆16可以流过隔室190并进入结合垫136中是典型的并且是预期的。接下来,将淋洗缓冲液添加到入口124,并且使用者重复真空程序,即,再次按压并释放致动器122,以使血浆和缓冲液流过含有检测抗体138的结合垫136,并进入三维结构140中。多余的血浆/淋洗缓冲液(如果有的话)排入拇指部件25a中。当样品中存在的检测抗体138和抗原沿着三维结构140向下芯吸时,它们会与包埋在三维结构测试区域中的捕获抗体142结合,该检测区域会基于样品中存在的抗原浓度而改变颜色。在样品中不存在或缺少足够的抗原的情况下,测试区域的颜色保持不变。对于正常运行的测试,阳性对照标记将是可见的,并且对于阳性测试,测试标记也将是可见的。然后可以插入并通过poc读取仪检测侧流试纸条192上的阳性对照和测试标记,以验证测试是否正常运行并报告测试结果。然后,单次使用的一次性装置100可以在测试完成之后被丢弃。
88.图9-12图解了本公开内容的血液分离装置200的示例性实施方式。参考图9-12,本公开内容的血液分离装置200适于接收具有全血部分14和血浆部分16的血液样品12。本公开内容提供了一种允许使用单个电源生成高质量血浆的血液分离装置和分离方法。
89.图9-12图解了本公开内容的血液分离装置的另一示例性实施方式。图9-12中图解的实施方式包括与图1
–
4中图解的实施方式和图5-8中图解的实施方式相似的部件,并且相似的部件由附图标记后跟字母b表示。为了简洁起见,将不对全部这些类似的部件和使用血液分离装置200(图9-12)的相似步骤结合图9-12中图解的实施方式进行讨论。
90.在一个示例性实施方式中,血浆分离盒被设计成用单独的三维结构上的单个阳性对照和测试标记代替整个侧流试纸条。已经观察到硝化纤维素膜以及其他类型的膜会引入分析物偏倚,这可能使最终的测试结果产生偏差。因此,在该装置中使用的三维结构被显著减小以最小化那些偏倚效应。带有膜试纸条的血浆分离盒被设计为从血液中分离血浆,并使分离的血浆流过含有检测抗体的结合垫,进入含有三维结构例如包埋有捕获抗体的硝化纤维素膜的小试纸条的两个不同的孔,该试纸条基于样品中存在的抗原浓度改变颜色。该装置不严格限于使用硝化纤维素膜或典型的结合垫材料。可以替代地使用其他非偏倚的三维结构、膜或垫。
91.参考图9-12,血液分离装置200通常包括壳体220和致动器222。在一个实施方式中,壳体220可以包括顶部部件21b、底部部件23b和第三部件或拇指部件25b。在一个示例性实施方式中,壳体220包括适于接收血液样品12的入口224、具有与入口224流体连通的第一腔室流动通道228的第一腔室或血液腔室226、具有第二腔室流动通道232的第二或血浆腔室230和设置在第一腔室226和第二腔室230之间的分离构件34b。分离构件34b适于将全血部分14限制在第一腔室流动通道228中,并允许血浆部分16从其穿过进入第二腔室流动通道232。在一个实施方式中,分离构件34b包括径迹蚀刻膜。
92.在一个示例性实施方式中,壳体220还包括与第二腔室流动通道232流体连通的测试区域135b。在一个实施方式中,测试区域135b包括具有第一测试物质138b的第一部分136b和具有第二测试物质142b的第二部分140b。
93.在一个示例性实施方式中,测试区域135b包括膜试纸条280。在一个实施方式中,第二部分140b包括含有第一膜试纸条284的第一凹槽282。在一个实施方式中,第二部分140b包括容纳第二膜试纸条288的第二凹槽286。在一个实施方式中,第一部分136b包括结合垫。在一个实施方式中,第一测试物质138b包括检测抗体和第二测试物质142b包括捕获抗体。
94.在一个示例性实施方式中,致动器222至少部分地设置在壳体220内并与入口224、第一腔室226和第二腔室230连通。血液分离装置200的致动器222在初始位置(图13和15)和压低位置(图14)之间可转换。在一个实施方式中,在致动器222致动(图14)之后,当致动器222返回到初始位置(图13和15)时,致动器222施加真空压力以同时通过第一腔室流动通道228抽取血液样品12和通过分离构件34a抽取血浆部分16到第二腔室流动通道232中。在一个实施方式中,致动器222是按钮50b。
95.用于血液分离装置200的真空操作与以上关于血液分离装置10所详细描述的相同。
96.使用血液分离装置200的一个重要区别是分离的血浆16接下来所发生的。例如,在一个示例性实施方式中,分离的血浆16流过基底部件23b中的通道,到达含有检测抗体138b的结合垫136b。此外,该装置200不严格限于使用典型的结合垫材料,而是可以替代地使用其他非偏倚材料。如果血浆16中存在目标抗原,则抗原与检测抗体138b结合,并且然后血浆16从结合垫136b流出并流入两个凹槽282、286中,该凹槽282、286包含包埋有捕获抗体142b的硝化纤维素膜的小的膜试纸条284、288。此外,该装置不严格限于使用硝化纤维素膜,而是可以替代使用其他非偏倚三维结构。对于含有目标抗原的样品,抗原和检测抗体138b附连到三维结构140b的测试区域中的捕获抗体142b上。穿过三维结构140b的多余的血浆16通过相同的阀68b排放到拇指部件25b的右隔室62b中,如上文关于装置10所描述的。在根据方案规定的温育时间后,使用致动器222将淋洗缓冲液冲洗通过装置200,以去除三维结构中未附连的抗体。如果样品中存在目标抗原,则在阳性样品的三维结构的测试区域中会出现可见的线条或标记,然后使用者可以通过肉眼进行检测或通过报告结果的poc读取仪成像。
97.在示例性实施方式中,可以通过首先从患者抽取血液样品12来使用血液分离装置200。然后将一部分血液样品12,最高350μl分配或吸移到微流体血浆分离装置200的入口224中。接下来,使用者按压并释放装置200上的致动器222,以将血液样品抽取到自动进行血浆分离的装置200中。当血浆16开始从血液样品12分离时,血浆16流入结合垫136b,在此处检测抗体138b与目标抗原配对。在穿过结合物垫136b之后,血浆16然后流到包埋有捕获抗体142b的单独的测试和阳性对照条280、284、288。如果存在目标抗原,则抗原和检测抗体138b附连到捕获抗体142b。用过的血液12和多余的血浆16排入拇指部件25b中。如果方案要求漂洗测试试纸条280、284、288,则漂洗溶液或淋洗缓冲液被分配或吸移到入口224中。然后,使用者重复真空程序,即再次按压并释放致动器222,以将样品12拉入装置200中并漂洗或冲洗测试试纸条280、284、288。多余的溶液排入拇指部件25b中。根据方案需要进行重复。对于正常运行的测试,阳性对照标记将是可见的,对于阳性测试,测试标记也将是可见的。
然后可以通过poc读取仪检测装置200中的阳性对照和测试试纸条280、284、288上的标记(如果可见),以验证测试是否正常运行并报告测试结果。然后,单次使用的一次性装置200可以在测试完成之后被丢弃。
98.图18a-18c图解了使用根据本发明的实施方式的血液分离装置的示例性甘油三酯测定。图18a显示了血液分离装置300,其中输入端324在血浆分离之前填充有血液样品。测试孔336含有干涸的(dried down)甘油三酯比色试剂,而阳性对照孔340不含有该试剂。图18a显示了由于上述原因在进出孔上方的胶带339。
99.图18b显示了就在血浆分离之后,即在时间0(零)分钟处的图18a中的血液分离装置。血浆填充测试孔336和阳性对照孔340。如上所述移除胶带。
100.图18c显示了在时间15分钟处与图18a和18b中相同的血液分离装置。在测试孔336中,血浆样品中的甘油三酯与干涸的试剂混合引起测试孔颜色改变并完全显影(左孔)。另一方面,不含试剂的阳性对照孔(340)的颜色保持不变。图19图解了使用基于反射率的poc读取仪的图18c中的实施方式的测试孔336和阳性对照孔340的图像。
101.图20a和20b分别显示了使用根据本发明实施方式的血液分离装置的示例性甘油三酯比色测定的图像和曲线图。在本发明的实施方式中,将具有一系列已知浓度的甘油三酯的血液样品收集在集成的tem-veritor
tm
盒中,在此处它们与用于酶促水解和甘油定量的试剂反应。在每种浓度下进行三次测定。将从veritor
tm
读取仪读取的像素强度相对于浓度作图。图20b中的图表显示了本发明的集成的tem-veritor tm
平台,该平台能够用比色法检测模式以良好的线性来检测甘油三酯。
102.图21比较使用ams临床化学分析仪(即,参考浓度)和根据本发明的实施方式的血液分离装置(即,内插(interpolated)浓度)测量的甘油三酯浓度。本发明的集成的tem-veritor
tm
盒用于分离血浆并在veritor
tm
读取仪上测定三个随机血液样品中的甘油三酯。该比较数据以相对于参考值的百分比差和相对于参考值的变异系数这两方面而言显示了本发明的血液分离装置在基于比色测定的应用中的可行性。
103.图22a-22c图解了使用根据本发明的实施方式的血液分离装置400的示例性tsh测定。图22a显示了在通过端口424收集血液样品之前,具有商业上可获得的tsh侧向流动检测条492的血液分离装置400。
104.图22b显示了图22a中的血液分离装置,其中在血浆分离后15分钟的时间处150μl全血样品掺有(spike)高浓度的tsh抗原。可见的阳性对照标记438指示测试正常运行。可见的测试标记442指示高tsh的阳性测试结果。
105.图22c显示了与图22a中相同的血液分离装置,其中在血浆分离后15分钟的时间处200μl全血样品(引入装置端口424中)掺有高浓度的tsh抗原。可见的阳性对照标记438指示测试正常运行。可见的测试标记442指示高tsh的阳性测试结果。
106.图23a显示了使用根据本发明的实施方式的血液分离装置500的示例性tsh测定装置510。图23b和23c显示了使用图23a中的血液分离装置的示例性tsh测定的图像。图23b显示了在测试试纸条592上可见的具有阳性对照线条538和阳性测试结果线条542的装置500的图像,以及显示阳性对照线条538和阳性测试结果线条542这二者的测试试纸条592的反射率图像。图23c显示了在测试试纸条592上可见阳性对照线条538和阳性测试结果线条542的装置500的图像,以及显示阳性对照线条538和阳性测试结果线条542这二者的测试试纸
条592的反射率图像。
107.图24a和24b分别显示了使用根据本发明实施方式的血液分离装置的示例性tsh测定的图像和曲线图。根据本发明的实施方式的集成的tem-veritor
tm
盒用于从具有已知的tsh浓度的血液样品分离血浆。在每种浓度下进行三次测定,并且阳性对照线条538和阳性测试结果线条的图像如图24a中所图解。从veritor
tm
读取仪读取tsh浓度。相对于浓度绘制来自图24a的反射率图像的像素强度。图24b中的图表显示,本发明的血液分离装置能够用比色法检测模式以良好的线性检测tsh。
108.图25显示了使用盒和根据本发明实施方式的血液分离装置测得的tsh浓度的比较。根据本发明的实施方式的集成的tem-veritor
tm
盒用于从具有已知浓度的tsh的血液样品分离血浆。使用veritor
tm
上的侧流测定法检测tsh浓度,并将其与使用盒测得的浓度比较。从三组测定中获得测试结果,比如图24a中所述的那些。图25的表中的比较数据的线性显示了本发明的血液分离装置用于基于比色测定法的应用的可行性。
109.图26a和26b分别显示了使用根据本发明的实施方式的血液分离装置的示例性蛋白质测定的图像和曲线图。血浆中总蛋白质的检测通常在血液样品的化学小组中进行。使用本发明的实施方式研究了基于比色测定法的总蛋白质浓度的检测。制备不同蛋白质浓度的样品,并将其与测定试剂混合,并使用rgb led之一(例如,绿光led)和商用平板读取仪(plate reader)的反射模式在本发明的集成tem-veritor
tm
上同时进行测试,以测量在装置的测试区域上的吸光度。将强度值绘制为总蛋白质浓度的函数,其中veritor
tm
的输出为像素强度。图26b显示了标准平板读取仪读数(吸收)随蛋白质浓度的增加而增加,而veritor
tm
读数(反射像素)随蛋白质浓度的增加而减小。然而,随着蛋白质浓度的变化,来自两个不同读取仪的读数呈线性变化。因此,图26b的比较结果表明,本发明的集成tem-veritor
tm
是在宽的浓度范围内对总蛋白质的可行的检测方法。
110.尽管已经将本公开内容描述为具有示例性设计,但是可以在本公开内容的精神和范围内进一步修改本公开内容。因此,本技术旨在涵盖使用其一般原理的本公开内容的任何变型、用途或改编。此外,本技术旨在涵盖在本公开内容所属领域中已知的或惯例的实践并且落入所附权利要求的限制之内的这些偏差。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1