微流路装置的制作方法
本发明涉及一种微流路装置。
背景技术:
已知有一种具有被称为微流路的微米级宽度的流路的装置(以下,称为“微流路装置”。)。例如在日本专利第5415538号公报中公开有一种器官模仿装置,其作为微流路装置具有被多孔质膜分隔的第一中央微通道及第二微通道。
以往技术文献
专利文献
专利文献1:日本专利第5415538号公报
技术实现要素:
发明要解决的技术课题
在公开于专利第5415538号公报的器官模仿装置中,上侧的第一中央微通道与下侧的第二中央微通道的中央部分在俯视下重叠,且入口端口及出口端口分离,在第一中央微通道与下侧的第二中央微通道在俯视下合流的合流部分形成有高低差部。
通过在第一中央微通道与下侧的第二中央微通道之间形成有高低差部,例如在使细胞悬浮液在第1微通道流动而在多孔质膜的表面形成细胞层时,多孔质膜因细胞悬浮液的液压弯曲而在高低差部与多孔质膜之间产生间隙。并且,在形成细胞层之后也同样地,在使试验液(例如血液稀释液、fitc-微珠等包含示踪剂的液体)在第一中央微通道流动而进行试验时,因试验液的液压而在高低差部与多孔质膜之间产生间隙。
此时,细胞悬浮液中的细胞或试验液中的红血球、示踪剂流入并夹在高低差部与多孔质膜之间的间隙而有可能导致细胞层、红血球或示踪剂的一部分位于下侧的第二中央微通道内。此时,例如利用器官模仿装置进行细胞、红血球或示踪剂的透过性试验时,夹在间隙的细胞、红血球或示踪剂犹如看似从第一中央微通道通过多孔质膜向第二中央微通道漏出,因此难以正确地进行透过性试验。
本发明提供一种能够抑制在形成于第1微流路与第2微流路之间的高低差部与多孔膜之间产生间隙,并能够抑制细胞、红血球或示踪剂流入该间隙的微流路装置。
用于解决技术课题的手段
本发明的第1方式所涉及的微流路装置具有:第1微流路,形成于第1流路部件;第2微流路,形成于第2流路部件,在俯视下至少一部分与第1微流路重叠且在与第1微流路之间形成有高低差部;多孔膜,具有沿厚度方向贯穿的多个孔,且配置于第1流路部件与第2流路部件之间而分隔第1微流路与第2微流路;及加强部件,设置于第1流路部件或第2流路部件与多孔膜之间,刚性比多孔膜高,加强多孔膜的至少面向高低差部的部分。
根据上述结构,在第1微流路与第2微流路之间形成有高低差部,多孔膜的面向高低差部的部分通过加强部件被加强。因此,使细胞悬浮液在第1微流路或第2微流路流动而在多孔膜的表面形成细胞层时,能够抑制多孔膜因细胞悬浮液的液压弯曲而在高低差部与多孔膜之间产生间隙,并能够抑制细胞流入该间隙。
同样地,使试验液在第1微流路或第2微流路流动来进行试验时,能够抑制多孔膜因试验液的液压弯曲而在高低差部与多孔膜之间产生间隙,并能够抑制红血球或示踪剂流入该间隙。
本发明的第2方式所涉及的微流路装置在第1方式所涉及的微流路装置中,第1微流路与第2微流路在俯视下一部分分离,高低差部形成于第1微流路与第2微流路在俯视下合流的合流部分。
根据上述结构,在形成于第1微流路与第2微流路在俯视下合流的合流部分的高低差部中,通过利用加强部件加强多孔膜而能够抑制在高低差部与多孔膜之间产生间隙。
本发明的第3方式所涉及的微流路装置在第1方式所涉及的微流路装置中,第1微流路的宽度比第2微流路的宽度窄,高低差部通过第1微流路与第2微流路的宽度差而形成。
根据上述结构,在通过第1微流路与第2微流路的宽度差而形成的高低差部中,通过利用加强部件加强多孔膜而能够抑制在高低差部与多孔膜之间产生间隙。
本发明的第4方式所涉及的微流路装置在第1~第3方式中的任一方式所涉及的微流路装置中,将加强部件设为覆盖多孔膜整体的大小,在多孔膜面向第1微流路或第2微流路的部分,在加强部件形成有狭缝。
根据上述结构,通过利用加强部件覆盖多孔膜整体,能够更加加强多孔膜。并且,通过在加强部件上形成狭缝,在细胞、红血球或示踪剂经由多孔膜在第1微流路与第2微流路之间移动时,能够抑制细胞、红血球或示踪剂的移动受到加强部件的阻碍。
本发明的第5方式所涉及的微流路装置在第4方式所涉及的微流路装置中,将加强部件的狭缝宽度设为第1微流路及第2微流路的宽度以下。
根据上述结构,将加强部件的狭缝宽度设为第1微流路及第2微流路的宽度以下。因此,与加强部件的狭缝宽度比第1微流路及第2微流路的宽度大的情况相比,能够更加抑制在形成于第1微流路与第2微流路之间的高低差部与多孔膜之间产生间隙。
本发明的第6方式所涉及的微流路装置在第1~第5方式中的任一方式所涉及的微流路装置中,加强部件为由聚对苯二甲酸乙二酯构成的膜部件。
根据上述结构,将加强部件设为由不易对细胞培养产生影响的聚对苯二甲酸乙二酯构成的膜部件,因此能够抑制加强部件中所包含的成分对第1微流路内或第2微流路内的细胞等产生影响。
本发明的第7方式所涉及的微流路装置在第1~第5方式中的任一方式所涉及的微流路装置中,加强部件为由聚丙烯构成的膜部件。
根据上述结构,将加强部件设为由不易对细胞培养产生影响的聚丙烯构成的膜部件,因此能够抑制加强部件中所包含的成分对第1微流路内或第2微流路内的细胞等产生影响。
本发明的第8方式所涉及的微流路装置在第1方式~第7方式中的任一方式所涉及的微流路装置中,将加强部件的厚度设为12μm以上。
根据上述结构,通过将由聚对苯二甲酸乙二酯构成的加强部件的厚度设为12μm以上,与将加强部件的厚度设为小于12μm的结构相比,能够提高加强部件的刚性,并能够通过加强部件更坚固地加强多孔膜。
本发明的第9方式所涉及的微流路装置在第1~第8方式中的任一方式所涉及的微流路装置中,将加强部件的厚度设为比第1微流路及第2微流路的深度更薄。
根据上述结构,将加强部件的厚度设为比第1微流路及第2微流路的深度更薄。因此,与加强部件的厚度比第1微流路及第2微流路的深度大的情况相比,使细胞悬浮液在第1微流路或第2微流路流动而在多孔膜的表面形成细胞层时,能够抑制细胞向多孔膜的播种受到加强部件的阻碍。
发明效果
根据本发明,能够抑制在形成于第1微流路与第2微流路之间的高低差部与多孔膜之间产生间隙,并能够抑制细胞、红血球或示踪剂流入该间隙。
附图说明
图1是表示第1实施方式中的微流路装置的整体结构的斜视图。
图2是表示第1实施方式中的微流路装置的整体结构的分解斜视图。
图3是表示俯视观察第1实施方式中的微流路装置的状态的透视图。
图4是图3中的a-a线剖视图。
图5是图3中的b-b线剖视图。
图6是表示第1实施方式中的微流路装置的多孔膜的俯视图。
图7是图6中的c-c线剖视图。
图8是表示第2实施方式中的微流路装置的整体结构的分解斜视图。
图9是表示俯视观察第2实施方式中的微流路装置的状态的透视图。
图10a是表示使细胞悬浮液在实施例的微流路装置流动的状态的放大俯视图。
图10b是图10a中的d-d线剖视图。
图11a是表示使细胞悬浮液在比较例的微流路装置流动的状态的放大俯视图。
图11b是图11a中的e-e线剖视图。
具体实施方式
(第1实施方式)
以下,利用图1~图7对本发明的第1实施方式进行说明。另外,以下的实施方式为本发明的例示,并不限制本发明的范围。并且,为了易于说明各结构,适当变更了图中各结构的尺寸。因此,图中的比例尺与实际不同。
<流路单元>
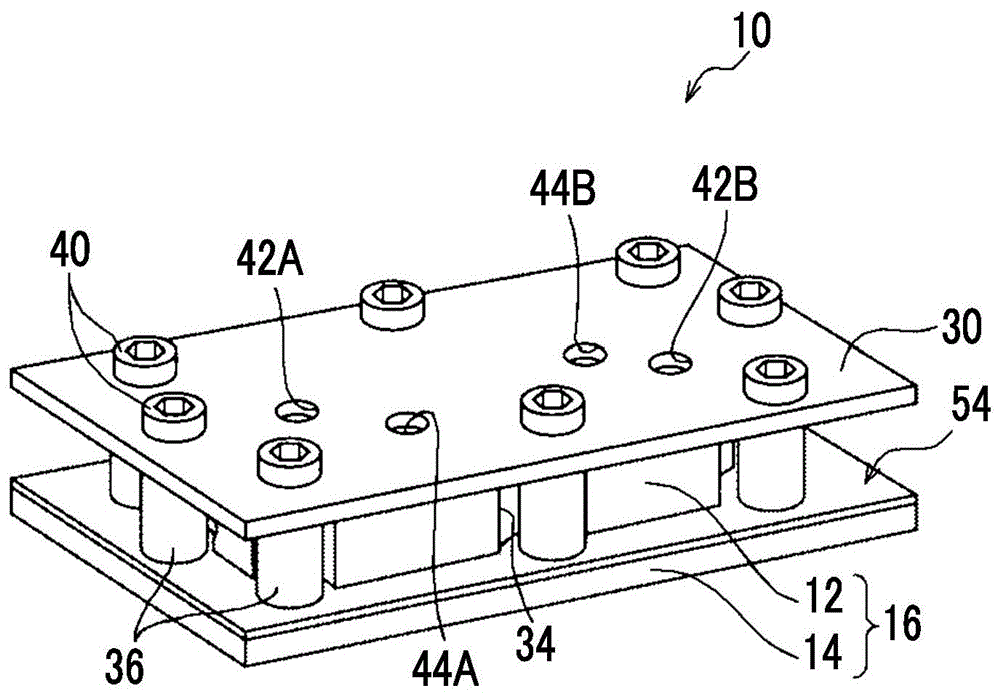
如图1所示,本实施方式的微流路装置10具有由沿厚度方向层叠的第1流路部件12和第2流路部件14构成的流路单元16。第1流路部件12作为一例由pdms(聚二甲基硅氧烷)等具有弹性的透明材料构成,第2流路部件14作为一例优选由cop(环烯烃聚合物)等具有刚性的透明材料构成。
另外,作为构成第1流路部件12及第2流路部件14的材料,除pdms(聚二甲基硅氧烷)、cop(环烯烃聚合物)以外,还可以举出环氧系树脂、聚氨酯系树脂、苯乙烯系热塑性弹性体、烯烃系热塑性弹性体、丙烯酸系热塑性弹性体、聚乙烯醇等。
如图2所示,在第1流路部件12的下表面,即在与第2流路部件14对向的对向面12a形成有第1微流路18。第1微流路18具有流入口18a、流出口18b及连通流入口18a与流出口18b且以大致直线状延伸的流路部18c。
同样地,在第2流路部件14的上表面,即在与第1流路部件12对向的对向面14a形成有第2微流路20。第2微流路20具有流入口20a、流出口20b及连通流入口20a与流出口20b且以大致直线状延伸的流路部20c。
在此,如图3所示,第1微流路18的流入口18a及流出口18b设置于与第2微流路20的流入口20a及流出口20b在俯视下分离的位置。另一方面,第1微流路18的流路部18c设置于与第2微流路20的流路部20c在俯视下重叠的位置。
由此,如图3、图4所示,在第1微流路18与第2微流路20的合流部分,即在流入口18a、20a与流路部18c、20c之间及流出口18b、20b与流路部18c、20c之间分别形成有高低差部22。
并且,如图3、图5所示,第1微流路18的流路部18c的宽度比第2微流路20的流路部20c的宽度窄,通过流路部18c与流路部20c的宽度差形成有高低差部24。
如图2所示,在第1流路部件12中分别形成有沿厚度方向贯穿第1流路部件12且下端与第1微流路18的流入口18a及流出口18b连通的贯穿孔26a、26b和下端与第2微流路20的流入口20a及流出口20b连通的贯穿孔28a、28b。
并且,在第1流路部件12的上侧设置有覆盖第1流路部件12的上表面整体的大小的保持板30。在保持板30及第2流路部件14的相互对应的位置分别形成有沿厚度方向贯穿的多个(在本实施方式中为8个)螺栓孔32。
另一方面,在第1流路部件12的外周面,在与螺栓孔32对应的位置分别形成有凹部34,在流路单元16的凹部34的外侧分别设置有规定保持板30与第2流路部件14之间的间隔的多个(在本实施方式中为8个)间隔物36。
间隔物36为将内径设为与螺栓孔32的内径大致相同的尺寸的圆筒形状的部件,分别配置于与螺栓孔32对应的位置。并且,保持板30和第2流路部件14通过插穿在螺栓孔32及间隔物36并用螺帽38固定的多个螺栓40而与后述加强部件54一同接合。
另外,在保持板30上分别形成有分别与第1流路部件12的贯穿孔26a、26b、28a、28b连通的贯穿孔42a、42b、44a、44b。在贯穿孔42a、42b、44a、44b中分别连接有未图示的软管,溶液或细胞悬浮液等通过软管流入第1微流路18及第2微流路20,溶液或细胞悬浮液等从第1微流路18及第2微流路20流出。
<多孔膜>
在第1流路部件12及第2流路部件14对向的对向面12a、14a之间配置有多孔膜46。多孔膜46作为一例由能够溶解于疏水性有机溶剂的疏水性聚合物构成。另外,疏水性有机溶剂为在25℃的水中的溶解度为10(g/100g水)以下的液体。
作为疏水性聚合物,可举出聚苯乙烯、聚丙烯酸酯、聚甲基丙烯酸酯、聚丙烯酰胺、聚甲基丙烯酰胺、聚氯乙烯、聚偏二氯乙烯、聚偏二氟乙烯、聚六氟丙烯、聚乙烯醚、聚乙烯咔唑、聚醋酸乙烯酯、聚四氟乙烯、聚酯(例如聚对苯二甲酸乙二酯、聚萘二甲酸乙二酯、聚乙烯琥珀酸酯、聚丁二酸丁二酯、聚乳酸、聚-3-羟基丁酸酯等)、聚内酯(例如聚己内酯等)、聚酰胺或聚酰亚胺(例如尼龙、聚酰胺酸等)、聚氨酯、聚脲、聚丁二烯、聚碳酸酯、聚芳烃、聚砜、聚醚砜、聚硅氧烷衍生物、酰化纤维素(例如三乙酰纤维素、乙酸丙酸纤维素、乙酸丁酸纤维素)等聚合物。
这些聚合物从对溶剂的溶解性、光学物性、电气物性、膜强度、弹性等观点考虑,根据需要,可以设为均聚物、共聚物、聚合物混合物或聚合物合金。并且,这些聚合物可以单独使用1种或混合使用2种以上。另外,多孔膜46的材料并不限于疏水性聚合物,从细胞的粘接性的观点等考虑,能够选择各种材料。
将多孔膜46的上表面46a及下表面46b(以下,有时将上表面46a及下表面46b统称为“主表面”。)设为大致覆盖第1微流路18及第2微流路20的流路部18c、20c的大小,并分隔第1微流路18和第2微流路20。具体而言,多孔膜46的上表面46a面向第1微流路18,多孔膜46的下表面46b面向第2微流路20。
如图6、图7所示,在多孔膜46形成有沿厚度方向贯穿的多个孔48,在多孔膜46的上表面46a及下表面46b分别设置有孔48的开口48a。并且,如图6所示,开口48a在俯视下为圆形形状。将开口48a彼此相互分离设置,在相邻开口48a之间延伸有平坦部50。另外,开口48a并不限于圆形形状,也可以设为多边形状或椭圆形状。
多个开口48a规则地配置,在本实施方式中,作为一例配置为蜂窝状。蜂窝状的配置为将平行六边形(优选为正六边形)或与此近似的形状为单位且开口48a的中心位于这些图形的顶点及对角线的交点的配置。其中“开口的中心”表示俯视下开口48a的中心。
另外,开口48a的配置并不限于蜂窝状,也可以设为格子状或面心格子状。格子状的配置为以平行四边形(当然包括正方形、长方形、菱形。优选为正方形)或与此近似的形状为单位且开口的中心位于这些图形的顶点的配置。面心格子状的配置为以平行四边形(当然包括正方形、长方形、菱形。优选为正方形)或与此近似的形状为单位且开口的中心位于这些图形的顶点及对角线的交点的配置。
如图7所示,将多孔膜46的孔48设为切取了球体的上端及下端的球台形状。并且,彼此相邻的孔48彼此在多孔膜46的内部通过连通孔52连通。
1个孔48优选与相邻的所有孔48连通,如本实施方式,多个孔48的开口48a以蜂窝状配置时,1个孔48通过6个连通孔52分别与相邻的6个孔48连通。另外,孔48可以设为桶形状或圆柱形状或多边柱形状等,并且,连通孔52也可以设为连接相邻的孔48彼此的筒状的空隙。
另外,在多孔膜46的主表面中至少播种有细胞的区域优选被选自包括纤连蛋白、胶原蛋白(例如、第一型胶原蛋白、第四型胶原蛋白或第五型胶原蛋白)、层粘连蛋白、玻连蛋白、明胶、串珠蛋白聚糖(perlecan)、巢蛋白、蛋白聚糖、骨桥蛋白、肌腱蛋白、nephronectin、基底膜基质及聚赖氨酸的组中的至少1种被覆。并且,多孔膜46的孔48内也优选被这些中的至少1种被覆。通过被覆多孔膜46,能够提高细胞的粘接性。
并且,多孔膜46为细胞粘接而增殖的基础,多孔膜46的开口率越高,并且,多孔膜46的膜厚越薄,则一侧表面的细胞与另一侧表面的细胞之间的细胞间相互作用(cell-cellinteraction),即通过体液因子的信息传递及细胞彼此的接触(cell-cellcontact)中的至少一种变得活跃。在多孔膜46的主表面上培养细胞时的细胞间相互作用越变得活跃,越能够制造具有近似活体内组织的功能的模型。
作为制作形成有孔48的多孔膜46的方法,例如除纳米印刷法或结露法以外,还可以举出蚀刻法、喷砂法、压制成形等方法。纳米印刷法为通过使构成多孔膜46的材料流入具有凹凸形状的模具或将模具按压到构成多孔膜46的材料上来制作孔48的方法。并且,结露法为使构成多孔膜46的材料的表面结露,将水滴作为模具来形成孔48的方法。
结露法与其他方法相比,能够将多孔膜46的膜厚作薄,并且能够提高孔隙率或开口48a的开口率,并且能够在多孔膜46内设置连通孔52。因此,在本实施方式中,通过结露法制作多孔膜46。关于结露法的详细内容,例如记载于日本专利第4945281号公报、日本专利第5422230号公报、日本特开2011-074140号公报、日本专利第5405374号公报中。
<加强部件>
如图1~如图5所示,在多孔膜46与第2流路部件14对向的对向面14a之间配置有刚性比多孔膜46高的加强部件54。加强部件54作为一例设为由聚对苯二甲酸乙二酯构成的膜部件,并设为覆盖多孔膜46整体的大小。具体而言,将加强部件54设为与第2流路部件14对向的对向面14a大致相同的大小,对多孔膜46中面向形成于第1微流路18与第2微流路20之间的高低差部22、24的部分进行覆盖。
并且,将加强部件54的厚度优选设为12μm以上且比第1微流路18或第2微流路20的深度设薄,具体而言,加强部件54的厚度更优选为12μm以上且400μm以下,进一步优选为12μm以上且200μm以下。
并且,加强部件54的刚性能够通过测定将钢球载置于加强部件54上时的加强部件54的变形量来评价。具体而言,准备开设有φ50mm的孔的厚度3mm的sus(不锈钢)制的板,利用双面胶带(nittodenkocorporation制no.5000ns)将70mm见方的加强部件54的4边固定在板上。并且,将直径11mm、重量5.5g的钢球从加强部件54的上方载置于孔的中心部,通过激光位移计(keyencecorporation制lk-g85)从板下测定此时在孔中心部的加强部件54朝向下方向的变形量。
在上述的评价方法中,加强部件54的刚性越高变形量越小,使用上述评价方法时,加强部件54的变形量优选为3mm以下,更优选为1mm以下。
另外,加强部件54的刚性至少比多孔膜46设高即可,并且,由不易对细胞培养产生影响的材料构成即可。作为不易对细胞培养产生影响的材料,例如除聚对苯二甲酸乙二酯以外,还可以举出pdms(聚二甲基硅氧烷)等硅酮系材料、聚苯乙烯、pen(聚萘二甲酸乙二酯)、聚丙烯、cop(环烯烃聚合物)、pe(聚乙烯)等。并且,加强部件54所需的厚度也通过加强部件54的材质适当决定。
如图2所示,在与加强部件54中的第2流路部件14的螺栓孔32对应的位置形成有多个(在本实施方式中为8个)螺栓孔56,加强部件54通过螺栓40与保持板30及第2流路部件14接合。并且,在与加强部件54中的第2微流路20的流入口20a及流出口20b对应的位置分别形成有贯穿孔57。
并且,在多孔膜46面向第1微流路18及第2微流路20的部分,在加强部件54形成有狭缝58。具体而言,如图3所示,狭缝58设置于与第1微流路18的流路部18c及第2微流路20的流路部20c在俯视下重叠的位置,将狭缝58的宽度设为与第1微流路18的流路部18c的宽度大致相同的宽度。另外,狭缝58的宽度设为至少为第1微流路18的流路部18c的宽度以下即可。
<作用及效果>
根据本实施方式,在第1微流路18与第2微流路20的合流部分形成有高低差部22,通过第1微流路18的流路部18c与第2微流路20的流路部20c的宽度差形成有高低差部24。并且,多孔膜46的面向高低差部22、24的部分通过利用加强部件54被覆而被加强。
因此,例如使细胞悬浮液在第1微流路18流动而在多孔膜46的上表面46a形成细胞层时,即使在对多孔膜46施加有细胞悬浮液的液压的情况下,也能够通过加强部件54抑制多孔膜46向第2微流路20侧的弯曲。由此,能够抑制在高低差部22、24与多孔膜46之间产生间隙,并能够抑制细胞流入该间隙。
并且,在本实施方式中,将加强部件54设为覆盖多孔膜46整体的大小,因此与将加强部件54设为仅覆盖多孔膜46的局部的大小的结构相比,能够更加加强多孔膜46。
进而,在多孔膜46面向第1微流路18及第2微流路20的部分中,在加强部件54形成有狭缝58。因此,例如在进行细胞、红血球或示踪剂的透过性试验等时,细胞、红血球或示踪剂能够经由加强部件54的狭缝58及多孔膜46在第1微流路18与第2微流路20之间移动,由此能够抑制细胞、红血球或示踪剂的移动受到加强部件54的阻碍。
尤其在本实施方式中,将加强部件54的狭缝58的宽度设为与第1微流路18的流路部18c的宽度大致相同的宽度。因此,与加强部件54的狭缝58的宽度比流路部18c的宽度更大的情况相比,更加能够抑制在高低差部24与多孔膜46之间产生间隙。并且,与加强部件54的狭缝58的宽度比流路部18c的宽度更小的情况相比,更加能够抑制细胞、红血球或示踪剂的移动受到加强部件54的阻碍。
并且,根据本实施方式,将加强部件54设为由具有活体适合性的聚对苯二甲酸乙二酯等构成的膜部件。因此,能够抑制加强部件54中所包含的成分对第1微流路18内或第2微流路20内的细胞等产生影响。
并且,将加强部件54的厚度设为12μm以上且比第1微流路18或第2微流路20的深度薄。因此,与将加强部件54的厚度设为小于12μm的结构相比,能够提高加强部件54的刚性,并能够通过加强部件54更加坚固地加强多孔膜46。
进而,与加强部件54的厚度比第1微流路18及第2微流路20的深度大的情况相比,使细胞悬浮液在第1微流路18或第2微流路20流动而在多孔膜46的表面形成细胞层时,能够抑制细胞向多孔膜46的播种受到加强部件54的阻碍。
(第2实施方式)
接着,利用图8、图9对本发明的第2实施方式进行说明。另外,为了易于说明各结构,适当变更了图中各结构的尺寸。因此,图中的比例尺与实际不同。并且,对与第1实施方式相同的结构标注相同符号而省略说明。
如图8所示,本实施方式的微流路装置60与第1实施方式的微流路装置10同样地具有形成有第1微流路68的第1流路部件62和形成有第2微流路70的第2流路部件64。
第1微流路68与第2微流路70通过多孔膜46被分隔,与第1实施方式同样地,分别具有流入口68a、70a、流出口68b、70b及连通流入口68a、70a与流出口68b、70b且以大致直线状延伸的流路部68c、70c。
如图9所示,第1微流路68的流入口68a及流出口68b设置于与第2微流路70的流入口70a及流出口70b在俯视下分离的位置。并且,第1微流路68的流路部68c设置于与第2微流路70的流路部70c在俯视下重叠的位置。
由此,在第1微流路68与第2微流路70的合流部分,即在流入口68a、70a与流路部68c、70c之间及流出口68b、70b与流路部68c、70c之间分别形成有高低差部72。另一方面,在本实施方式中,将第1微流路68的流路部68c的宽度和第2微流路70的流路部70c的宽度设为大致相同的大小。
在多孔膜46与第2流路部件64对向的对向面64a之间配置有刚性比多孔膜46高的一对加强部件74。一对加强部件74作为一例,设为由聚对苯二甲酸乙二酯等构成的矩形形状的膜部件,将一对加强部件74的厚度设为12μm以上且比第1微流路18及第2微流路20的深度薄。
并且,将一对加强部件74设为分别覆盖多孔膜46中面向形成于第1微流路68与第2微流路70之间的高低差部72的部分的大小。进而,一对加强部件74彼此隔着间隔配置,在一对加强部件74之间存在第1微流路68的流路部68c及第2微流路70的流路部70c。
<作用及效果>
根据本实施方式,在第1微流路68与第2微流路70的合流部分形成有高低差部72,多孔膜46的面向高低差部72的部分通过利用一对加强部件74分别被覆而被加强。
因此,例如使细胞悬浮液在第1微流路68流动而在多孔膜46的上表面46a形成细胞层时,即使在对多孔膜46施加有细胞悬浮液的液压的情况下,也能够通过加强部件74抑制多孔膜46向第2微流路70侧的弯曲。由此,能够抑制在高低差部72与多孔膜46之间产生间隙,并能够抑制细胞、红血球或示踪剂流入该间隙。
并且,根据本实施方式,一对加强部件74彼此隔着间隔配置,在一对加强部件74之间存在第1微流路68的流路部68c及第2微流路70的流路部70c。因此,例如在进行细胞、红血球或示踪剂的透过性试验等时,能够抑制第1微流路68与第2微流路70之间的细胞、红血球或示踪剂的移动受到加强部件74的阻碍。
(其他实施方式)
以上,对本发明的实施方式的一例进行了说明,但本发明并不限定于上述,除上述以外,能够在不脱离其主旨的范围内进行各种变形来实施。
例如在第1、第2实施方式中,将加强部件54、74设置于多孔膜46与第2流路部件14、64对向的对向面14a、64a之间,但加强部件54、74也可以设置于第1流路部件12、62对向的对向面12a、62a与多孔膜46之间。
并且,在第1、第2实施方式中,在第1流路部件12、62的上侧设置有保持板30,并通过螺栓40接合保持板30与第2流路部件14、64。然而,可以不设置保持板30,第1流路部件12、62与第2流路部件14、64可以利用粘接、熔接、吸附(自行吸附)等相互接合。
实施例
以下,对本发明的实施例及比较例进行说明。另外,本发明不应因以下实施例而被限定性地解释。
<微流路装置的制作>
首先,作为多孔膜,准备由以蜂窝状配置有孔的聚碳酸酯构成的膜部件,将多孔膜利用胶原蛋白被覆之后,在多孔膜的两面贴附了灭菌纸。接着,利用镊子剥离多孔膜的下表面的灭菌纸,在形成有第2微流路的第2流路部件上载置多孔膜来接合了多孔膜与第2流路部件。
接着,利用镊子剥离多孔膜的上表面的灭菌纸,一边确认显微镜一边对第1流路部件与第2流路部件的位置进行对位,将形成有第1微流路的第1流路部件载置于多孔膜上来接合了多孔膜与第1流路部件。
并且,在第1流路部件的上部载置保持板,隔着间隔物利用螺栓及螺帽紧固保持板与第2流路部件,由此制作了成为基部的微流路装置。另外,将微流路装置的第1微流路的宽度及深度设为200μm,将第2微流路的宽度及深度设为400μm。
[实施例1]
在实施例1中,制作了与上述第1实施方式相同结构的微流路装置。具体而言,制作了在成为基部的微流路装置的多孔膜与第2流路部件之间作为加强部件夹入膜部件的微流路装置,该膜部件在中央部形成有狭缝且由聚丙烯构成。另外,将加强部件的大小设为与第2流路部件对向的对向面(主表面)大致相同的大小,将加强部件的厚度设为100μm,关于加强部件的刚性,通过利用前述钢球的评价方法,将变形量设为0.5mm。
[实施例2]
在实施例2中,制作了与上述第2实施方式相同结构的微流路装置。具体而言,制作了在成为基部的微流路装置的多孔膜与第2流路部件之间作为加强部件夹入由聚对苯二甲酸乙二酯构成的一对膜部件的微流路装置。另外,将加强部件的大小分别设为3mm见方,将加强部件的厚度分别设为12μm,关于加强部件的刚性,通过利用前述钢球的评价方法,将变形量设为1mm。并且,加强部件分别配置于第1微流路与第2微流路的合流部分。
[比较例1]
在比较例1中,未配置加强部件,直接使用了成为基部的微流路装置。
[比较例2]
在比较例2中,制作了在成为基部的微流路装置的多孔膜与第2流路部件之间作为加强部件夹入由聚对苯二甲酸乙二酯构成的一对膜部件的微流路装置。另外,将加强部件的大小分别设为3mm见方,将加强部件的厚度分别设为2μm。并且,加强部件分别配置于第1微流路与第2微流路的合流部分。
<细胞的观察>
在上述的实施例1、实施例2、比较例1及比较例2的微流路装置的多孔膜播种细胞,并观察了该细胞。具体而言,首先,将来自骨髓的间叶系干细胞(lonzagrouplimited)的悬浮液以浓度3×106cells/ml进行调整,将200μl的悬浮液注入到下侧的第2微流路中。接着,反转微流路装置,在co2培养箱内在37℃下静置3小时之后,使培养基以每分钟0.7μl的速度流动,并培养了一晩。
接着,将用celltrackerorange(thermofisherscientific)染色的来自ips细胞的血管内皮细胞(corporatedirections,inc.的icellec)的悬浮液以浓度1×106cells/ml进行调整,将200μl的悬浮液注入到上侧的第1微流路。
之后,在实施例1、实施例2、比较例1及比较例2的微流路装置中,利用荧光显微镜,分别观察了注入到第1微流路中的来自ips细胞的血管内皮细胞的分布。将实施例1的观察结果示于图10a、图10b,将比较例1的观察结果示于图11a、图11b。另外,在图10a、图10b、图11a及图11b中,仅图示来自ips细胞的血管内皮细胞。
在实施例1中,如图10a、图10b所示,确认到来自ips细胞的血管内皮细胞s残留在第1微流路内。另一方面,在比较例1中,如图11a、图11b所示,来自ips细胞的血管内皮细胞s的一部分位于第2微流路内,因此,确认到来自ips细胞的血管内皮细胞s犹如看似向第2微流路内漏出。
另外,虽省略图示,但关于实施例2及比较例2,也成为与实施例1及比较例1的观察结果相同的结果。具体而言,在实施例2中,来自ips细胞的血管内皮细胞s残留在第1微流路内,相对于此,在比较例2中,确认到来自ips细胞的血管内皮细胞s的一部分位于第2微流路内,来自ips细胞的血管内皮细胞s看似向第2微流路内漏出。
关于2018年3月2日申请的日本国专利申请2018-037511号的公开,其整体通过参考援用于本说明书中。
本说明书中记载的所有文献、专利申请及技术规格与通过参考援用于各个文献、专利申请及技术规格的情况被具体且各个记入的情况相同程度地,通过参考援用于本说明书中。
符号说明
10、60-微流路装置,12、62-第1流路部件,12a、62a-对向面,14、64-第2流路部件,14a、64a-对向面,16-流路单元,18、68-第1微流路,18a、68a-流入口,18b、68b-流出口,18c、68c-流路部,20、70-第2微流路,20a、70a-流入口,20b、70b-流出口,20c、70c-流路部,22、24、72-高低差部,26a、26b、28a、28b-贯穿孔,30-保持板,32、56-螺栓孔,34-凹部,36-间隔物,38-螺帽,40-螺栓,42a、42b、44a、44b-贯穿孔,46-多孔膜,46a-上表面,46b-下表面,48-孔,48a-开口,50-平坦部,52-连通孔,54、74-加强部件,57-贯穿孔,58-狭缝。
- 还没有人留言评论。精彩留言会获得点赞!