电解精炼Ti电解质制备TiCl3的方法及回收方法与流程
本发明属于稀有金属提炼技术领域,具体涉及一种电解精炼ti电解质制备ticl3的方法及回收方法。
背景技术
熔盐电解精炼钛,一般采用粗钛或含钛物料作为阳极,金属材料为阴极,电解质为碱金属或碱土金属卤化物与低价钛离子,粗钛在阳极溶出并以离子形式进入熔盐,在电场力及浓度梯度作用下迁移至阴极析出获得纯钛。其中,所使用的电解质通常为等摩尔比的nacl-kcl熔融电解质,并向其中加入低价钛离子,电解质中的低价钛离子通常采用ticl4与海绵钛在熔盐中反应制得,主要包括以下几个反应:
ti+ticl4=2ticl2
ticl2+ticl4=2ticl3
ti+2ticl3=3ticl2
制备时,由于以上几个反应同时发生,并且每个反应进行的速率以及程度无法精确控制,导致制备完成的电解质中既有ticl2也有ticl3。而熔盐电解精炼ti所使用的电解质在使用多个周期后会由于其中的杂质元素以及弥散的细微ti粉超标等原因而需要更换,更换的电解质中含有多种组分,较难实现各组分的纯净分离与利用。
常规回收制备三氯化钛有用各种还原剂还原ticl4而制得的,如在500~800℃下用氢还原制ticl3,反应为:2ticl4+h2—2ticl3+2hcl,但是,这个反应是可逆的,如果不断排出反应产物则还原反应便不容易进行。
也有用其他金属还原剂,控制适宜的反应条件还原ticl4而制取ticl3,如目前已公开的利用金属na、mg、h2、al等还原ticl4制备ticl3的方法中,但这些反应类似于金属ti还原ticl4,反应过程有多个反应同时发生,要获得纯净ticl3条件极难控制。
技术实现要素:
本发明所要解决的技术问题是提供一种电解精炼ti的电解质制备ticl3的方法。该方法包括以下步骤:将电解精炼ti的电解质与无水nicl2混合反应即可。
具体的,上述电解精炼ti的电解质制备ticl3的方法中,所述反应温度为670~800℃。
具体的,上述电解精炼ti的电解质制备ticl3的方法中,所述无水nicl2添加量为过量。
进一步的,上述电解精炼ti的电解质制备ticl3的方法中,所述过量为按摩尔比计,过量0.1~1倍。
优选的,上述电解精炼ti的电解质制备ticl3的方法中,所述电解精炼ti的电解质为nacl-kcl-ticl2-ticl3。
其中,上述电解精炼ti的电解质制备ticl3的方法中,所述电解质中ti2+占整个电解质的0~20wt%,ti3+占整个电解质的0~20wt%,ti2+与ti3+均不为0。
本发明所要解决的第二个技术问题是提供一种从电解精炼ti的电解质中回收ticl3的方法。该方法包括以下步骤:将电解精炼ti的电解质或上述方法混合反应后的电解质进行减压蒸馏,收集蒸馏冷凝物即可。
优选的,上述从电解精炼ti的电解质中回收ticl3的方法中,所述减压蒸馏压力为10~15pa。
优选的,上述从电解精炼ti的电解质中回收ticl3的方法中,所述减压蒸馏温度为350~440℃。
优选的,上述从电解精炼ti的电解质中回收ticl3的方法中,所述电解精炼ti的电解质为nacl-kcl-ticl2-ticl3。
其中,上述从电解精炼ti的电解质中回收ticl3的方法中,所述电解质中ti2+占整个电解质的0~20wt%,ti3+占整个电解质的0~20wt%,ti2+与ti3+均不为0。
本发明方法创造性地向熔融电解质中加入nicl2使初始电解质中的ticl2转化为ticl3,提高了钛总收率,使电解质中二价钛和三价钛的ti总回收率在94.8%以上。
本发明方法控制减压蒸馏的温度与蒸馏压力,在所述控制条件范围内nacl、kcl及其他杂质元素氯化物蒸气压均处于较低水平,提高了分离系数,并且所述条件范围内ticl3不会歧化为其他物质,因此可以获得较高纯度的ticl3,纯度可达到99.5%以上,且该蒸馏条件几乎能够百分之百回收电解质体系中的ticl3。
附图说明
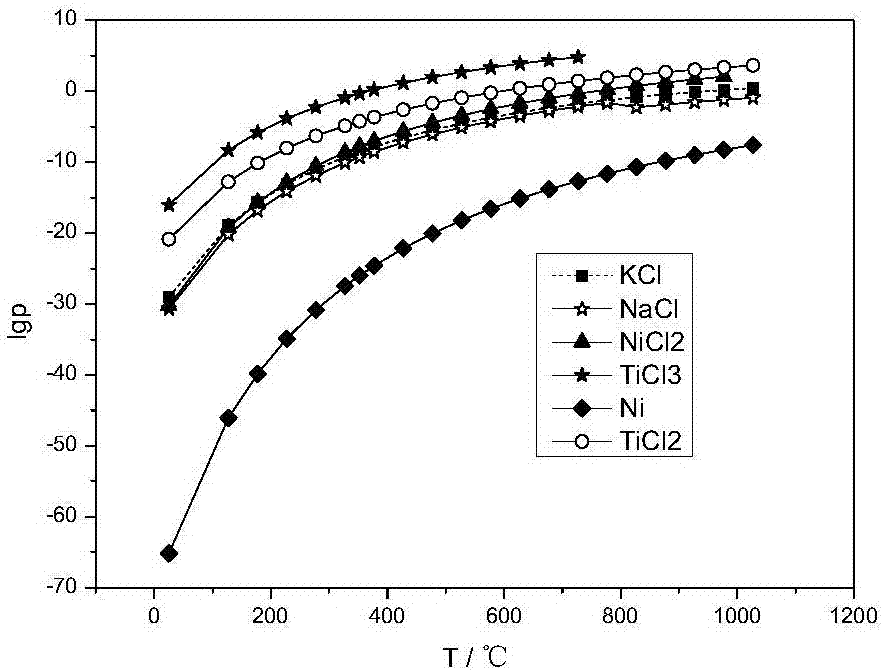
图1混合熔盐中各物质温度与蒸气压对数关系
图2不同压力下反应(2)自由能
图3不同压力下反应(3)自由能
图4实施例1产物xrd图
图5实施例2产物xrd图
具体实施方式
从电解精炼ti的电解质中制备并回收ticl3的方法,包括以下步骤:
a、向初始熔融电解质中加入无水nicl2,保持一定温度搅拌反应;
b、对步骤a获得的混合物采用减压蒸馏实现ticl3与其他组份的分离,收集蒸馏冷凝物获得纯净固体ticl3。
本发明方法步骤a中,所述初始熔融电解质为电解精炼ti的电解质。一般常用为nacl-kcl-ticl2-ticl3。其中ti2+的原始浓度为0<ti2+≤20wt%,ti3+的原始浓度为0<ti3+≤20wt%。
本发明方法步骤a中,无水nicl2加入目的为使初始熔融电解质中的ticl2发生式(1)反应:
2ticl2+nicl2=2ticl3+ni(1)
该反应的吉布斯自由能为:δg=-38.5t-118170kj·mol-1(25<t<1000℃)
在上述温度范围内式(1)反应吉布斯自由能恒小于0,表明均能发生,本发明步骤a中优选保温温度范围为670~800℃,在该温度范围内电解质可保持熔融状态,并且具有较好的流动性,利于nicl2与电解质充分混合并保持均匀,并且可提高式(1)反应速率,但是过高的温度熔盐组份挥发剧烈不利于保持稳定。
无水nicl2加入量为式(1)基准计量1.1~2倍是为确保初始熔融电解质中的ticl2最大限度的转化为ticl3。
经过步骤a处理后的熔盐主要组份为nacl、kcl、ticl3、nicl2、金属ni以及少量残余的ticl2,各物质蒸气压对数与温度关系如图1示。图1表明,混合熔盐中ticl3与其他各物质组份蒸气压在同温度下有较大差距,并且随温度增加蒸气压值均剧烈增大,选取适宜温度范围具有良好的分离可行性。
表1列出了在350~680℃范围内各物质蒸气压的具体数值,数据表明该温度范围内ticl3高于其他各物质组份的蒸气压4~11个数量级,而该温度范围内ticl3蒸气压为0.43~2.56×10+04pa。
表1混合熔盐中各物质温度与蒸气压关系
以上数据表明,350~680℃温度范围内,ticl3与电解质中的其他各物质组份具有良好的蒸馏分离性。
但是对纯ticl3而言,存在以下两个歧化反应,分别为式(2)反应、式(3)反应:
4ticl3=3ticl4(g)+ti(2)
2ticl3=ticl4(g)+ticl2(3)
上述两个反应的吉布斯自由能分别为:
δg0(1)=-463.9t+473050kj·mol-1(350≤t<700℃)
δg0(2)=-138.3t+116310kj·mol-1(350≤t<700℃)
因此上述两个反应在常压下均δg>0,不具备发生可能性,但本发明步骤b采用减压蒸馏实现ticl3的分离,负压条件下,反应吉布斯自由能计算公式为:
δg=δg0+rtln(p/p0)(4)
式中δg为反应吉布斯自由能,kj·mol-1;δg0为反应标准吉布斯自由能,kj·mol-1;r为气体常数,8.314kj·mol-1;t为温度,k;p为体系压力,pa;p0为标准大气压,1.01×105pa。
通过公式(4)对不同负压下两个反应吉布斯自由能进行计算,并绘制于图2、图3。结果表明对于ticl3的歧化反应(2)而言,350~700℃温度范围内,体系压力0.5pa~105pa范围内,δg均恒大于0,不具备发生可能性;而对于反应(3)而言,当体系压力<10pa,且温度大于440℃时,δg<0,表明反应具备发生可能性。因此为防止ticl3在负压下歧化,控制减压蒸馏温度范围为350~440℃,减压蒸馏压力范围为10~15pa。
下面通过实施例对本发明作进一步详细说明,但并不因此将本发明保护范围限制在所述的实施例范围之中。
实施例1
初始nacl-kcl-ticl2-ticl3熔融电解质,共计5000g,放置于密闭反应器内,其中ti2+和ti3+浓度均为2.5%;向初始熔融电解质中加入无水nicl2共计337.5g,保持温度800℃,高纯ar气搅拌120min,完成后对上述处理后的电解质进行减压蒸馏,蒸馏温度440℃,控制蒸馏罐压力15pa,完成后共计收集固相冷凝物588.1g,电解质中二价钛和三价钛总回收率94.8%。经xrd检测为ticl3物相(图4),无其他物相衍射峰,经icp成分检测na:0.02wt%,k<0.01wt%,ni<0.01wt%,ticl3含量>99.5%。
实施例2
初始nacl-kcl-ticl2-ticl3熔融电解质,共计5000g,放置于密闭反应器内,其中ti2+浓度为1.5%,ti3+浓度为3.0%;向初始熔融电解质中加入无水nicl2共计113.4g,保持温度680℃,高纯ar气搅拌240min,完成后对上述处理后的电解质进行减压蒸馏,蒸馏温度350℃,控制蒸馏罐压力10pa,完成后共计收集固相冷凝物536.1g,电解质中二价钛和三价钛总回收率96.1%。经xrd检测为ticl3物相(图5),无其他物相衍射峰,经icp成分检测na<0.01wt%,k<0.01wt%,ni<0.01wt%,ticl3含量>99.6%。
- 还没有人留言评论。精彩留言会获得点赞!