检测RNAG-四链体的方法与流程
本发明涉及生物技术领域,具体地,本发明涉及一种检测RNA G-四链体的方法。
背景技术:
RNA G-四链体是由富含鸟嘌呤的RNA序列形成的二级结构,该结构的基本单元为四个鸟嘌呤碱基通过Hoogsteen氢键形成的G-tetrad平面结构,并通过多个G平面的堆积,形成独特的G-四链体结构。在人类的转录基因的研究中发现,许多与恶性肿瘤发生发展关系密切的基因(如NRAS、ZIC1、MT3-MMP、NCAM2、BCL-2、TRF2、FGF-2、VEGF等),其转录产物mRNA的5’-UTR可形成大量的RNA G-四链体结构,研究表明这些RNA G-四链体在蛋白质的翻译过程中有重要的调控作用,因此,准确有效地检测RNA G-四链体结构对于抗肿瘤药物设计以及恶性肿瘤的早期检测都具有非常重要的意义。
然而,对RNA G-四链体的检测方法有待进一步开发。
技术实现要素:
本发明旨在至少在一定程度上解决相关技术中的技术问题之一。
本发明是基于发明人对下列问题和现象的发现而完成的:
现有检测RNA G-四链体的方法,如利用RNA G-四链体的CD光谱特性及G-四链体的亚氨基氢NMR谱特性来检测RNA G-四链体的存在,RNA G-四链体和其他RNA结构的CD光谱,差异较小,难以简单区分,然而NMR谱识别RNA G-四链体需要足够量的RNA G-四链体,RNA序列价格昂贵、合成困难,因此,该方法也大大限制了其使用范围。
而菁染料是一种常用染料,具有独特的光敏感性质。
基于对现有技术问题的发现和菁染料独特光敏特性的认识,发明人提出了一种利用菁染料检测RNA G-四链体的方法,该方法灵敏度高而且操作简便。
在本发明的第一方面,本发明提出了菁染料在制备试剂盒中的用途,所述试剂盒用于检测RNA G-四链体。根据本发明的实施例,利用菁染料检测RNA G-四链体,可以将菁染料聚集体紫外吸收峰小于0.01、菁染料聚单体紫外吸收峰大于0.05、菁染料单体荧光发射峰与预定参数相比高200~1200倍或混合溶液颜色为粉红色作为RNA G-四链体的指示,利用菁染料检测RNA G-四链体具有灵敏度高、操作简便特点。
在本发明的第二方面,本发明提出了一种确定待测样品中是否存在RNA G-四链体的方法。根据本发明的实施例,所述方法包括:(1)将待测样品与菁染料接触,以便得到混合溶液,所述待测样品被预先确定含有RNA;(2)对所述混合溶液进行紫外吸收光谱分析;以及(3)基于所述紫外吸收光谱分析结果,确定所述待测样品中是否存在RNA G-四链体,其中,所述紫外吸收光谱分析结果中菁染料聚集体特征峰小于0.01是所述待测样品中含有RNA G-四链体的指示。所述菁染料聚集体特征峰在628nm~668nm。在紫外吸收光谱分析中,上述的菁染料聚集体特征峰为菁染料聚集体吸收峰。根据本发明的实施例,RNA G-四链体可以使菁染料聚集体解聚为单体,菁染料聚集体特征峰(菁染料聚集体吸收峰)小于0.01可作为待测样品中含有RNA G-四链体的显著判定指标,本发明所提出确定待测样品中是否存在RNA G-四链体的方法具有准确度高、灵敏度高、操作简便的特点。
根据本发明的实施例,上述确定待测样品中是否存在RNA G-四链体的方法还可以进一步具有下列附加技术特征至少之一:
根据本发明的实施例,上述方法的步骤(1)进一步包括:将所述待测样品溶解在Tris缓冲液中,以便获得溶液A,所述Tris缓冲液含有钾离子,所述钾离子的浓度是40mM,所述Tris缓冲液pH为7.0~8.0;将所述菁染料与甲醇和Tris缓冲液混合,以便获得溶液B;将所述溶液A和溶液B混合并在避光条件下反应5~10小时,以便获得所述混合溶液,其中,所述混合溶液中RNA与所述菁染料的分子摩尔比为(0.5~4):1。根据本发明的实施例,本发明所提出的Tris缓冲液可以稳定RNA,保持RNA的生物活性,在该缓冲液条件下,菁染料聚集体与RNA G-四链体具有较强的相互作用。RNA G-四链体与菁染料分子的摩尔比为(0.5~4):1时,RNA G-四链体可以使菁染料从聚集体完全解聚为单体。在上述条件下,本发明提出的确定待测样品中是否存在RNA G-四链体的方法准确度、灵敏度进一步提高。
在本发明的第三方面,本发明提出了一种确定待测样品中是否存在RNA G-四链体的方法。根据本发明的实施例,所述方法包括:(1)将待测样品与菁染料接触,以便得到混合溶液,所述待测样品被预先确定含有RNA;(2)对所述混合溶液进行紫外吸收光谱分析;以及(3)基于所述紫外吸收光谱分析结果,确定所述待测样品中是否存在RNA G-四链体,其中,所述紫外吸收光谱分析结果中菁染料聚单体特征峰大于0.05是所述待测样品中含有RNA G-四链体的指示,所述菁染料单体特征峰在558nm~598nm。根据本发明的实施例,RNA G-四链体可以使菁染料聚集体解聚为单体,菁染料单体特征峰(菁染料单体吸收峰)大于0.05可作为待测样品中含有RNA G-四链体的显著判定指标,本发明所提出确定待测样品中是否存在RNA G-四链体的方法具有准确度高、灵敏度高、操作简便的特点。
根据本发明的实施例,上述确定待测样品中是否存在RNA G-四链体的方法还可以进一步具有下列附加技术特征至少之一:
根据本发明的实施例,上述方法的步骤(1)进一步包括:将所述待测样品溶解在Tris缓冲液中,以便获得溶液A,所述Tris缓冲液含有钾离子,所述钾离子的浓度是40mM,所述Tris缓冲液pH为7.0~8.0;将所述菁染料与甲醇和Tris缓冲液混合,以便获得溶液B;将所述溶液A和溶液B混合并在避光条件下反应5~10小时,以便获得所述混合溶液,其中,所述混合溶液中RNA与所述菁染料的分子摩尔比为(0.5~4):1。根据本发明的实施例,本发明所提出的Tris缓冲液可以稳定RNA,保持RNA的生物活性,在该缓冲液条件下,菁染料聚集体与RNA G-四链体具有较强的相互作用。RNA G-四链体与菁染料分子的摩尔比为(0.5~4):1时,RNA G-四链体可以使菁染料从聚集体完全解聚为单体。在上述条件下,本发明提出的确定待测样品中是否存在RNA G-四链体的方法准确度、灵敏度进一步提高。
在本发明的第四方面,本发明提出了一种确定待测样品中是否存在RNA G-四链体的方法。根据本发明的实施例,所述方法包括:(1)将待测样品与菁染料接触,以便得到混合溶液,所述待测样品被预先确定含有RNA;(2)对所述混合溶液进行荧光光谱分析;以及(3)基于所述荧光光谱分析结果,确定所述待测样品中是否存在RNA G-四链体,其中,所述荧光光谱分析结果中菁染料单体特征峰与预定参数相比高200~1200倍是所述待测样品中含有RNAG-四链体的指示,所述预定参数是利用菁染料进行平行试验确定的,所述菁染料单体特征峰在575nm~615nm。利用菁染料进行平行试验是指以只含有菁染料的Tris缓冲液(含钾离子)为对照溶液,其中,菁染料的浓度与上述混合溶液中菁染料的浓度相同,在与混合溶液相同检测条件下对上述对照溶液进行进行荧光光谱分析。根据本发明的实施例,RNA G-四链体可以使菁染料聚集体解聚为单体,菁染料单体特征峰(菁染料单体荧光发射峰)与预定参数相比高200~1200倍可作为待测样品中含有RNA G-四链体的显著判定指标,本发明所提出确定待测样品中是否存在RNA G-四链体的方法具有准确度高、灵敏度高、操作简便的特点。
根据本发明的实施例,上述确定待测样品中是否存在RNA G-四链体的方法还可以进一步具有下列附加技术特征至少之一:
根据本发明的实施例,上述方法的步骤(1)进一步包括:将所述待测样品溶解在Tris缓冲液中,以便获得溶液A,所述Tris缓冲液含有钾离子,所述钾离子的浓度是40mM,所述Tris缓冲液pH为7.0~8.0;将所述菁染料与甲醇和Tris缓冲液混合,以便获得溶液B;将所述溶液A和溶液B混合并在避光条件下反应5~10小时,以便获得所述混合溶液,其中,所述混合溶液中RNA与所述菁染料的分子摩尔比为(0.5~4):1。根据本发明的实施例,本发明所提出的Tris缓冲液可以稳定RNA,保持RNA的生物活性,在该缓冲液条件下,菁染料聚集体与RNA G-四链体具有较强的相互作用。RNA G-四链体与菁染料分子的摩尔比为(0.5~4):1时,RNA G-四链体可以使菁染料从聚集体完全解聚为单体。在上述条件下,本发明提出的确定待测样品中是否存在RNA G-四链体的方法准确度、灵敏度进一步提高。
在本发明的第五方面,本发明提出了一种确定待测样品中是否存在RNA G-四链体的方法。根据本发明的实施例,所述方法包括:(1)将待测样品与菁染料接触,以便得到混合溶液,所述待测样品被预先确定含有RNA;(2)观察所述混合溶液的颜色,确定所述待测样品中是否存在RNA G-四链体,其中,所述混合溶液的颜色为粉红色是所述待测样品中含有RNA G-四链体的指示。在本发明的实施例中,发明人惊奇地发现,单链RNA和菁染料的混合溶液呈现蓝色。根据本发明的实施例,本发明所提出的确定待测样品中是否存在RNA G-四链体的方法可以非常直观地从颜色变化的角度预先确定待测样品中是否存在RNA G-四链体。
根据本发明的实施例,上述确定待测样品中是否存在RNA G-四链体的方法还可以进一步具有下列附加技术特征至少之一:
根据本发明的实施例,上述方法进一步包括:将所述待测样品溶解在Tris缓冲液中,以便获得溶液A,所述Tris缓冲液含有钾离子,所述钾离子的浓度是40mM,所述Tris缓冲液pH为7.0~8.0;将所述菁染料与甲醇和Tris缓冲液混合,以便获得溶液B;将所述溶液A和溶液B混合并在避光条件下反应5~10小时,以便获得所述混合溶液,其中,所述混合溶液中RNA与所述菁染料的分子摩尔比为(0.5~4):1。根据本发明的实施例,本发明所提出的Tris缓冲液可以稳定RNA,保持RNA的生物活性,在该缓冲液条件下,菁染料聚集体与RNA G-四链体具有较强的相互作用。RNA G-四链体与菁染料分子的摩尔比为(0.5~4):1时,RNA G-四链体可以使菁染料从聚集体完全解聚为单体。菁染料聚集体和单体呈现完全不同的颜色。在上述条件下,本发明提出的通过颜色的变化确定待测样品中是否存在RNA G-四链体的方法灵敏度进一步提高。
在本发明的第六方面,本发明提出了一种用于检测RNA G-四链体的试剂盒。根据本发明的实施例,所述试剂盒包括菁染料;任选的Tris缓冲液;以及任选的甲醇。根据本发明的实施例,本发明提出的试剂盒能够方便快捷地检测RNA G-四链体。该试剂盒具有灵敏度高、准确度高的特点。
根据本发明的实施例,上述试剂盒还可以进一步具有下列附加技术特征至少之一:
根据本发明的实施例,所述Tris缓冲液含有钾离子,所述钾离子的浓度是40mM,所述Tris缓冲液pH为7.0~8.0。根据本发明的实施例,本发明所提出的Tris缓冲液可以稳定RNA,保持RNA的生物活性,在该缓冲液条件下,菁染料聚集体与RNA G-四链体具有较强的相互作用。在上述条件下,本发明提出的试剂盒准确度、灵敏度进一步提高。
需要说明的是,本专利中术语“第一”、“第二”仅用于描述目的,而不能理解为指示或暗示相对重要性或者隐含指明所指示的技术特征的数量。由此,限定有“第一”、“第二”的特征可以明示或者隐含地包括一个或者更多个该特征。在本发明的描述中,“多个”的含义是两个或两个以上,除非另有明确具体的限定。
附图说明
图1是根据本发明实施例的检测液丙(对照组)的紫外吸收光谱图;
图2是根据本发明实施例2的检测液甲的紫外吸收光谱图;
图3是根据本发明实施例2的检测液乙的紫外吸收光谱图;
图4是根据本发明实施例的检测液丙(对照组)的荧光光谱图;
图5是根据本发明实施例2的检测液甲的荧光光谱图;
图6是根据本发明实施例2的检测液乙的荧光光谱图;
图7是根据本发明实施例3的检测液甲的紫外吸收光谱图;
图8是根据本发明实施例3的检测液乙的紫外吸收光谱图;
图9是根据本发明实施例3的检测液甲的荧光光谱图;
图10是根据本发明实施例3的检测液乙的荧光光谱图;
图11是根据本发明实施例4的检测液甲的紫外吸收光谱图;
图12是根据本发明实施例4的检测液乙的紫外吸收光谱图;
图13是根据本发明实施例4的检测液甲的荧光光谱图;
图14是根据本发明实施例4的检测液甲的荧光光谱图;
图15是根据本发明实施例5的检测液甲的紫外吸收光谱图;
图16是根据本发明实施例5的检测液乙的紫外吸收光谱图;
图17是根据本发明实施例5的检测液甲的荧光光谱图;以及
图18是根据本发明实施例5检测液乙的荧光光谱图。
具体实施方式
下面详细描述本发明的实施例。下面描述的实施例是示例性的,仅用于解释本发明,而不能理解为对本发明的限制。
在本发明的一个方面,本发明提出了一种利用菁染料确定待测样品中是否存在RNA G-四链体的方法。
在本发明中,菁染料的分子结构如式I所示,
根据本发明的实施例,利用菁染料可通过如下方法确定待测样品中是否存在RNA G-四链体:
制备RNA和菁染料的混合溶液
将待测样品溶于pH值为7.0-8.0的缓冲液中,得到溶液A;将菁染料溶于甲醇,再用pH值为7.0~8.0的缓冲液稀释,得到溶液B;将溶液A和溶液B混合,使溶液中待测RNA与菁染料的分子摩尔比为(0.5~4):1,避光条件下反应5-10h后,以便获得RNA和菁染料的混合溶液。
其中,缓冲液具体为Tris-HCl(含K+)缓冲溶液,K+的浓度是40mM。根据本发明的实施例,在该缓冲液中,菁染料聚集体与RNA G-四链体具有较强的相互作用,而与单链RNA几乎没有作用;当RNA G-四链体与菁染料分子的摩尔比为(0.5~4):1时,RNA G-四链体可以使菁染料从聚集体完全解聚为单体。基于菁染料聚集体特征峰和单体特征的差异,发明人进一步采用了紫外吸收光谱分析法或荧光光谱分析法对获得RNA和菁染料的混合溶液进行测定,以此来确定待测样品中是否存在RNA G-四链体。
紫外吸收光谱分析
对上述获得RNA和菁染料的混合溶液进行紫外吸收光谱分析,如果菁染料聚集体特征峰(628nm~668nm)(此处为紫外吸收峰)小于0.01或菁染料单体特征峰(558nm~598nm)(此处为紫外吸收峰)峰值大于0.05,则待测样品中存在RNA G-四链体。
荧光光谱分析
对上述获得RNA和菁染料的混合溶液进行荧光光谱分析,如果溶液在575nm~615nm处出现较强的菁染料单体特征峰(此处为荧光发射峰),则待测样品中存在RNA G-四链体。
根据本发明的实施例,在RNA G-四链体与菁染料的摩尔比为(0.5~4):1时,可使菁染料单体特征峰(此处为荧光发射峰)荧光强度增强200~1200倍。在根据本发明的实施例,发明人发现单链RNA与菁染料的摩尔比在与RNA G-四链体与菁染料摩尔比相同的条件下,菁染料单体的荧光强度增强只有2倍。因此,通过检测菁染料聚集体与待测RNA相互作用后的菁染料单体特征峰(此处为荧光发射峰)荧光强度,就能够快速简便地检测待测RNA,从而判断待测样品中存在RNA G-四链体。
观察颜色变化
观察上述获得RNA和菁染料的混合溶液的颜色变化,如果溶液颜色为粉红色,则待测样品中存在RNA G-四链体。根据本发明的实施例,如果单链RNA与菁染料混合,且混合条件与RNA G-四链体和菁染料混合条件一致,所得溶液的颜色为蓝色。由此,利用菁染料检测RNA G-四链体,可以通过明显的颜色特征预先与其它的RNA(如单链RNA)区别开来。从颜色变化的角度可以预先定性地确定待测样品中是否含有RNA G-四链体。
根据本发明的实施例,本发明提出的利用菁染料检测RNA G-四链体的方法能够在溶液体系中高效地识别RNA G-四链体;能够利用简单的光谱学仪器快捷地识别出RNA G-四链体;能够直接通过溶液颜色的变化预先确定RNA G-四链体。通过溶液颜色的变化能够预先定性地确定待测样品中是否存在RNA G-四链体,通过光谱学仪器的测定能够更加精确地确定待测样品中是否存在RNA G-四链体,如进行定量分析等。
在本发明的另一方面,本发明提出了菁染料在检测RNA G-四链体的新用途。应用菁染料检测RNA G-四链体具有简单、快捷的优点,克服了现有检测价格昂贵,灵敏度差的缺陷。菁染料检测RNA G-四链体的方法可以直接观察溶液的颜色来预先确定RNA是否是RNA G-四链体,通过紫外吸收光谱、荧光光谱的方法进一步快速检测RNA G-四链体。
下面将结合实施例对本发明的方案进行解释。本领域技术人员将会理解,下面的实施例仅用于说明本发明,而不应视为限定本发明的范围。实施例中未注明具体技术或条件的,按照本领域内的文献所描述的技术或条件或者按照产品说明书进行。所用试剂或仪器未注明生产厂商者,均为可以通过市购获得的常规产品。
实施例1制备样本
在以下实施例中所用的样本如下所述:
样本1:RNA G-四链体样本,在以下实施例中用到的RNA G-四链体,又称为BCL-2,BCL-2具有SEQ ID NO:1所示的核苷酸序列。
AGGGGGCCGUGGGGUGGGAGCUGGGG(SEQ ID NO:1)。
BCL-2由广州锐博生物有限公司合成。将BCL-2溶解于Tris-HCl(含K+)溶液中,BCL-2终浓度为20微摩尔/升,并加温至90℃后,然后自然降到室温,即可得到样本1。
样本2:单链RNA样品,在以下实施例中用到的单链RNA,又称为Af22,Af22具有SEQ ID NO:2所示的核苷酸序列。
UGAGCUUAAUUGUAUAUAUUCG(SEQ ID NO:2)。
Af22由广州锐博生物有限公司合成,将Af22溶解于Tris-HCl(含K+)溶液中,Af22终浓度为20微摩尔/升,并加温至90℃后,然后自然降到室温,即可得到样本2。
菁染料:菁染料的具体制备方法如下(参考文献G.E.Ficken,The Chemistr of Synthetic Dyes;Academic Press,New York.1971;Vol.4)
以上合成路线所用原料,均可购自Sigma公司,在以下实施例中所用菁染料具有式I所示的结构。
实施例2检测RNA G-四链体
1、制备反应液(溶液甲、溶液乙、溶液丙)
1)溶液甲
在2mL的反应管中加入4微升200微摩尔/升的菁染料的甲醇(优级纯)溶液,然后加入20微升20微摩尔/升的样本1(pH 7.2),继而用Tris-HCl(含K+)定容到400微升,混匀,得到溶液甲,其中,RNA G-四链体与菁染料的摩尔比为0.5:1。
2)溶液乙
在2mL的反应管中加入4微升200微摩尔/升的菁染料的甲醇(优级纯)溶液,然后加入20微升20微摩尔/升的样本2(pH 7.2),继而用Tris-HCl(含K+)定容到400微升,混匀,得到溶液乙,其中,单链RNA与菁染料的摩尔比为0.5:1。
3)溶液丙
在2mL的反应管中加入4微升200微摩尔/升的菁染料的甲醇(优级纯)溶液,然后用Tris-HCl(含K+)溶液(pH 7.2)定容到400微升,混匀,得到溶液丙,作为对照样品。
2、检测反应液
溶液甲、乙、丙中菁染料的浓度均为2微摩尔/升,溶液甲、乙、丙避光反应5~10h,得到检测液甲,检测液乙和检测液丙。
1)紫外吸收光谱分析
将检测液甲、乙、丙进行紫外吸收光谱分析。
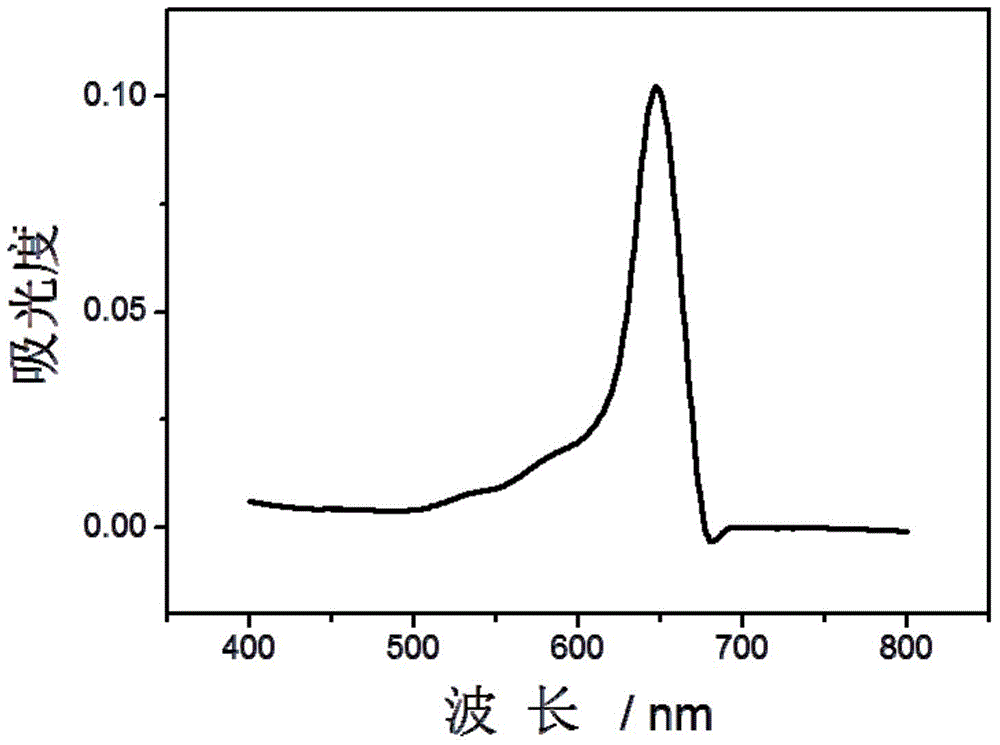
检测结果如图1~3所示,其中图1是检测液丙的紫外吸收光谱图,图2是检测液甲的紫外吸收光谱图,图3是检测液乙的紫外吸收光谱。
由图1~3结果可以看出,检测液丙(未加入RNA)的吸收光谱中只有菁染料聚集体特征峰(此处为紫外吸收峰)(648nm),强度为0.10;检测液甲(含有RNA G-四链体)的吸收光谱中菁染料聚集体特征峰(此处为紫外吸收峰)消失,而578nm处的菁染料单体特征峰(此处为紫外吸收峰)出现,强度为0.05;检测液乙(含有单链RNA)的吸收光谱中菁染料聚集体特征峰(此处为紫外吸收峰)强度为0.13。
2)荧光光谱分析
将检测液进行荧光光谱分析。
检测结果如图4~图6所示,其中图4是检测液丙的荧光光谱,图5是检测液甲的荧光光谱,图6是检测液乙的荧光光谱。
由图4~图6结果可以看出,检测液丙(未加入RNA)的荧光光谱中菁染料聚集体特征峰(此处为荧光发射峰)(655nm),强度为25,而菁染料单体特征峰(此处为荧光发射峰)(595nm)很弱,强度约为2;检测液甲(含有RNA G-四链体)的荧光光谱中会出现很强的菁染料单体特征峰(此处为荧光发射峰)(595nm),强度为420,检测液甲菁染料单体特征峰(此处为荧光发射峰)相对检测液丙菁染料单体特征峰(此处为荧光发射峰)高约200倍;检测液乙(含有单链RNA)的荧光光谱中菁染料单体特征峰(此处为荧光发射峰)未有明显的增加,菁染料聚集体特征峰(此处为荧光发射峰)(655nm),强度约为30。
3、结果分析
进行紫外吸收光谱分析时,当溶液中没有RNA存在时,菁染料呈聚集体状态,只有聚集体的紫外吸收峰(648nm),而不会出现单体的紫外吸收峰(578nm)。当加入RNA G-四链体时,菁染料与RNA G-四链体发生强烈的相互作用,使得菁染料由J-聚集体状态(菁染料聚集体状态)转变为单体,聚集体的紫外吸收峰消失,出现单体紫外吸收峰。当加入单链RNA时,菁染料的聚集体几乎不能被解离成单体,因此,也没有单体紫外吸收峰出现。
进行荧光光谱分析时,当溶液中没有RNA存在时,菁染料呈聚集体状态,只有聚集体的荧光发射峰(655nm),而不会出现单体的荧光发射峰(595nm)(很弱,强度约为2,有时可忽略不计);当加入RNA G-四链体时,菁染料与RNA G-四链体发生强烈的相互作用,使得菁染料由J-聚集体状态(菁染料聚集体状态)转变为单体,聚集体的荧光发射峰消失,出现单体荧光发射峰。当加入单链RNA时,菁染料的聚集体几乎不能被解离成单体,因此,也没有单体荧光发射峰出现(很弱,强度为约为2,有时可忽略不计)。
实施例3检测RNA G-四链体
1、制备反应液(溶液甲、溶液乙、溶液丙)
1)溶液甲
在2mL的反应管中加入4微升200微摩尔/升的菁染料的甲醇(优级纯)溶液,然后加入40微升20微摩尔/升的样本1(pH 7.2),继而用Tris-HCl(含K+)定容到400微升,混匀,得到溶液甲,RNA G-四链体与菁染料的摩尔比为1:1。
2)溶液乙
在2mL的反应管中加入4微升200微摩尔/升的菁染料的甲醇(优级纯)溶液,然后加入40微升20微摩尔/升的样本2(pH 7.2),继而用Tris-HCl(含K+)定容到400微升,混匀,得到溶液甲,单链RNA与菁染料的摩尔比为1:1。
3)溶液丙
在2mL的反应管中加入4微升200微摩尔/升的菁染料的甲醇(优级纯)溶液,继而用Tris-HCl(含K+)溶液(pH 7.2)定容到400微升,混匀,得到溶液丙,作为对照样品。
2、反应液检测
溶液甲、乙、丙中菁染料的浓度均为2微摩尔/升,溶液甲、乙、丙避光反应5-10h,得到检测液甲,检测液乙和检测液丙。
1)紫外吸收光谱分析
将检测液进行紫外吸收光谱分析,检测液丙的紫外吸收光谱同实施例2中检测液丙的紫外吸收光谱,检测液甲的紫外吸收光谱如图7所示,检测液乙的紫外吸收光谱如图8所示。
由图1、图7~图8可以看出,检测液丙(未加入RNA)的吸收光谱中只有菁染料聚集体的吸收峰(648nm),强度为0.10;检测液甲(含有RNA G-四链体)的吸收光谱中菁染料聚集体吸收峰消失,而578nm处的单体吸收峰出现,强度为0.08;检测液乙(含有单链RNA)的吸收光谱中菁染料聚集体的吸收峰强度为0.15。
2)荧光光谱分析
将检测液进行荧光光谱分析,检测液丙的荧光光谱同实施例2中检测液丙的荧光光谱,检测液甲的荧光光谱如图9所示,检测液乙的荧光光谱如图10所示。
由图4、图9~图10可以看出,检测液丙(未加入RNA)的荧光光谱中只有菁染料聚集体的发射峰(655nm),强度为25,而菁染料单体荧光发射峰(595nm)很弱,强度约为2;检测液甲(含有RNA G-四链体)的荧光光谱中会出现很强的菁染料单体发射峰(595nm),强度为930,检测液甲菁染料单体荧光发射峰相对检测液丙菁染料单体荧光发射峰高约400倍。检测液乙(含有单链RNA)的荧光光谱中菁染料单体荧光发射峰未有明显的增加,菁染料聚集体荧光发射峰(655nm),强度约为30。
3、结果分析
进行紫外吸收光谱分析时,当溶液中没有RNA存在时,菁染料呈聚集体状态,只有聚集体的吸收峰(648nm),而不会出现单体的吸收峰(578nm)。当加入RNA G-四链体时,菁染料与RNA G-四链体发生强烈的相互作用,使得菁染料由J-聚集体状态转变为单体,聚集体的吸收峰消失,出现单体峰。当加入单链RNA时,菁染料的聚集体几乎不能被解离成单体,因此,也没有单体吸收峰出现。
进行荧光光谱分析时,当溶液中没有RNA存在时,菁染料呈聚集体状态,只有聚集体的荧光发射峰(655nm),而不会出现单体的荧光发射峰(595nm)(弱,强度为2~3,有时可忽略不计);当加入RNA G-四链体时,菁染料与RNA G-四链体发生强烈的相互作用,使得菁染料由J-聚集体状态(菁染料聚集体状态)转变为单体,聚集体的荧光发射峰消失,出现单体荧光发射峰。当加入单链RNA时,菁染料的聚集体几乎不能被解离成单体,因此,也没有单体荧光发射峰出现(弱,强度为2~3,有时可忽略不计)。
实施例4检测RNA G-四链体
1、制备反应液(溶液甲、溶液乙、溶液丙)
1)溶液甲
在2mL的反应管中加入4微升200微摩尔/升的菁染料的甲醇(优级纯)溶液,然后加入80微升20微摩尔/升的样本1(pH 7.2),继而用Tris-HCl(含K+)定容到400微升,混匀,得到溶液甲,RNA G-四链体与菁染料的摩尔比为2:1。
2)溶液乙
在2mL的反应管中加入4微升200微摩尔/升的菁染料的甲醇(优级纯)溶液。然后加入80微升20微摩尔/升的样本2(pH 7.2),继而用Tris-HCl(含K+)定容到400微升,混匀,得到溶液乙,单链RNA与菁染料的摩尔比为2:1。
3)溶液丙
在2mL的反应管中加入4微升200微摩尔/升的菁染料的甲醇(优级纯)溶液,继而用Tris-HCl(含K+)溶液(pH 7.2)定容到400微升,混匀,得到溶液丙,作为对照样品。
2、反应液检测
溶液甲、乙、丙中菁染料的浓度均为2微摩尔/升,溶液甲、乙、丙避光反应5-10h,得到检测液甲,检测液乙和检测液丙。
1)紫外吸收光谱分析
将检测液进行紫外吸收光谱分析,其中,检测液丙的紫外吸收光谱同实施例2中检测液丙的吸收光谱,检测液甲的紫外吸收光谱如图11所示,检测液乙的紫外吸收光谱如图12所示。
由图1、图11~图12可以看出,检测液丙(未加入RNA)的紫外吸收光谱中只有菁染料聚集体的吸收峰(648nm),强度为0.10;检测液甲(含有RNA G-四链体)的吸收光谱中菁染料聚集体吸收峰消失,而578nm处的单体吸收峰出现,强度为0.09;检测液乙(含有单链RNA)的吸收光谱中菁染料聚集体的吸收峰强度为0.15。
2)荧光光谱分析
将检测液进行荧光光谱分析,检测液丙的荧光光谱同实施例2中检测液丙的荧光光谱,检测液甲的荧光光谱如图13所示,检测液乙的荧光光谱如图14所示。
由图4、图13~图14可以看出,检测液丙(未加入RNA)的荧光发射光谱中只有菁染料聚集体的发射峰(655nm),强度为25,而菁染料单体荧光发射峰(595nm)很弱,强度约为2;检测液甲(含有RNA G-四链体)的荧光发射光谱中会出现很强的菁染料单体发射峰(595nm),强度为1430,检测液甲菁染料单体荧光发射峰相对检测液丙菁染料单体荧光发射峰高约700倍。检测液乙(含有单链RNA)的荧光光谱中菁染料单体荧光发射峰未有明显的增加,菁染料聚集体荧光发射峰(655nm),强度约为30。
3、结果分析
紫外可见吸收光谱分析时,当溶液中没有RNA存在时,菁染料呈聚集体状态,只有聚集体的吸收峰(648nm),而不会出现单体的吸收峰(578nm)。当加入RNA G-四链体时,菁染料与RNA G-四链体发生强烈的相互作用,使得菁染料由J-聚集体状态转变为单体,聚集体的吸收峰消失,出现单体峰。当加入单链RNA时,菁染料的聚集体几乎不能被解离成单体,因此,也没有单体吸收峰出现。
进行荧光光谱分析时,当溶液中没有RNA存在时,菁染料呈聚集体状态,只有聚集体的荧光发射峰(655nm),而不会出现单体的荧光发射峰(595nm)(弱,强度为2~3,有时可忽略不计);当加入RNA G-四链体时,菁染料与RNA G-四链体发生强烈的相互作用,使得菁染料由J-聚集体状态(菁染料聚集体状态)转变为单体,聚集体的荧光发射峰消失,出现单体荧光发射峰。当加入单链RNA时,菁染料的聚集体几乎不能被解离成单体,因此,也没有单体荧光发射峰出现(弱,强度为2~3,有时可忽略不计)。
实施例5检测RNA G-四链体
1、制备反应液(溶液甲、溶液乙、溶液丙)
1)溶液甲
在2mL的反应管中加入4微升200微摩尔/升的菁染料的甲醇(优级纯)溶液,继而加入160微升20微摩尔/升的样本1(pH 7.2),用Tris-HCl(含K+)定容到400微升,混匀,得到溶液甲,RNA G-四链体与菁染料的摩尔比为4:1。
2)溶液乙
在2mL的反应管中加入4微升200微摩尔/升的菁染料的甲醇(优级纯)溶液,然后加入160微升20微摩尔/升的样本2(pH 7.2),继而用Tris-HCl(含K+)定容到400微升,混匀,得到溶液甲,单链RNA与菁染料的摩尔比为4:1。
3)溶液丙
在2mL的反应管中加入4微升200微摩尔/升的菁染料的甲醇(优级纯)溶液,继而用Tris-HCl(含K+)溶液(pH 7.2)定容到400微升,混匀,得到溶液丙,作为对照样品。
2、反应液检测
溶液甲、乙、丙中菁染料的浓度均为2微摩尔/升,溶液甲、乙、丙避光反应5-10h,得到检测液甲,检测液乙和检测液丙。
1)紫外吸收光谱分析
将检测液进行紫外吸收光谱分析,检测液丙的紫外吸收光谱同实施例2中检测液丙的紫外吸收光谱,检测液甲的紫外吸收光谱如图15所示,检测液乙的紫外吸收光谱如图16所示。
由图1、图15~图16可以看出,检测液丙(未加入RNA)的紫外吸收光谱中只有菁染料聚集体的吸收峰(648nm),强度为0.10;检测液甲(含有RNA G-四链体)的吸收光谱中菁染料聚集体吸收峰消失,而578nm处的单体吸收峰出现,强度为0.10;检测液乙(含有单链RNA)的吸收光谱中菁染料聚集体的吸收峰强度为0.12。
2)荧光光谱分析
将检测液进行荧光光谱分析,检测液丙的荧光光谱同实施例2中检测液丙的荧光光谱,检测液甲的荧光光谱如图17所示,检测液乙的荧光光谱如图18所示。
如图4、图17~图18可以看出,检测液丙(未加入RNA)的荧光光谱中只有菁染料聚集体的发射峰(655nm),强度为25,而菁染料单体荧光发射峰(595nm)很弱,强度约为2;检测液甲(含有RNA G-四链体)的荧光光谱中会出现很强的菁染料单体发射峰(595nm),强度为2300,检测液甲菁染料单体荧光发射峰相对检测液丙菁染料单体荧光发射峰高约1100倍。检测液乙(含有单链RNA)的荧光光谱中菁染料单体荧光发射峰未有明显的增加,菁染料聚集体荧光发射峰(655nm),强度约为30。
3、结果分析
进行紫外可见吸收光谱分析时,当溶液中没有RNA存在时,菁染料呈聚集体状态,只有聚集体的吸收峰(648nm),而不会出现单体的吸收峰(578nm)。当加入RNA G-四链体时,菁染料与RNA G-四链体结构发生强烈的相互作用,使得菁染料由J-聚集体状态转变为单体,聚集体的吸收峰消失,出现单体吸收峰。当加入单链RNA时,菁染料的聚集体几乎不能被解离成单体,因此,也没有单体吸收峰出现。
进行荧光光谱分析时,当溶液中没有RNA存在时,菁染料呈聚集体状态,只有聚集体的荧光发射峰(655nm),而不会出现单体的荧光发射峰(595nm)(弱,强度为2~3,有时可忽略不计);当加入RNA G-四链体时,菁染料与RNA G-四链体发生强烈的相互作用,使得菁染料由J-聚集体状态(菁染料聚集体状态)转变为单体,聚集体的荧光发射峰消失,出现单体荧光发射峰。当加入单链RNA时,菁染料的聚集体几乎不能被解离成单体,因此,也没有单体荧光发射峰出现(弱,强度为2~3,有时可忽略不计)。
实施例6、检测RNA G-四链体
1)溶液甲
在2mL的反应管中加入4微升200微摩尔/升的菁染料的甲醇(优级纯)溶液,然后加入80微升20微摩尔/升的样本1(pH 7.2),继而用Tris-HCl(含K+)定容到400微升,混匀,得到溶液甲,RNA G-四链体与菁染料的摩尔比为2:1。
2)溶液乙
在2mL的反应管中加入4微升200微摩尔/升的菁染料的甲醇(优级纯)溶液,然后加入80微升20微摩尔/升的样本2的(pH 7.2),继而用Tris-HCl(含K+)定容到400微升,混匀,得到溶液乙,RNA单链与菁染料的摩尔比为2:1。
2、观察溶液的的颜色
观察配制好的溶液甲和乙
3、结果分析
溶液甲(含有RNA G-四链体)中菁染料呈现粉红色,溶液乙(含有单链RNA)中菁染料呈现蓝色,因此,只需要通过颜色的变化预先检测RNA G-四链体。
在本说明书的描述中,参考术语“一个实施例”、“一些实施例”、“示例”、“具体示例”、或“一些示例”等的描述意指结合该实施例或示例描述的具体特征、结构、材料或者特点包含于本发明的至少一个实施例或示例中。在本说明书中,对上述术语的示意性表述不必须针对的是相同的实施例或示例。而且,描述的具体特征、结构、材料或者特点可以在任一个或多个实施例或示例中以合适的方式结合。此外,在不相互矛盾的情况下,本领域的技术人员可以将本说明书中描述的不同实施例或示例以及不同实施例或示例的特征进行结合和组合。
尽管上面已经示出和描述了本发明的实施例,可以理解的是,上述实施例是示例性的,不能理解为对本发明的限制,本领域的普通技术人员在本发明的范围内可以对上述实施例进行变化、修改、替换和变型。
- 还没有人留言评论。精彩留言会获得点赞!