一种毛细管等电聚焦测定重组蛋白质等电点的改进方法与流程
本发明属于生物制品分离分析领域,具体涉及一种毛细管等电聚焦测定酸性重组蛋白质等电点的方法。
背景技术:
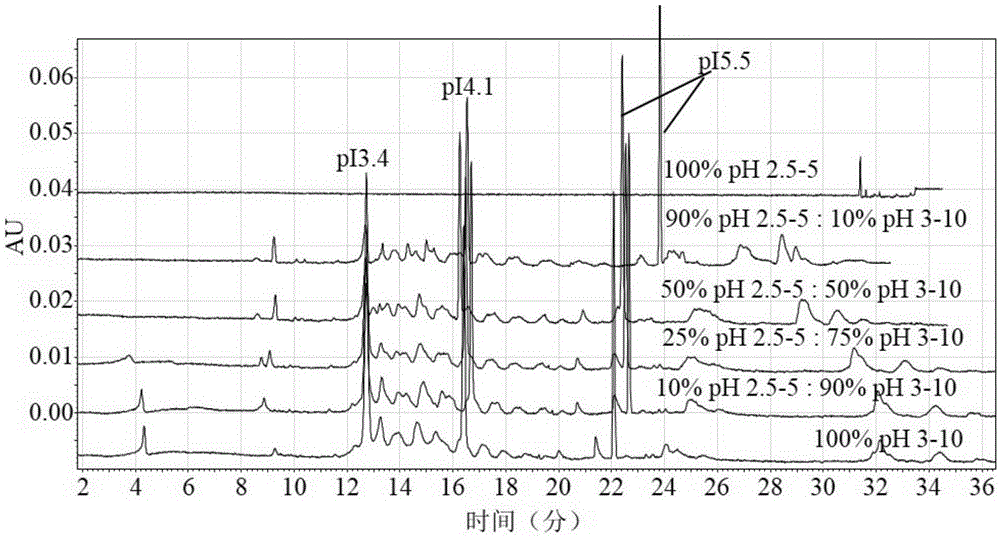
:近年来,随着DNA重组技术的飞速发展,重组蛋白类药物用于治疗各种疾病已成为生物医药行业研发的热点之一。目前,大多数重组蛋白都属于糖蛋白,重组蛋白类药物的糖基化和糖结构与体内稳定性和生物学活性密切相关。在生产过程中,宿主动物细胞、培养基组成、培养条件、培养环境和蛋白质结构以及分离纯化工艺都会影响重组蛋白质的糖基化水平。糖蛋白类生物技术药物因糖基化的差异产生多种异构体,每种异构体会对重组蛋白的理化性质和药理起到不同的作用,主要体现在蛋白质的电荷状态、稳定性、溶解性、免疫原性、体内外生物学活性、药物动力学等方面。为了保证重组蛋白类药物治疗效果的稳定性,须将不同生产批次蛋白质产品糖基化水平的异质性控制在合理的范围内,确保各种异构体的含量达到一定的标准,从而保证糖蛋白类生物技术药物质量和产品的均一性。由于重组蛋白异构体的分子量、分子结构非常接近,常用的分析方法如平板凝胶等电聚焦方法无法有效区分这些异构体,因而不适用于分析重组蛋白各种异构体组成和含量。然而,等电点(pI)是重组蛋白异构体固有的性质之一,不同的异构体由于糖型组成和结构的不同,等电点通常也有差异,因而可以利用不同异构体等电点的差异对其进行分离和定量分析。对重组蛋白质等电点准确掌握的程度,直接关系到最终生产药物的质量。所以,准确测定蛋白质等电点是保证产品质量、完善生产工艺的重要因素。人促卵泡激素(humanfolliclestimulatinghormone,hFSH)是一种异二聚体糖蛋白激素,由α亚基和β亚基通过非共价键结合而成,其中,α亚基和β亚基各含两个N-连接糖基化位点。唾液酸通常在hFSH糖基化侧链的末端,随着唾液酸含量升高,pI值降低,生物活性升高。对于长效hFSH药物来说,即将羧基末端肽(carboxylterminalpeptide,CTP)序列融合到hFSH的β亚基的C末端形成hFSH-CTP融合蛋白,引入了CTP的4个O-连接糖基化位点,从而提高了hFSH的生物学活性和半衰期。现有技术吉林大学硕士论文—重组人促卵泡激素的纯化及鉴定_刘慧娟(2007年)公开了采用IEF等电聚焦(isoelectricfocusing,IEF)检测重组人促卵泡激素等电点的方法,IEF 检测rhFSH等电点时,各等电点异构体的分离效果较差,rhFSH酸碱端条带不清晰,且主要根据等电点标记物来进行测算各异构体的pI值,因此pI值检测结果不够准确。毛细管等电聚焦(Capillaryisoelectricfocusing,cIEF)是基于等电点差异进行蛋白质分离的高分辨率分离技术,它通过将带有两性基团的样品、载体两性电解质和添加剂的混合物注入毛细管内,在电场下形成一定范围的pH梯度,样品组分依据其所带电性向阴极或阳极迁移,当柱内pH值与该组分的pI相同时,该组分的净电荷为零,溶质分子便实现聚焦,形成明显的区带,使蛋白质样品中各组分得到分离。cIEF克服了平板等电聚焦方法操作复杂、无法实现自动化和无法准确测定电荷异构体含量及等电点等缺点,具有高效、快速、操作简单、分离精度高(可达到0.01个pH单位)和定量分析能力强等优点,因而广泛应用于检测重组蛋白产品电荷异质性。尽管cIEF已广泛应用于重组蛋白类药物的质量分析,但是在分离分析重组蛋白质样品时,常以阳极为毛细管电泳仪检测样品的入口端、阴极为出口端(如AlejandroCifuentes等,JournalofChromatographyA,830(1999)453–463;ScottMack等,Electrophoresis2009,30,4049–4058等),使得样品电荷异构体出峰顺序为先碱性后酸性,所以对于酸性样品其分离峰通常在检测图谱的末端,分离效果差,特别是对于pI<4.1的电荷异构体以及等电点标记物,即使延长了分离时间,也不能使样品出峰,导致检测结果不准确。此外,检测样品离子强度、毛细管涂层材料、pH梯度稳定性以及聚焦分离条件等诸多因素,常影响酸性重组蛋白质各电荷异构体的分离效果、峰容量和cIEF检测方法的重复性及重现性等。因此,亟需发明一种可准确检测酸性重组蛋白质电荷异质性的cIEF方法。技术实现要素:鉴于现有技术存在的技术缺陷,本发明提供了一种毛细管等电聚焦测定重组蛋白质等电点的方法,使用阴极为毛细管电泳仪检测样品的入口端、阳极为出口端,并用氨水作为化学迁移液,以保证酸性重组蛋白质电荷异构体的出峰顺序为先酸性后碱性,使得各分离峰可以较好的位于等电点标记物标示范围以内,并具有较好的分离效果。另一方面,本发明提供了不同占比的Pharmalyte(2.5-5)和Pharmalyte(3-10)载体两性电解质的混合物,浓缩脱盐后待检样品中添加适量的尿素,和优化的聚焦分离条件,可有效提高酸性重组蛋白质各电荷异构体的分离效果。该方法具有分离效果好、峰容量高、重复性好、重现性强等优点,且尤其适用于酸性重组蛋白质的质量控制。本发明提供的一种毛细管等电聚焦测定重组蛋白质等电点的方法,包括以下步骤:1)取重组蛋白溶液,经浓缩脱盐,得到浓缩蛋白溶液;2)将载体两性电解质、凝胶、助溶剂、占位剂、等电点标记物与步骤1)所述的浓缩蛋白溶液进行混合,制备为供cIEF分析的样品混合液;3)用不同溶液对毛细管进行活化;4)将步骤2)中所述的样品混合液上样于步骤3)中已活化的毛细管中,,毛细管电泳仪检测,20℃下进行聚焦分离,采用迁移溶液迁移,紫外吸收检测器记录cIEF图谱。5)根据步骤4)中的cIEF图谱,检测待分析样品混合物中重组蛋白各电荷异构体的等电点。所述步骤1)中重组蛋白优选酸性重组,特别是pH值3-6的重组蛋白,具体优选重组人促卵泡激素(Recombinathumanfolliclestimulatinghormone,rhFSH);所述的浓缩脱盐采用浓缩柱进行脱盐处理。其中所述的浓缩柱为10kDa超滤离心柱;所述的浓缩蛋白溶液浓度为5-10mg/ml,优选10mg/ml(溶剂为Tris缓冲液);所述步骤2)中,载体两性电解质包括:Ampholine、Biolyte、Pharmalyte、Servalyt中的一种或多种,优选的所述载体两性电解质是Pharmalyte(3-10)和Pharmalyte(2.5-5)的一种或两种,更优选的,Pharmalyte(2.5-5)的体积比为0~90%,Pharmalyte(3-10)的体积比例为10%~100%。进一步优选所述Pharmalyte(3-10)的体积比例为50%~90%,Pharmalyte(2.5-5)的体积比为10~50%,进一步所述的Pharmalyte(3-10)和Pharmalyte(2.5-5)体积比为90%:10%,75%:25%和50%:50%,分离效果最佳。载体两性电解质(CA)是指包含多种既可充当酸又可充当碱的两性组分溶液。载体两性电解质pH梯度的形成及蛋白区带的聚焦受溶液中载体两性电解质物质数目的影响。载体两性电解质数目越多,该毛细管柱内邻近位点之间的pH差异越小,使得pH梯度在使用大量载体两性电解质时更平稳。本发明在分析酸性重组蛋白质等电点时,使用不同pH范围PharmalyteTM混合的载体两性电解质,即Pharmalyte(2.5-5)与Pharmalyte(3-10)的混合物,较单独使用Pharmalyte(3-10),不仅可以有效降低CA成分自身紫外吸收,提高检测的灵敏度和稳定性,还可以在酸性pH梯度内防止pH梯度在电渗流作用下发生迁移,从而有效提高待检重组蛋白各电荷异构体等电点的分离效果和峰容量,而只用Pharmalyte(2.5-5)检测时,rhFSH样品各电荷异构体的分离效果差,出峰不明显。所述的凝胶包括:乙二醇、聚环氧己烷中的一种或多种,优选的,所述凝胶是cIEF凝胶 (ABSCIEX公司)。所述的助溶剂包括:尿素、甘油、乙烯、丙二醇、两性离子和中性去垢剂中的一种或多种。由于聚焦会发生在一个较窄的区带里,使得重组蛋白异构体局部浓度增加,同时异构体电荷被中和,导致重组蛋白各异构体的溶解性降低,聚焦区域可能会发生蛋白质沉淀,进而可能导致电流不稳并最终降至为零,影响聚焦过程,此外还会在分离过程中出现沉淀峰,即极窄的峰或尖峰,影响样品的分离效果。因此,本发明在样品中加入一定浓度的助溶剂来提高重组蛋白的溶解度和稳定性,避免蛋白沉淀,提高重组蛋白各异构体的分离效果。具体的,所述的助溶剂为尿素,且尿素的浓度存在选择,过高浓度会使蛋白质变性,过低浓度不能有效破坏氢键结合来增加蛋白的溶解度,优选的,所述的尿素是先用凝胶溶解后形成的尿素胶,尿素胶加入到样品混合溶液中的浓度为3-6M(mol/L),更优选的,所述尿素胶的浓度是3-4.5M(mol/L)。所述的占位剂选自阳极稳定液亚氨基二乙酸(IDA),优选所述的IDA浓度为200mM(mmol/L),溶剂为水。由于等速电泳效应易导致毛细管中CA扩散到电极液中,使得待检样品中重组蛋白各异构体聚焦区域的pH梯度范围缩小,从而降低待检样品中重组蛋白异构体的分离效果。同时,由于毛细管充满了CA和样品溶液,聚焦在检测器到毛细管出口端的蛋白质在迁移过程中无法被检测到,因此,在本发明中,在待检样品混合物中添加所述的占位剂选自阳极稳定液亚氨基二乙酸(IDA),用于占据阳极端到检测器之间的毛细管,可有效阻止CA扩散到电解液中,从而有利于重组蛋白异构体获得最佳的分离效果和pH梯度的稳定性。所述的等电点标记物包括:多肽等电点标记物(如ABSCIEX公司),小分子等电点标记物(如Beckman公司),优选的,所述的等电点标记物是多肽等电点标记物,更优选的,样品混合液包含多肽标记物pI3.4、pI4.1和pI5.5。本发明使用pI3.4、pI4.1和pI5.5标记物,保证待检样品重组蛋白各异构体等电点位于标记物标示范围内,使得标准曲线校正时能得到较好的线性,从而保证检测结果更准确、可靠。所述步骤3)中不同溶液活化毛细管,具体的,cIEF检测前用超纯水以50psi压力冲洗5min,乙酸溶液以50psi压力冲洗2min,cIEF胶以50psi压力冲洗5min。所述的毛细管包括中性毛细管(Beckman公司),有效长度为20cm,内径50μm,和μSilFC毛细管,内径50μm(Agilent公司)。所述步骤4)中样品混合液上样于步骤3)中已活化的毛细管中,毛细管电泳仪检测是以 阴极作为样品检测的入口端、以阳极为出口端,先用尿素溶液以50psi压力冲洗3min;超纯水以50psi压力冲洗2min;以压力20psi进样99sec。其中,所述的阴极液为300mMNaOH,阳极液为200mMH3PO4。cIEF检测酸性蛋白质时,本发明采用阴极作为毛细管电泳仪检测样品的入口端、阳极为出口端,可有效保证酸性蛋白质电荷异构体的出峰顺序为先酸性后碱性,使得各分离峰可以较好的位于等电点标记物标示范围以内,且具有较好的分离效果。所述的聚焦条件是20-30kV维持3-15min,优选的,25-30kV维持4-8min;聚焦电压的增加会提高分离效果,但若电压过高会导致电流变大、焦耳热变大,并降低物质间的分离度。本发明采用聚焦电压25-30kV,维持4-8min,可使样品各电荷异构体得到有效分离,且各分离峰的峰宽合适。所述的分离,采用100mM氨水作为化学迁移液,25-30kV,维持30min。本发明在待检样品聚焦后,采用氨水作为化学迁移液,使得毛细管阳极中阳离子浓度升高,促使pH值升高,pH梯度快速迁移,以实现待检样品各电荷异构体有效分离。所述的紫外吸收检测器,其检测波长是280nm。所述步骤5)中,检测待分析的样品混合物中重组蛋白各电荷异构体等电点的方法,包括:以等电点标记物pI值为纵坐标,其迁移时间为横坐标,作标准曲线。通过积分得到样品各主峰的迁移时间后,代入标准曲线,即可计算得到样品主峰以及酸端和碱端的pI值。本发明相对于现有技术具有如下的优点及有益效果:1、提供了一种毛细管等电聚焦检测酸性重组蛋白质的改进方法,采用阴极为毛细管电泳仪检测样品的入口端、阳极为出口端,并用氨水作为化学迁移液,可有效保证酸性重组蛋白质电荷异构体的出峰顺序为先酸性后碱性,使得各分离峰可以较好的位于等电点标记物标示范围以内,且具有较好的分离效果。2、提供了一种毛细管等电聚焦检测酸性重组蛋白质的方法,对待检样品进行浓缩脱盐后加入适量的尿素,再加入不同体积比的Pharmalyte(2.5-5)和Pharmalyte(3-10)载体两性电解质的混合物,并结合优化的聚焦分离条件,可实现待检样品混合物中重组蛋白电荷异构体的有效分离,且保证了pH梯度的稳定性,有效提高检测的峰容量,且重复性好、重现性强;3、使用pI3.4、pI4.1和pI5.5等电点标记物,保证待检样品重组蛋白各异构体等电点位于标记物标示范围内,得到的pI标准曲线,具有较好的线性,保证了检测结果准确可靠;4、提供了一种毛细管等电聚焦检测酸性重组蛋白质的方法,方法适用性强,可用于酸性蛋白质的糖基化修饰、稳定性等质量研究中并建立相应的药物产品质量标准。附图说明图1为rhFSH样品混合液含有不同浓度的尿素胶时,毛细管等电聚焦检测rhFSH的等电聚焦图谱;图2为rhFSH样品混合液含有不同体积比的Pharmalyte(3-10)和Pharmalyte(2.5-5)载体两性电解质时,使用μSilFC毛细管(内径50μm,Agilent公司)等电聚焦检测rhFSH的等电聚焦图谱;图3为rhFSH样品混合液含有不同体积比的Pharmalyte(3-10)和Pharmalyte(2.5-5)载体两性电解质时,使用毛细管(NeutralCapillary,50μmID,Beckman公司)等电聚焦检测rhFSH的等电聚焦图谱;图4为不同聚焦电压时,毛细管等电聚焦检测rhFSH的等电聚焦图谱;图5为不同聚焦时间时,毛细管等电聚焦检测rhFSH的等电聚焦图谱;图6为不同分离电压时,毛细管等电聚焦检测rhFSH的等电聚焦图谱;图7为验证毛细管等电聚焦测定rhFSH的等电点方法最优条件的重复性时,rhFSH等电聚焦图谱;图8为验证毛细管等电聚焦测定rhFSH的等电点方法最优条件的重现性时,rhFSH等电聚焦图谱;图9为rhFSH样品浓缩脱盐和未浓缩脱盐时,毛细管等电聚焦检测rhFSH的等电聚焦图谱;图10为使用常规方法与改进方法时,毛细管等电聚焦检测rhFSH的等电聚焦图谱。其中常规方法是指将阳极作为毛细管电泳仪检测rhFSH样品的入口端、阴极为出口端;改进方法是指将阴极作为rhFSH样品检测的入口端、阳极为出口端。具体实施方式下面结合实施例和附图对本发明作进一步详细的描述,但发明的实施方式不限于此。实施例使用的重组人促卵泡激素(rhFSH)样品采用专利文献PCT/US1984/01766和CN200310102844.9中所述方法制备。所得rhFSH溶液浓度为4mg/ml(溶剂为水),纯度98.0%。实施例1.毛细管等电聚焦测定重组人促卵泡激素的等电点1)、重组人促卵泡激素(rhFSH)样品浓缩脱盐取400μgrhFSH溶液,加入到10kDa超滤离心柱(MerckMillipore公司)中,12000×g离心15min,弃废液;加入eCAPTris缓冲液,pH8.0(Beckman公司),12000×g离心15min,取出浓缩柱管,将重组人促卵泡激素样品倒转装入一个新的干净的离心管中,3000×g离心3min,收集预处理的样品浓度约为10mg/ml,得到浓缩蛋白溶液。2)、rhFSH样品混合液制备将步骤1)中脱盐制得的rhFSH浓缩蛋白溶液与表1中各组分按配比进行混合,制备为待检的rhFSH样品混合液。表1.rhFSH样品混合液配比组分加入量(μl)6M尿素胶90Pharmalyte(3-10)6200mM阳极稳定夜IDA15等电点标记物pI3.42等电点标记物pI4.12等电点标记物pI5.52脱盐后的rhFSH样品103)、用不同溶液对毛细管进行活化按照表1.2和表1.3中A1-F1先后顺序,准备毛细管电泳仪(Beckman,PA800Plus)的缓冲盘(BufferTray),除废液瓶中加入0.8ml超纯水以外,其余瓶中均加入1.5ml对应的溶液。然后用超纯水以50psi压力冲洗5min,350mM乙酸溶液以50psi压力冲洗2min,cIEF胶以50psi压力冲洗5min,对μSilFC毛细管(内径50μm,Agilent公司)进行活化。表1.2入口缓冲盘(InBufferTray)表1.3出口缓冲盘(OutBufferTray)4)、rhFSH样品混合液上样检测步骤3)中毛细管活化后,将步骤2)制备的rhFSH样品混合液20℃上样,用毛细管电泳仪(Beckman,PA800plus)检测,以阴极为样品检测的入口端,以阳极为出口端,其中阴极液为300mMNaOH,阳极液为200mMH3PO4。先用4.3M尿素溶液以50psi压力冲洗3min;超纯水以50psi压力冲洗2min;以压力20psi进样99sec。以电压25kV聚焦6min;然后将出口瓶溶液更换为100mM氨水,以30kV分离30min。5)、数据分析通过紫外吸收检测器(检测波长:280nm)记录步骤4)中所检测的rhFSH样品等电聚焦图谱。检测结果如图1所示,当尿素胶浓度为6M时,rhFSH样品等电点聚焦图谱分离效果较好,峰容量较高,各电荷异构体的pI值为3.5-5.4。实施例2.毛细管等电聚焦测定重组人促卵泡激素的等电点1)、采用与实施例1中相同的方法对rhFSH样品进行浓缩脱盐,得rhFSH浓缩溶液;2)、将步骤1中脱盐制得的rhFSH浓缩溶液分别与表2-3中各组分按配比进行混合,制备为待检的rhFSH样品混合液;3)、采用与实施例1相同的方法,用不同溶液对毛细管进行活化;4)、采用与实施例1相同的方法,对rhFSH样品混合液上样检测;5)、采用与实施例1相同的方法,记录rhFSH样品等电聚焦图谱。检测结果如图1所示,当尿素胶浓度为3M或4.5M时,rhFSH样品等电点聚焦图谱分离效果好,峰容量高,各电荷异构体的pI值为3.5-5.4。表2.rhFSH样品混合液配比组分加入量(μl)3M尿素胶90Pharmalyte(3-10)6200mM阳极稳定夜IDA15等电点标记物pI3.42等电点标记物pI4.12等电点标记物pI5.52脱盐后的rhFSH样品10表3.rhFSH样品混合液配比组分加入量(μl)4.5M尿素胶90Pharmalyte(3-10)6200mM阳极稳定夜IDA15等电点标记物pI3.42等电点标记物pI4.12等电点标记物pI5.52脱盐后的rhFSH样品10实施例3.毛细管等电聚焦测定重组人促卵泡激素的等电点1)、采用与实施例1中相同的方法对rhFSH样品进行浓缩脱盐,得rhFSH浓缩溶液;2)、将步骤1中脱盐制得的rhFSH浓缩溶液分别与表4-7中各组分按配比进行混合,制备为待检的rhFSH样品混合液;3)、采用与实施例1相同的方法,用不同溶液对毛细管进行活化;4)、采用与实施例1相同的方法,对rhFSH样品混合液上样检测;5)、采用与实施例1相同的方法,记录rhFSH样品等电聚焦图谱。检测结果如图2所示,当Pharmalyte(2.5-5)和Pharmalyte(3-10)的体积比分别为10-90%时,rhFSH样品电荷异构体的分离效果较好、峰容量较高,且当Pharmalyte(2.5-5)和Pharmalyte(3-10)的体积比为50%:50%时,其分离效果最好。所以,在该方法检测样品,使用μSilFC毛细管(Agilent公司)时,可以添加体积比为10-90%的Pharmalyte(2.5-5)载体两性电解质来提高rhFSH样品电荷异构体的分离效果。表4.rhFSH样品混合液配比组分加入量(μl)6M尿素胶9090%Pharmalyte(3-10)5.410%Pharmalyte(2.5-5)0.6200mM阳极稳定夜IDA15等电点标记物pI3.42等电点标记物pI4.12等电点标记物pI5.52脱盐后的rhFSH样品10表5.rhFSH样品混合液配比组分加入量(μl)6M尿素胶9075%Pharmalyte(3-10)4.525%Pharmalyte(2.5-5)1.5200mM阳极稳定夜IDA15等电点标记物pI3.42等电点标记物pI4.12等电点标记物pI5.52脱盐后的rhFSH样品10表6.rhFSH样品混合液配比组分加入量(μl)6M尿素胶9050%Pharmalyte(3-10)350%Pharmalyte(2.5-5)3200mM阳极稳定夜IDA15等电点标记物pI3.42等电点标记物pI4.12等电点标记物pI5.52脱盐后的rhFSH样品10表7.rhFSH样品混合液配比组分加入量(μl)6M尿素胶9010%Pharmalyte(3-10)0.690%Pharmalyte(2.5-5)5.4200mM阳极稳定夜IDA15等电点标记物pI3.42等电点标记物pI4.12等电点标记物pI5.52脱盐后的rhFSH样品10实施例4.毛细管等电聚焦测定重组人促卵泡激素的等电点1)、采用与实施例1中相同的方法对rhFSH样品进行浓缩脱盐,得rhFSH浓缩溶液;2)、将步骤1中脱盐制得的rhFSH浓缩溶液分别与表1、5中各组分按配比进行混合,制备为待检的rhFSH样品混合液;3)、采用与实施例1相同的方法,用不同溶液对毛细管(NeutralCapillary,50μmID,Beckman公司)进行活化;4)、采用与实施例1相同的方法,对rhFSH样品混合液上样检测;5)、采用与实施例1相同的方法,记录rhFSH样品等电聚焦图谱。检测结果如图3所示,从峰型与分离效果来看,当载体两性电解质为体积比25%∶75%Pharmalyte(2.5-5)和Pharmalyte(3-10)的混合物以及100%Pharmalyte(3-10)时,rhFSH样品分离效果较好,峰容量较高,且前者略好。使用等电点标记物pI作线性图,采用外标法计算样品各电荷异构体的pI值,两者基本无差别。所以,在该方法检测样品,使用毛细管(NeutralCapillary,50μmID,Beckman公司)时,可以添加体积比为0-25%Pharmalyte(2.5-5)载体两性电解质来提高样品各电荷异构体等电点的分离效果。实施例5.毛细管等电聚焦测定重组人促卵泡激素的等电点1)、采用与实施例1中相同的方法对rhFSH样品进行浓缩脱盐,得rhFSH浓缩溶液;2)、采用与实施例1中相同的方法,制备为待检的rhFSH样品混合液;3)、采用与实施例1相同的方法,用不同溶液对毛细管进行活化;4)、采用与实施例1相同的方法,对rhFSH样品混合液上样检测,聚焦条件为:电压30kV,维持6min;分离条件与实施例1相同;5)、采用与实施例1相同的方法,记录rhFSH样品等电聚焦图谱。检测结果如图4所示,聚焦电压越大,rhFSH样品电荷异构体全部出峰的分离时间越长。聚焦电压为25kV时,分离效果和峰容量最佳。实施例6.毛细管等电聚焦测定重组人促卵泡激素的等电点1)、采用与实施例1中相同的方法对rhFSH样品进行浓缩脱盐,得rhFSH浓缩溶液;2)、采用与实施例1中相同的方法,制备为待检的rhFSH样品混合液;3)、采用与实施例1相同的方法,用不同溶液对毛细管进行活化;4)、采用与实施例1相同的方法,对rhFSH样品混合液上样检测,聚焦条件为:电压25kV,分别维持4min、6min和8min;分离条件与实施例1的相同;5)、采用与实施例1相同的方法,记录rhFSH样品等电聚焦图谱。检测结果如图5所示,聚焦时间为4-8min时,rhFSH样品各电荷异构体的等电点分离效果与峰容量均较好。实施例7.毛细管等电聚焦测定重组人促卵泡激素的等电点1)、采用与实施例1中相同的方法对rhFSH样品进行浓缩脱盐,得rhFSH浓缩溶液;2)、采用与实施例1中相同的方法,制备为待检的rhFSH样品混合液;3)、采用与实施例1相同的方法,用不同溶液对毛细管进行活化;4)、采用与实施例1相同的方法,对rhFSH样品混合液上样检测,聚焦条件与实施例1的相同;分离条件为:以25kV电压,分离30min;5)、采用与实施例1相同的方法,记录rhFSH样品等电聚焦图谱。检测结果如图6所示,分离电压为25kV或30kV时,rhFSH样品各电荷异构体等电点的分离效果与峰容量都较好。实施例8.毛细管等电聚焦测定重组人促卵泡激素等电点方法的最优条件1)、采用与实施例1中相同的方法对rhFSH样品进行浓缩脱盐,得rhFSH浓缩溶液;2)、将步骤1中脱盐制得的rhFSH与表8中各组分按配比进行混合,制备为待检的rhFSH 样品混合液。表8.rhFSH样品混合液配比组分加入量(μl)4.5M尿素胶9050%Pharmalyte(3-10)350%Pharmalyte(2.5-5)3200mM阳极稳定夜IDA15等电点标记物pI3.42等电点标记物pI4.12等电点标记物pI5.52脱盐后的rhFSH样品103)、采用与实施例1相同的方法,用不同溶液对毛细管进行活化;4)、采用与实施例1相同的方法,对rhFSH样品混合液上样检测;5)、采用与实施例1相同的方法,记录rhFSH样品等电聚焦图谱。检测结果如图10所示,rhFSH样品各电荷异构体等电点的分离效果好、峰容量高。实施例9毛细管等电聚焦测定重组人促卵泡激素等电点方法的重复性在本发明实施例8的毛细管等电聚焦检测的条件下,选取3份rhFSH样品(Y20150301)进行重复性实验,检测结果见图7,结果表明,本发明检测方法具有良好的重复性。实施例10.毛细管等电聚焦测定重组人促卵泡激素等电点方法的重现性在本发明实施例8的毛细管等电聚焦检测的条件下,选取3个不同批次的rhFSH样品(Y20150201、Y20150301、Y20150702)进行重现性实验,检测结果见表9和图8,结果表明,本发明检测方法的重现性高。表9.3批次样品等电点检测的重现性实验数据样品批次酸端碱端Y201507023.565.33Y201503013.535.36Y201502013.585.32CV%0.71%0.39%对比实施例1.毛细管等电聚焦测定重组人促卵泡激素的等电点1)、采用与实施例1相同的方法,将浓度为10mg/ml未经浓缩脱盐的rhFSH样品与表10中各组分按配比进行混合,制备为待检的rhFSH样品混合液;3)、采用与实施例1相同的方法,用不同溶液对毛细管进行活化;4)、采用与实施例1相同的方法,对rhFSH样品混合液上样检测;5)、采用与实施例1相同的方法,记录rhFSH样品等电聚焦图谱。检测结果如图9所示,未浓缩脱盐的rhFSH样品电荷异构体出峰时间明显延长,pI4.1等电点标记物和pI5.5等电点标记物的出峰时间也明显延迟,且3个等电点标记物的等电点线性不好;而浓缩脱盐后的rhFSH样品分离效果更好,检测结果更准确。表10未浓缩脱盐的rhFSH样品混合液配比组分加入量(μl)6M尿素胶90Pharmalyte(3-10)6200mM阳极稳定夜IDA15等电点标记物pI3.42等电点标记物pI4.12等电点标记物pI5.52未浓缩脱盐的rhFSH样品10对比实施例2.毛细管等电聚焦测定重组人促卵泡激素的等电点1)、采用与实施例1中相同的方法对rhFSH样品进行浓缩脱盐;2)、将步骤1中脱盐制得的rhFSH分别与表11中各组分按配比进行混合,制备为待检的rhFSH样品混合液;3)、采用与实施例1相同的方法,用不同溶液对毛细管进行活化;4)、采用与实施例1相同的方法,对rhFSH样品混合液上样检测;5)、采用与实施例1相同的方法,记录rhFSH样品等电聚焦图谱。检测结果如图1所示,当尿素胶浓度达到7.5M时,rhFSH样品的电荷异构体出峰范围内基线漂移,分离效果差;当尿素胶浓度为3-6M时,样品电荷异构体的分离效果好、峰容量高。表11.rhFSH样品混合液配比组分加入量(μl)7.5M尿素胶90Pharmalyte(3-10)6200mM阳极稳定夜IDA15等电点标记物pI3.42等电点标记物pI4.12等电点标记物pI5.52脱盐后的rhFSH样品10对比实施例3.毛细管等电聚焦测定重组人促卵泡激素的等电点1)、采用与实施例1中相同的方法对rhFSH样品进行浓缩脱盐;2)、将步骤1中脱盐制得的rhFSH与表12中各组分按配比进行混合,制备为待检的rhFSH样品混合液;3)、采用与实施例1相同的方法,用不同溶液对毛细管进行活化;4)、采用与实施例1相同的方法,对rhFSH样品混合液上样检测;5)、采用与实施例1相同的方法,记录rhFSH样品等电聚焦图谱。检测结果如图2所示,当载体两性电解质为100%Pharmalyte(2.5-5)时,rhFSH样品电荷异构体的分离效果差,且出峰不明显。表12.rhFSH样品混合液配比组分加入量(μl)6M尿素胶90Pharmalyte(2.5-5)6200mM阳极稳定夜IDA15等电点标记物pI3.42等电点标记物4.12等电点标记物5.52脱盐后的rhFSH样品10对比实施例4.毛细管等电聚焦测定重组人促卵泡激素的等电点1)、采用与实施例1中相同的方法对rhFSH样品进行浓缩脱盐;2)、将步骤1中脱盐制得的rhFSH分别与表6、表12中各组分按配比进行混合,制备为待检的rhFSH样品混合液;3)、采用与实施例1相同的方法,用不同溶液对毛细管(NeutralCapillary,50μmI.D.,Beckman公司)进行活化;4)、采用与实施例1相同的方法,对rhFSH样品混合液上样检测;5)、采用与实施例1相同的方法,记录rhFSH样品等电聚焦图谱。检测结果如图3所示,当载体两性电解质全部为Pharmalyte(2.5-5)时,rhFSH样品各电荷异构体的分离效果差,出峰不明显。对比实施例5.毛细管等电聚焦测定重组人促卵泡激素的等电点1)、采用与实施例1中相同的方法对rhFSH样品进行浓缩脱盐;2)、采用与实施例1中相同的方法,制备为待检的rhFSH样品混合液;3)、采用与实施例1相同的方法,用不同溶液对毛细管进行活化;4)、采用与实施例1相同的方法,对rhFSH样品混合液上样检测,聚焦条件为:电压15kV,维持15min;分离条件与实施例1相同;5)、采用与实施例1相同的方法,记录rhFSH样品等电聚焦图谱。检测结果如图4所示,聚焦电压为15kV时,rhFSH样品各电荷异构体的分离效果和峰容量均较差。对比实施例6.毛细管等电聚焦测定重组人促卵泡激素的等电点1)、采用与实施例1中相同的方法对rhFSH样品进行浓缩脱盐;2)、采用与实施例1中相同的方法,制备为待检的rhFSH样品混合液;3)、采用与实施例1相同的方法,用不同溶液对毛细管进行活化;4)、采用与实施例1相同的方法,对rhFSH样品混合液上样检测,聚焦条件与实施例1的相同;分离条件为:以20kV电压,分离30min;5)、采用与实施例1相同的方法,记录rhFSH样品等电聚焦图谱。检测结果如图6所示,分离电压为20kV时,rhFSH样品各电荷异构体出峰时间较长,且分离效果和峰容量均较差。对比实施例7.毛细管等电聚焦测定重组人促卵泡激素的等电点1)、采用与实施例1中相同的方法对rhFSH样品进行浓缩脱盐;2)、采用与实施例1中相同的方法,制备为待检的rhFSH样品混合液;3)、用不同溶液对毛细管进行活化;按照表13和表14中A1-F1先后顺序,准备毛细管电泳仪(Beckman,PA800plus)的缓冲盘(BufferTray),采用与实施例1相同的方法,对毛细管进行活化;4)、rhFSH样品混合液上样检测;步骤3中毛细管活化后,将步骤2制备的rhFSH样品混合液,20℃上样,使用毛细管电泳仪(Beckman,PA800plus)检测,以常规方法所采用的阳极为样品检测的入口端,以阴极为出口端,其中阳极液为200mMH3PO4,阴极液为300mMNaOH。采用与实施例1相同的方法,对rhFSH样品混合液上样检测,聚焦条件为以25kV,聚焦15min;分离条件与实施例1的相同。5)、采用与实施例1相同的方法,记录rhFSH样品等电聚焦图谱。检测结果如图10所示,使用常规方法检测rhFSH样品时,电荷异构体出峰顺序为先碱性后酸性,使得分离峰在检测图谱的末端,分离效果差。特别是对于pI<4.1的异构体以及等电点标记物即使延长了分离时间也不能出峰,导致检测结果不准确。而使用实施例1的方法,则可有效保证rhFSH样品电荷异构体的出峰顺序为先酸性后碱性,使得各分离峰可以较好的位于等电点标记物标示范围以内,且具有较好的分离效果。表13入口缓冲盘(InBufferTray)表14出口缓冲盘(OutBufferTray)上述实施例为本发明较佳的实施方式,但本发明的实施方式并不受上述实施例的限制,其他的任何未背离本发明的精神实质与原理下所作的改变、修饰、替代、组合、简化,均应为等效的置换方式,都包含在本发明的保护范围之内。当前第1页1 2 3
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1