一种测定丹知青娥片中指标成分含量的方法与流程
本发明涉及中药质量控制领域,更具体地涉及一种测定丹知青娥片中指标成分含量的方法,特别是补骨脂素、异补骨脂素、补骨脂苷、异补骨脂苷、丹酚酸b和芒果苷含量的测定方法。
背景技术:
丹知青娥片由补骨脂、杜仲、丹参、知母等组成,能够缓解围绝经期综合征的各种症状,并且能够有效改善血脂水平。补骨脂素和异补骨脂素是补骨脂的主要活性成分,具有雌激素样作用;丹参中的丹酚酸b具有降脂、抗氧化和心脏保护作用;知母中的芒果苷具有雌激素样、抗炎、抑菌作用。《中华人民共和国药典》2015版一部规定:盐补骨脂药材“含量测定”项下,以补骨脂素和异补骨脂素总量作为指标成分进行质量控制;丹参药材“含量测定”项下,以丹酚酸b作为指标成分之一进行质量控制;知母药材“含量测定”项下,以芒果苷作为指标成分之一进行质量控制。因此选择补骨脂素、异补骨脂素、芒果苷、丹酚酸b作为指标成分开展丹知青娥片的质量控制研究。
(异)补骨脂苷是(异)补骨脂素的糖苷类前体成分,(异)补骨脂苷在肠道菌群代谢作用下发生脱糖基反应生成(异)补骨脂素,导致(异)补骨脂素大量吸收,血药浓度增加,半衰期延长;高浓度(异)补骨脂素易导致肝脏损害,因此在补骨脂提取工艺设计时除去了(异)补骨脂苷,防止口服丹知青娥片生成(异)补骨脂素,避免肝脏损害的发生。然而目前对丹知青娥片的质量控制方法尚没有涉及到检测其中的补骨脂苷和异补骨脂苷的残存含量,从临床用药的安全性上来讲有一定的欠缺。
另外,丹知青娥片化学成分复杂,多个成分同时测量时其他成分容易对指标成分的检测造成干扰,且给药品生产企业质量分析部门的工作人员增加了操作上的复杂度和不稳定性。
技术实现要素:
基于上述问题,发明人提供了一种测定丹知青娥片中指标成分含量的方法,增加了补骨脂苷、异补骨脂苷作为指标成分;另外,为避免其它成分对指标成分检测造成干扰;同时考虑到药品生产企业质量分析部门在应用含量测定分析方法时的可操作性、简便性、稳定性等因素,在构建含量测定分析方法时发明人采用液相色谱等度洗脱方法单独测量每种指标成分的含量,分别建立了补骨脂素和异补骨脂素、补骨脂苷和异补骨脂苷、丹酚酸b、芒果苷多个含量测定的方法。
本发明提供一种测定丹知青娥片中指标成分含量的方法,其特征在于,所述方法单独测定每种指标成分,所述指标成分包括补骨脂素、异补骨脂素、补骨脂苷、异补骨脂苷、丹酚酸b和芒果苷,所述方法包括:
(1)获得每种指标成分供试品溶液的高效液相色谱图
对于补骨脂素和异补骨脂素:称取质量为m1的丹知青娥片粉末,精密称定,用体积为v1的、体积分数90~100%的甲醇对指标成分补骨脂素和异补骨脂素进行提取,超声处理10-20分钟,离心取上清液作为指标成分补骨脂素和异补骨脂素的供试品溶液,其中,补骨脂素的浓度以c补骨脂素表示,异补骨脂素的浓度以c异补骨脂素表示,m1与v1的比为0.01-0.05g/ml;
对于补骨脂苷和异补骨脂苷:称取质量为m2的丹知青娥片粉末,精密称定,用体积为v2的、体积分数65~85%的甲醇对指标成分补骨脂苷和异补骨脂苷进行提取,超声处理15-30分钟,离心取上清液作为指标成分补骨脂苷和异补骨脂苷的供试品溶液,其中,补骨脂苷的浓度以c补骨脂苷表示,异补骨脂苷的浓度以c异补骨脂苷表示,m2与v2的比为0.01-0.05g/ml;
对于丹酚酸b:称取质量为m3的丹知青娥片粉末,精密称定,用体积为v3的、体积分数65~85%的甲醇对指标成分丹酚酸b进行提取,超声处理10-20分钟,离心取上清液作为指标成分丹酚酸b的供试品溶液,其中,丹酚酸b的浓度以c丹酚酸b表示,m3与v3的比为0.002-0.02g/ml;
对于芒果苷:称取质量为m4的丹知青娥片粉末,精密称定,用体积为v4的、体积分数40~65%的甲醇对指标成分芒果苷进行提取,超声处理10-20分钟,离心取上清液作为指标成分芒果苷的供试品溶液,其中,芒果苷的浓度以c芒果苷表示, m4与v4的比为0.004-0.02g/ml;
在每种指标成分所对应的预设色谱条件下,将每种指标成分的供试品溶液分别注入高效液相色谱仪中,获得每种指标成分供试品溶液的高效液相色谱图;
(2)建立每种指标成分标准品的标准曲线
分别精密称定补骨脂素和异补骨脂素标准品,用体积分数90~100%的甲醇溶解,分别制成具有已知浓度的补骨脂素和异补骨脂素标准品储备液,用体积分数90~100%的甲醇制备成至少3个具有不同已知浓度的补骨脂素和异补骨脂素混合标准品溶液;其中,补骨脂素和异补骨脂素浓度范围均为2-250μg/ml;
分别精密称定补骨脂苷和异补骨脂苷标准品,用体积分数65~85%的甲醇溶解,分别制成具有已知浓度的补骨脂苷和异补骨脂苷标准品储备液,用体积分数65~85%的甲醇制备成至少3个具有不同已知浓度的补骨脂苷和异补骨脂苷混合标准品溶液;其中,补骨脂苷和异补骨脂苷浓度范围均为2-150μg/ml;
精密称定丹酚酸b标准品,用体积分数65~85%的甲醇溶解,制成具有已知浓度的丹酚酸b标准品储备液,用体积分数65~85%的甲醇将丹酚酸b标准品储备液稀释成至少3个具有不同已知浓度的丹酚酸b标准品溶液;其中,丹酚酸b浓度范围为5-600μg/ml;
精密称定芒果苷标准品,用体积分数40~65%的甲醇溶解,制成具有已知浓度的芒果苷标准品储备液,用体积分数40~65%的甲醇将芒果苷标准品储备液稀释成至少3个具有不同已知浓度的芒果苷标准品溶液;其中,芒果苷浓度范围为2-250μg/ml;
在(1)中的每种指标成分所对应的预设色谱条件下,将该种指标成分的各浓度标准品溶液分别注入高效液相色谱仪中,获得该种指标成分的各浓度标准品溶液的高效液相色谱图;
以各标准品溶液的高效液相色谱图中各指标成分的色谱峰峰面积为纵坐标或横坐标,以各指标成分的浓度为横坐标或纵坐标,分别建立各指标成分的标准曲线;
(3)确定供试品中每种指标成分的含量
根据每种指标成分供试品溶液高效液相色谱图中各自的色谱峰峰面积,根 据已建立的各指标成分的标准曲线,分别读出每种指标成分在其供试品溶液中的浓度,并分别按照下列公式计算出各指标成分在丹知青娥片中的含量,其中,
补骨脂素含量%=c补骨脂素*v1/m1*100%;
异补骨脂素含量%=c异补骨脂素*v1/m1*100%;
补骨脂苷含量%=c补骨脂苷*v2/m2*100%;
异补骨脂苷含量%=c异补骨脂苷*v2/m2*100%;
丹酚酸b含量%=c丹酚酸b*v3/m3*100%;
芒果苷含量%=c芒果苷*v4/m4*100%。
根据本发明的一个实施方案,所述步骤(1)中,
称取质量为m1的丹知青娥片粉末,用体积为v1的、体积分数95~100%的甲醇对指标成分补骨脂素和异补骨脂素进行提取,超声处理12-18分钟,其中,m1与v1的比为0.01-0.03g/ml。
根据本发明的另一个实施方案,所述步骤(1)中,
称取质量为m2的丹知青娥片粉末,用体积为v2的、体积分数70~80%的甲醇对指标成分补骨脂苷和异补骨脂苷进行提取,超声处理15-25分钟,其中,m2与v2的比为0.01-0.03g/ml。
根据本发明的另一个实施方案,所述步骤(1)中,
称取质量为m3的丹知青娥片粉末,用体积为v3的、体积分数70~80%的甲醇对指标成分丹酚酸b进行提取,超声处理12-18分钟,其中,m3与v3的比为0.002-0.005g/ml。
根据本发明的另一个实施方案,所述步骤(1)中,
称取质量为m4的丹知青娥片粉末,用体积为v4的、体积分数45~60%的甲醇对指标成分芒果苷进行提取,超声处理12-18分钟,其中,m4与v4的比为0.005-0.01g/ml。
根据本发明的一个具体的实施方案,所述步骤(1)中,
称取质量为m1的丹知青娥片粉末,用体积为v1的、体积分数100%的甲醇对 指标成分补骨脂素和异补骨脂素进行提取,超声处理15分钟,其中,m1与v1的比为0.02g/ml;
称取质量为m2的丹知青娥片粉末,用体积为v2的、体积分数75%的甲醇对指标成分补骨脂苷和异补骨脂苷进行提取,超声处理20分钟,其中,m2与v2的比为0.02g/ml;
称取质量为m3的丹知青娥片粉末,用体积为v3的、体积分数75%的甲醇对指标成分丹酚酸b进行提取,超声处理15分钟,其中,m3与v3的比为0.004g/ml;
称取质量为m4的丹知青娥片粉末,用体积为v4的、体积分数50%的甲醇对指标成分芒果苷进行提取,超声处理15分钟,其中,m4与v4的比为0.008g/ml。
根据本发明的一个实施方案,所述每种指标成分所对应的预设色谱条件包括:
色谱柱采用十八烷基硅烷键合硅胶的固定相,流速0.5-2.0ml/分钟,柱温20-40℃;其中,
对于补骨脂素和异补骨脂素,流动相包括,a相:甲醇,b相:水;
对于补骨脂苷和异补骨脂苷,流动相包括,a相:乙腈,b相:0.01~1%甲酸水溶液;
对于丹酚酸b,流动相包括,a相:乙腈,b相:0.01~1%甲酸水溶液;
对于芒果苷,流动相包括,a相:乙腈,b相:0.01~1%冰乙酸水溶液。
根据本发明的一个优选的实施方案,所述每种指标成分所对应的预设色谱条件包括:
色谱柱采用十八烷基硅烷键合硅胶的固定相,流速0.8-1.5ml/分钟,柱温25-35℃;其中,
对于补骨脂素和异补骨脂素,流动相包括,a相:甲醇,b相:水,其中甲醇与水的体积比为51:49;
对于补骨脂苷和异补骨脂苷,流动相包括,a相:乙腈,b相:0.01~1%甲酸水溶液,其中乙腈与0.01~1%甲酸水溶液的体积比为12:88;
对于丹酚酸b,流动相包括,a相:乙腈,b相:0.01~1%甲酸水溶液,其中乙腈与0.01~1%甲酸水溶液的体积比为24:76;
对于芒果苷,流动相包括,a相:乙腈,b相:0.01~1%冰乙酸水溶液,其中乙腈与0.01~1%冰乙酸水溶液的体积比为12:88。
根据本发明的一个更优选的实施方案,所述每种指标成分所对应的预设色谱条件包括:
色谱柱采用十八烷基硅烷键合硅胶的固定相,流速1ml/分钟,柱温30℃;其中,
对于补骨脂素和异补骨脂素,流动相包括,a相:甲醇,b相:水,其中甲醇与水的体积比为51:49;
对于补骨脂苷和异补骨脂苷,流动相包括,a相:乙腈,b相:0.1%甲酸水溶液,其中乙腈与0.1%甲酸水溶液的体积比为12:88;
对于丹酚酸b,流动相包括,a相:乙腈,b相:0.1%甲酸水溶液,其中乙腈与0.1%甲酸水溶液的体积比为24:76;
对于芒果苷,流动相流动相包括,a相:乙腈,b相:0.2%冰乙酸水溶液,其中乙腈与0.2%冰乙酸水溶液的体积比为12:88。
根据本发明的一个实施方案,所述离心具体为:在14000转/分钟的条件下离心8~12分钟。
本发明增加了补骨脂苷、异补骨脂苷作为指标成分对丹知青娥片进行质量控制,可以弥补现有标准的不足,能够更好、更全面地控制和反映丹知青娥片的内在质量,保证丹知青娥片临床用药的安全性和有效性。另外,本发明单独测定每种指标成分,发明人意外地发现了一定浓度的提取溶剂、提取溶剂的体积、以及提取时间的特定组合,能够实现特定指标成分的高效富集,从而有效减少其它成分对指标成分检测造成干扰。同时考虑到药品生产企业质量分析部门在应用含量测定分析方法时的可操作性、简便性、稳定性等因素,在构建含量测定分析方法时发明人采用液相色谱等度洗脱方法分别建立了补骨脂素和异补骨脂素、补骨脂苷和异补骨脂苷、丹酚酸b、芒果苷多个含量测定的方法,具有简单快速、专属性强、重现性好等优点。
附图说明:
图1为补骨脂素标准品的纯度检查(1-补骨脂素)色谱图。
图2为异补骨脂素标准品的纯度检查(1-异补骨脂素)色谱图。
图3为补骨脂苷标准品的纯度检查(1-补骨脂苷)色谱图。
图4为异补骨脂苷标准品的纯度检查(1-异补骨脂苷)色谱图。
图5为丹酚酸b标准品的纯度检查(1-丹酚酸b)色谱图。
图6为芒果苷标准品的纯度检查(1-芒果苷)色谱图。
图7a为测定补骨脂素和异补骨脂素含量时,丹知青娥片供试品溶液的色谱图。
图7b为测定补骨脂素和异补骨脂素含量时,阴性制剂(缺补骨脂药材)供试品溶液的色谱图。
图7c为测定补骨脂素和异补骨脂素含量时,补骨脂素标准品的色谱图。
图7d为测定补骨脂素和异补骨脂素含量时,异补骨脂素标准品的色谱图。
图7e为测定补骨脂素和异补骨脂素含量时,补骨脂对照药材的色谱图。
图8a为测定补骨脂苷和异补骨脂苷含量时,丹知青娥片供试品溶液的色谱图。
图8b为测定补骨脂苷和异补骨脂苷含量时,阴性制剂(缺补骨脂药材)供试品溶液的色谱图。
图8c为测定补骨脂苷和异补骨脂苷含量时,补骨脂苷标准品的色谱图。
图8d为测定补骨脂苷和异补骨脂苷含量时,异补骨脂苷标准品的色谱图。
图8e为测定补骨脂苷、异补骨脂苷含量时,补骨脂对照药材的色谱图。
图9a为测定丹酚酸b含量时,丹知青娥片供试品溶液的色谱图。
图9b为测定丹酚酸b含量时,阴性制剂(缺丹参药材)供试品溶液的色谱图。
图9c为测定丹酚酸b含量时,丹酚酸b标准品的色谱图。
图9d为测定丹酚酸b含量时,丹参对照药材的色谱图。
图10a为测定芒果苷含量时,丹知青娥片供试品溶液的色谱图。
图10b为测定芒果苷含量时,阴性制剂(缺知母药材)供试品溶液的色谱图。
图10c为测定芒果苷含量时,芒果苷标准品的色谱图。
图10d为测定芒果苷含量时,知母对照药材的色谱图。
图11补骨脂素、异补骨脂素标准品的标准曲线。
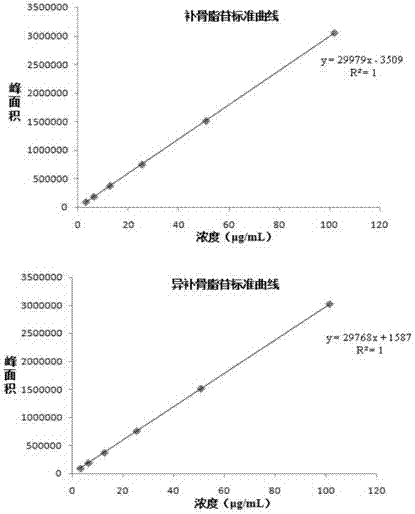
图12补骨脂苷、异补骨脂苷标准品的标准曲线。
图13丹酚酸b标准品的标准曲线。
图14芒果苷标准品的标准曲线。
具体实施方式
在本发明的实施过程中,发明人在提取每种指标成分的过程中发现,每种指标成分分别在以下提取条件下提取、分离效果最佳:
对于补骨脂素和异补骨脂素:称取质量为m1的丹知青娥片粉末,用体积为v1的,体积分数90~100%、优选95~100%、更优选98~100%的甲醇、最优选甲醇对指标成分补骨脂素和异补骨脂素进行提取,超声处理10-20分钟、优选12-18分钟、更优选14-16分钟、最优选15分钟,m1与v1的比为0.01-0.05g/ml、优选0.01-0.04g/ml、更优选0.01-0.03g/ml、最优选0.02g/ml;
对于补骨脂苷和异补骨脂苷:称取质量为m2的丹知青娥片粉末,用体积为v2的,体积分数65~85%、优选70~80%、更优选72~78%、最优选75%的甲醇对指标成分补骨脂苷和异补骨脂苷进行提取,超声处理15-30分钟、优选18-25分钟、更优选20分钟,m2与v2的比为0.01-0.05g/ml、优选0.01-0.04g/ml、更优选0.01-0.03g/ml、最优选0.02g/ml;
对于丹酚酸b:称取质量为m3的丹知青娥片粉末,用体积为v3的,体积分数65~85%、优选70~80%、更优选72~78%、最优选75%的甲醇对指标成分丹酚 酸b进行提取,超声处理10-20分钟、优选12-18分钟、更优选14-16分钟、最优选15分钟,m3与v3的比为0.001-0.03g/ml、优选0.002-0.01g/ml、更优选0.003-0.005g/ml、最优选0.004g/ml;
对于芒果苷:称取质量为m4的丹知青娥片粉末,用体积为v4的,体积分数40~65%的甲醇对指标成分芒果苷进行提取,超声处理10-20分钟、优选12-18分钟、更优选14-16分钟、最优选15分钟,m4与v4的比为0.003-0.03g/ml、优选0.005-0.01g/ml、更优选0.006-0.009g/ml、最优选0.008g/ml。
下面结合附图和实施例对本发明做进一步的说明,但不限于本发明的保护范围。
本发明所使用的仪器和材料如下:
仪器与试药:高效液相色谱仪:waterse2695hplc(美国沃特世公司),pda2998检测器;色谱柱:agilenteclipsexdb-c18(4.6×150mm,5μm,美国安捷伦公司);丹知青娥片(方法学研究批号:20150327,取200片粉碎供方法学研究用;含量测定批号:20150610、20150615、20150617,取20片/批次粉碎供含量测定用);色谱纯甲醇(美国sigma-aldrich公司);色谱纯乙腈(美国sigma-aldrich公司);补骨脂对照药材(批号121056-200904)、丹参对照药材(批号120923-201414)、知母对照药材(批号121070-201105)、杜仲对照药材(批号121202-201103)均购于中国食品药品检定研究院;超纯水(milli-q超纯水系统,美国millipore公司);甲酸(批号20130607,天津市大茂化学试剂厂);冰乙酸(批号20140808,天津市风船化学试剂科技有限公司)。
标准品来源及纯度检查:补骨脂素(批号110739-201115)、异补骨脂素(批号110738-201313)、丹酚酸b(批号111562-201212、111562-201313)、芒果苷(批号110607-200402)均购于中国食品药品检定研究院,补骨脂苷、异补骨脂苷为实验室自制;分别以补骨脂素(0.2mg/ml)、异补骨脂素(0.2mg/ml)、补骨脂苷(0.2mg/ml)、异补骨脂苷(0.2mg/ml)、丹酚酸b(0.5mg/ml)、芒果苷(0.2mg/ml)标准品溶液,采用高效液相色谱面积归一化法法检查标准品纯度,色谱图在2倍tr范围内积分,结果表明补骨脂素、异补骨脂素、芒果苷、丹酚酸b、补骨脂苷、异补骨脂苷纯度均为98%以上,结果见图1~6。
实施例1丹知青娥片中补骨脂素和异补骨脂素的含量测定
1)制备供试品溶液
取丹知青娥片粉末0.5g,精密称定,置于25ml量瓶中,加甲醇适量,超声处理15分钟,取出,放置室温,并定容至刻度,摇匀,取上清液14000转/分钟离心10分钟,取上清液进样分析。
2)色谱条件
采用色谱柱agilenteclipsexdb-c18(4.6×150mm,5μm,美国安捷伦公司)、流速1.0ml/分钟,柱温30℃,检测波长246nm,考察甲醇-水体系不同比例对补骨脂素和异补骨脂素色谱分离的影响。结果表明:采用色谱柱agilenteclipsexdb-c18(4.6×150mm,5μm),以甲醇-水(51:49)为流动相,流速1.0ml/分钟,柱温30℃,检测波长246nm,在此条件下补骨脂素、异补骨脂素实现基线分离,且缺盐补骨脂的阴性制剂供试品溶液(按处方配比,取盐杜仲、丹参、知母药材,按丹知青娥片的制备工艺制成提取物干膏,按照上述供试品溶液制备方法制得阴性制剂供试品溶液)在补骨脂素和异补骨脂素出峰处无干扰,色谱图见图7a~7e。
因为丹知青娥片中含有大量的小极性成分(如丹参中的丹参酮类成分、补骨脂中的补骨脂黄酮和补骨脂酚等成分),在色谱柱上强保留,为了减少残留成分对后续分析的影响,在完成补骨脂素与异补骨脂素的分析(12分钟)后,采用梯度洗脱冲洗色谱柱(12-13分钟,51~90%甲醇;13-17分钟,90%甲醇),其目的主要是为了洗脱色谱柱上强保留的低极性成分,避免对后续样品分析的影响。
3)建立标准曲线
取补骨脂素标准品10.04mg、异补骨脂素标准品10.16mg,精密称定,分别置于10ml棕色量瓶中,加甲醇溶解并定容至刻度,制得浓度分别为1.004mg/ml和1.016mg/ml补骨脂素、异补骨脂素标准品溶液。精密移取补骨脂素、异补骨脂素标准品溶液各2ml置于同一10ml量瓶中,加甲醇定容至刻度,摇匀,配制成混合标准品溶液,甲醇逐级稀释2、4、8、16、32、64倍,得到一系列不同浓度的混合标准品溶液。按色谱条件进样10μl测定,平行进样2次,以标准品浓度x(μg/ml)对峰面积y进行线性回归;以信噪比s/n3为检测限(lod)、s/n10为定量限(loq)测定补骨脂素、异补骨脂素的检测限和定量限。结果表明,各指标成分在各自浓度范围内线性关系良好,结果见表1、图11。
表1补骨脂素和异补骨脂素的线性回归方程、线性范围、lod、loq
4)精密度试验
日内精密度:取丹知青娥片粉末0.5g,精密称定,置于25ml量瓶中,按照所述供试品溶液制备方法制备,按照所述色谱条件分析,重复进样6次,测得补骨脂素、异补骨脂素峰面积,计算rsd分别为0.25%、0.17%。表明日内精密度良好,结果见表2。
日间精密度:取丹知青娥片粉末0.5g,精密称定,置于25ml量瓶中,按照所述供试品溶液制备方法制备,按照所述色谱条件分析,重复进样6次,连续进样三天,每天处理同一批号样品制备供试品溶液,测得补骨脂素、异补骨脂素日间精密度的rsd分别为1.3%、1.6%,表明日间精密度良好。结果见表3。
表2样品中补骨脂素与异补骨脂素日内精密度试验结果(n=6,峰面积)
表3样品中补骨脂素与异补骨脂素日间精密度试验结果(n=3,mg/g)
5)重复性试验
取丹知青娥片粉末0.5g,精密称定,称取6份,分别置于25ml量瓶中,按照所述供试品溶液制备方法制备,按照所述色谱条件分析,测定样品中补骨脂素与异补骨脂素含量,结果表明,丹知青娥片中补骨脂素、异补骨脂素平均含量分别为1.10、1.00mg/g,rsd分别为1.2%、0.93%,表明该方法重复性良好。结果见表4。
表4样品中补骨脂素与异补骨脂素测定的重复性试验结果(n=6,mg/g)
6)加样回收率试验
取丹知青娥片粉末0.25g,精密称定,称取6份,分别置于25ml量瓶中,分别精密加入补骨脂素标准品溶液1.4ml(200.8μg/ml)、异补骨脂素1.2ml(203.2μg/ml),加甲醇适量,超声处理15分钟,取出,放至室温,加甲醇定容至刻度,摇匀,取上清液14000转/分钟离心10分钟,取上清液,按照所述色谱条件分析,计算样品中补骨脂素与异补骨脂素的加样回收率,结果见表5。
表5样品中补骨脂素与异补骨脂素测定的加样回收率结果(n=6)
研究结果表明,补骨脂素、异补骨脂素平均加样回收率分别为100.2%、100.1%,rsd分别为2.4%、2.3%。
7)稳定性试验
取按照所述供试品溶液制备方法制备样品溶液,分别于0、2、4、6、8、10、12小时进样分析,测得补骨脂素、异补骨脂素峰面积的rsd分别为1.8%、1.3%。表明室温条件下丹知青娥片供试品溶液中补骨脂素与异补骨脂素在12小时内基本稳定,结果见表6。
表6样品中补骨脂素与异补骨脂素测定的稳定性试验结果(n=7,峰面积)
8)三批丹知青娥片中补骨脂素与异补骨脂素的含量测定
取丹知青娥片20片,粉碎,取0.5g,精密称定,置于25ml量瓶中,按照所述供试品溶液制备方法制备,按照所述色谱条件分析,分别测定三批丹知青娥片样品中补骨脂素与异补骨脂素的含量,结果见表7。
表7三批丹知青娥片中补骨脂素与异补骨脂素含量测定结果(n=2,mg/片*)
*每片样品重量按0.63g计
实施例2丹知青娥片中补骨脂苷和异补骨脂苷的含量测定
1)制备供试品溶液
取丹知青娥片粉末0.5g,精密称定,置于25ml量瓶中,加75%甲醇适量,超声处理20分钟,取出,放置室温,并定容至刻度,摇匀,取上清液14000转/分钟离心10分钟,取上清液进样分析。
2)色谱条件
采用色谱柱agilenteclipsexdb-c18(4.6×150mm,5μm,美国安捷伦公司)、流速1.0ml/分钟,柱温30℃,检测波长246nm,考察乙腈-0.1%甲酸水溶液体系 不同比例对补骨脂苷和异补骨脂苷色谱分离的影响。结果表明:采用色谱柱agilenteclipsexdb-c18(4.6×150mm,5μm),以乙腈-0.1%甲酸水溶液(12:88)为流动相,流速1.0ml/分钟,柱温30℃,检测波长246nm,在此条件下丹知青娥片中补骨脂苷、异补骨脂苷实现基线分离,且缺盐补骨脂的阴性制剂溶液(按处方配比,取盐杜仲、丹参、知母药材,按丹知青娥片的制备工艺制成提取物干膏,按照上述供试品溶液制备方法制得阴性制剂溶液)在补骨脂苷和异补骨脂苷出峰处无干扰,色谱图见图8a~8e。
因为丹知青娥片中含有大量的小极性成分(如丹参中的丹参酮类成分、补骨脂中的补骨脂黄酮和补骨脂酚等成分)在色谱柱上强保留,为了减少残留成分对后续分析的影响,在完成补骨脂苷与异补骨脂苷的分析(20分钟)后,采用梯度洗脱程序(20-24分钟,12~85%乙腈;24-30分钟,85%乙腈;30-33分钟,85~12%乙腈;33-40分钟,12%乙腈)冲洗色谱柱,其目的主要是为了洗脱色谱柱上强保留的低极性成分,避免对后续分析的影响。
3)建立标准曲线
取补骨脂苷标准品5.09mg、异补骨脂苷标准品5.07mg,精密称定,分别置于5ml棕色量瓶中,加甲醇溶解并定容至刻度,制得浓度分别为1.018mg/ml和1.014mg/ml的补骨脂苷、异补骨脂苷标准品溶液。精密移取补骨脂苷、异补骨脂苷标准品溶液各1ml置于同一10ml量瓶中,加75%甲醇定容至刻度,摇匀,配制成浓度分别为101.8、101.4μg/ml补骨脂苷和异补骨脂苷混合标准品溶液,75%甲醇逐级稀释2、4、8、16、32倍,得到一系列不同浓度的混合标准品溶液。按色谱条件进样10μl测定,平行分析2次,以标准品浓度x(μg/ml)对峰面积y进行线性回归;以信噪比s/n3为检测限(lod)、s/n10为定量限(loq)测定补骨脂苷、异补骨脂苷的检测限和定量限。结果表明,补骨脂苷、异补骨脂苷在各自浓度范围内线性关系良好,结果见表8、图12。
表8补骨脂苷和异补骨脂苷的线性回归方程、线性范围、lod、loq
4)精密度试验
标准品溶液的精密度试验
日内精密度:取浓度分别为12.73μg/ml、12.68μg/ml补骨脂苷、异补骨脂苷的混合标准品溶液,按照所述色谱条件分析,重复进样6次,测得补骨脂苷、异补骨脂苷峰面积的rsd分别为0.48%、0.34%。表明仪器的精密度良好,结果见表9。
日间精密度:取浓度分别为12.73μg/ml、12.68μg/ml补骨脂苷、异补骨脂苷的混合标准品溶液,按照所述色谱条件分析,重复进样6次,连续进样三天,测得补骨脂苷、异补骨脂苷日间精密度的rsd分别为0.93%、0.88%,表明仪器的日间精密度良好。结果见表10。
表9补骨脂苷、异补骨脂苷混合标准品溶液日内精密度试验结果(n=6,峰面积)
表10补骨脂苷、异补骨脂苷混合标准品溶液日间精密度试验结果(n=3,峰面积)
丹知青娥片样品中补骨脂苷、异补骨脂苷的精密度试验
日内精密度:取丹知青娥片粉末0.5g,精密称定,置于25ml量瓶中,按照所述供试品溶液制备方法制备,按照所述色谱条件分析,重复进样6次。结果见表11,样品中均未检测到补骨脂苷和异补骨脂苷。
日间精密度:取丹知青娥片粉末0.5g,精密称定,置于25ml量瓶中,按照所述供试品溶液制备方法制备,按照所述色谱条件分析,重复进样6次,连续进样三天,每天处理同一批号样品制备供试品溶液。结果见表12,样品中均未检测到补骨脂苷和异补骨脂苷。
表11样品中补骨脂苷和异补骨脂苷测定的日内精密度试验结果(n=6,峰面积)
“-”:未检测到
表12样品中补骨脂苷和异补骨脂苷测定的日间精密度试验结果(n=3,峰面积)
“-”:未检测到
5)重复性试验
取丹知青娥片粉末0.5g,精密称定,称取6份,分别置于25ml量瓶中,按照所述供试品溶液制备方法制备,按照所述色谱条件分析。结果见表13,样品中均未检测到补骨脂苷和异补骨脂苷。
表13样品中补骨脂苷与异补骨脂苷测定的重复性试验结果(n=6,mg/g)
“-”:未检测到
6)加样回收率试验
取丹知青娥片粉末0.25g,精密称定,称取6份,分别置于25ml量瓶中,精密加入补骨脂苷、异补骨脂苷混合标准品溶液1.6ml(补骨脂苷101.8μg/ml、异补骨脂苷101.4μg/ml),加75%甲醇适量,超声处理20分钟,取出,放至室温,加75%甲醇定容至刻度,摇匀,取上清液14000转/分钟离心10分钟,取上清液,按照所述色谱条件分析,计算补骨脂苷、异补骨脂苷加样回收率,结果见表14。
表14样品中补骨脂苷和异补骨脂苷测定的加样回收率试验结果(n=6)
“-”:未检测到
研究结果表明,补骨脂苷、异补骨脂苷平均加样回收率分别为98.81%、101.1%,rsd分别为0.23%、0.69%。
7)稳定性试验
标准品溶液的稳定性试验
取浓度分别为12.73μg/ml、12.68μg/ml补骨脂苷、异补骨脂苷标准品混合溶液,按照所述色谱条件分析,分别于0、2、4、6、8、10、12小时进样,测得补骨脂苷、异补骨脂苷峰面积,计算rsd分别为0.32%、0.39%。表明室温条件下标准品溶液中补骨脂苷与异补骨脂苷在12小时内基本稳定,结果见表15。
表15补骨脂苷与异补骨脂苷测定的稳定性试验结果(n=7,峰面积)
丹知青娥片样品中补骨脂苷和异补骨脂苷稳定性试验
取丹知青娥片粉末0.5g,精密称定,置于25ml容量瓶中,按照所述供试品溶液制备方法制备,按照所述色谱条件分析,分别于0、2、4、6、8、10、12小时进样。结果见表16,样品中均未检测到补骨脂苷和异补骨脂苷。
表16样品中补骨脂苷与异补骨脂苷测定的稳定性试验结果(n=7,峰面积)
“-”:未检测到
8)三批丹知青娥片中补骨脂苷和异补骨脂苷的含量测定
取丹知青娥片20片,粉碎,取0.5g,精密称定,置于25ml容量瓶中,按照所述供试品溶液制备方法制备,按照所述色谱条件分析,分别测定三批丹知青娥片样品中补骨脂苷与异补骨脂苷的含量,结果见表17。
表17三批丹知青娥片中补骨脂苷和异补骨脂苷含量测定结果(n=2,mg/片*)
“-”:未检测到,*每片样品重量按0.63g计
实施例3丹知青娥片中丹酚酸b的含量测定
1)制备供试品溶液
取丹知青娥片粉末0.2g,精密称定,置于50ml量瓶中,加75%甲醇适量,超声处理15分钟,取出,放置室温,并定容至刻度,摇匀,取上清液14000转/分钟离心10分钟,取上清液进样分析。
2)色谱条件
采用色谱柱agilenteclipsexdb-c18(4.6×150mm,5μm,美国安捷伦公司),流速1.0ml/分钟,柱温30℃,检测波长286nm,考察乙腈-0.1%甲酸水体系不同比例对丹知青娥片中丹酚酸b色谱分离的影响。结果表明:采用色谱柱agilenteclipsexdb-c18(4.6×150mm,5μm),以乙腈-0.1%甲酸水溶液(24:76)为流动相,流速1.0ml/分钟,柱温30℃,检测波长286nm,在此条件下丹酚酸b与样品中其它指标成分实现基线分离,且缺丹参的阴性制剂溶液(按处方配比,取 盐补骨脂、盐杜仲、知母药材,按丹知青娥片的制备工艺制成提取物干膏,按照上述供试品溶液制备方法制得阴性制剂溶液)在丹酚酸b出峰处无干扰,色谱图见图9a~9d。
因为丹知青娥片中含有大量的小极性成分(如丹参中的丹参酮类成分、补骨脂中的补骨脂黄酮和补骨脂酚等成分)在色谱柱上强保留,为了减少残留成分对后续分析的影响,在完成丹酚酸b的分析(12分钟)后,采用梯度洗脱冲洗色谱柱(12-13分钟,24~90%乙腈;13-17分钟,90%乙腈),其目的主要是为了洗脱色谱柱上强保留的低极性成分,避免对后续分析的影响。
3)建立标准曲线
取丹酚酸b10.07mg,精密称定,置于10ml棕色量瓶中,加75%甲醇溶解并定容至刻度,制得浓度为1.007mg/ml丹酚酸b标准品溶液。精密移取丹酚酸b标准品溶液5ml置于10ml容量瓶中,加75%甲醇定容至刻度,摇匀,得到浓度为503.5μg/ml的标准品溶液,75%甲醇逐级稀释2、4、8、16、32、64倍,得到一系列不同浓度的标准品溶液。按色谱条件进样10μl测定,平行分析2次,以标准品浓度x(μg/ml)对峰面积y进行线性回归;以信噪比s/n3为检测限(lod)、s/n10为定量限(loq)测定丹酚酸b的检测限和定量限。结果表明,丹酚酸b在其浓度范围内线性关系良好,结果见表18、图13。
表18丹酚酸b的线性回归方程、线性范围、lod、loq
4)精密度试验
日内精密度:取丹知青娥片粉末0.2g,精密称定,置于50ml量瓶中,按照所述供试品溶液制备方法制备,按照所述色谱条件分析,重复进样6次,测得丹酚酸b峰面积,计算rsd为0.93%。表明精密度良好,结果见表19。
日间精密度:取丹知青娥片粉末0.2g,精密称定,置于50ml量瓶中,按照所述供试品溶液制备方法制备,按照所述色谱条件分析,重复进样6次,连续进样三天,每天处理同一批号样品制备供试品溶液,测得丹酚酸b日间精密度的rsd为1.3%,表明日间精密度良好。结果见表20。
表19样品中丹酚酸b测定的日内精密度试验结果(n=6,峰面积)
表20样品中丹酚酸b测定的日间精密度试验结果(n=3,mg/g)
5)重复性试验
取丹知青娥片粉末0.2g,精密称定,称取6份,分别置于50ml量瓶中,按照所述供试品溶液制备方法制备,按照所述色谱条件分析,测定丹酚酸b含量,结果表明,丹知青娥片中丹酚酸b含量平均值为18.79mg/g,rsd为0.68%,表明该方法重复性良好。结果见表21。
表21样品中丹酚酸b测定的重复性试验结果(n=6,mg/g)
6)加样回收率试验
取丹知青娥片粉末0.1g,精密称定,称取6份,分别置于50ml量瓶中,分别精密加入丹酚酸b标准品溶液1.5ml(1.266mg/ml),加75%甲醇适量,超声处理15分钟,取出,放至室温,加75%甲醇定容至刻度,摇匀,取上清液14000转/分钟离心10分钟,取上清液,按照所述色谱条件分析,计算丹知青娥片中丹酚酸b的加样回收率,结果见表22。
表22样品中丹酚酸b测定的加样回收率试验结果(n=6)
研究结果表明,丹知青娥片中丹酚酸b平均加样回收率为99.32%,rsd为1.8%。
7)稳定性试验
取按照所述供试品溶液制备方法制备样品溶液,分别于0、2、4、6、8、10、12小时进样,测得丹酚酸b峰面积的rsd为1.1%。表明室温条件下丹知青娥片供试品溶液中丹酚酸b在12小时内基本稳定,结果见表23。
表23样品中丹酚酸b测定的稳定性试验结果(n=7,峰面积)
8)三批丹知青娥片中丹酚酸b的含量测定
取本品20片,粉碎,取0.2g,精密称定,置于50ml量瓶中,按照所述供试品溶液制备方法制备,按照所述色谱条件分析,分别测定三批丹知青娥片样品中丹酚酸b的含量,结果见表24。
表24三批丹知青娥片中丹酚酸b含量测定结果(n=2,mg/片*)
*每片样品重量按0.63g计
实施例4丹知青娥片中芒果苷的含量测定
1)制备供试品溶液
取丹知青娥片粉末0.2g,精密称定,置于25ml量瓶中,加50%甲醇适量,超声处理15分钟,取出,放置室温,并定容至刻度,摇匀;取上清液14000转/分钟离心10分钟,取上清液进样分析。
2)色谱条件
采用色谱柱agilenteclipsexdb-c18(4.6×150mm,5μm,美国安捷伦公司),流速1.0ml/分钟,柱温30℃,检测波长258nm,考察不同流动相(乙腈-0.1%甲酸水溶液、乙腈-0.2%冰乙酸水溶液、甲醇-0.1%甲酸水溶液)及其不同比例对丹知青娥片中芒果苷色谱分离的影响。结果表明:采用色谱柱agilenteclipsexdb-c18(4.6×150mm,5μm),以乙腈-0.2%冰乙酸水溶液(12:88)为流动相,流速1.0ml/分钟,柱温30℃,检测波长258nm,在此条件下芒果苷与样品中其它指标成分实现基线分离,且缺知母的阴性制剂溶液(按处方配比,取盐补骨脂、盐杜仲、丹参药材,按丹知青娥片的制备工艺制成提取物干膏,按照上述供试品溶液制备方法制得阴性制剂溶液)在芒果苷出峰处无干扰,色谱图见图10a~10d。
因为丹知青娥片中含有大量的小极性成分(如丹参中的丹参酮类成分、补骨脂中的补骨脂黄酮和补骨脂酚等成分)在色谱柱上强保留,为了减少残留成分对后续分析的影响,在完成芒果苷的分析(12分钟)之后,采用梯度洗脱冲洗色谱柱(12-13分钟,12~90%乙腈;13-17分钟,90%乙腈),其目的主要是为了洗脱色谱柱上强保留的低极性成分,避免对后续分析的影响。
3)建立标准曲线
取芒果苷10.04mg,精密称定,置于10ml棕色量瓶中,加50%甲醇溶解并定容至刻度,制得芒果苷标准品溶液浓度为1.004mg/ml。精密移取芒果苷标准品溶液2ml置于10ml量瓶中,加50%甲醇定容至刻度,摇匀,得到浓度为200.8μg/ml的标准品溶液,50%甲醇逐级稀释2、4、8、16、32、64倍,得到 一系列不同浓度的标准品溶液。按色谱条件进样10μl测定,平行分析2次,以标准品浓度x(μg/ml)对峰面积y进行线性回归;以信噪比s/n3为检测限(lod)、s/n10为定量限(loq)测定芒果苷的检测限和定量限。结果表明,芒果苷在其浓度范围内线性关系良好,结果见表25、图14。
表25芒果苷的线性回归方程、线性范围、lod、loq
4)精密度试验
日内精密度:取丹知青娥片粉末0.2g,精密称定,置于25ml量瓶中,按照所述供试品溶液制备方法制备,按照所述色谱条件分析,重复进样6次,测得芒果苷峰面积的rsd为0.35%。表明精密度良好,结果见表26。
日间精密度:取丹知青娥片粉末0.2g,精密称定,置于25ml量瓶中,按照所述供试品溶液制备方法制备,按照所述色谱条件分析,重复进样6次,连续进样三天,每天处理同一批号样品制备供试品溶液,测得芒果苷日间精密度的rsd为1.2%,表明日间精密度良好。结果见表27。
表26丹知青娥片中芒果苷测定的日内精密度试验结果(n=6,峰面积)
表27丹知青娥片中芒果苷测定的日间精密度试验结果(n=3,mg/g)
5)重复性试验
取丹知青娥片粉末0.2g,精密称定,称取6份,分别置于25ml容量瓶中,按照所述供试品溶液制备方法制备,按照所述色谱条件分析,测定芒果苷含量,结果表明,丹知青娥片中芒果苷含量平均值为2.50mg/g,rsd为0.38%,表明该方法重复性良好。结果见表28。
表28丹知青娥片中芒果苷测定的重复性试验结果(n=6,mg/g)
6)加样回收率试验
取丹知青娥片粉末0.1g,精密称定,称取6份,分别置于25ml容量瓶中,精密加入芒果苷标准品溶液1.2ml(200.8μg/ml),加50%甲醇适量,超声处理15分钟,取出,放至室温,加50%甲醇定容至刻度,摇匀,取上清液14000转/分钟离心10分钟,取上清液,按照所述色谱条件分析,计算丹知青娥片中芒果苷加样回收率,结果见表29。
表29丹知青娥片中芒果苷测定的加样回收率试验结果(n=6)
研究结果表明,丹知青娥片中芒果苷测定平均加样回收率为99.72%,rsd为2.4%。
7)稳定性试验
取按照所述供试品溶液制备方法制备样品溶液。分别于0、2、4、6、8、10、12小时进样,测得丹知青娥片中芒果苷峰面积的rsd为1.1%。表明室温条件下丹知青娥片供试品溶液中芒果苷在12小时内基本稳定,结果见表30。
表30丹知青娥片中芒果苷测定的稳定性试验结果(n=7,峰面积)
8)三批丹知青娥片中芒果苷的含量测定
取丹知青娥片20片,粉碎,取0.2g,精密称定,置于25ml容量瓶中,按照所述供试品溶液制备方法制备,按照所述色谱条件分析,分别测定三批丹知青娥片样品中芒果苷的含量,结果见表31。
表31三批丹知青娥片中芒果苷含量测定结果(n=2,mg/片*)
*每片样品重量按0.63g计
上述参照具体实施方式对丹知青娥片的检测进行详细描述,是说明性的而不是限定性的,可按照所限定范围列举出若干个实施例,因此在不脱离本发明总体构思下的变化和修改,应属本发明的保护范围之内。
- 还没有人留言评论。精彩留言会获得点赞!