用于感测汗液中的分析物的生物传感器及其制造方法与流程
本发明涉及一种用于感测在流体中的分析物的生物传感器和用于制造所述生物传感器的方法,特别地,可以使用所述生物传感器用于检测在汗液中的葡萄糖和乳酸盐。
背景技术:
在医疗诊断中,可穿戴的生物传感器对于提供与患者的当前健康状态相关的信息是相当重要的。
生物传感器是一种用于感测分析物的装置。生物传感器包括生物识别元件(敏感的生物元件)和感测元件,所述感测元件将由分析物与该生物元件的相互作用得到的信号转化为可以容易地测量和量化的进一步的信号。
特别地,与基于血液样品的分析不同,汗液的分析不需要用于采集待分析的样品的侵入性过程,迄今汗液的分析在用于葡萄糖和乳酸盐的分析中受到了特别的关注。
电解质是汗液的最容易被分析的组分。类似诸如乳酸和葡萄糖的代谢物则更难测量。但是,因为这些代谢物的基本诊断作用,人们对于监测这些代谢物有极大的兴趣。例如,乳酸是缺氧的指标;乳酸的过度增加是缺血的症状,而且是某些类型的癌症的指标。另外,葡萄糖的监测是在糖尿病管理中的重要基础。在血液中的葡萄糖和乳酸盐的浓度和在汗液中存在的浓度之间存在直接的关系。
目前用于通过汗液的分析监测代谢物的方法设想诉诸于已知的技术,如反向离子电渗。基于反向离子电渗的装置设置有布置于与患者的皮肤接触的电端子(阴极和阳极),电流可在它们之间流动。通过患者的皮肤在该装置的阴极和阳极之间提供的低电流使得用于运输在汗液中存在的葡萄糖和乳酸盐分子的钠和氯离子分别向阴极和阳极渗透迁移。在其中一个上布置的是对于分析物特异的酶,从而有可能从酶-分析物的相互作用测量分析物浓度。然而,由于存在流经皮肤本身的电流,根据此技术的装置可能引起敏感患者的皮肤不适或刺激。
技术实现要素:
因此,本发明的目的是提供一种克服已知方案的缺点的生物传感器及其制造方法。
根据本发明,如在所附的权利要求中限定的,提供了一种生物传感器及其制造方法。
附图说明
现仅通过非限制性实施例的方式,参考所附的附图描述本发明的优选实施方式以理解本发明,其中:
图1示出根据本公开的一个实施方式的生物传感器;
图2-11示出制造图1的生物传感器的步骤;
图12-18示出代替图2-11的制造步骤的制造步骤;以及
图19示出根据图12-18的步骤制造的根据本公开的又一个实施方式的生物传感器。
具体实施方式
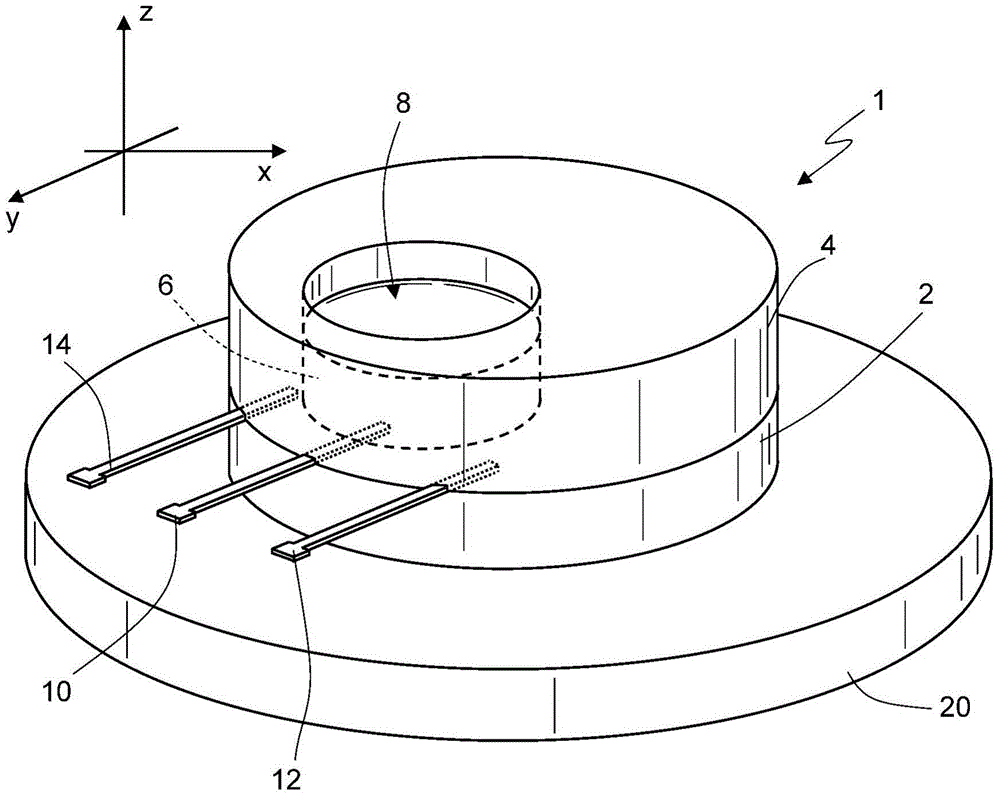
图1示出在三轴参照系X,Y,Z中,根据本公开的一个方面的生物传感器1。该生物传感器1包括:光敏水凝胶的第一结构层2;光敏水凝胶的第二结构层4,其在该第一结构层2上延伸;感测区域6,其包括其中分散有生物识别元件,特别是如GOx(葡萄糖氧化酶)和LOx(乳酸盐氧化酶)的酶的光敏水凝胶的基质。该第二结构层4在该感测区域6具有贯通开口8,从而使该感测区域6通过贯通开口8至少部分地暴露于外部环境。
工作电端子10被布置为与感测区域6电接触,而对电极电端子被布置在感测区域6旁边的第一层2(或者在第一层2的部分)上,且不与感测区域6直接电接触。参考电端子14在感测区域6旁边在第一层2(或者在第一层2的部分)上延伸,且不与感测区域6直接电接触。特别地,在XY平面俯视图中,感测区域6在对电极电端子12和参考电端子14之间延伸。
工作电端子10、对电极电端子12和参考电端子14由类似诸如选自金、银、铂的惰性金属、导电聚合物和碳制成的导电材料。参考电极14还可由氯化银AgCl制成。
在实践中,生物传感器1提供了具有三个电极的电化学电池。
本领域中已知的水凝胶对于制造生物化学传感器是特别有吸引力的,这是由于它们是由形成了用于包封功能的酶、细胞和其他生物材料的优异基质的亲水性分子的聚合物链构成的。特别地,在水凝胶内的环境条件对于使在其中分散的生物分子的变性最小化,有利于其功能性而言是理想的。
用于形成第一结构层2、第二结构层4和感测区域6的光敏水凝胶包括,包含以共价键和非共价键彼此交联聚合物链的亲水性聚合物。在生理温度、pH值和离子力下,它们的单体或预聚物可溶于水,而聚合物不溶于水。水含量(%H2O)被定义为,%H2O=100·(溶胀的聚合物重量/干燥的聚合物重量)/(溶胀聚合物的重量)。聚合物可具有500-200000道尔顿的范围内的分子量,并根据特定的应用优化它们的性质,包括粘度、软化点、和降解温度。
第一结构层2、第二结构层4和感测区域6可包括:单体、低聚物或预聚物(预聚物的分子量控制机械性质和粘度),或者调节混合物的机械性质(粘合性等)的粘合剂;进一步控制类似诸如混合物的粘度的机械性质的一种或多种溶剂;以及光活性化合物(PACs)或光抑制剂(PhIs)。
根据本公开的一个实施方式,第一结构层2、第二结构层4、和感测区域6的水凝胶的作用类似于在光刻工艺中使用的负光致抗蚀剂,因此,第二结构层4和感光区域6的一部分的受控的UV辐照导致仅辐照区域的聚合,使得未辐照区域通过在水中显影而去除。因此,在这种情况下,该水凝胶含有单体或低聚物或前体预聚物,并例如,通过暴露于入射的UV照射而经受光聚合和/或光交联的反应。所涉及层的光交联确定它们分子量的增加,这导致了层在水中溶解度的有利的降低。
可根据本公开使用的,由简单单体或不同的单体混合物制成的水凝胶的实例是:
聚乙二醇二丙烯酸酯(PEG-DA),
聚乙二醇二甲基丙烯酸酯,
聚丙二醇富马酸酯-共-乙二醇,
甲基丙烯酸酯改性的葡聚糖,
换向的透明质酸(Commutated hyaluronic acid),
聚乙烯醇(PVA)
丙烯酸酯改性的PVA,
聚[双(甲氧基乙氧基乙氧基)磷腈](MEEP),
聚磷腈
聚甲基丙烯酸羟乙酯(PHEMA)
在本说明书的下文中将明确提及PEG-DA,这并不表示失去任何一般性。
图2-11示出,在平面XZ的侧视图中,根据本公开的一个方面的图1的生物传感器1的连续制造步骤。
首先制备基板20(图2),例如,玻璃、硅、或塑料材料(例如,聚对苯二甲酸乙二酯PET、聚萘二甲酸乙二酯PEN、聚醚醚酮PEEK)。
然后(图3),如在下文所述,在基板20上形成第一可光定义(photo-definible)水凝胶层22。通过以2-3%v/v的百分比添加PEG-DA光引发剂而制备预聚混合物。任何具有吸收UV照射和进行光反应,产生聚合并构成预聚混合物的反应性物质和自由基的能力的光引发剂都适用于所述目的。特别地,使用商业上也被称为DarocurTM的2-羟基-2-甲基-1-苯基丙烷-1-酮作为光引发剂。使用旋涂技术在基板20上(在700-1000rpm,持续8-15秒,特别是在800rpm,持续10秒)沉积这样形成的预聚溶液。
第一可光定义水凝胶层22具有包含在100nm和1000nm之间的,例如200nm的厚度。可以根据用于得到具有所需厚度的层22的基于水凝胶的溶液的粘度调整沉积参数。
下一步骤(图4)是形成工作电端子10、对电极电端子12和参考电端子14的导电纤维的布置(商业上可得到的)。上述纤维具有,例如,包含在50nm和200nm之间的直径,并由选自金、银、铂、导电聚合物和碳的材料制成。
该纤维在交联步骤之前布置在层22上。该纤维仅部分透过进层22。以这种方式,可以由以上电性接入它们(特别是工作电端子10)。
然后(图5),使用产生UV照射25的UV灯23在第一可光定义水凝胶层22的选择的部分上进行交联步骤。特别地,为了得到第一可光定义水凝胶层22的选择性聚合,使用具有不透明区域24a(其设计为阻挡入射的UV照射25)和透明区域24b(其对于入射的UV照射25是透明的)的掩模24。以这种方式,由于水凝胶的行为类似于负光致抗蚀剂,仅第一可光定义水凝胶层22的在透明区域24b中延伸的部分受到交联处理。
根据本公开的一个方面,形成工作电端子10、对电极电端子12和参考电端子14的纤维部分在聚合的第一可光定义水凝胶层22的区域内侧,且部分在外侧地延伸,从而,如图6中所示,在聚合步骤之后,纤维由形成的第一结构层2的外侧电性接入。
使用以下曝光参数进行聚合步骤:根据使用的光引发剂选择UV照射的波长,例如(在使用DarocurTM的情况下)365nm;曝光功率包括在12mW/cm2和20mW/cm2之间的范围内,特别是18mW/cm2;曝光时间包括在5秒和20秒之间,特别是7秒。
如图6中所示,在去离子水中水浴的后续步骤使得第一未聚合的可光定义的水凝胶层22去除了一小部分,从而形成了第一结构层2。
然后(图7),在基板20和第一结构层2上形成第二可光定义的水凝胶层26(设置有生物识别元件,例如酶)。第二可光定义的水凝胶层26在随后的制造步骤中形成感测区域6。
具体而言,由水凝胶(例如,PEG-DA)的预聚溶液、3%v/v的光引发剂(例如,DarocurTM)和1%v/v的还原-氧化(氧化还原)介体起始形成第二可光定义的水凝胶层26。氧化还原介体是能够介导还原-氧化反应,或者,换言之,能够促进由还原-氧化反应产生的电子通过水凝胶基质流动的分子。例如,氧化还原介体为,二茂铁衍生物,如乙烯基二茂铁。
通过在pH为6和6.5之间范围内的磷酸盐缓冲液(PBS)中溶解适当的酶,以及作为用于改善酶在基质中的保留的试剂的戊二醛而制备酶溶液。根据一个实施方式,从葡萄糖氧化酶(GOx)和乳酸盐氧化酶(LOx)之间选择酶。酶在PBS中的浓度为,例如,20mg/mL。
在包含在4℃和5℃之间的温度下一起混合由此制备的预聚溶液和酶溶液持续4h和5h之间的时间。预聚溶液和酶溶液之间的比例为10:1v/v,但可以根据需要而变化。由此得到的混合物(称为“感测基质”)形成第二可光定义的水凝胶层26,它被以与参考第一可光定义的水凝胶层22的已描述的相似的方式,使用旋涂技术沉积在基板20上和第一结构层2上。第二可光定义的水凝胶层26具有包括在100nm和1000nm之间,例如200nm的厚度。此外,在这种情况下,可以根据用于得到具有所需厚度的层26(以及由此的感测区域6)的第二可光定义的水凝胶层26的溶液的粘度调整沉积参数。
然后(图8),使用适当的掩模28进行暴露于UV照射的步骤,以利于第二可光定义的水凝胶层26的选择部分的交联。例如,使用与之前使用的产生UV照射25的相同的UV灯23得到曝光。为了得到第二可光定义水凝胶层26的选择性聚合,使用具有不透明区域28a(其设计为阻挡入射的UV照射25)和透明区域28b(其对于入射的UV照射25是透明的)的掩模28。以这种方式,仅第二可光定义的水凝胶层26的在透明区域28b中延伸的部分受到交联处理。
根据本公开的一个方面,形成工作电端子10的金属纤维部分在聚合的第二可光定义水凝胶层26的区域内侧,且部分在外侧地延伸,从而,在聚合步骤之后,纤维从由此形成的感测区域62的外侧电性接入。
使用以下曝光参数进行聚合步骤:根据使用的光引发剂选择UV照射的波长,例如(在使用DarocurTM的情况下)365nm;曝光功率包括在12mW/cm2和20mW/cm2之间的范围内,特别是18mW/cm2;曝光时间包括在5秒和20秒之间,特别是7秒。
之后(图9),进行在去离子水中水浴的步骤,使得未聚合的第二可光定义的水凝胶层26去除了一小部分,从而在对应于工作电极10的区域形成了感测区域6,并与之电接触。
之后(图10),形成第二结构层4。为此目的,在基板20上、第一结构层2上和在感测区域6上形成第三可光定义水凝胶层34。
为此目的,如参考第一可光定义水凝胶层22的,通过向聚乙二醇二丙烯酸酯(以下称PEG-DA)以2-3%v/v的百分比添加光引发剂而制备预聚混合物。特别地,使用商业上也被称为DarocurTM的2-羟基-2-甲基-1-苯基丙烷-1-酮作为光引发剂。在基板20上、第一结构层2上和在感测区域6上使用旋涂技术沉积由此形成的预聚溶液。在700rpm和1000rpm之间进行旋涂8至15秒,特别是在800rpm下进行10秒。
由此形成的第三可光定义的水凝胶层34具有包括在100nm和1000nm之间,例如200nm的厚度。可以根据用于得到具有所需厚度的层34的基于水凝胶的溶液的粘度调整沉积参数。
然后再次参照图10,使用适当的掩模36进行暴露于UV照射的步骤,以利于第三可光定义的水凝胶层34的选择部分的交联。例如,使用与之前使用的产生UV照射25的相同的UV灯23得到曝光。为了得到第三可光定义水凝胶层34的选择性聚合,设置具有不透明区域36a(其设计为阻挡入射的UV照射25)和透明区域36b(其对于入射的UV照射25是透明的)的掩模36。以这种方式,仅第三可光定义的水凝胶层34的在透明区域36b中延伸的部分受到交联处理。
使用以下曝光参数进行第三可光定义的水凝胶层34的聚合步骤:根据使用的光引发剂选择UV照射的波长,例如(在使用DarocurTM的情况下)365nm;曝光功率包括在12mW/cm2和20mW/cm2之间的范围内,特别是18mW/cm2;曝光时间包括在5秒和20秒之间,特别是7秒。
如图11中所示,在去离子水中显影的后续步骤使得第三未聚合的可光定义的水凝胶层34去除了一部分,从而形成了第二结构层4。
根据本公开,设置了具有在使用时(即,当掩模36布置成与第三可光定义的水凝胶层34对齐时)覆盖了在感测区域6上延伸的第三可光定义的水凝胶层34的一部分的不透明区域的掩模36。以此方式,在感测区域6上的第三可光定义的水凝胶层34的部分不经过交联过程,并在去离子水中显影的步骤期间被去除。因此形成了贯通开口8,通过贯通开口8感测区域6至少部分地暴露。如此形成图1的生物传感器1。
最后,通过剥离步骤去除基板20以得到图1的生物传感器1。剥离基板20的步骤是可选的。
图12-19示出用于制造根据另一实施方式的生物传感器1'的步骤。
参考图12,首先制备基板40,例如,玻璃、或硅、或塑料材料(例如,PET、PEN、PEEK)。
然后,参考与图3中的层22所述的相似的方式,在基板40上形成第一可光定义的水凝胶层42,且在此不再进一步描述。
然后(图13),使用产生UV照射25的UV灯23在第一可光定义的水凝胶层42的选择的部分上进行交联步骤。特别地,为了得到第一可光定义水凝胶层42的选择性聚合,使用具有不透明区域44a(其设计为阻挡入射的UV照射25)和透明区域44b(其对于入射的UV照射25是透明的)的掩模44。以这种方式,仅第一可光定义的水凝胶层42的在透明区域44b中延伸的部分受到交联处理。
特别地,在随后的制造步骤中将容纳工作电端子10'、对电极电端子12'、和参考电端子14'的基板40的部分40'上延伸的区域中的第一可光定义的水凝胶层42未被辐照。可以根据在第一结构层2(聚合步骤之后)上预期赋予的几何形状自由地选择基板40的部分40';例如,基板40的部分40'沿基板40的周围延伸。
然后(图14),在去离子水中进行水浴,使得第一未聚合的可光定义的水凝胶层42去除了一小部分,从而形成了第一结构层2'。
之后(图15A),通过设计为允许在基板40和第一结构层2'的特定区域中的金属材料的沉积的掩模(未示出)的协助,进行通过溅射的金属材料的沉积步骤,类似诸如通过溅射的金沉积。由此形成由第一结构层2'的表面向基板40的部分40'延伸的金属带。
在XY平面俯视图中,图15B示出了由此形成的具有第一结构层2',并具有工作电端子10'、对电极电端子12'、和参考电端子14'的基板40。它们也可以由如银、铂的金属,或导电聚合物,或碳制成。
然后(图16),与生物传感器1的感测区域6类似地,获得感测区域6'。
为此目的,在基板40、第一结构层2',以及工作电端子10'、对电极电端子12'、和参考电端子14'上形成第二可光定义的水凝胶层46(设置有生物识别元件,例如酶)。在后续的制造步骤中第二可光定义的水凝胶层46形成感测区域6'。
参考前述的第二可光定义的水凝胶层26,由水凝胶(例如,PEG-DA)的预聚溶液、3%v/v的光引发剂(例如,2-羟基-2-甲基-1-苯基丙烷-1-酮)和1%v/v的氧化还原介体(例如,二茂铁的衍生物,如乙烯基二茂铁)起始形成第二可光定义的水凝胶层46。通过在pH水平为6和6.5之间范围内的PBS磷酸盐缓冲液中溶解适当的酶,以及作为用于改善酶在基质中的保留的试剂的戊二醛而制备酶溶液。根据一个实施方式,在葡萄糖氧化酶(GOx)和乳酸盐氧化酶(LOx)之间选择酶。酶在PBS中的浓度为,例如,20mg/mL。
在包含在4℃和5℃之间的温度下一起混合由此制备的预聚溶液和酶溶液持续4h和5h之间的时间。预聚溶液和酶溶液之间的比例为10:1v/v,但可以根据需要而变化。以与参考第二可光定义的水凝胶层26的已描述的相似的方式,由此得到的混合物(称为“感测基质”)被使用旋涂技术沉积,并形成第二可光定义的水凝胶层46。第二可光定义的水凝胶层46具有包括在100nm和1000nm之间,例如200nm的厚度。此外,在这种情况下,可以根据用于得到具有所需厚度的层46(以及由此的感测区域6)的第二可光定义的水凝胶层46的溶液的粘度调整沉积参数。
然后(图17),使用适当的掩模(未示出)进行暴露于UV照射的步骤,以利于第二可光定义的水凝胶层46的选择部分的交联。例如,使用与之前使用的产生UV照射25的相同的UV灯23得到曝光。为了得到第二可光定义的水凝胶层46的选择性聚合,使用设置有设计为阻挡入射的UV照射25的不透明区域和对于入射的UV照射25是透明的区域的掩模。以这种方式,由于水凝胶的行为类似于负光致抗蚀剂,仅沿Z与透明区域对齐的第二可光定义水凝胶层46的部分受到交联处理。
使用之前已在用于第二可光定义的水凝胶层26中指示的曝光参数进行聚合步骤。如图17中所示,在去离子水中水浴步骤使得未聚合的第二可光定义的水凝胶层46去除了一小部分,从而形成了感测区域6'。
在去除未聚合的水凝胶的步骤之后,仅形成了工作电端子10'的金属路径延伸与感测区域6'直接接触。形成对电极电端子12'和参考电端子14'的金属路径不与感测区域6'直接接触,而是沿着它延伸。
然后(图18),与生物传感器1的第二结构层4类似地,形成第二结构层4'。用于生产第二结构层4'的步骤与之前用于第二结构层4所述的类似(参见图10和11的描述),且在此不再进一步提及。
特别地,用于生产第二结构层4'的过程中设想在感测区域6'形成贯通开口8'。感测区域6'通过贯通开口8'至少部分地暴露。
图19示出在立体图中的根据图12-18的步骤生产的生物传感器1'。
如从图19可以看出,在本实施方式中,未去除基板40,只要其功能为用于支撑工作电端子10'、对电极电端子12'、和参考电端子14'即可。为了有利于基板40对第一结构层2'的粘合,可以在图12的第一水凝胶层42的沉积步骤之前,在基板40和第一结构层2'之间插入粘合层,如基于有机硅烷的粘合层。
基板40与硅烷分子的官能化可根据已知的,例如,在US2014/0017772中所述的工艺得到。特别地,通过氧-等离子体处理(对于此目的使用的常见的等离子体蚀刻系统)来处理基板。硅烷溶液(2%v/v)同样以在异丙醇中的甲基丙烯酸3-(三甲氧基甲硅烷基)丙酯制备,以醋酸校正pH值至4.5-5的值。然后,该溶液经过温和搅拌,然后在其使用之前需要等待几分钟(即,至少30分钟)。这使得硅氧烷基团水解。
然后将基板40浸渍在硅烷溶液中,以异丙醇清洗,且然后加热至120℃60分钟。由此基板40被以硅烷分子官能化以暴露甲基丙烯酸基团,随后水凝胶42将在其聚合期间与甲基丙烯酸基团结合,以形成状态2'。根据在基板上沉积的水凝胶的类型选择硅烷。在基于PEG-DA的水凝胶的情况下,硅烷可以选自丙烯酸酯或甲基丙烯酸酯硅烷、环状偶氮硅烷(cyclic azosilanes),具有胺端部的硅烷,双臂硅烷(dipodal silanes)和羧酸盐硅烷。
可以通过将生物传感器1,1'直接放置在待监测的患者的皮肤上,从而使感测区域6,6'通过贯通开口8,8'面对皮肤而使用该生物传感器1,1'。通过第二结构水凝胶层4,4'形成的贯通开口8,8'在使用中提供了不妨碍皮肤的自然蒸发,但显著地限制了与外部环境的空气交换的封闭腔室,导致了皮肤的局部温度迅速增加至约35-40℃的值。在贯通开口8,8'内所产生的蒸汽使环境饱和,且有利于汗液的形成,汗液与感测区域6,6'接触,使得能够进行生物分析。借助于在感测基质中存在的酶GOx或LOx,可以从产生的汗液中实际监测葡萄糖或乳酸盐。
监测在工作电端子10,10'和对电极电端子12,12'之间存在的电流可以使以已知的方式得到的信息用于检测的分析物浓度。
本申请人已经发现,根据本公开所使用的水凝胶基质以建立感测区域6,6'提供了对于葡萄糖的10μM至4mM,以及对于乳酸盐1μM至4mM的浓度范围内,即,与在人体汗液中通常存在的浓度相容的范围内的线性响应。
在使用中,生物传感器1用作电流式传感器。如已知的,电流式传感器是基于在工作电端子10和对电极电端子12之间的电流,即由在工作电端子10上得到的在分析物和酶之间的氧化还原反应诱导的电流的测量。电流与待监测的分析物的浓度成比例。为了这个目的,对电化学电池施加恒定电势(通过介体的氧化还原电势确定,通过循环伏安测量预先评估),并监测电流的响应。此电势使得在用于监测电流的最优条件下操作。特别是,相对于参考电端子14,工作电极10固定在一个电势,例如,0.25V。0.25V的值是本申请人测定的在水凝胶基质中固定的乙烯基二茂铁中的介体的阳极电势峰值。对电极端子是辅助电极,并用作在工作电端子10上的氧化还原反应期间产生的电流的漏极(对电极12“收集”通过酶-分析物反应产生的电子)。
三电极结构保证了在工作电端子10和参考电端子14之间的稳定电势的存在。然而,根据本公开的进一步的方式,也可能类似的使用其他配置,特别是具有两个电极的配置(其中参考电极与对电极相同)。
恒电势仪(图中未示出)可被可操作地耦合至工作电端子10、对电极电端子12、和参考电端子14,且可以被配置以通过工作端子/对电极端子对控制电压,以及调整它以保持在工作端子10和参考端子14之间施加的电势差。参考电端子测量并控制工作电端子10的电势,同时对电极电端子12允许所有其他用于平衡仍可在工作电端子10上观察到的电流的通路。以此配置,可以使通过氧化还原反应产生的电流经过工作端子10和对电极端子12之间。可以被测量的此电流表明了在分析物中存在的电活性物质的浓度。
根据已在上文的描述,生物传感器1'以与生物传感器1类似的方式起作用。
从上述说明中可知,本发明可得到的优点是显而易见的。
特别地,第一结构层2和第二结构层4操作成为支撑、保护、并包含感测区域6的微仓,且同时,用作电极之间的绝缘层。因此,无需进一步的支撑和围护层,使得生物传感器1简单且廉价的生产。
制造过程设想使用在微机电装置的微加工领域中广泛采用的装置和技术,且特别是通过简单的光刻步骤限定了层2、2'、4、4'的形状。由此,可以利用相同的制造技术使生物传感器1,1'集成在更复杂的电子装置或微机电系统(MEMS)中。
水凝胶的使用使得获得的生物传感器在使用期间不会引起不适(为柔性材料),并具有,例如,小药膏状的外观。因此其简单易用,自足完备,且美观隐蔽。所讨论的生物传感器还进一步的在低电势下工作。它可以进一步地以隐蔽的方式集成在医疗装置或者其他可穿戴装置,如手环中。
由于该分析是基于患者的汗液进行的,因而生物传感器1,1'的使用不会引起任何疼痛。
最后,显然地,可以对本文所描述和说明的内容作出许多修改和变型,这些都落入在所附的权利要求书中所限定的本发明的观点的范围内。
例如,可以使用其他技术,如通过喷墨沉积得到电端子10,10',12,12',14,14'。
此外,圈闭于生物活性区域6中的生物识别元件可以与酶GOx和Lox不同;例如,它们可以选自其他类型的酶,或者另选自抗体、核酸、和细胞受体。
- 还没有人留言评论。精彩留言会获得点赞!