快速制备海洋小型鱼类或仔稚鱼中期分裂相染色体的方法与流程
本发明属于海洋生物技术领域,具体的涉及一种快速制备海洋小型鱼类或仔稚鱼中期分裂相染色体的方法。
背景技术:
:
染色体是遗传物质的载体,对鱼类染色体的研究,不仅可以探讨其分类地位和系统演化,也有助于近缘物种的鉴定和群落分析,对资源的开发利用和遗传育种都有重要的意义。全世界现存鱼类有22000多种,是脊椎动物中分布最广、种类最多的类群,体现多种多样的生物学特性,具有重大的经济价值。但在脊椎动物中,鱼类的染色体较小,数目偏多,有关染色体研究的进展较缓慢,至2005年前后,已有染色体核型报道的鱼类只有2100种左右,约占总数的10%,这些有染色体记载的鱼类主要集中在鲤形目和鲈形目,且大多数为淡水鱼类(高文,鱼类染色体研究进展,宁德师专学报(自然科学版),2005,17(1):15-17),有关海水鱼类染色体记载的报道还不多,这与海水鱼类增养殖业迅猛发展不符。
自1966年Ojima等(Ojima Y S,Hitotsumachi S,Makino.Cytogentic studies in lower vertebrates.Proc Jap Acad,1966,42(1):62-66)首次采用低渗处理和空气干燥法制片,进行鱼类染色体研究取得成功后,目前的鱼类染色体制片都采用这种方法,但采用这种方法要制得大量中期分裂相且染色体图像清晰的片子较难,不能满足染色体相关分析的要求。人们普遍认为鱼类细胞分裂指数低,需要辅助使用PHA(植物血球凝集素)(Yamamoto K,Ojima Y.A PHA-culture method for cells from tissue of teleosts.Japan J Genet,1973,48(3):235-238)来促进细胞分裂,以期获得更多的良好的分裂相,然而这种染色体制备方法因多了PHA处理的程序,对鱼体多造成一次伤害,而且注射PHA和秋水仙素的方法所需时间较长,有些长达30多个小时,常因试验鱼死亡而告失败。不同鱼类的不同组织细胞分裂相指数不尽相同,在大多数鱼类中,造血器官是肾脏(头肾),尤其淡水鱼类在制作染色体制片时都采用肾脏组织。按照习惯用肾脏组织制片,有的鱼类的肾脏组织却不是很发达,得不到足够的分裂相(毛连菊,李雅娟.5种海水鱼类染色体的组型分析,大连水产学院学报,2002,17(2):108-113)。也有取鱼类鳃组织和脾脏来制作染色体制片的,但染色体分裂相数目因鱼而异,成功报道也只有绒杜父鱼和绵鳚的脾脏,而脾脏只在高等类群的鱼类中才比较发达。对于小型鱼类和仔稚鱼而言,要解剖出它们的肾脏、脾脏并用于制备染色体绝非易事。
染色体制备需充分考虑实验目的和试验材料本身的特性,海洋鱼类从两极到赤道,从海岸到大洋,从表层到万米左右的深渊都有分布。生活环境的多样性,促成了海洋鱼类的多样性。但由于生活方式相同,千姿百态的海洋鱼类有一系列的共同特点:具有呼吸水中溶解氧的鳃,鳍状的便于水中运动的肢体,能分泌粘液以减少水中运动阻力的皮肤。海洋环境又是处处暗藏危机的,直接接触水体的鱼体需要不断地适应水体中的各种刺激,所以体表组织细胞一般都处于旺盛的分裂增生的状态。要制备大量分裂相染色体,必须保证试验鱼的所取组织细胞大量处于分裂增生的状态。
鱼类育种工作有不少种类涉及到染色体组操作,如雌核发育和多倍体诱导等。育种初期获得的试验鱼都非常珍贵,科研人员想检测他们的染色体组成却又不舍得杀死试验鱼。小型鱼类和鱼苗更是无法采用传统的方法来制备染色体,传统的鱼类染色体制备方法不仅耗时长,还必须处死试验鱼,代价极其惨重。
技术实现要素:
:
本发明要解决的技术问题在于提供一种快速制备海洋小型鱼类或仔稚鱼中期分裂相染色体的方法,所述方法通过对现有海水鱼类染色体制备方法的改进,以最少量的实验用鱼体表组织制备出大量的分散较好的中期分裂相染色体,以满足各种海洋小型鱼类或仔稚鱼种质鉴定、染色体倍性分析、染色体荧光原位杂交分析、性别控制等研究的需求。本发明方法能克服试验鱼数量少、个体小的限制,从处理试验鱼开始,6~9小时即可观察到结果,操作简单便捷,可灵活调整制备步骤和处理强度,可在养殖育苗基地或生产单位随时开展,制备染色体后基本保证试验鱼存活下来。
本发明是按照以下操作方法完成的:
一种快速制备海洋小型鱼类或仔稚鱼中期分裂相染色体的方法,所述方法包括:1)充分了解试验鱼的生物学特性及玻片的清洗;2)把小型试验鱼类或仔稚鱼放入秋水仙素溶液中游泳;3)取试验鱼的鳃组织或鳍条组织进行染色体制备。
所述的充分了解试验鱼的生物学特性及玻片的清洗:了解试验鱼的体型特征、营养组成、游泳活动方式和生活方式,以确定取样部位和试验方案,确定取样部位及试验方案的标准如下:鳍条短小者在鳍条游离末端取样,鳍条如蝉翼透明革质或角质则不适合取样,改取鳃丝,鳍条脂肪含量高的应加大低渗力度,选用0.0375M或0.05M KCl低渗液,鳃盖开口度大的取鳃丝游离端,运动激烈的试验鱼游泳水体要求1.5L以上,静止不动的试验鱼鱼游泳水体要求100-200ml;染色体制片的载玻片要求干净无油污,不挂水,在染色体制备前清洗干净。
所述的把小型试验鱼类或仔稚鱼放入秋水仙素溶液中游泳:配制含0.005%或0.01%(g/ml)秋水仙素的海水,让试验鱼在其中游泳4-6小时,游泳水体的水温较原暂养水温提高或降低2-3℃,以刺激增强试验鱼体表组织分裂增生的能力;
所述的取试验鱼少量鳃组织或鳍条组织进行染色体制备:取1-8mm3鳃组织或鳍条组织,立即放入0.0375M、0.05M或0.075M KCl溶液中低渗50min,再转移至新鲜配制预冷的卡诺氏固定液中固定,每一步骤过程中都需要轻轻摇晃处理样品的试管,使作用更充分;然后采用热滴片法制片。
进一步,所述的卡诺氏固定液为甲醇与冰醋酸的体积比为3:1的混合液。
进一步,所述的在卡诺氏固定液中的固定方法为更换固定液3次,每次固定15分钟。
本发明与已有技术相比的有益效果:
1.本发明制备小型鱼中期分裂相染色体的方法简单快捷,便于操作,制备染色体后基本保证试验鱼存活下来,可重复多次制备,所需实验用鱼可少至1条,适用于各种海洋鱼类。只需了解试验鱼的生理和生活特性,确定样品部位为鳃还是鳍即可。
2.采用本方法可保证实验样品新鲜,细胞活性好,制备的中期分裂相染色体形态好,分散度好,便于观察和计数。
附图说明
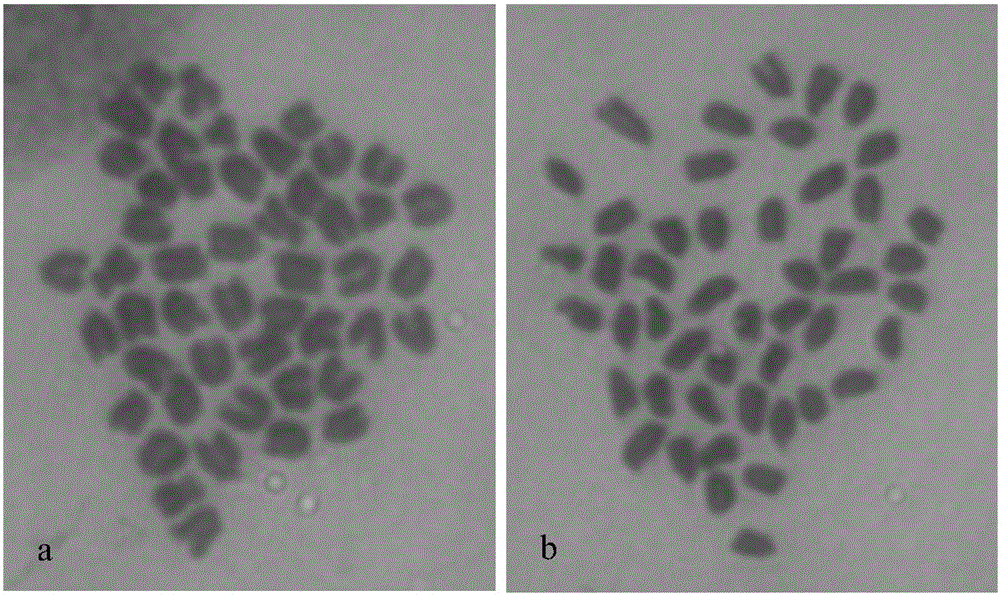
图1银鲳幼鱼中期分裂相染色体:a、第一尾幼鱼染色体,b、第二尾幼鱼染色体。
图2石斑鱼幼鱼中期分裂相染色体:a、体色发黑幼鱼染色体,b、体色发白幼鱼染色体。
具体实施方式:
下面通过具体实施例结合附图对本发明进行详细说明,以下是最佳实施例具体操作工艺过程,本发明的保护范围不受实施例任何形式上的限制。
实施例1:
快速制备银鲳中期分裂相染色体的方法,其步骤包括:1)充分了解银鲳的生物学特性及玻片的清洗;2)银鲳幼鱼秋水仙素溶液中游泳;3)取鱼体少量鳃组织进行染色体制备。完成上述操作过程具体操作如下:
2016年7月8日,取1龄鲳鱼2尾,体长5-6cm,饲以特制的“鲳鱼奶膏”于20L过滤海水中,银鲳鱼生性活泼,不停游泳,易受惊吓而跳出水面。其鳍条质如蝉翼,细胞不易解离。因此决定取鳃作为制备染色体的材料。染色体制片的载玻片要求干净无油污,不挂水,在染色体制备前清洗干净。载玻片先用中浓度重铬酸钾洗液(浓硫酸200ml,蒸馏水200ml,重铬酸钾20g)浸泡24小时,纯净水反复冲洗至洗液完全冲尽后控干水分,浸泡到无水乙醇中12小时,取出后酒精灯烧制,冷却后装盒备用,切勿用手碰触载玻片表面造成油渍污染。
将配置的质量比为0.4%的秋水仙素母液用过滤海水稀释至秋水仙素终浓度为0.01%的工作液2L,工作液水温较银鲳原养殖水体温度提高2-3℃,也可以降低2-3℃,让幼鲳鱼在工作液中游泳5小时,由于银鲳生性胆小,易受惊吓跳出水面或腹部胀气打挺,惊吓过度会导致死亡,因此游泳期间,容器上方需遮挡,容器周围尽量保证安静和减少人影晃动。取少量鳃组织,用0.075mol/L的KCL溶液低渗50分钟,再用预冷的新鲜配制的卡诺氏(Carnoy)液(甲醇:冰醋酸=3:1)充分固定,更换固定液3次,每次固定15分钟。然后采用热滴片法制片,制片时先用50%的冰醋酸溶液解离鳃组织成细胞悬液,通过弹壁或吸管吹打的方式,使细胞从组织团块中解离出来,放在4℃冰箱中预冷,载玻片放在光滑石板上或金属面上预热,石板或金属面可用电炉加热至55-60℃,吸取解离的细胞悬液,从80cm的高处滴2-3滴至预热的载玻片上,用剪成的3层滤纸碎片的尖角快速吸干滴液,并把滴片移至旁边晾干。市售吉姆萨工作液染色30分钟,自来水流水冲洗载玻片表面多余的染色液约10秒钟,晾干后即可镜检,观察染色体形态。中期分裂相多,染色体形态和分散度均很好,见图1。
实施例2:
快速制备石斑鱼中期分裂相染色体的方法,其步骤包括:1)充分了解石斑鱼苗的生物学特性及玻片的清洗;2)石斑鱼幼鱼秋水仙素溶液中游泳;3)取鱼体少量鳍条组织进行染色体制备。完成上述操作过程具体操作如下:
2011年10月份,取6月龄石斑鱼苗2尾,分别为培育的新种质,一尾体长5cm,体色发黑,一尾体长7cm,体色发白,精心饲养于20L过滤海水中。石斑鱼幼鱼喜游泳,但活动不剧烈,尾鳍和背鳍发达,细胞易解离,因此决定取背鳍或尾鳍组织作为制备染色体的材料。染色体制片的载玻片要求干净无油污,不挂水,在染色体制备前清洗干净。载玻片先用中浓度重铬酸钾洗液浸泡24小时,所述的重铬酸钾洗液的配制方法为400ml溶液中由200ml的浓硫酸、200ml的蒸馏水、20g重铬酸钾组成,纯净水反复冲洗至洗液完全冲尽后控干水分,浸泡到无水乙醇中12小时,取出后酒精灯烧制,冷却后装盒备用,切勿用手碰触载玻片表面造成油渍污染。
将配置的质量比为0.4%的秋水仙素母液用过滤海水稀释至秋水仙素终浓度为0.005%的工作液1L,工作液水温较石斑鱼原养殖水体温度提高2-3℃,也可以降低2-3℃,让幼石斑鱼在工作液中游泳4小时,由于作用水体偏小,为保证幼鱼活性,游泳期间宜以小气石充气。取少量鳍组织,用0.0375mol/L的KCL溶液低渗50分钟,再用预冷的新鲜配制的卡诺氏(Carnoy)液(甲醇与冰醋酸的体积比为3:1混合)充分固定,更换固定液3次,每次固定15分钟。然后采用热滴片法制片,制片时先用50%的冰醋酸溶液解离鳍组织成细胞悬液,通过弹壁或吸管吹打的方式,使细胞从组织团块中解离出来,放在4℃冰箱中预冷,载玻片放在光滑石板上或金属面上预热,石板或金属面可用电炉加热至55-60℃,吸取解离的细胞悬液,从70cm的高处滴2-3滴至预热的载玻片上,用剪成的2-4层滤纸碎片的尖角快速吸干滴液,并把滴片移至旁边晾干。市售吉姆萨工作液染色30分钟,自来水流水冲洗载玻片表面多余的染色液约10秒钟,晾干后即可镜检,观察染色体形态。两条鱼的中期分裂相都很多,染色体形态和分散度均很好,见图2。
通过我们发明的这种快速制备海洋鱼类中期分裂相染色体的方法,还制备了半滑舌鳎、大菱鲆和漠斑牙鲆等鱼类的中期分裂相染色体,为这些海洋鱼类的种质鉴定、遗传育种、性别控制等研究提供了遗传依据。
- 还没有人留言评论。精彩留言会获得点赞!