用于检测对象中存在与ATP耗竭相关的状况的方法和装置与流程
本发明涉及用于测量对象生理状况的装置和方法,具体地说,涉及测量对象(例如人类患者)中与ATP耗竭相关的状况(例如缺血)的存在。
背景技术:
缺血是对组织血液供应的限制,导致细胞代谢所需的氧气和葡萄糖短缺。通常地缺血是由血管闭塞或破裂引起的,由此导致组织损伤或功能障碍。一系列的疾病状态源于缺血,或者导致缺血,其中包括急性病如缺血性中风,短暂性脑缺血发作(TIA),和心血管疾病如心肌梗塞(MI)。缺血也可能由包括血管功能不全在内的慢性疾病引起,如糖尿病危重肢体缺血(CLI),由血管疾病引起的慢性脑缺血和慢性缺血性心脏病(IHD)。在心脏病中,其特征性表现例如为心绞痛和缺血性心肌病。缺血可能存在于对象的某一身体部位,并且使用现有技术难以或不可能检测到。这种慢性缺血性疾病的特征可能是数月,数年甚至数十年的稳定症状,并且在其早期阶段可能是无症状的,或者症状可能是轻微的且未被注意到的。然而,这种情况更容易发展为晚期急性缺血性疾病,因此早期检测将具有显着的临床价值。
细胞代谢是由ATP与ADP之间的不平衡驱动的(Nicholls DG,Ferguson SJ.Bioenergetics 2.London:Academic Press;1992)(本文引用的所有参考文献均通过引用并入),因此在细胞中存在酶促途径以快速除去ADP并有效地将其转化为腺苷(Sims RE,Dale N.Activity-Dependent Adenosine Release May Be Linked to Activation of Na(+)-K(+)ATPase:An In Vitro Rat Study.PLoS One 2014;9(1))以及下游的嘌呤和次黄嘌呤。在缺血性疾病中,组织缺氧导致细胞产生ATP的能力丧失,导致细胞内腺苷和下游嘌呤的积累,然后通过平衡转运蛋白流出。尽管一些研究已经检查了在颈动脉内膜剥脱术过程中急性事件如卒中(Laghi Pasini F et al.Increase in plasma adenosine during brain ischemia in man:a study during transient ischemic attacks,and stroke.Brain Res Bull 2000;51(4):327-30)和脑缺血期间血液中嘌呤水平是否增加(Weigand MA,et al.Adenosine:a sensitive indicator of cerebral ischemia during carotid endarterectomy.Anesthesiology 1999;91(2):414-21),但是这还没有被广泛研究。
虽然从现有技术已知嘌呤水平在急性局部缺氧/缺血的情况下升高,但在现有技术中,在明显健康的对象中,慢性缺血和嘌呤水平升高之间没有联系。这些先前的研究依赖于在远离对象的临床分析仪中进行的测量,并且由于全血中的酶将嘌呤迅速分解,样品需要在取出后立即冷冻,冷冻输送到仪器,解冻然后分离血浆;解冻和分离过程缓慢,导致样品中嘌呤大量分解。这一系列的事件导致测量不敏感也不可靠,不适合于常规的临床实践。本发明的一个目的是提供使得嘌呤的测量与对象(例如人类患者)缺血的存在相关联的方法和装置,并且在一些实施方案中提供使得嘌呤的测量与对象中疾病状况的存在或对象发生这种状况的风险相关联的方法和装置。
发明描述
根据第一方面,本发明提供了一种确定对象中与ATP耗竭(通常地为缺血事件)相关的状况的倾向性的方法,包括:
测量对象体液中一种或多种嘌呤的浓度,所述嘌呤选自腺苷,肌苷,次黄嘌呤,黄嘌呤和ATP,以及
将测得浓度与所述一种或多种嘌呤的阈值浓度进行比较,
其中阈值浓度通常在约2μM至约8μM的范围内,并且其中高于阈值浓度的测得浓度指示状况的存在,例如缺血。
该状况可能是与一种体液(如血液)中存在的ATP分解产物相关的状况。这些包括缺氧和低氧,葡萄糖剥夺(如低血糖和糖尿病,炎症,感染,肿胀(如积液/脑积水),神经退行性疾病(如阿尔茨海默病和帕金森病)和多发性硬化症。该状况可能是缺血事件,例如脑缺血事件。
该方法通常识别对象将发生与ATP耗竭相关的状况(例如缺血事件)的风险增加。对象通常不具有明显的与ATP耗竭有关的状况的身体症状,例如缺血。例如,对象确实存在缺血的身体症状,却不存在中风,短暂性脑缺血发作(TIA),坏疽肢体,心脏病发作或创伤性头部损伤迹象的身体症状。明显的身体症状包括肢体突然虚弱;说话混乱或有困难;突然单眼或双眼看不清东西;突发行动困难;头晕;和突然的严重头痛。中风可能是缺血性中风,出血性中风。
对象可能患有本身具有缺血风险的状况,例如糖尿病,高血压,心房纤颤或动脉狭窄,或者超过50岁。该方法允许鉴别另外的不明显的缺血事件或显示事件将发生的风险的增加。
确定对象存在缺血可以指示对象患有慢性缺血性医学状况的可能性,或者可以指示对象可能以后发生急性缺血性医学状况的风险程度。
在一些实施方案中,测得浓度可以用于指示所述的概率或风险程度,较低测得浓度指示较低概率或较低的风险程度,较高浓度指示较高概率或风险程度。
在一些实施方案中,阈值浓度在2μM至6μM的范围内,在一些实施方案中在4μM至8μM的范围内,在一些实施方案中在2μM至4μM的范围内,以及在一些实施方案中在3μM至4μM的范围内。
在一些实施方案中,该方法包括将测得浓度与阈值浓度进行比较,并使用测得浓度与阈值浓度之间的差异来确定隐性缺血性状况存在于对象中的概率或对象以后可能发展急性缺血性疾病。例如,远高于阈值的测得浓度可以指示较高的所述概率或风险,接近阈值的测得浓度可以指示较低的概率或风险。
根据该实施方案,慢性医学状况可以是由血管疾病导致的慢性脑缺血,例如以如心绞痛和缺血性心肌病为特征的慢性缺血性心脏病(IHD)等心血管疾病,严重肢体缺血(CLI),癌症患者的低氧肿瘤和卧床患者的褥疮;急性缺血性疾病可以是缺血性中风,短暂性脑缺血发作(TIA),心肌梗塞(MI)和深静脉血栓形成。
对象可以是一个出生后的人,例如3个月,6个月,1年,5年或10年的儿童,或15岁或以上的成年人。
对象可能是新生儿或子宫内的胎儿。该方法可以包括在出生之前,期间或之后的一次或多次测量婴儿体液中的嘌呤浓度,以确定婴儿的缺氧状况。
通常地,对象可以没有急性缺血性疾病的通常症状,例如中风的症状如语音不清,单侧无力或瘫痪,单侧面部麻痹或意识丧失或MI的症状,并且该方法可以用于确定缺血的存在,如隐匿性或慢性缺血性疾病。
以这种方式,该方法提供了一种方法来确定隐性缺血存在于对象中,其中缺血的存在或者由缺血导致或造成的医疗状况从对象的身体检查中并不明显。
在一些实施方案中,本发明提供了一种诊断缺血或隐匿性缺血性医学状况的方法,并且在一些实施方案中提供了一种预测方法,其中一种或多种嘌呤的测得浓度指示预后发现,例如较高的测得浓度指示疾病进展的风险较高。
以这种方式,该方法提供了一种方法来确定对象存在隐性缺血,其中缺血的存在或者由缺血导致或造成的医学状况从对象的身体检查中并不明显。
该方法还提供了优先化对象以进行治疗或进一步研究的手段,嘌呤浓度大于阈值指示更高的优先级,低于阈值的浓度指示较低的优先级或不需要进一步的行动。该方法进一步提供了一种将对象分配给对象亚群的手段,嘌呤浓度大于阈值时将对象分配给第一亚群(例如较高风险亚群),而浓度低于阈值时将对象分配给第二个亚群(例如风险较低的亚群)。
可以选择阈值浓度以便为患者群体整体或亚群提供较高和较低风险之间的适当区分标准。在一些实施方案中,该方法包括将对象分配给亚群,然后选择在适用于所述亚群的方法中使用的进一步的阈值浓度。例如,亚群可以包括具有特定医疗状况或可疑医疗状况的对象,并且可以由其他对象特异性因素如年龄,体重,性别或吸烟/不吸烟来表征。
阈值浓度可以被选择用于根据该实施方案的方法中。阈值浓度可以在2至8μM,4至8μM或3至4μM的范围内选择,例如2.0,2.2,2.4,2.5,2.6,2.8,3.0,3.2,3.4,3.5,3.6,3.8,4.0,4.5,5.0,5.5,6.0,6.5,7.0,7.5或8.0μM。阈值浓度可以根据要使用该方法的对象的亚群来选择。阈值浓度可以被选择以给方法提供适当的选择性和特异性,以确定对象缺血的存在。阈值可以被选择以给出假阳性和假阴性结果之间的期望平衡,例如比率。在一些实施方案中,该方法包括根据观察由这样的确定导致的结果来修改阈值浓度。
这里为了清楚和简洁,大于阈值浓度的浓度被认为包括浓度等于阈值浓度的情况。在一些实施方案中,低于阈值浓度的浓度包括浓度等于阈值浓度的情况。
根据该实施方案,体液可以是全血,血清,血浆或脑脊液。通常,体液是全血,血清或血浆。血液,血清或血浆可能是动脉血,静脉血,可能是外周血。在进行测量之前,可以将体液稀释或与另外的液体或化合物混合。
在各种实施方案中,测得浓度和阈值浓度可以是
(i)从所述嘌呤选择的单一嘌呤,单独测量;
(ii)两种或更多种所述嘌呤的总浓度,各自单独测量;
(iii)两种或更多种所述嘌呤的浓度的加权总和,每种单独测量,例如为以下形式:
总浓度=A×[嘌呤(1)]+B×[嘌呤(2)],方括号表示浓度;
(iv)通过响应于两种或更多种所述嘌呤的测量方法测量的等效总嘌呤浓度,总嘌呤测量相对于该方法对单一嘌呤的响应而校准;
(v)总嘌呤的两次或更多次所述测量的加权总和,例如为以下形式:
总浓度=A×[嘌呤(1)和嘌呤(2)]+B×[嘌呤(3)和嘌呤(4)]。
在方法(iv)和(v)中,测量方法的响应可以使得对第二嘌呤的响应对第一嘌呤响应是一种已知函数,例如比率,使得当用已知浓度的第一个嘌呤进行校准后,对第二个嘌呤的响应是已知的。
在一些实施方案中,测得浓度和阈值浓度是从对所述嘌呤的三,四和五种敏感的测量方法得到的总嘌呤浓度,其中相对于对校准嘌呤的响应校准测量值,测量方法具有已知的校准嘌呤的响应对每个其余嘌呤的响应的比率。
例如,所述三种嘌呤可以是腺苷,肌苷和次黄嘌呤,校准嘌呤可以是三种嘌呤之一,通常是腺苷。所述四种嘌呤可以是腺苷,肌苷,次黄嘌呤和黄嘌呤,校准嘌呤可以是四种嘌呤之一,通常是腺苷。
在这样的方法中,测量方法或测量装置如传感器对次黄嘌呤,黄嘌呤和肌苷的响应与对腺苷的响应的比率可以从方法或装置的参数中获知,该方法可以包括将对样品中存在的所有嘌呤的响应与对已知浓度的腺苷的响应进行比较,以获得以腺苷的等效浓度表示的总嘌呤浓度的值。
例如,测量装置如传感器可以具有由以下给出的响应S:
S=A[腺苷]+B[肌苷]+C[次黄嘌呤]+D[黄嘌呤]
其中校准因子A,B,C和D的值基本上与浓度一致,使得肌苷,次黄嘌呤和黄嘌呤各自对腺苷的响应的比值是恒定值b=B/A,c=C/A和D=D/A。
对样品中嘌呤组合的测量响应Sm为:
Sm=A([腺苷]m+b.[肌苷]m+c.[次黄嘌呤]m+d.[黄嘌呤]m)
对已知浓度的腺苷([腺苷]校准)的校准响应是:
Sc=A[腺苷]校准
Sm可以用腺苷[腺苷]’的等效浓度表示:
Sm=Sc([腺苷]’/[腺苷]校准),
其中[腺苷]’=[腺苷]m+b.[肌苷]m+c.[次黄嘌呤]m+d.[黄嘌呤]m
因此,在一些实施方案中,总嘌呤的测得浓度可以是腺苷[腺苷]’的等效浓度。
对于对每种嘌呤同样敏感的测量方法,因子b,c和d都等于1,[腺苷]’简单地是单个嘌呤浓度的总和。包括使每种嘌呤与常见被测物如过氧化氢反应的酶级联的某些酶传感器可以归入这一类,如下所述。通常,传感器可能对每个嘌呤具有不同的灵敏度,因素b,c和d从传感器的固有特性已知或者在制造过程中通过校准发现。
相应地,在一些实施方案中,所述一种或多种嘌呤的测得浓度以一种嘌呤的等效浓度表示,传感器的响应使用所述嘌呤进行校准,阈值浓度是所述等效浓度的值。
相应地,在一些实施方案中,该方法包括:
(i)当与包含体液的样品接触时,测量响应于选自腺苷,肌苷,次黄嘌呤,黄嘌呤和ATP的多于一种嘌呤的测量装置的测量响应,
(ii)测量所述测量装置对所述嘌呤之一的校准浓度的校准响应,
(iii)导出所述一种嘌呤的等效浓度,当样品中所述嘌呤单独存在时这将导致相同的测量响应,以及
(iv)将所述等效浓度与等效浓度的阈值进行比较,
其中所述阈值浓度通常在2μM至8μM的范围内,并且其中高于所述阈值浓度的测量的等效浓度指示所述状况的存在。
测量装置可以是如本文所述的生物传感器。
测得浓度可以根据浓度值导出,或者可以作为来自测量装置的测量信号来导出,当存在已知浓度的嘌呤时所测量的信号与所测量的校准信号进行比较来校准,所述阈值浓度被表示为信号的阈值。
在一些实施方案中,该方法包括:
(i)当与来自对象的体液样品中的多种嘌呤接触时测量来自测量装置的测量信号,
(ii)当与校准嘌呤接触时测量校准信号,
(iii)使用测量信号和校准信号来导出代表校准嘌呤等效浓度的等效信号,和
(iv)将等效信号与表示阈值等效浓度的阈值信号值进行比较,
其中大于所述阈值信号值的等效信号指示所述状况的存在。
在一些实施方案中,该方法包括独立于其他嘌呤测量一种或多种嘌呤的浓度,并将测得浓度与所述嘌呤的阈值浓度进行比较。嘌呤可以是腺苷,黄嘌呤,肌苷或ATP中的一种,阈值浓度可以在2μM到4μM的范围内。嘌呤可以是次黄嘌呤,阈值浓度可以在2μM到8μM的范围内。
嘌呤可以是腺苷,肌苷,次黄嘌呤和黄嘌呤,校准嘌呤可以是腺苷,阈值浓度可以在2μM到8μM的范围内。
嘌呤可以是肌苷,次黄嘌呤和黄嘌呤,校准嘌呤可以是肌苷,阈值浓度可以在2μM到8μM的范围内。
嘌呤可以是次黄嘌呤和黄嘌呤,校准嘌呤可以是次黄嘌呤,阈值浓度可以在2μM到8μM的范围内。
以这种方式,在一些实施方案中,不导出每个单独的嘌呤的实际浓度,并且一种或多种嘌呤的测得浓度不一定是存在于样品中的嘌呤的个体浓度的总和;而是测得浓度可以是指示样品的总嘌呤含量的值,然后将其与阈值进行比较以确定患者中存在诸如缺血等状况。
对象体液中嘌呤浓度的改变可能暗示了隐性缺血并且可能表明缺血性疾病的进展或消退。
在一些实施方案中,该方法包括:
在第一和第二时间点中的每一个时间点测量一种或多种所述嘌呤的浓度,
将测得浓度的变化与所述变化的阈值进行比较,以及
如果所述变化速率高于所述阈值,则确定所述对象中所述状况的存在。
第一次和第二次测量之间的变化的阈值可以在1μM到8μM之间,或者在第一和第二次测量之间可以在2μM到4μM之间,或者1μM到3μM之间。第一次和第二次测量可以隔开1天至2年,例如1至12周,3个月至6个月,6个月至2年的时间间隔。
该变化可以表示为随时间变化的速率,变化速率阈值可以在每年1μM至8μM的范围内,或者2μM至4μM,或者1μM至3μM,或者每年高于8μM。
嘌呤浓度的增加可能表明缺血的存在或进展,减少可能表明缓解或解决。该变化可以是测量的单一嘌呤浓度的变化,或如本文所述测量的两种或更多种嘌呤总浓度的变化。
在一些实施方案中,该方法包括
a.在第一和第二时间点中的每一个时间点测量一种或多种所述嘌呤的浓度,以及
b.使用一个时间点处的测得浓度以及第一和第二时间点之间的测得浓度的变化来确定对象中急性缺血性障碍的存在。
缺血的存在可以通过(i)一种或多种嘌呤浓度高于阈值浓度和(ii)一种或多种嘌呤的测得浓度变化高于该变化阈值的组合来指示。
该方法可以包括导出指示对象中存在缺血的概率的值或对象后来发展缺血性疾病的风险。例如,值V可以从以下形式的等式导出:
V=A.[嘌呤]+B.([嘌呤]的变化速率,其中A和B是常数或者是其他变量的函数,例如针对个体或亚群(其中对象是其中成员)的特定缺血性的其他风险因子的函数。
在一些实施方案中,缺血的存在可以通过以下的组合来指示:(i)高于阈值浓度的一种或多种嘌呤的浓度和(ii)一种或多种嘌呤的变化速率高于变化速率阈值。如上所述的值V可以取决于测得浓度或浓度变化速率与相应阈值之间的差异:
V=A.([嘌呤]-阈值浓度)+B.([嘌呤]的变化速率-变化速率阈值)
这样,通过观察趋势导致更高浓度的趋势,可能比单独测量可能由混杂效应产生的浓度更可靠地指示缺血的存在。在一些实施方案中,浓度测量的较低阈值(其本身可能导致假阳性结果)可与第一和第二测量值之间的变化一起用于阈值以上以确定缺血的存在。例如,在这样的实施方案中,浓度阈值可以在2μM到4μM的范围内,并且在第一和第二测量之间的变化速率阈值可以在1μM到8μM的范围内,或者在1μM到每年8μM。
在一些实施方案中,通过响应于所述一种或多种嘌呤的生物传感器来测量浓度。生物传感器可以是酶传感器,包括以一种或多种所述嘌呤之一为底物的酶。生物传感器可以对两种或更多种所述嘌呤敏感,使得生物传感器提供代表两种或更多种嘌呤总浓度的信号。
第一嘌呤的浓度可以测量为来自响应于第一和第二嘌呤的生物传感器的信号与响应于第二嘌呤的生物传感器的信号之间的差异。
如本文所述的浓度可以由来自对一种或多种嘌呤敏感的生物传感器的信号表示,并且浓度的测量可以包括测量所述信号并且将该信号与与已知浓度的所述一种或多种嘌呤的信号校准值进行比较。
一种或多种嘌呤的测得浓度与阈值浓度的比较可以通过比较来自对所述一种或多种嘌呤敏感的生物传感器的信号与代表阈值浓度的所述信号的值来完成。
浓度可以使用包含含有一种或多种固定化酶的酶电极的生物传感器来测量,如例如在专利US8417314和EP1565565中所述。合适的酶电极的实施例包括:
(1)可以用包含甘油激酶和甘油-3-磷酸氧化酶的酶电极生物传感器测量ATP,其中甘油激酶和甘油-1,3-磷酸氧化酶催化样品中ATP的反应以形成磷酸甘油酯和氢过氧化氢(H2O2),电极检测反应中产生的H2O2。
(2)次黄嘌呤和黄嘌呤的综合浓度可以用包含黄嘌呤氧化酶的酶电极生物传感器测量,其中黄嘌呤氧化酶催化次黄嘌呤形成尿酸和H2O2的反应,电极检测反应中产生的H2O2。
(3)可以用包含核苷磷酸化酶和黄嘌呤氧化酶的酶电极生物传感器测量肌苷,次黄嘌呤和黄嘌呤的综合浓度,其中核苷磷酸化酶催化肌苷反应形成次黄嘌呤,黄嘌呤氧化酶催化次黄嘌呤反应形成尿酸盐和H2O2,电极检测反应中产生的H2O2。
(4)腺苷,肌苷,次黄嘌呤和黄嘌呤的综合浓度可以用包含腺苷脱氨酶,核苷磷酸化酶和黄嘌呤氧化酶的酶电极生物传感器测量,其中腺苷脱氨酶催化腺苷反应形成肌苷,核苷磷酸化酶催化肌苷反应形成次黄嘌呤,黄嘌呤氧化酶催化次黄嘌呤形成尿酸和H2O2的反应,电极检测反应中产生的H2O2。
(1)-(4)这样的生物传感器测定的一种以上的嘌呤的组合浓度的测定结果的差异可以导出单一的嘌呤的浓度。例如,腺苷的浓度可以由上述对腺苷,肌苷,次黄嘌呤和黄嘌呤敏感的酶电极(4)所进行的测量和由上述对肌苷,次黄嘌呤和黄嘌呤敏感的酶电极(3)所进行的测量之间的差异导出。
来自生物传感器的信号可以是流过电极的电流的值,并且测量值可以由电流表示。阈值浓度可以由阈值电流表示,并且测得浓度与阈值浓度的比较可以通过比较对应的电流来实现。
例如来自生物传感器的电流形式的生物传感器信号可以通过减去来自“无效”生物传感器的对照信号(如下文所述)的电流来校正与嘌呤含量无关的干扰,该“无效”生物传感器中在传感层不含有酶,与相同的样品,参比液或者校准液接触。
传感器的校准可以通过使传感器与含有已知浓度的嘌呤的液体接触来完成。可以将嘌呤添加到样品中以跟踪标定(spike)样品以允许校准。在一些实施方案中,传感器对多于一种嘌呤敏感,并且通过使传感器与所述嘌呤中的一种接触来完成校准,传感器对所述嘌呤的总浓度的响应源自对单一所述校准的响应嘌呤。例如,包含如上所述的对腺苷,肌苷,次黄嘌呤和黄嘌呤敏感的酶电极(4)的生物传感器可以通过使传感器与已知浓度的腺苷接触来校准,对腺苷的响应用于校准传感器对其余嘌呤的响应。在这种类型的酶传感器中,通常校准使用贯穿整个酶促反应级联的嘌呤。以这种方式确定酶级联的正确运作和对进一步进入反应级联下游的嘌呤的响应。
生物传感器可以被配置为对其感测的每种嘌呤同样敏感。例如,如上所述的酶传感器(4)可以被配置为使得由腺苷脱氨酶催化的腺苷的反应中产生的所有肌苷基本上全部通过酶级联反应形成H2O2。以这种方式,传感器可以对于肌苷和对腺苷具有基本相等的响应。肌苷,次黄嘌呤和黄嘌呤的反应同样可以应用,使得传感器对每种嘌呤基本上是同等响应的。以这种方式,传感器被配置为测量嘌呤的总浓度基本上等于它们各自浓度的总和。
在一些实施方案中,传感器对不同嘌呤的灵敏度之间的关系可以是已知的,并且可以例如是传感器设计的特性,使得对第二嘌呤的灵敏度将位于对第一嘌呤灵敏度的范围之内。以这种方式,对第二个嘌呤的反应可以从对第一个嘌呤的反应中得到。例如,对肌苷,次黄嘌呤或黄嘌呤的反应可以是对腺苷反应的一个已知百分比,或者可以在对腺苷反应的一个已知百分比范围内。在一些实施方案中,对“总嘌呤”的响应是对样品中存在的所有嘌呤的响应,通过对单一嘌呤的响应进行校准,并且不导出对单个嘌呤的响应。
在一些实施方案中,体液是全血,例如外周全血。在专利US8417314和EP1565565中提及的包含钌紫介质的生物传感器,如以下所例示的,适于在全血中进行快速测量。
因此,所述方法可以包括使用生物传感器测量一种或多种嘌呤的浓度,所述生物传感器包含固定有以所述嘌呤为底物的酶和钌紫介质的电极。
在一些实施方案中,该方法包括:
使适于测量选自腺苷,次黄嘌呤,黄嘌呤,肌苷和ATP的一种或多种嘌呤的浓度的生物传感器与参考液体如缓冲液,
在生物传感器与参考液体接触之后的第一运行时间(a first elapsed time)测量参考信号,
使生物传感器与体液接触,
在生物传感器与体液接触之后的第二运行时间(a second elapsed time)测量测量信号,
从测量信号和参考信号中导出一种或多种嘌呤浓度的测量值。
经过的时间可以选择在5秒到600秒范围内,10秒到300秒范围内,或30秒到180秒范围内,例如90,120,150或180秒。
通常地,第一次和第二运行时间基本相同,例如彼此在10%,5%或2%以内。
在一些实施方案中,该方法包括:
使生物传感器与包含已知浓度的嘌呤的液体接触
在生物传感器与所述液体接触之后的第三运行时间测量校准信号,
将测量信号与校准信号进行比较以导出一种或多种嘌呤浓度的测量。
通常地,第一次,第二次和第三运行时间基本相同,例如彼此在10%,5%或2%以内。
在一些实施例中,该方法包括:
从测量信号中减去参考信号以导出校正的测量信号,
从校准信号中减去参考信号以导出校正的校准信号,
从校正的测量信号与校正的校准信号的比率导出浓度测量。
校准液体可以是包含一种已知浓度嘌呤的缓冲液,或者可以是来自包含添加到样品中的已知浓度的嘌呤的对象的样品。
该方法可以包括采集体液样品并测量样品中一种或多种嘌呤的量或浓度。在一些实施方案中,样品可以通过本领域已知的手段采取,例如使用VacutainerTM,并且可以立即测试,而无需事先处理样品。
该方法可以包括在测量浓度之前指导对象经历一段休息时间。该方法可以包括在测量浓度之前指导对象执行和行动或锻炼。该方法可以包括测量一种或多种所述嘌呤的基线浓度,然后指导对象进行动作或锻炼,并在动作或锻炼期间或之后测量相同的嘌呤,并将这些浓度与基线浓度进行比较。
该方法可以包括在测量浓度之前指导对象经历一段禁食时间。该方法可以包括在测量浓度之前指导对象进食或饮食。所述方法可以包括测量一种或多种所述嘌呤的基线浓度,然后指导对象进食或饮酒,并在对象进食或喝醉后测量相同的嘌呤,并将这些浓度与基线浓度进行比较。
在一些实施方案中,本发明提供监测对象对临床过程如手术或药物疗法的响应的方法,其包括在程序之后的一个或多个时间间隔测量如本文所述的一种或多种嘌呤的浓度以确定改变测得浓度的程序。该方法可用于确定进一步干预的需要,比如延长的随访或进一步的程序,或确定对象将需要这种进一步干预的可能性。例如,测得的嘌呤浓度的下降可能表明干预中成功地减轻了缺血。
该方法可以包括:
测量一种或多种所述嘌呤的基线浓度,
执行临床程序,
在手术后以一个或多个时间间隔测量所述一种或多种嘌呤的浓度
将浓度与基线浓度进行比较,其中使用所述浓度之间的差异来确定对象中存在的缺血程度的变化。
该方法可以包括:
测量一种或多种所述嘌呤随时间浓度的基线趋势,
执行临床程序,
在手术后以一个或多个间隔测量所述一种或多种嘌呤的浓度,
将手术后浓度的趋势与基线趋势进行比较,其中所述趋势之间的差异用于确定对象中存在的缺血程度的变化。
测得浓度可以与阈值进行比较以确定手术的成功与否。
对象中存在的缺血程度的改变可用于确定其中一个或多个例如手术成功的一个度量,对象将需要进一步干预的一个概率以及对象可能继续发展成急性缺血性疾病的一种风险。
根据第二方面,本发明提供了一种被配置为执行如本文所述的方法的装置。通常地,该装置包括适于测量体液中一种或多种嘌呤浓度的生物传感器,嘌呤选自腺苷,肌苷,次黄嘌呤,黄嘌呤和ATP。
生物传感器可以包括酶电极,所述酶电极上固定有以所述嘌呤之一作为底物的酶和钌紫介质,例如对腺苷,肌苷,次黄嘌呤和黄嘌呤全部四个都响应的酶电极,例如在US8417314中公开的。
在一些实施方案中,所述装置被配置为执行本文所述的方法以确定对象存在缺血或测量对象中存在缺血的概率,或者对象后来发展为急性缺血性障碍的风险。
在一些实施例中,该装置还包括控制器,该控制器被配置为测量来自生物传感器的信号并且:
在生物传感器与参考液体接触之后的第一运行时间测量参考信号,
在生物传感器与体液接触之后的第二运行时间测量测量信号,以及
从所述信号中导出一个或多个嘌呤的测得浓度。
通常第一次和第二运行的时间基本相同。
在一些实施方案中,控制器被配置为:
在生物传感器与所述液体接触之后的第三运行时间测量校准信号,
将测量信号与校准信号进行比较以导出一种或多种嘌呤的测得浓度。
通常第一次、第二次和第三运行时间基本相同。
在一些实施方案中,控制器被配置为:
从测量信号中减去参考信号以导出校正的测量信号,
从校准信号中减去参考信号以导出校正的校准信号,
从校正的测量信号和校正的校准信号的比率导出一个或多个嘌呤的测得浓度。
在一些实施方案中,该装置包括用于接收和保持来自对象的体液的液体接收元件以及与液体接收元件流体连通的生物传感器。液体接收元件可以包括其上设置有酶电极的生物传感器表面的一部分。液体接收元件可以包括测试室,生物传感器可以设置在测试室内。该装置可以包括入口以允许参考液体和样品被引入到测试室中。该装置可以被配置为接收用户引入的参考液体和样本,并且在液体被引入之后的选定的经过时间从生物传感器读取信号。该装置可以被配置成将参考液体引入到测试室中并且在控制器的控制下将样本引入到测试室中。在一些实施方案中,该装置被配置成将校准液体引入到测试室中。该装置可以包括通向测试室的一个或多个流体通道,通过该流体通道可以引入如样品,参比液和校准液的液体。该装置可以包括流体致动装置如泵以使得液体流入测试室,并且可以包括用于液体的储存器,每个储存器经由流体通道以及或者由阀门连接到测试室。
该设备可以包括控制器以控制该设备并实施本发明的方法。控制器可以控制液体的流动和嘌呤的测量,并且可以将测量结果与如本文所述的阈值进行比较。该设备可以报告嘌呤测量结果,并且可以将来自嘌呤测量结果的数据或者从与阈值的比较结果传送到如计算机的远程接收设备。控制器可以是计算机实现的,并且可以包括存储在数据存储器中的处理器和指令以控制设备的操作。
该装置可以被配置为与诸如VacutainerTM之类的采样装置相互配合,例如在未决的国际专利申请WO2014087137中所公开的。该装置可以被配置成从对象取得样本如血液样本,并且如本文所描述的使形成该装置生物传感器部分与样本接触。
本发明的第二方面的优选特征与第一方面相同,细节上有必要的修改。
附图简述
图1示出了形成可用于执行该方法的酶传感器的一部分的感测电极的图,示出了用于检测血嘌呤的酶级联。酶被包埋在钌紫(RP)涂覆的金电极上的层内。
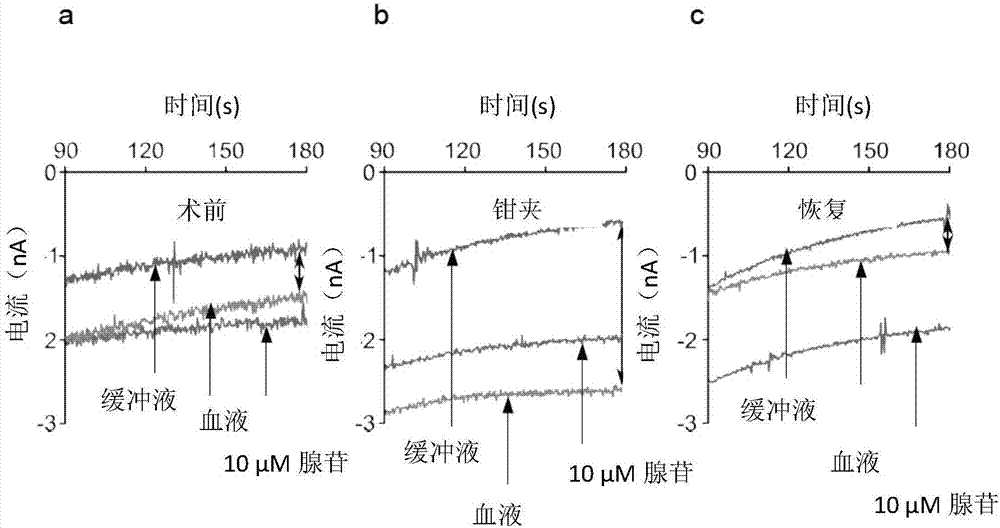
图2显示了实施例中讨论的来自3型患者的血液测量期间的传感器电流的示例记录,显示术前血液嘌呤水平,颈动脉夹紧后不久和恢复后。
图3显示了一些清醒患者在颈动脉内膜剥脱术期间的连续血液嘌呤测量,揭示了嘌呤释放的不同概况。a)图左,1型患者血嘌呤水平的连续测量实施例。阴影矩形表示颈动脉夹持的时间和持续时间。图右,图示所有1型患者,术前,颈动脉钳夹和嘌呤恢复水平。b)图左,2型患者血液嘌呤水平的连续测量的实施例。图右,图示所有2型患者,术前,颈动脉钳夹和嘌呤恢复水平。c)图左,是3型患者血液嘌呤水平的连续测量的实施例。图右,图示所有3型患者,术前,颈动脉钳夹和嘌呤恢复水平。d)1型,2型和3型患者在钳夹阶段从颈动脉钳夹到最大记录嘌呤释放的中位时间的直方图。
图4显示了用于肌苷(Ino)和次黄嘌呤(Hx)的相对于对腺苷(Ado)的反应的传感器的响应:(a)针对每个传感器对于腺苷的响应均一化后5个传感器的响应的平均值和标准方差(SD);(b)其中一个传感器响应相对于时间的变化,其中该传感器对于肌苷的响应接近于对于腺苷的响应,对于次黄嘌呤的响应更大;(c)样品中微摩尔浓度的腺苷,肌苷和次黄嘌呤的组合的实施例,并且对于具有(a)中所示的相对响应的传感器,所得到的测量的“总嘌呤”浓度表示为相当于微摩尔浓度的腺苷。
发明实施方案描述
在一个实施方案中,本发明提供了确定对象缺血存在的方法,包括:
测量对象体液中多种嘌呤的浓度,所述嘌呤是腺苷,次黄嘌呤,黄嘌呤和肌苷,并且
将测得浓度与一种或多种嘌呤的阈值浓度进行比较,
其中阈值浓度在2μM到4μM的范围内,并且嘌呤的总浓度大于阈值浓度的测量值指示存在缺血。
在该实施方案中,所述方法包括使用响应于所有四种所述嘌呤的生物传感器测量腺苷、肌苷、次黄嘌呤和黄嘌呤的浓度。生物传感器包括(i)如前面和US8417314中所述的类型(4)的酶电极和(ii)包括与酶电极相同但不含酶的无效传感器,以校正来自接触生物传感器液体的背景信号,在任何给定时间来自生物传感器的信号是酶电极电流与当时的无效传感器电流之间的差异。酶电极用单一浓度的腺苷进行校准,对其他三种嘌呤的响应与腺苷的响应的比率由电极的特性决定,例如酶层的尺寸、物理和化学性质以及在它们内提供的酶活性。测得浓度如先前所述表示为腺苷的等效浓度,并且在下文中并且在该实例中被称为“总嘌呤”的量度。
图4a显示了用于实例中的此类五种针对肌苷(ino)和次黄嘌呤(hx)传感器相对于分别对于腺苷(ado)响应的平均值和标准方差(SD)。根据这些数据,传感器的响应可以与样品中的总嘌呤含量相关,从而允许总体响应根据腺苷进行校准。对于图4a中的实例,如上所述的肌苷响应的比率b约为1.15,次黄嘌呤响应的比率c约为1.80。黄嘌呤氧化酶催化次黄嘌呤反应形成黄嘌呤和H2O2,再与黄嘌呤反应形成尿酸和进一步的H2O2,电极检测反应中产生的H2O2,因此这类电极对次黄嘌呤的响应将接近对黄嘌呤的两倍。比率d因此将在0.9左右。
图4b显示了传感器的响应相对于时间的变化,其中对肌苷的响应接近于腺苷,对次黄嘌呤的响应更大。可以看出,对每个嘌呤的响应时间过程彼此重叠,允许在任何时间点的相对响应可以简单地通过嘌呤存在的曲线和PBS的曲线之间的差异进行测定,以及对嘌呤的响应在任何时间点通过对腺苷在相同时间点的响应进行校准。
通过这种方式,本文所述的“总嘌呤”响应可以与样品中存在的所述嘌呤的已知个体浓度或所有所述嘌呤的总已知浓度相关,以提供“总嘌呤浓度”,用腺苷的等效浓度表示,通过对单一嘌呤如腺苷的响应进行校准。
图4c给出了样品中可能存在的微摩尔浓度的腺苷、肌苷和次黄嘌呤的组合的实例,并且对于图4a所示的具有相对响应的传感器,所得到的测量的“总嘌呤”浓度(以相当于微摩尔浓度的腺苷表示)。可以看出,对于各个嘌呤浓度范围的组合,所测量的总嘌呤浓度可以在约2μM至约8μM的范围内。
在下面的例子中可以看出,以这种方式测量和校准的总嘌呤浓度与总嘌呤浓度的阈值(其中阈值在2μM至4μM范围内)的比较,可以有效指示对象存在缺血状况,并不需要测量个别嘌呤浓度。
在一些实施方案中,测得浓度可以用于确定对象患有慢性缺血性医学状况的概率或确定对象可能以后发展急性缺血性医学状况的风险程度。基于测得浓度,概率或风险可以被表示为较高或较低的概率或风险。
该方法可以包括使用测得浓度来将对象分配给具有较低的慢性缺血性医学状况的可能性或具有较低的发展急性缺血性医学状况的风险的第一群体或具有较高的所述可能性的第二群体或风险。
参考图3c(右),可以看到3型对象在手术前具有总嘌呤(腺苷,次黄嘌呤,黄嘌呤和肌苷)水平的升高,并且在颈动脉内膜剥脱术中颈动脉夹紧期间具有增加的脑缺氧的风险,可能是由于大脑循环系统其他部位的血管闭塞所致,正如夹钳就位时发生的意识不清所显示的那样。因此,这些患者显示发生急性脑缺血症状的风险增加。总嘌呤的水平升高使得在2μM至4μM范围内选择的阈值浓度将检测到这些患者。参照图3b(右),可以看出两名2型患者也将通过这样的阈值来选择,并且这些患者可能与手术过程中嘌呤水平的大幅增加的3型患者具有类似的阻塞,除了不那么严重。1型患者在手术过程中总嘌呤水平有轻微变化,因此被归类为局限性脑血管血流量减少,因此发生急性脑缺血的风险较低,术前嘌呤水平低于4μM。此外,术前水平处于4μM的类型1范围的高限的一种类型1患者在手术过程中经历了比其他类型1患者更大的嘌呤水平升高,因此可以被归类为具有脑血管血流受到的限制比其他患者更大,因此也可以用2μM到4μM的阈值检测。
通过这种方式,实施方案提供了一种“健康”测试,其中可以测量人类对象中的嘌呤浓度,并且对象可以被分配到指示进一步诊断测试或治疗的较高风险人群或在测试时这些程序是不需要的较低风险人群。
现在将通过以下非限制性实例来说明根据本发明并且根据该实施方案的方法。
实施例
使用微电极生物传感器测量来自18名知情同意的患者在局部麻醉下进行清醒颈动脉内膜剥脱术(CEA)的未经处理的新鲜动脉血液中的嘌呤水平。样品在术前、颈动脉暴露、夹紧阶段和夹钳取出后的恢复阶段进行测量。在手术过程中记录每位患者的神经状态。
外科手术
所有颈动脉内膜剥脱术(CEA)均在局部麻醉下进行。使用3.5倍放大率进行手术,并使用选择性分流和贴片策略。在钳夹颈静脉之前,静脉注射肝素,使用固定剂量的4000单位。手术后,患者在PACU(麻醉后护理单元)过夜恢复。经颅多普勒用于评估手术后脑微栓塞(Saedon M,等人,Registry report on kinetics of rescue antiplatelet treatment to abillish cerebral microemboli after carotid endarterectomy,Stroke 2013;44(1):230-3.14)。
神经学评估
分流是由清醒测试确定的,分流的指征是严重神经系统失调,或由麻醉师的持续临床评估确定的显著混乱,不安定或不能响应命令。第一个90秒内发生的严重恶化是通过开放动脉并使缺损恢复来处理的。然后在全身麻醉下继续手术,以便可控地插入颈动脉分流器。在交叉钳夹90秒之后,但在颈动脉切开术(试验钳夹5分钟)之前发生的缺陷是通过临时夹钳释放处理的。一旦正常的神经学恢复,然后重新施加钳,允许在患者第二次闭塞之前插入分流器(Imray CH et al.Oxygen administration can reverse neurological deficit following carotid cross-clamping.Br J Anaesth 2005;95(2):274;author reply 5)。
血液采样
作为常规手术期间和手术后监测的一部分,将局部麻醉下插入对侧桡动脉的动脉导管。在手术前、暴露阶段期间、交叉钳夹之前、交叉钳夹阶段、钳夹释放后、闭合期间以及麻醉后护理单元(PACU)中,从麻醉室的该导管中抽取血液样品。
生物传感器测量
利用如(Tian F,Llaudet E,Dale N.Ruthenium purple-mediated microelectrode biosensors based on sol-gel film.Anal Chem 2007;79(17):6760-6)描述的微电极生物传感器测量新鲜未加工血液中的嘌呤。简而言之,这些金电极涂有钌紫色层,其充当介质以提供抗干扰因素如抗坏血酸盐、尿酸盐和对乙酰氨基酚所必需的选择性。这可以准确测量全血中的嘌呤。
嘌呤传感器具有酶层,其含有如图1所示的三种酶的级联,并在上文中被称为类型(4),其允许其检测所有这些酶的底物:腺苷、肌苷、次黄嘌呤和黄嘌呤(Tian F.et al.2007op.cit.;Llaudet E,Botting NP,Crayston JA,Dale N.A three-enzyme microelectrode sensor for detecting purine release from central nervous system.Biosens Bioelectron 2003;18(1):43-52)。进行电流测量以检测由检测级联中的最终酶黄嘌呤氧化酶产生的过氧化物的电还原。使用“无效”生物传感器记录作为每个实验的对照比较。无效的生物传感器在所有方面与嘌呤生物传感器相同,只是它们缺少酶级联,因此不能响应于嘌呤(Frenguelli BG,Llaudet E,Dale N.High-resolution real-time recording with microelectrode biosensors reveals novel aspects of adenosine release during hypoxia in rat hippocampal slices.J Neurochem 2003;86(6):1506-15)。
图2显示了3型患者血液测量期间的传感器电流的实例记录,其中(a)术前,(b)颈动脉夹紧后不久,和(c)恢复后。将生物传感器相对于Ag/AgCl伪参比电极极化至-50mV 180秒。目前的记录显示了测量的最后90秒,是嘌呤和无效的生物传感器之间的差异。曲线在缓冲液中显示“零电流”,用10μM腺苷进行校准,并在全血中测量。血液中的嘌呤浓度是通过将血液和缓冲液的曲线(黑色双头箭头)之间的差异计算出来的,并将其表示为校准和缓冲液痕迹之间的差异的比例。
采样后尽快将无效和嘌呤生物传感器引入血样。它们被同时极化到-50mV(相对于Ag/AgCl)的工作电位,并且如图2所示记录安培法拉电荷充电电流。3分钟后,从嘌呤生物传感器中减去无效传感器的电流值,得到“嘌呤电流”。通过将其与通过在已知量的腺苷中校准传感器获得的电流相比较,将其转化为嘌呤浓度。
统计呈现和分析
所有数据均以中位数和95%置信区间表示。对于数据较小的亚组(1型,2型和3型),95%置信区间与数据范围相同。对于整个组,使用双向Friedman ANOVA分析数据,比较每名患者的预钳,钳夹和恢复期嘌呤水平,分别通过Mann Whitney U检验和Kolmogorov Smirnov检验比较中位数和分布。
结果
测量结果收集自18名患者。首先从这些患者获得的数据作为一个单独的组进行分析。总体而言,术前测量的血液中静息嘌呤水平中位数为2.4μM(1.3至4.0μM)。该值与文献中的其他值相当,表明人体中次黄嘌呤/黄嘌呤(血液中主要的嘌呤)的血浆浓度在1-2μM(Yamamoto T et al.Effect of ethanol and fructose on plasma uridine and purine bases.Metabolism 1997;46(5):544-7;Ohno M,et al.Effects of exercise and grape juice ingestion in combination on plasma concentrations of purine bases and uridine.Clin Chim Acta 2008;388(1-2):167-72)。在颈动脉夹闭期间,相对于术前基线,每名患者的血液嘌呤水平升高。钳位阶段的中位嘌呤水平为6.7μM(4.7至11.5μM)。恢复后,血液嘌呤降至术前基线(1.9μM,1.4至2.7μM)。分析显示,在钳夹释放后的较短时间内(不到2小时(h)),对于整个患者组而言,血液嘌呤水平与术前基线没有区别。
检查整个颈动脉过程中进行的血嘌呤反复连续测量的情况,并结合对患者的伴随神经评估,可将该组群分为三类:1型,2型和3型。1型和2型患者(分别为7/18和8/18)在颈动脉夹闭期间未显示主要的神经症状。然而,3型患者(3/18)在夹紧颈动脉后迅速变得无意识。
结果如图3描述,其显示a)图左,1型患者中血嘌呤水平的连续测量的实例。阴影矩形表示颈动脉夹持的时间和持续时间。图右,图示所有1型患者,术前,颈动脉钳夹和嘌呤恢复水平。b)图左,2型患者血嘌呤水平的连续测量的实例。图右,图示所有2型患者术前,颈动脉钳夹和嘌呤恢复水平。c)图左,3型患者血液嘌呤水平的连续测量的实例。在施用颈动脉夹之后不久,患者意识丧失,需要快速安装颈动脉分流器(箭头)以恢复脑血流。请注意安装分流器后嘌呤水平如何快速下降。图右,图示所有3型患者,术前,颈动脉钳夹和嘌呤恢复水平。d)1型、2型和3型患者在钳夹阶段从颈动脉钳夹到最大记录嘌呤释放的中位时间的直方图。误差线是上和下四分位数。
在1型患者中,嘌呤水平的升高在整个钳夹期持续,并在钳夹期结束时达到最大值(图3a)。在这些患者中,最大嘌呤血液水平的中值时间为21分钟(14至29分钟,图3d)。对于1型患者,术前中位嘌呤水平为1.5μM(0.8~4.0μM)。在颈动脉钳夹期间,其升高至5.7μM(3至11.5μM),在恢复期间降至1.8μM(0.05至3.1μM,图3a)。
2型患者的术前基线嘌呤为2.4μM(0.7至5.6μM),并且在颈动脉夹闭期间表现出短暂的嘌呤释放模式。他们的血液嘌呤比1型患者(3分钟,1-16分钟,p=0.001,Mann Whitney U检验相比Type 1)更快达到峰值(10.0μM,范围3·4-18.6μM)1名患者,图3b,3d)。达到这个峰值后,血嘌呤水平下降,但仍有6/8例高于术前基线水平(3.2μM,0.9至13.6μM)。在恢复时,嘌呤水平恢复至2.2μM(0.4至8.7μM,图3b)。
颈动脉夹闭后3型患者(n=3)迅速变得无意识。与1型和2型患者相比,基线嘌呤水平升高(5.4μM,3.9至6.7μM,图3c,3d)。钳夹期间嘌呤升至9.6μM(9.1至22.5μM)之前上升,随后在恢复过程中下降至1.8μM(1.8至2.6μM)之前。该恢复值低于术前基线值。重要的是,当颈动脉分流以恢复脑血流量时,血液嘌呤水平降至术前基线水平以下(1.4μM,0.4至2.9μM)。这一观察结果表明,由于颈动脉血流受阻,这些患者的大脑长期缺血,通过分流(因此嘌呤水平下降)缓解了颈动脉血流量,并且长期受手术结果的影响。
讨论
执行颈动脉内膜剥脱术(CEA)是为了减少未来中风的风险。由于颈动脉夹的计时和释放以及此后的缺血性损伤是确定的,该过程提供了一个很好的机会来测试人类患者血液中的嘌呤水平是否为脑缺血的标志物。在所有18名患者中,动脉血中的嘌呤水平在施用颈动脉夹之后几分钟内升高。在大多数患者中,这在没有任何主要的神经系统症状的情况下发生。这表明嘌呤是一种非常敏感的脑缺血的量度。在整个钳夹期间观察到嘌呤水平升高,表明当缺血性损伤持续存在时,嘌呤持续产生并从脑中释放。在钳夹释放后,血液嘌呤水平相对较快地返回(1-2小时内)至钳前基线。因此嘌呤是脑缺血的一个相对短暂的指示。这意味着可以首先使用嘌呤在最早期检测脑缺血的发病率,其次监测缺血性损伤的持续性。
这些例子中的病人根据手术过程中的嘌呤释放情况以及他们是否失去意识分成3组。1型患者,因为他们的血液嘌呤相对增加较慢,可能比其他两个患者组具有更高的能力通过脑底动脉环(Circle of Willis)闭塞增强来自对侧的血流以补偿来自同侧颈动脉的血流损失。在1型患者中,代偿流与同侧血流的限制快速启动,这有减缓和限制颈动脉夹闭期间嘌呤上升的作用。
结果提示,2型患者可能保留一些对侧补偿的能力,但是补偿的开始被延迟——因此血液嘌呤初始增加的趋势较高,并且在钳位阶段后期嘌呤水平的降低。
颈动脉夹闭期间3型患者迅速失去意识。结果表明,他们失去了从对侧增强血流的能力。此外,由于即使在术前阶段血嘌呤也很高,它们的大脑可能处于慢性缺血性应激状态。
实施例显示,对于具有慢性缺血性应激的3型患者,术前嘌呤水平升高与健康水平(通常约1μM)相比可用于指示慢性脑缺血的存在。这些患者的术前水平为5.4μM(3.9-9.7μM)将高于在2μM到4μM范围内的阈值浓度。2型患者可能代表3型患者的连续群,除了他们的对侧补偿损失程度较小,因此没有经历无意识。他们的术前嘌呤水平在0.7~5.6μM范围内,使得具有这一范围的高处的患者极有可能遭受类似于3型患者的慢性缺血,这将可以用在2μM到4μM范围内的阈值指示。因此,2μM至4μM范围内的阈值可用于指示具有慢性缺血程度的患者,并且如本实例所示,可用于指示患有急性缺血症状的风险较高的患者,并优先考虑患者进一步诊断。
如3型患者的结果所示,阈值浓度较高,例如在4μM至8μM的范围内,可用于指示更严重的缺血程度,并且可用于优先考虑这些患者的即时进一步的诊断或治疗程序。
该实例显示随着时间的推移测得浓度的变化可以显示患者缺血程度的变化,例如颈动脉夹闭的情况下的缺血的严重程度的增加,缺血程度的减小在颈动脉内膜剥脱术(CEA)之后恢复脑血流量。以这种方式,根据本发明的嘌呤的测量可以指示缺血程度的增加或减小,并且因此改变发展成随后的急性缺血症状的风险程度。
已经仅以举例的方式描述了本发明,应该理解,在不脱离本发明的范围的情况下,可以对上述实施方案进行改变。
关于上面的描述,应当认识到,本发明的部件的最佳尺寸关系,包括尺寸、材料、形状、形式、功能以及操作、组装和使用的方式的变化,对于本领域技术人员来说是显而易见,并且与附图中所示和说明书中所描述的所有等同关系均被包括在本发明中。
因此,前述内容仅被认为是对本发明原理的说明。此外,由于本领域技术人员容易想到许多修改和变化,因此不希望将本发明限制于所示出和描述的确切的构造和操作,并且因此所有合适的修改和等同物可以采用落入本发明的范围内。
- 还没有人留言评论。精彩留言会获得点赞!