一种番茄叶片保卫细胞游离钙离子浓度的荧光指示剂检测方法与流程
本发明涉及植物检测领域,特别是涉及一种番茄叶片保卫细胞游离钙离子浓度的荧光指示剂检测方法。
背景技术:
Ca2+作为细胞内的第二信使,参与ABA等激素诱导的气孔运动中。同时许多生物或非生物胁迫都会引起植物细胞胞质内Ca2+浓度([Ca2+]cyt)的变化,植物会根据[Ca2+]cyt变化的差异解码不同的刺激从而使细胞作出相应的反应。比如叶片上的保卫细胞在受到外界刺激时其膜电位会发生变化,从而引起[Ca2+]cyt的变化,但每一个成熟的保卫细胞由于不是同步发育的,造成每个保卫细胞有其独有的信号转导方式。一部分保卫细胞[Ca2+]cyt在某种环境的诱导下会发生变化,可能会表现为胞质内Ca2+浓度的上升,这种上升幅度的不同产生了不同的“钙信号”,最终导致了外界环境刺激下气孔的不同步关闭或打开。
现在一般认为细胞对许多外界环境和激素等刺激作出的反应是通过细胞胞质中游离Ca2+浓度变化来传递的,因此检测细胞内[Ca2+]cyt的变化对于研究信号转导是非常重要的。近年来钙离子的荧光测定法得到不断的发展,包括定性及定量测定技术,能够在亚细胞水平实时、无损伤的研究细胞内[Ca2+]cyt的变化。但目前的荧光指示剂检测方法存在不同植物组织中检查灵敏度差异大,不同植物组织荧光指示剂装载条件的差异性且番茄叶片保卫细胞中没有优化的具体指示剂荧光检测方法的问题。
技术实现要素:
基于上述现有技术所存在的问题,本发明提供一种番茄叶片保卫细胞游离钙离子浓度的荧光指示剂检测方法,能间接直观地检测番茄叶片保卫细胞游离钙离子浓度。
为解决上述技术问题,本发明提供一种番茄叶片保卫细胞游离钙离子浓度的荧光指示剂检测方法,包括:
本发明实施例提供一种番茄叶片保卫细胞游离钙离子浓度的荧光指示剂检测方法,包括:
步骤1,配制设定浓度的荧光指示剂工作液;
步骤2,获取番茄叶片下表皮;
步骤3,将配制的所述荧光指示剂溶液装载至获取的所述番茄叶片下表皮;
步骤4,用激光扫描共聚焦显微镜对装载所述荧光指示剂溶液的所述番茄叶片下表皮进行荧光图像采集,根据所采集的荧光图像确定番茄叶片保卫细胞游离Ca2+浓度。
本发明的有益效果为:通过将配制好的设定浓度荧光指示剂工作液装载至获取的番茄叶片下表皮,并利用激光扫描共聚焦显微镜对装载所述荧光指示剂溶液的所述番茄叶片下表皮进行荧光图像采集,进而间接测定番茄叶片保卫细胞游离Ca2+浓度。该方法检测准确,操作方便。
附图说明
为了更清楚地说明本发明实施例的技术方案,下面将对实施例描述中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图仅仅是本发明的一些实施例,对于本领域的普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他附图。
图1为本发明实施例提供的番茄表皮保卫细胞中不同浓度的Fluo-8AM装载效果图;
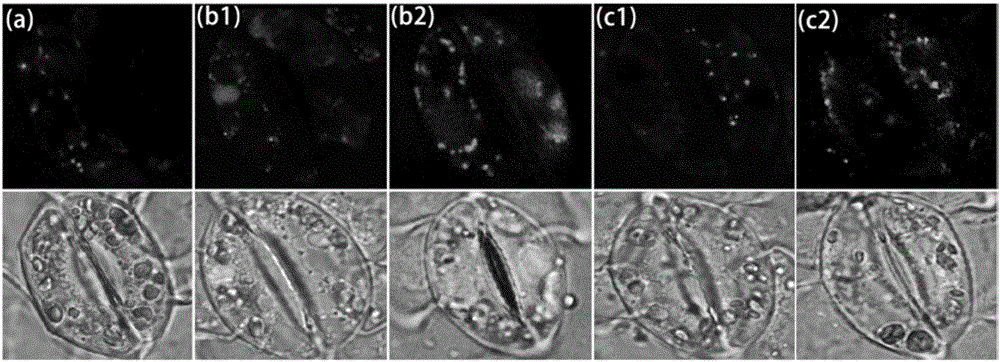
图2为本发明实施例提供的不同温度及时间条件下Fluo-8AM的装载情况图。
具体实施方式
下面对本发明实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例仅仅是本发明一部分实施例,而不是全部的实施例。基于本发明的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都属于本发明的保护范围。
本发明实施例提供一种番茄叶片保卫细胞游离钙离子浓度的荧光指示剂检测方法,包括:
步骤1,配制设定浓度的荧光指示剂工作液;优选荧光指示剂工作液的浓度为10μM;
步骤2,获取番茄叶片下表皮;
步骤3,将配制的所述荧光指示剂溶液装载至获取的所述番茄叶片下表皮;
步骤4,用激光扫描共聚焦显微镜对装载所述荧光指示剂溶液的所述番茄叶片下表皮进行荧光图像采集,根据所采集的荧光图像确定番茄叶片保卫细胞游离Ca2+浓度。
上述检测方法中,荧光指示剂采用Fluo-8AM。
上述检测方法中,配制荧光指示剂溶液包括:
步骤11,采用粉末状的荧光指示剂为原料;
步骤12,用二甲基亚砜溶解所述荧光指示剂,配制成1或2mM的母液;
步骤13,所述母液密封分装于-20℃避光保存;
步骤14,使用前将母液稀释成需要浓度的工作液即为荧光指示剂工作液。
上述检测方法步骤14中,稀释母液采用10mM的Mes-Tris,pH为6.1的缓冲液。
上述检测方法中,获取番茄叶片下表皮包括:
步骤21,选取植株健壮、苗龄为4~5片真叶的番茄幼苗;
步骤22,选取步骤1选定的所述番茄幼苗从下向上数第三片真叶相同位置的小叶;
步骤23,将步骤2选取的叶片在50μM浓度的茉莉酸甲酯中孵育一小时作为前处理;
步骤24,用尖头镊子撕取所述前处理后的叶片下表皮,放置在载玻片上,然后用毛笔铺展所述表皮,用于荧光指示剂的装载。
上述检测方法中,将配制的所述荧光指示剂溶液装载至获取的所述番茄叶片下表皮包括:
步骤31,将荧光指示剂工作液的装载浓度配制成三个浓度,分别为5μM、10μM、15μM;
步骤32,向载玻片上铺展的所获取的番茄叶片下表皮上分别滴加三个浓度的荧光指示剂工作液,使番茄叶片下表皮浸在荧光指示剂工作液中,然后常温黑暗下孵育30min~50min;优选的常温黑暗下孵育时间为50min;
步骤33,用Mes-Tris缓冲液洗涤步骤32的各番茄叶片下表皮三次,去除荧光指示剂工作液,室温放置20min,即完成将配制的所述荧光指示剂溶液装载至获取的所述番茄叶片下表皮上。
上述方法中,步骤4中所用的激光扫描共聚焦显微镜为Leica TCS SP5型激光扫描共聚焦显微镜。
下面结合具体实施例对本发明作进一步说明
本发明的目的是提供一种优化的检测番茄叶片保卫细胞游离Ca2+浓度的荧光指示剂法,为进一步研究番茄叶片保卫细胞内钙信号转导机理奠定了基础。
本发明方法包括:步骤1,荧光指示剂Fluo-8AM溶液的配制;步骤2,番茄叶片下表皮的获得;步骤3,荧光指示剂的装载(孵育)方法;步骤4,运用激光扫描共聚焦显微镜进行荧光图像的采集等步骤。
其中,步骤1的荧光指示剂Fluo-8AM溶液的配制步骤如下:
步骤11.荧光指示剂第一次使用时需要配成母液,且由于试剂微量,开封前适当轻弹几次管壁,保证粉末不会大量粘在管壁上。
步骤12.用质量高的DMSO(二甲基亚砜)溶解指示剂,配制成1或2mM的母液。
步骤13.母液建议分装保存,然后用封口膜封口,并用锡箔纸包裹,放在密闭性较好的塑料袋中,并放入干燥剂,于-20℃密封避光保存。
步骤14.使用前再根据实验需要把母液稀释成不同浓度的工作液。
步骤2的番茄叶片下表皮的获得包括以下步骤:
步骤21.选取植株健壮、苗龄为4-5片真叶的番茄幼苗。
步骤22.实验过程中要选取从下向上数第三片真叶相同位置的小叶。
步骤23.为了保证能够用荧光指示剂检测到叶片保卫细胞胞质内的钙离子信号,取下的叶片需要提前在50μM浓度的茉莉酸甲酯中孵育一个小时,可以促进钙离子浓度的上升。
步骤24.所有不同条件的孵育都要保持一个变量,番茄苗的生长状态、苗的生长环境、叶片获取的位置、叶片的前处理等都要保持相同。
步骤25.用尖头镊子小心撕取前处理后的叶片下表皮,放置在载玻片上,然后再用毛笔小心铺展表皮,进行下一步荧光指示剂的装载。
步骤3的荧光指示剂的装载(孵育)包括以下步骤:
步骤31.荧光指示剂的工作液需要用10mM的Mes-Tris,pH为6.1的缓冲液稀释母液得到。
步骤32.指示剂的装载浓度配制成三个浓度,分别为5μM、10μM、15μM。
步骤33.载玻片上铺展的叶片下表皮上分别滴加三个浓度的指示剂,使下表皮浸在溶液中,然后常温黑暗下孵育40min。
步骤34.用Mes-Tris缓冲液洗涤表皮三次,去除指示剂。室温放置20min,以确保AM体在细胞内的完全酯化作用。
步骤35.用激光扫描共聚焦显微镜观察这三个荧光指示剂浓度的装载效果,显微镜具体操作见下一部分。
以上步骤是优化指示剂的装载浓度,5μM是指示剂说明书的建议浓度,10μM是文献报道的其他植物叶片保卫细胞中检测钙离子的指示剂浓度。结果见图1。
为了进一步优化荧光指示剂装载的温度及时间,进行了下面的实验步骤:
(1)指示剂在装载温度上设置了4℃、室温(25℃)以及30℃,然后黑暗孵育。
(2)4℃下孵育1.5h,室温下孵育30min和50min,30℃下孵育30min和50min。
(3)以上条件孵育结束后用Mes-Tris缓冲液洗涤表皮三次,去除指示剂。室温放置30min,以确保AM体在细胞内的完全酯化作用。
(4)用激光扫描共聚焦显微镜观察以上条件荧光指示剂的装载效果,从而优化番茄叶片保卫细胞游离Ca2+浓度的荧光指示剂检测法。结果见图2。
步骤4的激光扫描共聚焦显微镜进行荧光图像的采集包括以下步骤:
本步骤中使用的显微镜为Leica TCS SP5型激光扫描共聚焦显微镜
步骤41,依次打开系统的“PC Microscope”、“Scanner Power”及“Laser Power”三个圆形按钮,然后把“Laser Power”按钮右侧的激光开关钥匙(Laser Emission)顺时针旋转90度至“On”的位置。记录开机时间。
步骤42,双击电脑显示器桌面上的“LAS AF”图标启动Leica共聚焦软件。
步骤43,点击“OK”以打开软件。
步骤44,软件界面上点击工具栏下方的“Configuration”,再点击“Lsaer”,用对勾打开所需激光。本实验需使用Argon离子激光,拖动滑块儿调节激光的输出功率到所需的值。
步骤45,系统预热30min。
步骤46,点击“Aquire”进行光路的设置,选择FITC通道,调节488波长激光输出功率。
步骤47,单击“Additional Channels”进行透射光检测器的选择,选择观察方式有BF、DIC等。
步骤48,选择扫描模式。在“Acquire”菜单栏的”Acquisition”中选择扫描模式为xyz模式,这是默认模式,是最常用的扫描模式。
步骤49,设置扫描参数。在“Acquire”菜单栏的”Acquisition”中设置扫描参数,包括分辨率(format)、扫描速度(speed)、针孔大小(pinholesize)、线平均(line average)、面平均(frame average)、累加(accumulation)等为默认值,放大倍数(zoom)选择3。
步骤410,预览图像。点击“Live”以设定的扫描参数预览图像,图像将显示在右侧的显示屏上,此时可以调整扫描参数,以达到最佳效果。
步骤411,采集图像。单击“Capture Image”可以采集一维图像。对于序列扫描,或者多维图像扫描,单击“Start”进行图像采集。
步骤412,图像文件的保存及输出。在“Acquire”的”Experiment”下显示采集的所有图像文件名称,右键点击图像文件名,可进行多种操作。
步骤413,关机。观察完后把对应波长激光输出功率调为0,把离子激光输出功率调为0并关闭;若使用过油镜,需要用无水乙醇清洗镜头;关闭LAS AF软件,将电脑桌右侧的激光开关钥匙(Laser Emission)逆时针旋转90度至“OFF”位置;关闭“Scanner Power”按钮;电脑关闭;关闭“PC Microscope”按钮;风扇停止后,关闭“Laser Power”按钮,记录关机时间及仪器使用状况。
上述步骤4采集的图像如图1、2所示,图1为番茄表皮保卫细胞中不同浓度的Fluo-8AM装载效果。其中,(a)为5μM浓度的指示剂;(b)为10μM浓度的指示剂;(c)为15μM浓度的指示剂。由图可以看出在其他条件相同的情况下10μM浓度的Fluo-8AM检测番茄叶片保卫细胞中[Ca2+]cyt效果更好。
图2为不同温度及时间条件下Fluo-8AM的装载情况。其中,(a)为4℃下孵育1.5h;(b1)为室温下孵育30min;(b2)为室温下孵育50min;(c1)为30℃下孵育30min;(c2)为30℃下孵育50min。由图1和图2综合可以得出10μM浓度的Fluo-8AM在室温下孵育50min来检测番茄叶片保卫细胞中[Ca2+]cyt效果最好。
上述实施例中通过不同浓度的荧光指示剂,不同装载(孵育)温度及时间来确定了番茄叶片保卫细胞游离Ca2+浓度的荧光指示剂检测的最佳方法。
本发明方法中采用Fluo-8AM荧光染料作为荧光指示剂来检测,这种染料是AM酯化型(酯溶性)的,它可以穿透细胞膜进入细胞后被细胞内的酯酶剪切形成Fluo-8,Fluo-8若以游离形式存在时几乎是非荧光性的,但是当它与细胞内自由钙离子结合后可以产生较强的荧光,最大激发波长为506nm,最大发射波长为526nm。实际检测时使用的激发波长为488nm左右,发射波长为525~530nm。可以使用激光共聚焦显微镜或流式细胞仪检测细胞内钙离子浓度的变化。但由于植物细胞壁中存在的非特异性酯酶的影响常使指示剂装载不成功,因此本发明确定了不同浓度指示剂,不同装载温度及时间对检测的影响,从而得出优化的番茄叶片保卫细胞游离Ca2+浓度的荧光指示剂检测方法,保证了检测结果的准确性。本发明方法中由于使用了激光扫描共聚焦显微镜成像,可以进行荧光图像的比较,是一种优化的检测方法,为进一步研究番茄叶片保卫细胞内钙信号转导机理奠定了基础。
以上所述,仅为本发明较佳的具体实施方式,但本发明的保护范围并不局限于此,任何熟悉本技术领域的技术人员在本发明披露的技术范围内,可轻易想到的变化或替换,都应涵盖在本发明的保护范围之内。因此,本发明的保护范围应该以权利要求书的保护范围为准。
- 还没有人留言评论。精彩留言会获得点赞!